一种抗病毒的外用制剂的制备方法和质量控制方法与流程
本发明涉及中药制药和质量分析,具体涉及一种抗病毒的外用制剂的制备方法和质量控制方法。
背景技术:
1、病毒性皮肤病是由病毒感染皮肤黏膜而引起的疾病,根据病毒的种类不同,在临床状态上有一定区别。一般认为患者机体免疫力的下降,是病毒性皮肤病发作的一大诱因,也决定着临床症状和并发症的严重程度。目前传统治疗主要通过服用抑制或阻断病毒增殖的抗病毒药物,结合抗炎镇痛、神经营养、免疫调剂药物辅助治疗,以缩短病程为主要原则。然而,抗病毒药物通常在杀灭病毒的同时也会对自身免疫系统造成一定不良影响,因此存在耐药性、副作用较多等问题。另外由于环境污染、生活压力等因素对机体免疫力的持续损耗,使得常规治疗方法对病毒性皮肤病通常难以维持疗效。
2、中医对于病毒性皮肤病有着丰富的理论认识与治疗经验,无论是内服、外用制剂以及针灸,主要以扶正祛邪为治疗原则,均疗效确切,且无明显毒副作用。中医外治法采用中医治疗体系的中药,具有直接作用于病灶、疗效快、不良反应小、使用方便等优点。通过中医理论结合现代经皮给药制剂技术创新,促进优势产品的成果转化,发挥中医药外用制剂的市场竞争力、生产成本优势、销售价格优势与临床治疗优势,可以填补目前市场的空白,市场前景较广。
3、此外,关于中药制剂的质量控制技术已有长足发展,然而仅建立几个有效成分定性或定量的检测方法,并不能反应中医药多成分共同作用的药效特点,无法实现对质量水平的整体监控。本发明在提供抗病毒外用制剂的制备方法的基础上,完成对成品hplc指纹图谱的研究,从而对本发明抗病毒的外用制剂进行准确而高效的整体质量控制。
技术实现思路
1、为了克服现有技术中的缺陷,本发明提供了一种抗病毒的外用制剂的制备方法和质量控制方法。该制剂具备中药制剂作用缓和、多成分靶点治疗的特点,又具备直接达到作用部位、起效快和降低毒副作用的优点,可用于治疗病毒性皮肤病,具有良好的新药开发潜力。
2、为实现上述目的,本发明采用如下技术方案:
3、本发明的第一方面是提供一种抗病毒的外用制剂的制备方法,该外用制剂包括如下质量份数的原料:金银花10-20份,细辛8-15份,野菊花10-20份,鱼腥草12-20份,青蒿10-15份,板蓝根10-20份,冰片4-8份;
4、该制备方法包括如下步骤:
5、步骤一,将金银花、细辛、野菊花、鱼腥草、青蒿和板蓝根粉粹,获得药材粗粉;
6、步骤二,加入乙醇溶液使上述药材粗粉充分浸润后,进行提取;
7、步骤三,将步骤二获得的提取液减压浓缩后,加入冰片溶液,醇沉过夜,除杂滤过后取滤液;
8、步骤四,将上述滤液浓缩后加入适量辅料,定容,制成外用制剂。
9、进一步地,上述外用制剂的剂型为喷雾剂、酊剂、气雾剂、软膏剂或乳膏剂。
10、进一步地,上述外用制剂包括如下质量份数的原料:金银花15-20份,细辛9-12份,野菊花15-20份,鱼腥草12-15份,青蒿12-15份,板蓝根12-15份,冰片4-6份,优选包括如下质量份数的原料:金银花15份,细辛9份,野菊花15份,鱼腥草15份,青蒿12份,板蓝根15份,冰片4份。
11、进一步地,在步骤一中,板蓝根单独粉碎,金银花、细辛、野菊花、鱼腥草、青蒿混合粉碎,两者混合后即得药材粗粉。
12、进一步地,在步骤二中,药材粗粉以用量为药材粗粉量的5-8倍、浓度为40-60%的乙醇溶液静置充分浸润0.5-2h,然后以用量为药材粗粉量的5-15倍、浓度为40-60%的乙醇溶液提取5-9天后获得提取液;或
13、在步骤二中,药材粗粉以用量为药材粗粉量的2-8倍、浓度为30-60%的乙醇溶液进行浸渍2-4日,完成后收集提取液,药渣以相同方法继续浸渍多次,将提取液混合。
14、优选地,在步骤二中,药材粗粉以用量为药材粗粉量的8倍、浓度为40%的乙醇溶液静置充分浸润1h,然后以用量为药材粗粉量的8倍、浓度为40%的乙醇溶液浸渍7天后获得提取液;或
15、在步骤二中,药材粗粉以用量为药材粗粉量的4倍、浓度为50%的乙醇溶液进行浸渍3日,完成后收集提取液,药渣以相同方法继续浸渍,共浸渍3次,将提取液混合。
16、进一步地,冰片溶液是以纯乙醇为溶剂,配制成浓度为0.15~0.30g/ml(优选为0.20g/ml)的溶液而获得。
17、进一步地,步骤三,提取液减压浓缩至0.95~1.05g生药/1g浓缩液(优选至1g生药/1g浓缩液),醇沉,加入冰片溶液,静置过夜;过滤后获取滤液。
18、本发明的第二方面是提供上述制备方法制备的外用制剂。
19、本发明的第三方面是提供一种上述外用制剂的质量控制控制方法,通过建立hplc特征图谱,来实现对成品制剂的整体质量控制,包括如下步骤:
20、供试品溶液的制备:采用甲醇配制供试品溶液,其中供试品溶液的浓度为0.1-1.0g/ml(优选为0.2g/ml);
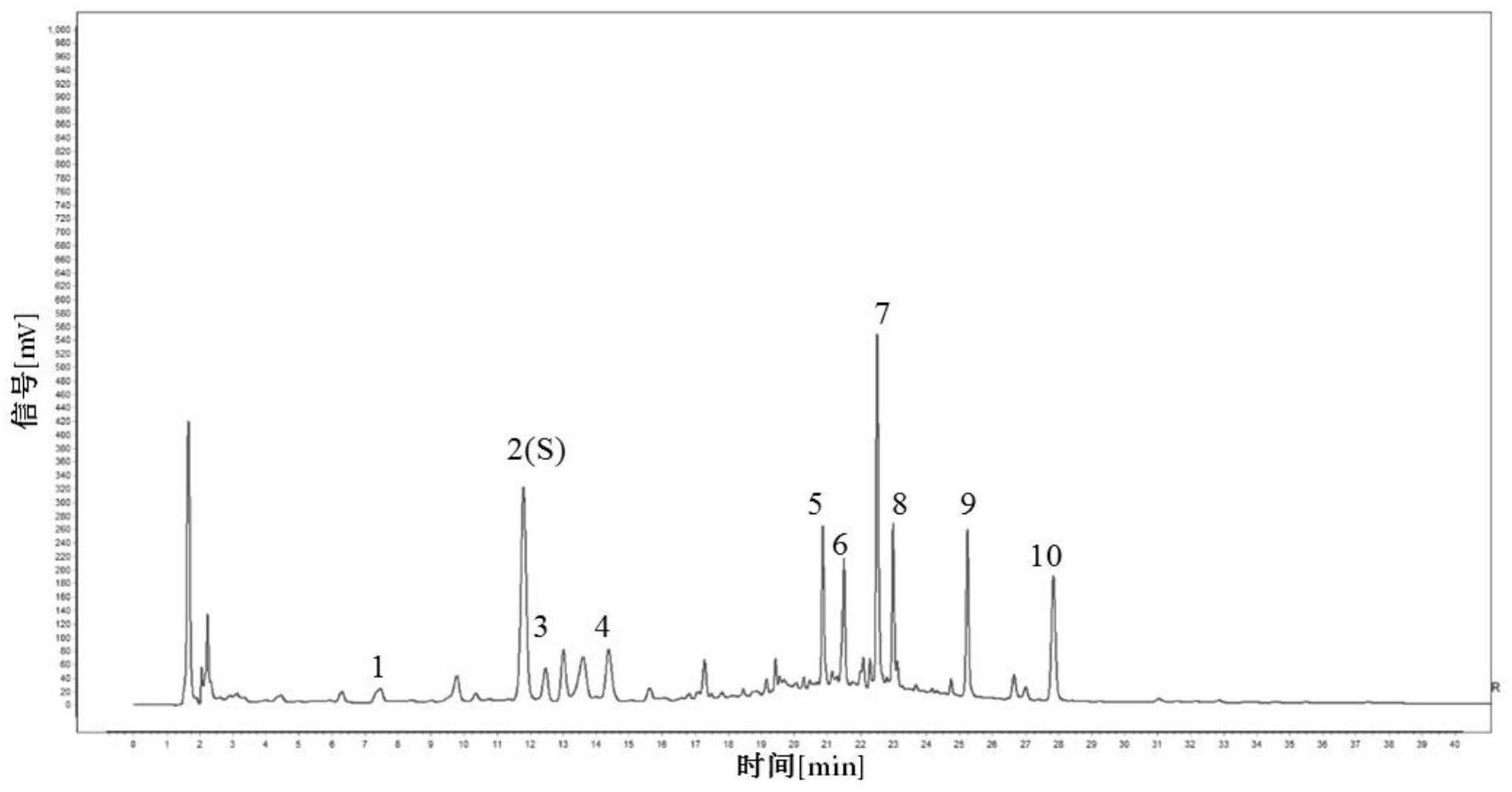
21、对照品溶液和标准品溶液的制备:取(r,s)-告依春、绿原酸、异绿原酸a、异绿原酸c、蒙花苷对照品适量,加入溶剂制成对照品混合溶液;以相同方法制成分别制备上述5种成分的标准品溶液,浓度与对照品混合溶液均保持一致;
22、采用hplc进行检测:色谱条件包括:以十八烷基硅烷键合硅胶为填充剂;以乙腈为流动相a,0.1%甲酸为流动相b,进行梯度洗脱;流速为每分钟0.2ml;柱温为25℃;检测波长为254nm;进样量为2μl。
23、进一步地,对照品混合溶液中每1ml分别含有(r,s)-告依春20μg,绿原酸0.4mg,异绿原酸a0.4 mg,异绿原酸c 0.4mg,蒙花苷0.1mg。
24、进一步地,梯度洗脱的程序为0-7min,5%流动相a;7-12min,5-10%流动相a;12-20min,10-30%流动相a;20-40min,30%流动相a。
25、进一步地,选用的色谱柱的规格为infinitylab poroshell 120ec-c18,柱长为150mm,内径为2.1mm,粒径为2.7μm。
26、进一步地,在hplc检测中,理论板数按绿原酸峰计算,不低于5000。
27、进一步地,供试品色谱中应呈现10个特征峰,其中,峰1、峰2、峰7、峰8、峰9应与(r,s)-告依春,绿原酸、异绿原酸a、异绿原酸c、蒙花苷对照品参照物峰的保留时间相对应;以绿原酸参照物峰相对应的峰为s峰,计算各特征峰与s峰的相对保留时间,其相对保留时间应在规定值的±10%范围之内,优选地,峰3、4、5、6、10的相对保留时间规定值分别为1.06、1.22、1.77、1.82、2.36。
28、本发明采用以上技术方案,与现有技术相比,具有如下技术效果:
29、本发明提供的外用制剂针对病毒性皮肤病疗效确切而稳定,且靶向性强、成本低、无不良反应、使用方便,具有较好的市场前景;本发明还提供了该外用制剂的质量控制方法,其中绿原酸特征峰为s峰,特征峰保留时间分布均匀,峰对称性好,基线平稳,分离度符合要求。该检测方法能够有效实现对制剂质量的全面控制,且方便快捷,准确可靠,重现性良好,成本较低,能够有效监控产品质量,确保产品的稳定性与质量可控性。
- 还没有人留言评论。精彩留言会获得点赞!