一种氨基吡喃衍生物的组合物的制作方法
本发明涉及一种氨基吡喃衍生物的组合物,更具体地说,涉及含氨基吡喃衍生物的口服固体制剂及其制备方法。
背景技术:
1、国际专利申请wo2015/192701和wo2015/192714公开了一系列氨基吡喃环衍生物,是一种较好的dppiv抑制剂,具有预防和/或治疗2型糖尿病的潜能,例如式(i)化合物、式(ii)化合物、式(iii)化合物,式(iii)化合物为式(ii)化合物的二盐酸盐等相关结构具有良好的降低血糖的功能,可用于治疗2型糖尿病,其结构如下所示:
2、
技术实现思路
1、本发明通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物存在易产生杂质、不稳定、质量不可控、不利于药物制剂的制备等缺点。
2、本发明提供了一种氨基吡喃衍生物的制剂,以便患者方便使用,制剂具有稳定、杂质少、质量可控的特点。
3、本发明提供了一种包含中性辅料的通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物制剂,解决了其易产生杂质、不稳定、质量不可控、不利于药物制剂的制备等缺点。
4、本发明提供了一种不包含还原糖的通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物制剂,解决了其易产生杂质、不稳定、质量不可控、不利于药物制剂的制备等缺点。
5、本发明提供了一种通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物制剂的制备方法。
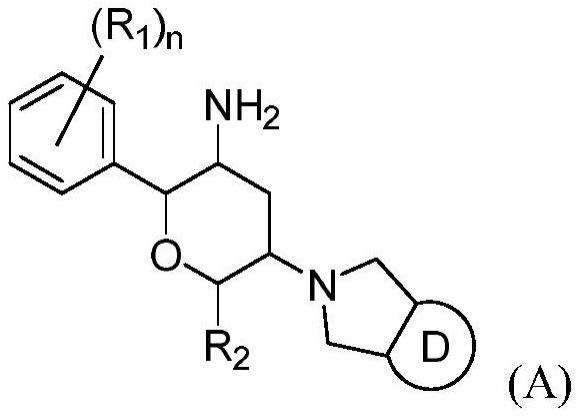
6、本发明提供了一种通式(a)化合物及其立体异构体、或其药学上可接受的盐或前药,其中
7、
8、r1各自独立的选自h、f、cl、br或i;
9、r2各自独立的选自h、f、cl、br、i或c1-4烷基,所述烷基任选进一步被0、1、2、3或4个选自h、f、cl、br或i的取代基所取代;
10、环d选自5元杂芳环基,所述的杂芳环基任选进一步被0、1、2、3或4个选自h、c1-4烷基、s(=o)2-c1-4烷基或d1的取代基所取代,所述的杂芳环基含有2或3个n原子;
11、d1各自独立的选自5元杂芳环基,所述的杂芳环基任选进一步被0、1、2、3或4个选自h或c1-4烷基的取代基所取代,所述的杂芳环基含有2、3或4个n原子;
12、n选自0、1、2、3、4或5。
13、在特定实例中,一种通式(a)化合物及其立体异构体、或其药学上可接受的盐或前药,其中
14、r1各自独立的选自h或f;r2各自独立的选自h或三氟甲基;
15、环d选自咪唑或吡唑,所述的咪唑或吡唑任选进一步被0、1、2、3或4个选自h、甲基、乙基、异丙基s(=o)2-甲基、s(=o)2-乙基、s(=o)2-异丙基或d1的取代基所取代;
16、d1各自独立的选自四氮唑,所述的四氮唑任选进一步被0、1、2、3或4个选自h、甲基、乙基或异丙基的取代基所取代;
17、n选自0、1、2、3、4或5。
18、在特定实例中,一种通式(a)化合物及其立体异构体、或其药学上可接受的盐或前药,其中药学上可接受的盐选自苯磺酸盐、水杨酸盐、苯甲酸盐、乙酸盐、s-(+)-扁桃酸盐、丙酸盐、巴豆酸盐、糠酸盐、肉桂酸盐、乙磺酸盐、羟基乙酸盐、乳酸盐、富马酸盐、甲酸盐、硫酸盐、氢溴酸盐、磷酸盐、三氟乙酸盐、酒石酸盐、柠檬酸盐、乙醇酸盐、盐酸盐、对甲苯磺酸盐、马来酸盐、丁二酸盐、草酸盐、甲磺酸盐、丙二酸盐或苹果酸盐。
19、根在特定实例中,一种通式(a)化合物及其立体异构体、或其药学上可接受的盐或前药,其中式(a)化合物选自如下结构之一:
20、
21、本发明提供了一种含有通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物的稳定的药物制剂;包含的制剂规格包括但不限于0.1-1mg,1-5mg,5-10mg,10-15mg,15-20mg,20-25mg,25-30mg,30-35mg,35-40mg,40-45mg和45-50mg规格的通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物;更具体来说,本制剂所含规格但不限于0.5mg,5mg,10mg,12.5mg,15mg,20mg、25mg和30mg规格的通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物;更优选5mg,12.5mg,15mg,25mg,30mg规格的通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物。
22、通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物在制剂中的所占比例包括但不限于,0.1%-50%重量百分比,0.1%-1%重量百分比、0.1%-2%重量百分比、0.1%-5%重量百分比、1%-10%重量百分比、5%-10%重量百分比、10%-25%重量百分比、20%-35%重量百分比、30-40%重量百分比、25%-50%重量百分比。例如通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物占制剂的百分比选自但不限于0.1%重量百分比、0.7%重量百分比、1%重量百分比、7.1%重量百分比、25.0%重量百分比、8.3%重量百分比、21.4%重量百分比、31.5%重量百分比、31.3%重量百分比、37.5%重量百分比、41.7%重量百分比,优选于高载药量的制剂。
23、在特定实例中,通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物在制剂中的含量选自0.1%-50%重量百分比、0.1%-1%重量百分比、0.1%-2%重量百分比、0.1%-5%重量百分比、1%-10%重量百分比、5%-10%重量百分比、10%-25%重量百分比、20%-35%重量百分比、0.1%-0.2%重量百分比、0.6%-0.8%重量百分比、7.0%-9.0%重量百分比、6.0%-8.0%重量百分比、20.5%-22.5%重量百分比、24.0%-26.0%重量百分比、30.0%-32.0%重量百分比、36.5%-38.5%重量百分比。
24、在通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物的制剂中,所用辅料优选使用中性稀释剂,所述稀释剂不含还原糖或还原糖混合物(稀释剂中允许含有少量以杂质形式存在的还原糖),辅料种类包括但不限于稀释剂、崩解剂、润滑剂、助流剂、表面活性剂、抗氧剂或甜味剂。
25、中性稀释剂为不含离子电荷的稀释剂。
26、在本发明的特定实例中,所用辅料占制剂重量百分比不低于90%,在本发明的另一些特定实例中,所用辅料占制剂重量百分比不低于80%,在本发明的还有一些特定实例中,所用辅料占制剂重量百分比不低于70%,在本发明的也有一些特定实例中,所用辅料占制剂重量百分比不低于60%,在本发明的也有一些特定实例中,所用辅料占制剂重量百分比不低于50%,在本发明的也有一些特定实例中,所用辅料占制剂重量百分比不低于40%。
27、在本发明的特定实例中,所用辅料占制剂重量百分比选自90%-99.9%、80%-99.9%、70%-99.9%、60%-99.9%、50%-99.9%、40%-99.9%。
28、本发明中所用的稀释剂包括但不限于蔗糖、甘露醇、微晶纤维素、木糖醇、麦芽糖醇、乳糖醇、淀粉、预胶化淀粉、羟丙基纤维素、羟丙甲纤维素和山梨醇中的一种或多种。本发明中优选于使用的稀释剂包括但不限于甘露醇、微晶纤维素、淀粉或预胶化淀粉中的一种或多种。
29、本发明中通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物药物制剂的辅料所选稀释剂不含有一水乳糖、硅化微晶纤维素、羟乙基纤维素、无水乳糖、葡萄糖、麦芽糖及其它还原性糖。
30、在本发明的特定实例中,稀释剂所占制剂重量百分比为80%-90%,在本发明的也有一些特定实例中,稀释剂所占制剂重量百分比为70%-80%,在本发明的还有一些特定实例中,稀释剂所占制剂重量百分比为60%-70%,在本发明的还有一些特定实例中,稀释剂所占制剂重量百分比为50%-60%。
31、在特定实例中,稀释剂所占制剂重量百分比选自40%-96%、50%-96%、60%-96%、70%-96%、80%-96%或90%-96%、50%-99%。
32、在本发明的特定实例中,稀释剂在单位制剂中的用量包括但不限于10-50mg,20-50mg,30-50mg,40-50mg。在其它一些特定实例中,稀释剂在单位制剂中的用量包括但不限于20-60mg,30-60mg,40-60mg,50-60mg。在其它一些特定实例中,稀释剂在单位制剂中的用量包括但不限于20-70mg,30-70mg,40-70mg,50-70mg,60-70mg。在其它一些特定实例中,稀释剂在单位制剂中的用量包括但不限于30-80mg,40-80mg,50-80mg,60-80mg,70-80mg。在其它一些特定实例中,稀释剂在单位制剂中的用量包括但不限于40-90mg,50-90mg,60-90mg,70-90mg,80-90mg。在其它一些特定实例中,稀释剂在单位制剂中的用量包括但不限于40-100mg,50-100mg,60-100mg,70-100mg,80-100mg。
33、在其它一些特定实例中,稀释剂在单位制剂中的用量包括但不限于100-150mg,110-150mg,120-150mg,130-150mg,140-150mg。在其它一些特定实例中,稀释剂在单位制剂中的用量包括但不限于150-200mg,160-200mg,170-200mg,180-200mg,190-200mg。在其它一些特定实例中,稀释剂在单位制剂中的用量包括但不限于200-250mg,210-250mg,220-250mg,230-250mg,240-250mg。在其它一些特定实例中,稀释剂在单位制剂中的用量包括但不限于250-300mg,260-300mg,270-300mg,280-300mg,290-300mg。在其它一些特定实例中,稀释剂在单位制剂中的用量包括但不限于300-350mg,310-350mg,320-350mg,330-350mg,340-350mg。
34、在本发明的特定实例中,稀释剂选择为两种稀释剂的混合物,本发明优选微晶纤维素和甘露醇。在特定实例中,该混合物占制剂的重量百分比为40%-96%,微晶纤维素占该混合物的重量百分比为55%-75%。该混合物占制剂的重量百分比为40%-90%,其中微晶纤维素占制剂重量百分比为40%-60%。在另一些特定实例中,该混合物占制剂的重量百分比为50%-90%,其中微晶纤维素占制剂重量百分比为50%-70%。在另一些特定实例中,该混合物占制剂的重量百分比为60%-90%,其中微晶纤维素占制剂重量百分比为10%-50%。在另一些特定实例中,该混合物占制剂的重量百分比为70%-90%,其中微晶纤维素占制剂重量百分比为20%-50%。
35、在特定实例中,所述稀释剂选择为两种稀释剂的混合物,本发明优选微晶纤维素和甘露醇。所述此混合物占制剂含量选自40%-96%重量百分比、50%-90%重量百分比、60%-90%重量百分比、70%-96%重量百分比、80%-96%重量百分比、90%-96%重量百分比,其中微晶纤维素所占此混合物的含量选自10%-90%重量百分比、40%-60%重量百分比、10%-50%重量百分比、50%-70%重量百分比、55%-75%重量百分比、20%-50%重量百分比。
36、在特定实例中,稀释剂选择为两种稀释剂的混合物,本发明优选微晶纤维素和甘露醇。在特定实例中,该混合物在单位制剂中用量为30-50mg,其中微晶纤维素为30-40mg。在另一些特定实例中,该混合物在单位制剂中为30-60mg,其中微晶纤维素用量为20-40mg。在另一些特定实例中,该混合物在单位制剂中用量为30-70mg,其中微晶纤维素用量为10-40mg。
37、在另一些特定实例中,该混合物在单位制剂中用量为30-80mg,其中微晶纤维素用量为10-50mg。在另一些特定实例中,该混合物在单位制剂中用量为80-100mg,其中微晶纤维素用量为20-50mg。在另一些特定实例中,该混合物在单位制剂中用量为80-120mg,其中微晶纤维素用量为20-60mg。在另一些特定实例中,该混合物在单位制剂中用量为80-140mg,其中微晶纤维素用量为20-70mg。在另一些特定实例中,该混合物在单位制剂中用量为100-160mg,其中微晶纤维素用量为30-80mg。在另一些特定实例中,该混合物在单位制剂中用量为100-180mg,其中微晶纤维素用量为30-90mg。在另一些特定实例中,该混合物在单位制剂中用量为100-200mg,其中微晶纤维素用量为30-100mg。在另一些特定实例中,该混合物在单位制剂中用量为100-220mg,其中微晶纤维素用量为30-110mg。在另一些特定实例中,该混合物在单位制剂中用量为100-240mg,其中微晶纤维素用量为30-120mg。在另一些特定实例中,该混合物在单位制剂中用量为100-260mg,其中微晶纤维素用量为30-130mg。
38、在特定实例中,制剂处方含34.81mg微晶纤维素和17.40mg甘露醇。
39、在特定实例中,制剂处方含15.00mg微晶纤维素和37.22mg甘露醇。
40、在特定实例中,制剂处方含微晶纤维素17.4mg和甘露醇34.8mg。
41、在特定实例中,制剂处方含55.59mg微晶纤维素和111.18mg甘露醇。
42、在本发明的特定实例中,药物制剂包含一种或几种润滑剂或助流剂。润滑剂包括但不限于硬脂酸镁、硬脂酸钙、硬脂酸、硬脂富马酸钠、氢化蓖麻油中的一种或多种。本发明优选硬脂酸镁。助流剂包括但不限于胶体二氧化硅、磷酸钙、硅酸镁和滑石粉中的一种或多种。
43、在特定实例中,润滑剂在单位制剂中的用量包括但不限于0.25-0.5mg、0.25-0.6mg、0.25-0.7mg、0.25-0.8mg、0.25-0.9mg、0.25-1.0mg、0.25-1.1mg、0.25-1.2mg、0.25-1.3mg、0.25-1.4mg、0.25-1.5mg、1.0-2.0mg、1.0-2.5mg、1.0-3.0mg、1.0-3.5mg、1.0-4.0mg、1.0-4.5mg、1.0-5.0mg。
44、在特定实例中,助流剂在单位制剂中的用量包括但不限于1-5mg、2-6mg、3-7mg、4-8mg。
45、特定实例中,润滑剂的用量占制剂的重量百分比包括但不限于0.05%-0.1%、0.05%-0.5%、0.05%-1%、0.05%-2%、0.05%-3%、1%-2%、1%-3%、2%-3%、2%-4%、2%-5%。特定实例中,助流剂的用量占制剂的重量百分比包括但不限于1%-2%、1%-3%、1%-4%、1%-5%。
46、合适的润滑剂用量,能让药物制剂有较好的外观形状,适宜的硬度,适中的崩解时限,因此润滑剂的用量对通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物的药物制剂非常重要。在该申请中,单位剂量重量百分比的2%或更多的润滑剂,能为通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物提供良好硬度、崩解及片剂外观。
47、在特定实例中,药物制剂可以包含崩解剂,包括但不限于交联羧甲基纤维素钠、羧甲基淀粉钠、低取代羟丙纤维素、交联聚维酮以及羧甲基纤维素钙中的一种或多种。在特定实施实例中,崩解剂为交联聚维酮。
48、特定实例中,崩解剂的用量占制剂的重量百分比包括但不限于1%-2%、1%-3%、1%-4%、1%-5%、1%-6%。
49、在特定实例中,药物制剂可以包含一种或多种中性表面活性剂或润湿剂。中性表面活性剂包括但不限于单油酸甘油酯、聚山梨酯、聚乙烯醇、山梨酯中的一种或多中。润湿剂包括但不限于泊洛沙姆、聚氧乙烯烷基醚、聚氧乙烯蓖麻油衍生物以及聚氧乙烯硬脂酸酯中的一种或多种。
50、在特定实例中,药物制剂可以进一步包含抗氧剂以增加制剂的稳定性,包括但不限于维生素e、α-生育酚、维生素c和其相关的钠盐或钙盐、棕榈酸维生素c酯、没食子酸丙酯、没食子酸辛酯、没食子酸月桂酯、丁羟甲苯(bht)、丁羟基茴香醚(bha)中的一种或多中。在特定实例中,抗氧剂选择bht或bha中的一种或多中。
51、特定实例中,抗氧剂的用量占制剂的重量百分比包括但不限于0%-2%、0%-1%、0.1%-1%、0.2%-0.8%、0.4%-0.8%。
52、在特定实例中,药物制剂中所述的辅料进一步可包含润滑剂、助流剂、崩解剂、表面活性剂、润湿剂、抗氧剂中的一种或多种。
53、在特定实例中,药物制剂中所述的润滑剂选自硬脂酸镁、硬脂酸钙、硬脂酸、硬脂富马酸钠、氢化蓖麻油中的一种或多种;助流剂选自胶体二氧化硅、磷酸钙、硅酸镁和滑石粉中的一种或多种;崩解剂选自交联羧甲基纤维素钠、羧甲基淀粉钠、交联聚维酮以及羧甲基纤维素钙中的一种或多种;表面活性剂选自单油酸甘油酯、聚山梨酯、聚乙烯醇、山梨酯中的一种或多种;润湿剂选自泊洛沙姆、聚氧乙烯烷基醚、聚氧乙烯蓖麻油衍生物以及聚氧乙烯硬脂酸酯中的一种或多种;抗氧剂选自维生素e、α-生育酚、维生素c和其相关的钠盐或钙盐、棕榈酸维生素c酯、没食子酸丙酯、没食子酸辛酯、没食子酸月桂酯、丁羟甲苯(bht)、丁羟基茴香醚(bha)中的一种或多种。
54、在特定实例中,药物制剂中所述的润滑剂含量选自0.05%-0.1%重量百分比、0.05%-0.5%重量百分比、0.05%-1%重量百分比、0.05%-2%重量百分比、0.05%-3%重量百分比、1%-2%重量百分比、1%-3%重量百分比、2%-3%、2%-4%重量百分比;助流剂含量选自1%-2%重量百分比、1%-3%重量百分比、1%-4%重量百分比、1%-5%重量百分比;崩解剂含量选自1%-5%重量百分比、1%-3%重量百分比;抗氧剂含量选自0%-2%、0%-1%、0.1%-1%重量百分比、0.2%-0.8%重量百分比、0.4%-0.8%重量百分比。
55、通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物优选剂型为片剂,包括但不限于湿法制粒或干法制粒压片及直接压片;在特定实例中为未包衣片;在其它一些实例中为含羟丙甲纤维素的卡乐康速释包衣粉包衣片;也有在特定实例中为尤特奇epo包衣粉包衣片。
56、在特定实例中,制剂可以进一步选择添加或不添加矫味剂或甜味剂。
57、在特定实例中,药物制剂包含1%-38%(w/w)的通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物、0.4%-0.8%(w/w)的bht、50%-96%(w/w)的微晶纤维素和甘露醇混合物或50%-96%(w/w)的微晶纤维素和预胶化淀粉混合物、2%的交联聚维酮、2%的硬脂酸镁。
58、在特定实例中,药物制剂包含1%-38%重量百分比的通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物、0%-0.8%重量百分比的抗氧剂、50%-96%重量百分比的稀释剂、1%-3%重量百分比的崩解剂、1%-3%重量百分比的润滑剂。
59、在特定实例中,药物制剂包含1%-38%重量百分比的通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物、0%-0.8%重量百分比的bht、50%-96%重量百分比的微晶纤维素和甘露醇混合物或50%-96%重量百分比的微晶纤维素和预胶化淀粉混合物、1%-3%重量百分比的交联聚维酮、1%-3%重量百分比的硬脂酸镁。
60、在特定实例中,药物制剂包含通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物含量选自0.1%-50%重量百分比、0.1%-1%重量百分比、0.1%-2%重量百分比、0.1%-5%重量百分比、1%-10%重量百分比、5%-10%重量百分比、10%-25%重量百分比、20%-35%重量百分比、0.1%-0.2%重量百分比、0.6%-0.8%重量百分比、7.0%-9.0%重量百分比、6.0%-8.0%重量百分比、20.5%-22.5%重量百分比、24.0%-26.0%重量百分比、30.0%-32.0%重量百分比、36.5%-38.5%重量百分比。
61、在特定实例中,式(i)化合物制剂包含0.5mg式(i)化合物,0.38mg抗氧剂,47.12mg非还原糖稀释剂非还原糖稀释剂混合物,1.0mg崩解剂,1.0mg润滑剂。
62、在特定实例中,式(i)化合物制剂包含0.5mg式(i)化合物,0.38mgbht,30.4mg微晶纤维素,16.72mg甘露醇,1.0mg交聚维酮,1.0mg硬脂酸镁。
63、在特定实例中,式(i)化合物制剂包含5mg式(i)化合物,0.38mg抗氧剂,52.22mg非还原糖稀释剂或非还原糖稀释剂混合物,1.2mg崩解剂,1.2mg润滑剂。
64、在特定实例中,式(i)化合物制剂包含5mg式(i)化合物,0.38mgbht,36.46mg微晶纤维素,15.76mg甘露醇,1.2mg交聚维酮,1.2mg硬脂酸镁。
65、在特定实例中,式(i)化合物制剂包含25mg式(i)化合物,0.38mg抗氧剂,51.42mg非还原糖稀释剂或非还原糖稀释剂混合物,1.6mg崩解剂,1.6mg润滑剂。
66、在特定实例中,式(i)化合物制剂包含25mg式(i)化合物,0.38mgbht,36.42mg微晶纤维素,15mg甘露醇,1.6mg交聚维酮,1.6mg硬脂酸镁。
67、此处所描述的制剂处方,可以采用湿法制粒或干法制粒或直接压片制得片剂。在特定实例中,制剂处方采用湿法制粒机制得颗粒,然后进行压片,在另外特定实例中,利用流化床制备颗粒,然后进行压片。
68、在其它特定实例中,所描述的制剂处方采用直接压片或干法制粒后压片制得。干法制粒压片采用干法制粒机制得颗粒。
69、在特定实例中,式(i)化合物制剂包含0.5mg式(i)化合物,0.38mg抗氧剂,67.02mg非还原糖稀释剂或非还原糖稀释剂混合物,1.4mg崩解剂,0.7mg润滑剂。
70、在特定实例中,式(i)化合物制剂包含0.5mg式(i)化合物,0.38mgbht,40mg微晶纤维素,27.02mg预胶化淀粉,1.4mg交聚维酮,0.7mg硬脂酸镁。
71、在特定实例中,式(i)化合物制剂包含5mg式(i)化合物,0.38mg抗氧剂,62.52mg非还原糖稀释剂或非还原糖稀释剂混合物,1.4mg崩解剂,0.7mg润滑剂。
72、在特定实例中,式(i)化合物制剂包含5mg式(i)化合物,0.38mgbht,40mg微晶纤维素,22.52mg预胶化淀粉,1.4mg交聚维酮,0.7mg硬脂酸镁。
73、在特定实例中,式(i)化合物制剂包含25mg式(i)化合物,0.38mg抗氧剂,71.62mg非还原糖稀释剂或非还原糖稀释剂混合物,2mg崩解剂,1mg润滑剂。
74、在特定实例中,式(i)化合物制剂包含25mg式(i)化合物,0.38mgbht,45mg微晶纤维素,26.62mg预胶化淀粉,2mg交聚维酮,1mg硬脂酸镁。
75、此处所描述的制剂处方,可以采用湿法制粒或干法制粒或直接压片制得片剂。在特定实例中,制剂处方采用湿法制粒机制得颗粒,然后进行压片,在另外特定实例中,利用流化床制备颗粒,然后进行压片。
76、在其它特定实例中,所描述的制剂处方采用直接压片或干法制粒后压片制得。干法制粒压片采用干法制粒机制得颗粒。
77、在特定实例中,式(i)化合物制剂包含0.5mg式(i)化合物,47.5mg非还原糖稀释剂或非还原糖稀释剂混合物,1.0mg崩解剂,1.0mg润滑剂。
78、在特定实例中,式(i)化合物制剂包含0.5mg式(i)化合物,30.4mg微晶纤维素,17.1mg甘露醇,1.0mg交聚维酮,1.0mg硬脂酸镁。
79、在特定实例中,式(i)化合物制剂包含5mg式(i)化合物,52.6mg非还原糖稀释剂或非还原糖稀释剂混合物,1.2mg崩解剂,1.2mg润滑剂。
80、在特定实例中,式(i)化合物制剂包含5mg式(i)化合物,36.46mg微晶纤维素,16.14mg甘露醇,1.2mg交聚维酮,1.2mg硬脂酸镁。
81、在特定实例中,式(i)化合物制剂包含25mg式(i)化合物,51.8mg非还原糖稀释剂或非还原糖稀释剂混合物,1.6mg崩解剂,1.6mg润滑剂。
82、在特定实例中,式(i)化合物制剂包含25mg式(i)化合物,36.8mg微晶纤维素,15mg甘露醇,1.6mg交聚维酮,1.6mg硬脂酸镁。
83、此处所描述的制剂处方,可以采用湿法制粒或干法制粒或直接压片制得片剂。在特定实例中,制剂处方采用湿法制粒机制得颗粒,然后进行压片,在另外特定实例中,利用流化床制备颗粒,然后进行压片。
84、在其它特定实例中,所描述的制剂处方采用直接压片或干法制粒后压片制得。干法制粒压片采用干法制粒机制得颗粒。
85、在特定实例中,式(i)化合物制剂包含0.5mg式(i)化合物,67.4mg非还原糖稀释剂或非还原糖稀释剂混合物,1.4mg崩解剂,0.7mg润滑剂。
86、在特定实例中,式(i)化合物制剂包含0.5mg式(i)化合物,40mg微晶纤维素,27.4mg预胶化淀粉,1.4mg交聚维酮,0.7mg硬脂酸镁。
87、在特定实例中,式(i)化合物制剂包含5mg式(i)化合物,62.9mg非还原糖稀释剂或非还原糖稀释剂混合物,1.4mg崩解剂,0.7mg润滑剂。
88、在特定实例中,式(i)化合物制剂包含5mg式(i)化合物,0.38mgbht,40mg微晶纤维素,22.9mg预胶化淀粉,1.4mg交聚维酮,0.7mg硬脂酸镁。
89、在特定实例中,式(i)化合物制剂包含25mg式(i)化合物,72mg非还原糖稀释剂或非还原糖稀释剂混合物,2mg崩解剂,1mg润滑剂。
90、在特定实例中,式(i)化合物制剂包含25mg式(i)化合物,45mg微晶纤维素,27mg预胶化淀粉,2mg交聚维酮,1mg硬脂酸镁。
91、此处所描述的制剂处方,可以采用湿法制粒或干法制粒或直接压片制得片剂。在特定实例中,制剂处方采用湿法制粒机制得颗粒,然后进行压片,在另外特定实例中,利用流化床制备颗粒,然后进行压片。
92、在其它特定实例中,所描述的制剂处方采用直接压片或干法制粒后压片制得。干法制粒压片采用干法制粒机制得颗粒。
93、在特定实例中,式(i)化合物制剂包含0.5mg式(i)化合物,56.72mg非还原糖稀释剂或非还原糖稀释剂混合物,1.2mg崩解剂,1.2mg润滑剂。
94、在特定实例中,式(i)化合物制剂包含0.5mg式(i)化合物,0.38mgbht,18.91mg微晶纤维素,37.81mg甘露醇,1.2mg交聚维酮,1.2mg硬脂酸镁。
95、在特定实例中,式(i)化合物制剂包含5mg式(i)化合物,52.2mg非还原糖稀释剂或非还原糖稀释剂混合物,1.2mg崩解剂,1.2mg润滑剂。
96、在特定实例中,式(i)化合物制剂包含5mg式(i)化合物,0.38mgbht,17.4mg微晶纤维素,34.8mg甘露醇,1.2mg交聚维酮,1.2mg硬脂酸镁。
97、在特定实例中,式(i)化合物制剂包含25mg式(i)化合物,166.8mg非还原糖稀释剂或非还原糖稀释剂混合物,4mg崩解剂,4mg润滑剂。
98、在特定实例中,式(i)化合物制剂包含25mg式(i)化合物,0.223mgbht,55.6mg微晶纤维素,111.2mg甘露醇,4mg交聚维酮,4mg硬脂酸镁。
99、此处所描述的制剂处方,可以采用湿法制粒或干法制粒或直接压片制得片剂。在特定实例中,制剂处方采用湿法制粒机制得颗粒,然后进行压片,在另外特定实例中,利用流化床制备颗粒,然后进行压片。
100、在其它特定实例中,所描述的制剂处方采用直接压片或干法制粒后压片制得。干法制粒压片采用干法制粒机制得颗粒。
101、本发明还提供一种药物制剂在制备用于糖尿病的药物中的用途,其中所述的药物制剂包含0.10mg-50mg规格的通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物;优选地,其中所述的药物制剂包含0.1-1mg、1-5mg、5-10mg、10-15mg、15-20mg、20-25mg、25-30mg、30-35mg、35-40mg、40-45mg或者45-50mg规格的通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物,进一步优选地,其中所述的药物制剂包含0.5mg、5mg、10mg、12.5mg、15mg,20mg、25mg或者30mg规格的通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物。
102、本发明提供一种药物制剂在制备用于糖尿病的药物中的用途,所述的用途通过给予受试者包含上述所涉及的药物制剂。
103、本发明提供一种药物制剂在制备用于糖尿病的药物中的用途,所述的用途通过口服的方式给药。
104、本发明提供一种药物制剂在制备用于糖尿病的药物中的用途,所述的方式给药包括:口服,一天一次、一周一次、两周一次或者1个月一次。
105、本发明提供一种药物制剂在制备用于糖尿病的药物中的用途,其中所述的用途通过给予受试者包含上述所涉及的药物制剂,通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物的给药剂量选自1-500mg/次。
106、本发明提供一种药物制剂在制备用于糖尿病的药物中的用途,其中所述的用途通过给予受试者包含上述所涉及的药物制剂,通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物的给药剂量选自1-400mg/次、1-350mg/次、1-300mg/次。
107、本发明提供一种药物制剂在制备用于糖尿病的药物中的用途,其中所述的用途通过给予受试者包含上述所涉及的药物制剂,通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物的给药剂量选自1-5mg/次、5-10mg/次、10-20mg/次、20-25mg/次、25-50mg/次、50-75mg/次、75-100mg/次、100-125mg/次、125-150mg/次、150-175mg/次、175-200mg/次、200-225mg/次、225-250mg/次、250-275mg/次、275-300mg/次。
108、本发明提供一种药物制剂在制备用于糖尿病的药物中的用途,其中所述的用途通过给予受试者包含上述所涉及的药物制剂,通式(a)化合物、式(i)化合物、式(ii)化合物或式(iii)化合物的给药剂量选自5mg/次、10mg/次、20mg/次、25mg/次、50mg/次、75mg/次、100mg/次、125mg/次、150mg/次、175mg/次、200mg/次、225mg/次、250mg/次、275mg/次、300mg/次。
109、除非有相反的陈述,在说明书和权利要求书中使用的术语具有下述含义。
110、“药学上可接受的盐”是指安全、无毒的并且既不在生物学上也不再其它方面不合乎需要,并且包括其对于兽医使用以及人类药物使用上药学可接受的,并且具有所期望的药理学活性的盐。
111、“前药”是指可经体内代谢转化为具有生物活性的本发明化合物。本发明的前药通过修饰本发明化合物中的酚基团来制备,该修饰可以通过常规的操作或者在体内被除去,而得到母体化合物。当本发明的前药被施予哺乳动物个体时,前药被割裂形成游离的羟基。
112、“立体异构体”是指由分子中原子在空间上排列方式不同所产生的异构体,包括顺反异构体、对映异构体和构象异构体。
113、“任选”或“任选地”或“选择性的”或“选择性地”是指随后所述的事件或状况可以但未必发生,该描述包括其中发生该事件或状况的情况及其中未发生的情况。例如,“选择性地被烷基取代的杂环基”是指该烷基可以但未必存在,该描述包括其中杂环基被烷基取代的情况,及其中杂环基未被烷基取代的情况。
- 还没有人留言评论。精彩留言会获得点赞!