一种改善肿瘤乏氧协同化疗增效的新型纳米药物
本发明属于脂质体纳米药物领域,具体涉及一种改善肿瘤缺氧微环境和化学疗法相结合的新型复合纳米制剂的制备方法及其抗肿瘤应用。
背景技术:
1、神经母细胞瘤(neuroblastoma,nb)是一种发生于婴儿期和儿童早期的交感神经系统肿瘤,临床称其为儿童肿瘤之王。目前多采用手术以及放化疗进行nb的治疗。因患者的年龄普遍偏低,为治疗带来极大挑战。
2、缺氧是侵袭性肿瘤的典型特征,常伴随肿瘤快速生长,血供不足的情况。在缺氧条件下,缺氧诱导因子-1α(hypoxia inducible factors 1α,hif-1α)的表达与肿瘤局部侵袭、远端转移及对放化疗抵抗密切相关。研究人员在对nb临床肿瘤标本中hif-1α的表达水平进行分析时发现hif-1α的高表达与肿瘤晚期分期和分化呈正相关,这一现象提示hif-1α是nb进展的潜在生物标志物。基于此,本发明考虑将hif-1α抑制剂与化疗药物联用,在化疗药物杀伤肿瘤细胞的同时,显著改善肿瘤乏氧微环境,通过增强肿瘤对化疗敏感性以克服肿瘤耐药,实现对nb的有效治疗。
3、坦螺旋霉素,简称17-aag,是一种强效hsp90抑制剂,ic50为5nm,分子式为c31h43n3o8。17-aag作为第一代hsp90的强效抑制剂在科研中被广泛研究。17-aag通过与hsp90的n端atp口袋结合,进一步诱导hsp90功能缺失,最终使得另一种不依赖氧的e3泛素连接酶去促进hif-1α的降解。并且17-aag也能够从基因水平上减少hif-1α表达量,其与hsp90结合导致的hsp90功能的缺失也会降低hif-1α的转录活性。以上途径均使得17-aag能够实现对于hif-1α的抑制,进而实现对肿瘤缺氧微环境的有效改善。
4、
5、阿霉素(doxorubicin,dox)是一种广谱化疗药物,分子式为c27h29no11,常用于神经母细胞瘤的临床治疗。阿霉素通过抑制肿瘤细胞dna和rna的合成,发挥强烈的细胞毒性作用。但是阿霉素对正常细胞也存在毒性,因此临床上患者使用阿霉素后会产生明显的不良反应,主要包括骨髓抑制与心脏毒性。同时患者在长期化疗下,肿瘤将产生明显的耐药性,导致治疗效果下降。由于阿霉素分子水溶性较差,临床上多采用其盐酸盐形式,即盐酸阿霉素用于癌症治疗。故本发明选用盐酸阿霉素作为化疗模型药物。
6、
7、盐酸阿霉素化学结构式。
8、脂质体是癌症治疗中最成功的且应用最为广泛的纳米药物之一。自从1995年聚乙二醇化脂质体阿霉素成为fda批准的第一种纳米药物以来,目前fda已经批准了六种以上的脂质体药物用于癌症治疗。纳米脂质体是一种具有均匀脂质核心的脂质囊泡。其本质是一种固体油脂颗粒,主要由磷脂、胆固醇等为膜材包合而成。脂质体具有亲水相的内核与亲油相的磷脂双分子层,能够同时负载具备不同理化性质的多种药物对肿瘤进行治疗,其能有效改善药物的溶解性并且降低药物的毒副作用。通过使用二硬脂酰基磷脂酰乙醇胺-聚乙二醇(dspe-peg2000)修饰脂质体,其体内循环时间明显提升,同时实体瘤组织的高通透性和滞留效应(epr)效应使得脂质体能够通过被动靶向的方式靶向肿瘤组织并实现杀伤。
技术实现思路
1、本发明旨在利用纳米脂质体作为纳米载体双递送化疗药盐酸阿霉素(dox)与缺氧诱导因子抑制剂坦螺旋霉素(17-aag),构建一种具备肿瘤靶向性的新型双载药纳米脂质体实现神经母细胞瘤的治疗。
2、本发明采用薄膜水化法将脂溶性药物17-aag嵌入脂质双分子层,再通过主动载药法将水溶性药物盐酸阿霉素包载于脂质体内核空腔中实现双药负载。此脂质体纳米药物显著改善17-aag的水溶性,提升双药在肿瘤区域的续集能力,发挥双药的协同作用,增强肿瘤杀伤效果并降低周身毒副作用。
3、基于以上目的,本发明首先制备了一种双载药纳米脂质体,所述双载药纳米脂质体中包括磷脂双分子层结构、负载在磷脂双分子层结构疏水腔中的缺氧诱导因子抑制剂坦螺旋霉素(17-aag)和磷脂双分子层结构的亲水内核中的化疗药物盐酸阿霉素(dox),所述磷脂双分子层结构包含卵磷脂、胆固醇和二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000。
4、大豆卵磷脂(spc)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(dspe-peg2000)、坦螺旋霉素(17-aag)、盐酸阿霉素(dox)重量比为:5~12:0.5~4:1:0.1~2:1~5。
5、一些具体的双载药纳米脂质体,卵磷脂、胆固醇、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000、坦螺旋霉素、盐酸阿霉素的重量比为:7~9:1.5~2.5:1:0.5~1.5:2~3。
6、一些具体的双载药纳米脂质体,卵磷脂、胆固醇、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000、坦螺旋霉素、盐酸阿霉素的重量比为:8:2:1:1:2.5。
7、一些具体的双载药纳米脂质体,所述的纳米药物直径为50-400nm。
8、一些具体的双载药纳米脂质体,所述的纳米药物直径为90-140nm。
9、一些具体的双载药纳米脂质体,所述的纳米药物直径为100-120nm。
10、本发明提供一种双载药纳米脂质体的制备方法,该方法包括如下步骤:
11、(1)将卵磷脂、胆固醇、dspe-peg2000的混合溶液与17-aag溶液混合后旋转蒸发除去溶剂得到药物脂质体薄膜;
12、(2)将ph 4.0的柠檬酸溶液加入步骤(1)所述药物脂质体薄膜中惰性气体环境下进行水化,得到药物脂质体悬液;
13、(3)使用碳酸钠溶液调节药物脂质体悬液的ph值至6.5-7.5;
14、(4)向步骤(3)的悬液中加入盐酸阿霉素溶液,惰性气体环境下进行水化;
15、(5)水化结束后超声一定时间,然后将样品挤过水系聚碳酸酯滤膜后得到纳米药物或者冻干后得到纳米药物。
16、卵磷脂、胆固醇、dspe-peg2000、17-aag、盐酸阿霉素的质量比为:5~12:0.5~4:1:0.1~2:1~5。
17、步骤2的水化结束后薄膜消失,脂质与药物均匀分布于溶液中。
18、步骤5中超声结束后脂质体溶液变成澄清透明溶液,观察不到浑浊物。
19、一些具体的双载药纳米脂质体的制备方法,步骤(2)和(4)中的水化温度为50℃-60℃,水化时间为40-80min;
20、步骤(5)中的超声功率为20-100w,超声时间为10-30分钟;步骤(4)中盐酸阿霉素溶液的浓度为1mg/ml-5mg/ml。溶解盐酸阿霉素的溶剂可以选用pbs、水。
21、具体的,溶解盐酸阿霉素的溶剂水优选超纯水。
22、一些具体的双载药纳米脂质体的制备方法,步骤3中使用ph为8.0-9.0的碳酸钠溶液调节药物脂质体悬液的ph值。
23、一些具体的双载药纳米脂质体的制备方法,卵磷脂、胆固醇、dspe-peg2000、17-aag、盐酸阿霉素的质量比为:7~9:1.5~2.5:1:0.5~1.5:2~3。
24、一些具体的双载药纳米脂质体的制备方法,卵磷脂、胆固醇、dspe-peg2000、17-aag、盐酸阿霉素的质量比为:8:2:1:1:2.5。
25、一种双载药纳米脂质体的制备方法,该方法包括如下步骤:
26、①将卵磷脂、胆固醇、17-aag和dspe-peg2000配置成溶液,按质量比为24:6:
27、3:3均匀混合;所述溶液的溶剂选用方便旋蒸除去的低沸点溶剂,具体的溶剂选自氯仿、乙醇、二氯甲烷或甲醇;
28、②将步骤①中所得的溶液中的溶剂通过旋转蒸发除去后,将负载药物的脂质薄膜分散在柠檬酸溶液中,得到负载17-aag药物的脂质体悬液,使用碳酸钠溶液调节脂质体溶液ph至7.0;
29、③将dox溶解于ph为7.0的pbs后加入至步骤②的载17-aag的脂质体悬液中,
30、再进行水化孵育,得到共负载dox与17-aag的脂质体悬液;
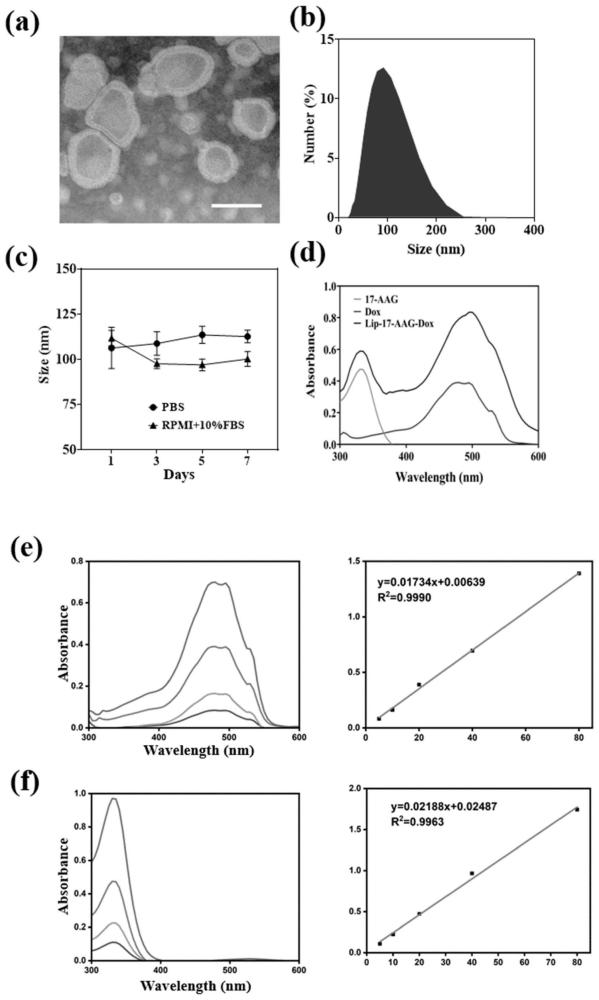
31、④使用水浴超声仪(宁波新芝scientz-iid)对步骤③脂质体进行超声,然后分别采用0.45μm与0.22μm水系聚碳酸酯膜进行过滤,得到双载药纳米脂质体。本发明的有益效果:本发明的双载药纳米脂质体具有合适的尺寸与良好的稳定性,显著改善17-aag的溶解度,使其临床静脉给药成为可能。在神经母细胞瘤的体外细胞水平上证实了其对hif-1α良好的抑制作用以及对肿瘤细胞增强的杀伤能力。由于经过了纳米脂质体的包载,药物在神经母细胞瘤的动物模型中显示出较高的肿瘤区域蓄积效率,并降低脱靶效应,进而减轻对外周非靶器官的毒副作用。与未经包载的阿霉素和阿霉素单载药脂质体相比,双载药纳米脂质体展现出更为显著的协同肿瘤抑制效果。本发明的双载药纳米脂质体不仅成功将两种药物共同递送到肿瘤部位,并且使二者发挥了1+1>2的协同治疗效果。hif-1α抑制与肿瘤杀伤的协同治疗策略为临床治疗神经母细胞瘤提供新的思路与方法,具有广阔的临床转化前景。
- 还没有人留言评论。精彩留言会获得点赞!