一种荧光-磁共振双模态造影剂及其制备方法与流程
本发明涉及医学诊断成像领域,更具体地,本发明涉及一种冻干粉针剂类荧光-磁共振双模态造影剂及其制备方法。
背景技术:
1、癌症是目前威胁人类健康的主要疾病之一。手术仍是首选的治疗方法,肿瘤原发灶切除为常用术式。但大量的临床病理证实,有相当部分的早期癌症找不到明显的病灶区域。并且肿瘤往往呈浸润性生长,导致与正常组织的界限模糊从而给手术切除带来很大的困难。肿瘤的不完全切除成为了现行手术治疗方案效果差,复发率高的主要原因。因此对肿瘤的术前精确定位成为了目前临床治疗面临的最紧迫需求。
2、磁共振成像(mri),利用人体组织中氢原子核(质子)在磁场中受到射频脉冲的激励而发生核磁共振现象,产生磁共振信号,经过电子计算机处理,重建出人体某一层面的图像的成像技术。在临床应用方面,mri有着诊断非侵入、软组织成像能力强,无电离辐射,无检测角度限制等优点而在世界各地的医院和研究机构中广泛使用;但其较低的灵敏度及mri造影剂循环时间短等缺点限制了其对肿瘤的成像效果,并且不能术中实时成像,使其临床实际应用受到很大限制。本发明申请人于2021年成功研制开发了一款全新的荧光-磁共振双模态造影剂化合物(专利公开号:wo2022242437a1),其具有良好的磁共振t1加权成像造影能力和活体荧光成像能力,具有高的弛豫率、优良的热稳定性,较低的毒副作用,良好的荧光与磁共振信号对应性等优点,可有效应用于活体细胞和活体的磁共振成像和荧光成像,给药6h后仍能够显著增强肝脏及肾脏磁共振信号,显著提高脏器边界分辨率,磁共振信号强度与荧光强度具有较高对应关系,具备临床所需的术前诊断及术中导航效果。
3、造影剂化合物一般制备成水针剂或粉针剂类药物制剂,通过静脉注射方式透过肿瘤血管内皮间隙进入到肿瘤组织以增强肿瘤影像检察效果。本技术发明人在以专利wo2022242437a1公开的造影剂原料药作为api成分配制造影剂水针剂时,发现:虽然专利wo2022242437a1公开的造影剂原料药具有很好的水溶性,但配制成水针剂后,长期稳定性不理想,特别是api成分中的荧光基团在水溶液下不稳定,容易聚集导致荧光淬灭,造成使用时荧光示踪效果减弱甚至失效。而直接用api成分于注射用水中溶解后进行冷冻干燥制成冻干粉针剂后,经hplc法测定,发现冻干后相对保留时间rrt约1.03处的未知杂质含量(本技术中称之为杂质rrt1.03)明显高于api成分中的杂质rrt1.03含量,且随着存储时间的延长,杂质rrt1.03含量有上升趋势,加大了冻干粉针剂的临床用药风险。
技术实现思路
1、药品中的杂质水平直接反映产品质量的稳定性,更低的杂质水平意味着产品稳定性更好,安全性更高,更有利于患者用药安全,本发明的目的在于,提供一种具有杂质水平低、制剂稳定性好、用药更安全的冻干粉针剂类荧光-磁共振双模态造影剂。
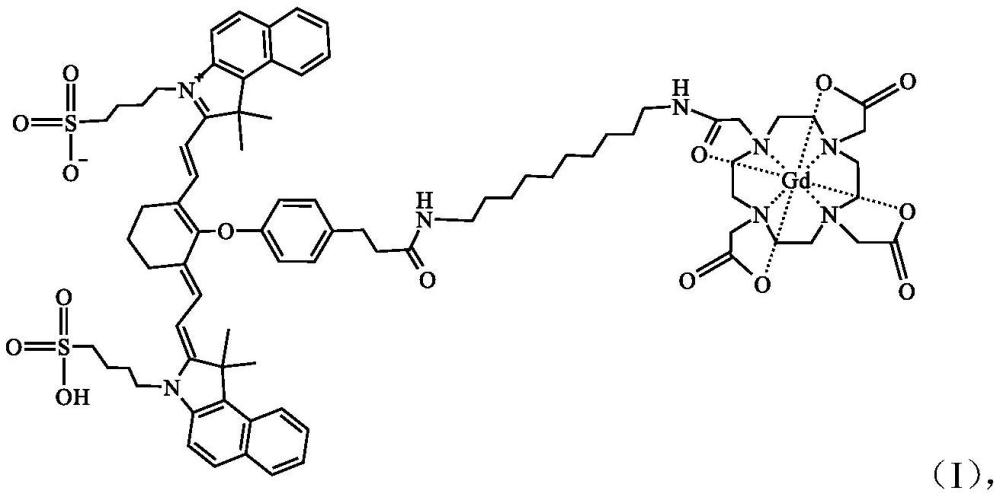
2、本发明的技术方案如下:一种荧光-磁共振双模态造影剂,所述双模态造影剂为冻干粉针剂,其包含以下式(i)化合物:
3、和冻干赋形剂及任选的ph调节剂。
4、所述冻干粉针剂用注射用水溶解成式(i)化合物浓度为10~40mg/ml的溶液ph值为5.0~7.0。
5、上述技术方案中,所述冻干粉针剂包含的物料以每40重量份的式(i)化合物计,冻干赋形剂的量为30~180重量份。
6、上述技术方案中,所述冻干赋形剂为糖类化合物,和/或糖醇类化合物;作为优选,所述糖类化合物选自右旋糖苷、无水葡萄糖、乳糖、蔗糖、海藻糖和麦芽糖中的一种或几种,进一步优选乳糖、蔗糖、海藻糖,更为优选蔗糖;所述糖醇类化合物选自山梨糖醇、甘露糖醇、赤藓糖醇中的一种或几种。
7、本发明人在制备以式(i)化合物为api成分的冻干粉针剂时,通过对冻干工艺及辅料包括ph调节剂、冻干赋形剂的选择等条件进行了研究,经过大量的实验探索发现,当引入特定的糖类化合物,和/或糖醇类化合物作为冻干赋形剂时,能明显抑制冷冻干燥获取冻干粉工序过程中杂质rrt1.03的增长,有效提升了以式(i)化合物为api成分的冻干粉针剂的药品质量稳定性和临床用药安全性。这些常规的冻干赋形剂在本领域的功能是赋予冻干粉针剂特定的形状,但是它们在本发明中呈现的技术效果却是完全与其常规功能无关的。
8、上述技术方案中,所述ph调节剂选自naoh、koh、磷酸二氢钠、磷酸氢二钠、磷酸二氢钾、磷酸氢二钾、盐酸、磷酸、硝酸、硫酸、或其组合。
9、上述技术方案中,所述冻干粉针剂在冷冻干燥前溶液中的固形物含量为2~12%(w/v),优选4~8%(w/v)。
10、术语“固形物含量”是指固体物质(例如本发明活性化合物及所用的全部赋形剂,重量/克)加入到溶剂(例如注射用水)中,溶解后得到一个溶液,所述固体物质的重量除以终溶液体积的百分数(重量/体积百分数,例如g/100ml)。
11、采用上述技术方案制备的冻干粉针剂的水分含量不超过3%。所述的水分含量是指经冷冻干燥工序得到冻干粉时的水分含量,而冻干粉针剂存储期的水分含量则不超过5%。
12、本发明中,符号%,根据其所使用的语境,可以具有本领域技术人员容易理解的含义。例如在提及固形物含量时,该符号表示重量/体积的百分数(w/v,例如g/100ml);又例如在提及冻干粉针剂中的“水分含量”时,例如水分含量在3%以下,此时该符号%表示重量/重量的百分数(w/w,g/100g)。一般而言,在固体分散在液体中时,%表示重量/体积百分数;在固体分散在固体中或者液体分散在固体中(例如冻干粉针剂的含水量)时,%表示重量/重量百分数。在其它情况下,如无另外说明,符号%表示重量/重量百分数。
13、上述技术方案中,所述冻干赋形剂选用蔗糖,所述式(i)化合物与冻干赋形剂的重量比为1:(0.75~4),优选1:(1~4),更为优选1:4。
14、本发明人经过大量实验发现,在制备以式(i)化合物为api成分的冻干粉针剂时,引入蔗糖作为冻干赋形剂,并调控式(i)化合物和蔗糖的用量配比,能更为有效地抑制冷冻干燥获取冻干粉工序过程中杂质rrt1.03的增长,制得的冻干粉针剂中杂质rrt1.03的含量不超过1%,明显低于式(i)化合物原料药中的杂质rrt1.03含量,确保了以式(i)化合物为api成分的冻干粉针剂的药品质量稳定性和临床用药安全性,且制得的冻干粉针剂更为蓬松。
15、本发明人经过大量实验验证进一步发现,在选用蔗糖作为冻干赋形剂的同时,调控冷冻干燥前的药液ph值至5.5~6.7,会进一步抑制冷冻干燥获取冻干粉工序过程中杂质rrt1.03的增长,制得的冻干粉针剂中杂质rrt1.03含量最低可降至0.32%,远低于式(i)化合物原料药中杂质rrt1.03含量,且在25℃±2℃,60%±5%rh条件下存储6个月后,杂质rrt1.03的含量基本稳定在一个较小值,大幅度提升了以式(i)化合物为api成分的冻干粉针剂的临床用药安全性。
16、采用上述技术方案制备的冻干粉针剂用注射用水溶解成式(i)化合物浓度为10mg/ml的溶液,根据中国药典2020年版四部通则0631方法测得其ph值为5.3~6.7。
17、在上述技术方案中,所述冻干粉针剂的水分含量不超过2%。此处的水分含量亦指经冷冻干燥工序得到冻干粉时的水分含量。
18、本发明的另一目的在于,提供一种上述荧光-磁共振双模态造影剂的制备方法,包括如下步骤:
19、(a)称取处方量的赋形剂置于配制罐中,加入适量注射用水,搅拌使之溶解;
20、(b)于配制罐中加入处方量的式(i)化合物,搅拌使之溶解;
21、(c)于配制罐中加入注射用水至其处方重,搅拌均匀,测定溶液ph值,必要时用ph调节剂调节至ph值为5~7;
22、(d)将药液除菌,按处方量灌装于西林瓶中,冷冻干燥除去水分,压塞,即得。
23、优选的,所述式(i)化合物与所述赋形剂的质量份数比为1:(0.75~4.5)。示范性的,所述冻干赋形剂为蔗糖,所述冻干粉针剂中所含的式(i)化合物与冻干赋形剂的重量比为1:(0.75~4),优选1:(1~4),更为优选1:4。
24、优选的,所述冻干赋形剂为糖类化合物,和/或糖醇类化合物;所述糖类化合物选自右旋糖苷、无水葡萄糖、乳糖、蔗糖、海藻糖和麦芽糖中的一种或几种,优选乳糖、蔗糖、海藻糖,更为优选蔗糖;所述糖醇类化合物选自山梨糖醇、甘露糖醇、赤藓糖醇中的一种或几种。
25、优选的,所述ph调节剂选自naoh、koh、磷酸二氢钠、磷酸氢二钠、磷酸二氢钾、磷酸氢二钾、盐酸、磷酸、硝酸、硫酸、或其组合;进一步优选,所述ph调节剂为naoh水溶液,所述naoh水溶液的浓度为0.002~0.05mol/l,优选0.005~0.02mol/l。
26、当选择naoh水溶液用于调节冷冻干燥前药液ph值时,出现ph值超范围的情况,优选用盐酸溶液进行回调。
27、优选的,所述荧光-磁共振双模态造影剂为冻干粉针剂。
28、优选的,所述冻干粉针剂在冷冻干燥前溶液中的固形物含量为2~12%(w/v),优选4~8%(w/v)。
29、优选的,所述冻干粉针剂的水分含量不超过3%,进一步优选的,所述冻干粉针剂的水分含量不超过2%。
30、优选的,所述冻干粉针剂用注射用水溶解成式(i)化合物浓度为10mg/ml的溶液,根据中国药典2020年版四部通则0631方法测定其ph值为5.3~6.7。
31、优选的,步骤(d)中,所述冷冻干燥除去水分包括将除菌灌装后的药液于-40℃以下进行预冻,待药液温度达-40℃以下时,维持0.5~4小时;于1~4小时内升温至-20℃以上,维持5~40小时,真空度<0.5mbar;于1~6小时内升温至10℃以上,维持1~20小时,再于0.5~5小时内升温至40℃以上,维持2~10小时,压塞,锁铝盖封口,包装,即得。
32、优选的,步骤(d)中,所述冷冻干燥除去水分包括将除菌灌装后的药液于-45℃进行预冻,待药液温度达-45℃时,维持1~4小时;于1~4小时内升温至-15℃,维持10~40小时,真空度<0.5mbar;于1~6小时内升温至20℃,维持1~20小时,再于1~5小时内升温至40℃以上,维持5~10小时,压塞,锁铝盖封口,包装,即得。
33、本发明的有益效果:
34、(1)本发明通过将不太稳定的以式(i)化合物作为api成分的水针剂制成冻干粉针剂,规避了以式(i)化合物作为api成分的水针剂长期稳定性差致使荧光示踪效果减弱甚至失效的技术缺陷,确保了api成分的荧光-磁共振双模态造影功效。
35、(2)本发明通过选用特定的冻干赋形剂,并调控冻干赋形剂与api成分的用量配比和体系ph值,不仅规避了冷冻干燥获取冻干粉工序带来的杂质rrt1.03含量增长风险,而且赋予了冻干粉针剂更低的杂质rrt1.03含量,制备的冻干粉外观饱满均一,水分含量低,药品稳定性高,25℃±2℃/60%±5%rh条件下放置6个月或40℃/75%rh条件下放置30天,冻干粉针剂中杂质rrt1.03含量基本维持在同一水平,仅偶有细微波动。
36、(3)本发明提供的冻干粉针剂能有效解决冷冻干燥获取冻干粉工序过程杂质rrt1.03明显增长问题和冻干后产品稳定性差问题,且冻干粉针剂不仅复溶时间短,而且复溶后不溶性微粒量极少,大大提高了临床用药安全性,进一步推动了后续式(i)化合物药剂临床应用研究的发展。
- 还没有人留言评论。精彩留言会获得点赞!