一种抗体药物偶联物的偶联位点分析的方法与流程
本发明属于药物分析,涉及一种抗体药物偶联物的偶联位点分析的方法。
背景技术:
1、抗体药物偶联物(antibody-drug conjugate,adc)是一类通过化学连接子(linker)将具有强细胞毒性的小分子毒素(payload)与高度靶向的单克隆抗体相结合的新型生物药物。近年来,adc已在癌症治疗领域展现出显著优于传统化疗的临床收益风险比,并因此受到了广泛关注。adc的生产制备通常基于特定化学反应机理,将小分子毒素特异性地与抗体蛋白表面氨基酸残基进行偶联反应,小分子毒素分布于各个偶联位点,所得的adc产品是一种含有不同数量毒素的蛋白质混合物。抗体蛋白质具有致密的三维结构,不同区域的氨基酸的溶液可及性存在差异。这导致偶联在不同位点的小分子连接子-毒素(linker-payload,lp)会表现出不同的毒素释放速率,从而影响adc的药物代谢动力学和脱靶毒性。因此,对于adc偶联位点的确认和批次间定量比较对于确保药物质量以及产品批次间一致性具有重要意义。
2、偶联位点分析在adc药物的结构表征分析中应用范围广泛,包括但不限于在偶联反应的开发和优化过程中对特定位点的偶联率进行监测;通过鉴定所有存在的偶联位点,在工艺开发过程中确保偶联副产物被顺利排除;以及在可比性研究中,确保adc产品不同批次间各位点偶联率可比,从而保障产品质量在不同批次的生产过程中保持稳定。基于液相色谱-质谱联用(lc-ms)的肽图分析法是工业界主流的大分子药物一级结构表征手段,也是业界分析adc偶联位点的标准方法(anal.chim.acta.955(2017)67–78.;j.chromatogr.b1140(2020).)。其实验步骤一般包括:1.将adc样品在变性条件下完全还原,并使用烷基化试剂修饰还原后游离的半胱氨酸巯基基团,防止再次形成二硫键;2.使用酶切试剂,对变性还原后的蛋白亚基进行酶解,制备肽段混合物样品;3.对酶解后的样品进行lc-ms/ms分析,利用肽段在质谱中通过碰撞能量产生的关键碎片离子进行偶联位点鉴定,同时通过计算偶联有lp的肽段占比相同肽段所有存在形式的质谱信号总面积的百分比来获得不同肽段上相应偶联位点的偶联率。
3、然而,目前传统肽图方法在定性地鉴别偶联位点和定量地测量偶联率方面仍然面临巨大挑战。首先,adc的小分子连接子-毒素lp的结构通常需要被设计为能在体内特定区域(如癌细胞区域)触发毒素分子的释放,并发挥毒素payload应有的作用机制(如dna拓扑异构酶抑制剂、微管抑制剂等),因此lp通常具有相对一般氨基酸翻译后修饰(post-translational modification,ptm)更加庞大、复杂且疏水(亲脂性为小分子成药关键因素)的小分子结构。在质谱内碰撞能量的影响下,lp容易裂解成多种具有不同复杂结构的碎片,这使得识别关键肽段碎片并确认lp所连接的氨基酸偶联位点变得非常困难。此时对于关键离子的判断往往要引入大量的人工检索和判断,并且通常需要反复优化碰撞能量以获得质量足够高的二级谱图,以便在大量小分子lp碎裂产生的干扰性碎片中寻找相对信号较低的关键肽段骨架碎片;对于工业界主流运用的高通量肽图分析软件而言,通过软件预设参数进行数据分析来完成这一过程几乎变为不可能,这也对工业界数据分析自动化流程产生了一道障碍。其次,由于偶联率的计算基于偶联lp的肽段与该肽段的所有形式(含偶联和未偶联)的提取离子流色谱图(eic)峰面积之比,而高疏水性的lp结构会导致偶联肽段与未偶联肽段之间的质谱离子化效率存在较大差异,因此使用传统肽图方法进行特定位点偶联率计算时可能出现较大的定量偏差。另外,在传统肽图方法中,通常为了还原或烷基化试剂发挥最佳效果,可能会引入56℃或以上的温度进行孵育,并且可能使用ph≥8.0的缓冲溶液以便于蛋白酶试剂保持高活。但这些高温或弱碱性条件都容易造成adc连接子中常见的琥珀酸亚胺结构的开环水解,不利于对样品连接子的原始状态的检测和对后续结构变化的追踪监控。
4、因此,为了在adc早期研究、工艺开发、和临床阶段更便捷地为结构表征和生产质量监测提供分析支持,有必要开发通用、便利且可靠的测试方法,以应对疏水性lp对偶联位点鉴定和偶联率定量带来的挑战。此外,还需对样品制备中所用的物理条件进行优化,防止在样品处理时引入额外的结构变化,避免影响对样品质量相关属性初始状态的分析检测。
技术实现思路
1、针对现有技术的不足,本发明的目的在于提供一种抗体药物偶联物的偶联位点分析的方法。本发明所述方法能够解决adc产品在早期研究、工艺开发和临床阶段在偶联位点分析方面存在的偶联位点鉴定困难和偶联率定量不准的问题。
2、为达到此发明目的,本发明采用以下技术方案:
3、一方面,本发明提供一种抗体药物偶联物的偶联位点分析的方法,所述方法包括以下步骤:
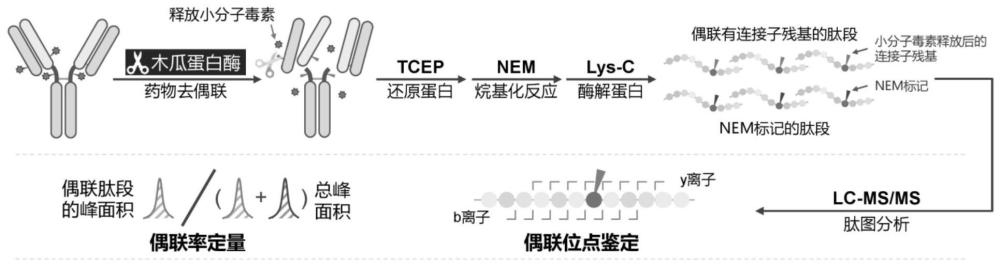
4、(1)利用木瓜蛋白酶在激活剂l-半胱氨酸的作用下对抗体药物偶联物进行酶解,释放出小分子毒素,将抗体药物偶联物中原本的化学连接子-小分子毒素结构转化为化学连接子残基;
5、(2)步骤(1)得到的含有化学连接子残基的样品在盐酸胍和三(羧乙基)膦还原剂存在下进行变性和还原,而后加入烷基化试剂进行烷基化;
6、(3)利用重组赖氨酸蛋白酶对步骤(2)得到的产物进行酶解,得到酶切后的肽段样品;
7、(4)对步骤(3)得到的酶切后的肽段样品进行数据采集,完成对抗体药物偶联物的如下至少一个目标的分析或测定:小分子毒素偶联位点的鉴定、对偶联水平的测定或对多种生物药产品质量属性的监测。
8、在本发明中,所述小分子毒素偶联位点鉴定具体包括以下步骤:
9、(i)在数据分析软件中设定化学连接子-小分子毒素的分子量和可能发生偶联的氨基酸位点,使用数据分析软件基于抗体药物偶联物的蛋白氨基酸序列进行数据库搜索;
10、(ii)数据分析软件进行搜库比对后,初步自动生成偶联位点的判断结果;
11、(iii)结合质谱的二级碎片数据进行人工验证,确认数据分析软件对偶联有氨基酸的关键离子碎片进行了正确的信息匹配,从而确认数据分析软件判断的偶联位点信息正确。
12、在本发明中,所述对偶联水平的测定具体包括以下步骤:
13、(i)在数据分析软件中设定化学连接子-小分子毒素和烷基化试剂的分子量,以及可能发生偶联和烷基化的氨基酸位点,使用软件基于抗体药物偶联物的蛋白氨基酸序列进行数据库搜索;
14、(ii)数据分析软件进行搜库比对后,自动生成软件判断出的偶联有化学连接子-小分子毒素的肽段列表,同时也会判断出相应的未偶联小分子毒素的肽段;
15、(iii)人工判断软件选出的偶联肽段是否准确,再验证软件中对质谱一级谱图中峰面积积分范围是否准确;
16、(iv)结合小分子毒素偶联位点鉴定的结果,并使用下述公式进行肽段的偶联水平计算:
17、
18、其中i位点表示小分子毒素偶联位点鉴定得到的偶联位点。
19、在本发明中,所述对质量属性的监测具体包括以下步骤:
20、(a)在数据分析软件中设定化学连接子-小分子毒素、化学连接子-小分子毒素在长期储存或稳定性考察试验(加速试验、影响因素试验)过程中可能产生的变化结构、烷基化试剂以及常见的蛋白翻译后修饰变化的分子量,同时设定可能发生偶联、烷基化以及常见蛋白翻译后修饰变化的氨基酸位点,使用数据分析软件基于抗体药物偶联物的蛋白氨基酸序列进行数据库搜索;
21、(b)数据分析软件进行搜库比对后,会自动生成软件判断出的肽段列表,并列举肽段上的偶联、烷基化、蛋白翻译后修饰这些质量属性发生变化的信息和推测的发生位点;软件会对各肽段的提取离子流色谱图(eic)峰面积进行提取,从而获取定量的峰面积积分数据,用于后续计算不同形式的肽段占比;
22、(c)对数据分析软件判断的质量属性变化发生位点和峰面积定量信息进行人工判断,通过质谱二级碎片数据确认质量属性变化发生位点的判断的正确性,通过质谱一级谱图中峰面积积分范围来确认定量信息是否准确;
23、(d)根据数据分析软件搜库结果,可判断氨基酸序列覆盖度;使用提取色谱流图的峰面积比例可进行偶联率、翻译后修饰变化比率、化学连接子结构变化比率等质量属性的计算;抗体药物偶联物分子具有对称性,其结构由两条相同的轻链和两条相同的重链组成,通过将每个位点小分子毒素偶联水平加和并乘以两倍,得到抗体药物偶联物样品的药物/抗体比率dar:
24、
25、其中i表示分析方法中检测到的任意偶联位点,为公式中的求和范围,n表示基于对称结构的抗体中单个重链和轻链的偶联位点总数,为公式中参与求和的计算项数。
26、在本发明中,如上所述数据分析软件为byos数据分析软件、mascot数据分析软件或biopharma finder数据分析软件。
27、优选地,所述人工验证或人工判断使用xcaliburtm数据分析软件。
28、在本发明中,当抗体药物偶联物的目标药物/抗体比率dar小于等于5,步骤(1)所述木瓜蛋白酶的使用量与抗体药物偶联物中抗体的重量比为1:500至1:333,例如1:500、1:480、1:450、1:430、1:400、1:380、1:370、1:350、1:340或1:333等。
29、优选地,当抗体药物偶联物的目标药物/抗体比率5<dar≤7,步骤(1)所述木瓜蛋白酶的使用量与抗体药物偶联物中抗体的重量比为1:330至1:222;例如1:330、1:320、1:300、1:280、1:250、1:240或1:222等。
30、优选地,当抗体药物偶联物的目标药物/抗体比率dar大于7,步骤(1)所述木瓜蛋白酶的使用量与抗体药物偶联物中抗体的重量比为1:220至1:181,例如1:220、1:210、1:200、1:190或1:181等。
31、在本发明中要控制木瓜蛋白酶的用量在上述范围内,如果木瓜蛋白酶的用量太少,则会造成抗体和肽段上偶联的小分子毒素释放不完全,酶解后仍偶联有毒素的肽段会分散总肽段质谱信号且与其他形式离子化效率存在较大差异,会造成定性鉴别的困难和定量计算的不准确;如果木瓜蛋白酶的用量太多,则木瓜蛋白酶本身会对抗体铰链区域产生多种非特异性酶解,最终增加了数据分析当中需要考虑的肽段形式,由于肽段信号分散在了不同的肽段形式上,因此会使定性鉴别和定量计算变得更为复杂。
32、优选地,所述激活剂l-半胱氨酸在酶解体系中的终浓度为3-4mm,例如3mm、3.3mm、3.5mm、3.8mm或4mm。在本发明中,如果激活剂l-半胱氨酸的在酶解体系中的终浓度太低则会导致无法充分将木瓜蛋白酶激活,木瓜蛋白酶活性不够可能会影响小分子毒素释放效率,太高会影响到后续烷基化反应,如果l-半胱氨酸在酶解体系中的终浓度太高,会存在过量的l-半胱氨酸,其会与后续烷基化试剂(n-乙基马来酰亚胺,n-ethylmaleimide,nem)形成加合物,导致烷基化试剂被过量消耗,无法将抗体上的半胱氨酸位点都标记。
33、优选地,步骤(1)所述酶解在tris-hcl缓冲溶液中进行。
34、优选地,所述tris-hcl缓冲溶液的ph值为6.8-7.5,例如6.8、6.9、7.0、7.2、7.4或7.5。
35、优选地,所述tris-hcl缓冲溶液的浓度为40-60mm,例如40mm、43mm、45mm、48mm、50mm、53mm、55mm、58mm或60mm。
36、优选地,步骤(1)所述酶解为在20-30℃(例如20℃、23℃、25℃、28℃或30℃)下孵育30-60分钟(例如30分钟、35分钟、38分钟、40分钟、45分钟、50分钟、55分钟或60分钟)或在30-37℃(30℃、33℃、35℃或37℃)下孵育20-30分钟(例如20分钟、23分钟、25分钟、28分钟或30分钟)。
37、优选地,步骤(2)所述盐酸胍在反应体系中的终浓度为4.3-6.5m,例如m、4.3m、4.5m、4.8m、5m、5.3m、5.5m、5.8m、6.0m、6.3m或6.5m。
38、在本发明中,选择使用还原剂三(羧乙基)膦(tcep)而不是dtt,是由于dtt具有的巯基结构与nem反应性更强,会消耗过多的nem烷基化试剂,导致用于标记抗体上半胱氨酸的烷基化试剂不足。
39、优选地,步骤(2)所述三(羧乙基)膦还原剂在反应体系中的终浓度为19-21mm,例如19mm、19.5mm、20mm、20.5mm或21mm。
40、优选地,步骤(2)所述进行变性和还原是在35-40℃(例如35℃、37℃、38℃、39℃或40℃)条件下孵育30-40分钟(例如30分钟、33分钟、35分钟、38分钟或40分钟)。
41、优选地,步骤(2)所述烷基化试剂为n-乙基马来酰亚胺(nem)。业界常用的烷基化试剂是nem和iam(碘代乙酰胺),本方法使用了nem,nem和木瓜蛋白酶释放掉小分子毒素后连接子残基结构更相似。
42、优选地,步骤(2)所述烷基化试剂在反应体系中的终浓度为14.2-15.2mm,例如14.2mm、14.5mm、14.8mm、15mm或15.2mm。
43、优选地,步骤(2)所述烷基化是在35-40℃(例如35℃、37℃、38℃、39℃或40℃)条件下孵育25-40分钟(例如25分钟、28分钟、30分钟、33分钟、35分钟、38分钟或40分钟)。
44、步骤(2)所述烷基化使得nem和未偶联的半胱氨酸残基充分反应,阻止二硫键的重新生成并减小偶联肽段和未偶联肽段的结构差异。
45、在步骤(2)所述烷基化完成后,需要使用超滤离心管对样品进行换液操作,去除多余的小分子试剂并将样品的溶液置换为ph值为7.5含有50mm盐酸胍(gdn-hcl)的8m尿素缓冲溶液。使用280nm uv波长来估算溶液中的蛋白浓度。
46、优选地,步骤(3)所述酶解为针对40μg步骤(2)得到的产物,加入1-2μg重组赖氨酸蛋白酶(lys-c),于37℃孵育0.5-1小时,之后使用50mm ph为7.5的tris-hcl缓冲溶液将样品稀释到100μl,再重新加入2μg lys-c酶解3-4小时。
47、在步骤(3)的反应结束后用三氟乙酸溶液终止酶解反应,得到酶切后的肽段样品用于数据采集。
48、在本发明的所述肽段样品的获取过程中,制备方法避免使用高温和碱性条件,这样避免了引入额外的翻译后修饰或adc连接子的结构变化。
49、在本发明中由于还原温度要避免高温,因此对还原剂tcep的用量有一定要求,而tcep的用量又会进一步影响到烷基化试剂nem的最佳用量,原因是tcep和nem也会形成加合物。使用nem是为了将所有含未偶联cys的肽段都实现完全的nem烷基化,并且nem最佳用量受到多种因素影响(反应温度、反应时间、tcep用量),如果nem用量过多,则会在同一个肽段上过量反应,如果太少则反应不完全,因此对nem的用量优化至关重要。
50、在本发明中,步骤(4)所述数据采集利用超高效液相色谱质谱联用仪进行。
51、优选地,步骤(4)所述数据采集时,使用agilent/poroshell 120sb-c18(2.1×150mm,2.7μm,agilent)反相色谱柱来进行样品分离。
52、优选地,进行样品分离时色谱柱温度为50℃,液相流速为0.2ml/min,使用含有0.05%三氟乙酸的水作为流动相a相和乙腈作为流动相b相进行洗脱,洗脱梯度起始于0.2%的流动相b相,保留两分钟,然后b相在13分钟内从0.2%变化到20%,再在25分钟内从20%变化到37%。洗脱结束后,使用90%的b相冲洗色谱柱,待冲洗完成后,b相比例恢复到起始状态,对色谱柱进行平衡。
53、优选地,步骤(4)所述数据采集时,基于thermo/orbitrap exploris 480/qe+质谱仪在正离子模式下进行质谱数据采集,仪器质核比扫描范围设置为250-2000m/z,离子源电喷雾电离源电压为4kv,二级碎裂模式使用高能碰撞解离(high energy collisiondissociation,hcd),以3秒时间作为一个循环进行数据依赖型采集。
54、在本发明中使用byos数据分析软件(protein metrics inc.,ca,usa)进行了数据搜库分析、肽段匹配、以及峰面积自动积分,使用了xcaliburtm对质谱ms2二级谱图数据进行了人工验证以确认偶联位点。
55、本发明的方法首先使用木瓜蛋白酶对adc样品进行水解,以释放偶联在半胱氨酸上lp结构中的小分子毒素。木瓜蛋白酶可以特异性的在二肽连接子或四肽连接子c端进行酶切,释放lp结构中的疏水毒素部分,而将分子量较小的连接子部分留在蛋白氨基酸上。随后,在变性条件下使用tcep对样品进行还原得到偶联小分子连接子残基及未发生偶联的抗体片段,然后再使用nem对还原后的半胱氨酸进行烷基化操作。nem和小分子连接子残基均含有马来酰亚胺结构,这使得nem烷基化的肽段和小分子连接子偶联的肽段具有类似的色谱和质谱表现。
56、接下来使用重组赖氨酸蛋白酶(lys-c)对样品进行酶解,并使用超高效液相色谱二级质谱串联体系进行数据采集。为使酶解后的肽段保持较高的均一性,本发明方法选择lys-c来进行酶解。传统肽图方法通常使用胰蛋白酶进行酶解,这种酶解方式会在赖氨酸和精氨酸的c端发生漏切,致使最终得到的肽段均一性差。因此,本发明方法使用lys-c酶解代替胰蛋白酶酶解。本方法中的lys-c酶解不会出现上述漏切情况,很好的解决了传统方法肽段均一性差的问题,简化了偶联水平的计算和偶联位点的鉴定过程。经过lys-c酶解后的肽段,使用超高效液相色谱二级质谱串联体系进行数据采集,并进行偶联水平的计算和偶联位点的鉴定。由于小分子毒素的疏水部分已经被释放,在进行偶联位点鉴定时,容易采集到偶联位点鉴定相关的关键性b/y离子,从而降低偶联位点鉴定的难度。小分子毒素的释放和nem的烷基化修饰减少了两条肽段之间的离子化效率差异。小分子毒素偶联水平的计算方式为:小分子毒素偶联肽段的提取离子流图(eic)峰面积除以这条肽段所有存在形式提取离子流图峰面积之和,离子化效率差异的降低,提高了偶联水平计算的准确性。
57、相对于现有技术,本发明具有以下有益效果:
58、(1)本发明有利于对adc偶联位点的准确鉴定,在传统肽图分析中,由于lp的结构庞大且复杂,在质谱碰撞能量的作用下极易裂解成多种具有不同复杂结构的碎片。本发明方法使用木瓜蛋白酶对adc的小分子毒素进行释放,可将高度疏水且结构复杂的毒素分子从adc上移除,从而将lp结构转化为相对较小的连接子残余结构;一对仅间隔1个氨基酸单位的关键肽段离子能够被用于确定小分子lp是否偶联至了该氨基酸位点,毒素的释放会大大简化质谱二级谱图的解析难度,使得关键肽段离子碎片更易产生、信号相对更强,从而有助于对关键肽段离子的鉴别和对偶联位点的顺利识别。
59、(2)与传统方法相比,本发明方法对于偶联位点偶联水平的计算更加准确。在传统的肽图方法中,由于小分子毒素不易带正电的特性,会导致发生偶联的肽段和未发生偶联的肽段之间的存在较大的离子化效率差异,从而影响偶联水平的计算,使得实际偶联水平被严重低估。木瓜蛋白酶可以将小分子毒素上的疏水结构从偶联肽段上进行释放,从而提高偶联肽段的离子化效率。与此同时,由于烷基化试剂nem和连接子均含有马来酰亚胺结构,这使得nem烷基化的肽段和小分子连接子偶联的肽段具有类似的色谱和质谱表现,nem的烷基化修饰会减弱未偶联肽段的离子化效率,从而可以减少偶联肽段和未偶联肽段之间的离子化效率差异,使计算得到的偶联水平更加准确。
60、(3)本发明方法的实验流程与传统肽图方法类似,所使用的试剂均为肽图实验常见试剂,实验操作简单,方便工业界日常检测使用。在进行偶联率的半定量检测时无需建立标准曲线,所得各位点偶联水平结果能够直接被用于adc样品批次间位点偶联水平的比较。本发明方法采用常规试剂进行实验制备,使得偶联位点的鉴定变得简单而高效。
61、(4)传统肽图方法通常使用弱碱性缓冲溶液以保障酶切步骤中内切酶的活性,也常使用56℃或以上的高温以提高还原剂等试剂的反应效率;本方法通过优化肽段样品制备条件,包括优化木瓜蛋白酶的用量和酶解条件、还原试剂、烷基化试剂以及酶切试剂的选择等,避免了在样品处理阶段使用碱性缓冲溶液以及高温加热操作,极大程度的保留了分子的原始状态,使得汇报样品在工艺中的结构变化信息,以及监控不同时间点的变化更加容易。本发明方法在样品制备过程中,通过对实验处理条件的优化和控制,减少了实验制备中引入额外氨基酸翻译后修饰或导致的连接子结构发生水解等变化的风险。例如,在样品制备的过程中,如果对样品进行高温加热或使用碱性缓冲溶液,则会导致连接子的琥珀酰亚胺环结构发生水解开环、抗体表面天冬酰氨发生脱酰胺化以及甲硫氨酸发生氧化等等。本发明方法通过实验条件的优化,避免了在样品处理阶段使用碱性缓冲溶液以及高温加热操作,同时平衡了缓冲溶液条件和温度条件调整带来的还原试剂、酶切试剂不能达到最佳状态的影响,使得在本方法中检测结果相比传统方法更能真实地反映分子原本的状态。
62、(5)本发明方法在提供adc各偶联位点的偶联水平信息之外,也能够监控adc样品可能发生的多种质量属性变化,包括但不限于adc样品的dar值变化,小分子连接子的水解等结构变化,肽段序列覆盖度的变化、以及其他各种氨基酸翻译后修饰的程度变化等。
63、(6)本发明方法具有高通用性,可全面适用于所有基于组织蛋白酶b/l(cathepsinb/l)的酶裂解连接子的adc药物,该类连接子被现阶段市场上获批和临床试验阶段的adc所广泛应用。截止目前,由fda批准上市的12种adc产品中,连接子设计采用了组织蛋白酶b/l可裂解连接子的adc占据了一半,包括和由于这些产品的已验证的优异临床效果和已阐明的连接子裂解机理,临床阶段的adc也大量采用了类似的组织蛋白酶可切连接子的设计(clinicaltrials.gov;molecules.2021,26,5847.;nat.rev.drug discov.2023,1-21.)。由于木瓜蛋白酶与组织蛋白酶b和组织蛋白酶l在三维结构上的相似性,三者同属于半胱氨酸蛋白酶家族,并且木瓜蛋白酶的酶切活性更强,因此可广泛被用于释放这些酶可切连接子相连的小分子毒素,这使本方法对市场上和研发阶段的adc分子具有很高的通用性。
64、(7)本发明方法对木瓜蛋白酶的孵育条件进行了优化,在使木瓜蛋白酶实现高效释放小分子毒素的同时,也极大程度的避免了木瓜蛋白酶在抗体铰链区附近进行的非特异性酶切。由于木瓜蛋白酶在本发明方法中不会产生铰链区下端的非特异性酶切,使得在分析铰链区偶联位点时,肽段形式较为均一,因此质谱强度信号不会在许多不同形式的肽段上分散,如此便简化了定性鉴定位点和定量计算偶联率的过程,并提升了计算结果的重现性,适合在工业界作为日常检测方法进行使用。
- 还没有人留言评论。精彩留言会获得点赞!