一种甲壳素纳米颗粒及其制备方法与应用
本发明属于药物载体领域,具体地,涉及一种甲壳素纳米颗粒及其制备方法与应用,以及一种载药甲壳素纳米颗粒及其制备方法。
背景技术:
1、姜黄植物最早种植在亚洲地区,主要是在化妆品和传统医学治疗中用作香水或着色剂,其具有优异的抗氧化活性、抗肿瘤、抗炎等药理作用。此外,姜黄素对人体消化系统和心血管系统有益。因其生物学和药理活性,姜黄素的研究应用已被广泛开展。然而,与大多数治疗剂和生物活性成分类似,姜黄素在水溶液中的溶解度极差并且很难被人体直接吸收。姜黄素水溶性低,在生理ph下的水解不稳定性高,快速的全身代谢等问题限制了其在食品和医疗行业的应用前景。因此,探索姜黄素新装载和输送方法,以提高水溶性和口服制剂时在胃肠道的吸收变得至关重要。目前,研究人员开展各种策略用于姜黄素的递送,如脂质体、乳液、聚合物颗粒或聚合物复合材料等。然而,每种方法的局限性同时也被发现。例如,乳化液的形成需要很高的表面活性剂的浓度(约20wt%),这将会增加生物毒性。其他方法也存在制备产率以及催化效率的问题。
2、聚合物纳米颗粒在药物、基因传递和诊断领域的应用发展十分迅速。聚合物纳米粒子通常由共价键交联和非共价键交联两种途径制备。通过分子内和分子间的共价键合作用,共价键交联形成的纳米粒子具有很好的稳定性,但是却存在着结构复杂、合成困难的缺点。相较于共价交联纳米粒子,基于非共价键交联的超分子纳米粒子具有独特的灵活性和通用性,能够满足各种不同的生物医学和食品相关应用,因而引起了人们极大的研究兴趣。在π-π堆积、氢键、金属配位等众多超分子作用里,基于β-环糊精(βcd)的主客体作用因其较好的生物安全性被广泛用来构建各种超分子纳米粒子。通过βcd与客体分子间的相互作用,两种或多种聚合物组份能够以“模块化”的方式,简单灵活地组装出各种功能的新型纳米粒子,从而在生物医用和食品领域表现出无限潜力。此外,βcd作为由7个α-d-吡喃葡萄糖单元首尾相连形成的截锥状大环化合物,具有锥体外壁亲水、内壁疏水的特点,能够对疏水药物分子进行完全或者部分包合,从而起到增加药物溶解性、降低药物毒性和调节药物释放速度的作用,因而在药物递送领域极具应用前景。
3、甲壳素作为地球上储量仅次于纤维素的第二大天然多糖,广泛存在于低等植物菌类、藻类的细胞壁,以及节肢动物包括虾、蟹等甲壳动物的外壳中,除具有生物相容和价廉的优点外,还具有纤维素所不具备的体内降解能力,因而拥有更为广阔的生物医用前景。
技术实现思路
1、本发明的目的是针对目前疏水功能因子递送平台包封率低以及递送药物稳定性差的问题,利用生物质废弃物虾壳甲壳素生物可降解、低毒和价格低廉的特点,将其作为药物载体的主体材料,通过主客体作用模块化组装形成生物相容的纳米颗粒,并对其在营养药物递送领域的应用作初步探索。
2、本发明的第一方面提供一种甲壳素纳米颗粒的制备方法,包括以下步骤:
3、(1)甲壳素原料的制备
4、将虾壳原料浸泡于naoh溶液中除去蛋白质,然后分散到hcl溶液中除去残留的矿物质,再然后分散到h2o2溶液中进行氧化脱色,最后进行干燥,得到纯化后的甲壳素粉末;
5、(2)羧乙基甲壳素cect的制备
6、将纯化后的甲壳素粉末分散在naoh/尿素水溶液中,先冷冻然后在室温下快速搅拌至溶液解冻,离心得到澄清的甲壳素溶液;向甲壳素溶液中滴加丙烯酰胺后搅拌反应,然后中和、透析、冷冻干燥,得到丙烯酰胺改性甲壳素ct-am;将ct-am溶于naoh水溶液中搅拌水解,中和、透析、冷冻干燥,得到羧乙基甲壳素cect;
7、(3)羧乙基甲壳素接枝环糊精cect-βcd的制备
8、将环糊精与对甲苯酰氯搅拌反应,得到ots-βcd,将ots-βcd溶解在1,6-己二胺中,75-85℃的氮气氛下搅拌反应、浓缩、重结晶、真空干燥,得到白色粉末βcd-had;然后,将edc和nhs引入含有βcd-had和mes的cect溶液中,搅拌反应后对水透析,冷冻干燥后得到cect-βcd;
9、(4)羧乙基甲壳素接枝金刚烷cect-ad的制备
10、向cect溶液中加入氢离子交换树脂,搅拌反应后过滤,滴加四丁基氢氧化铵中和后冻干得到甲壳素铵盐;将甲壳素铵盐与金刚烷胺和无水三乙胺搅拌反应,然后透析、冷冻干燥得到cect-ad;
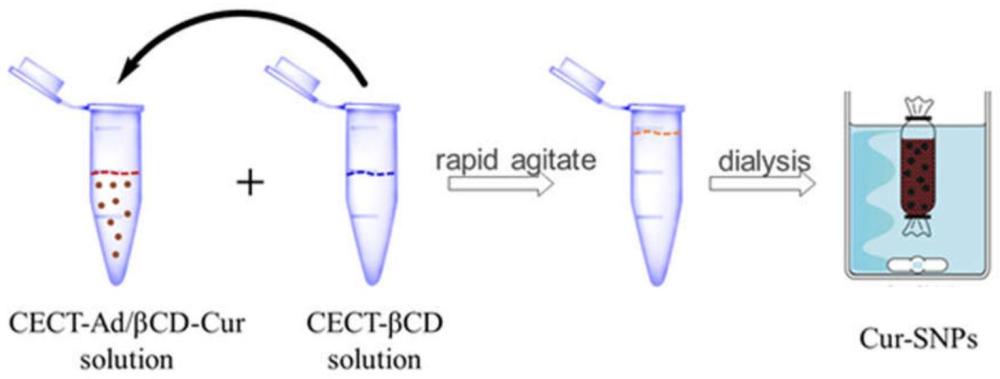
11、(5)超分子甲壳素纳米颗粒snps的制备
12、将cect-ad和cect-βcd分别溶于超纯水中,在剧烈搅拌下,将cect-βcd水溶液缓慢加入至cect-ad水溶液中,继续剧烈搅拌0.5~12h,组装得到超分子甲壳素纳米颗粒snps。
13、根据本发明一种优选实施方式,步骤(1)包括:将虾壳原料浸泡于naoh溶液中,在室温下搅拌除去蛋白质;然后分散到hcl溶液中室温搅拌除去残留的矿物质;再然后分散到h2o2溶液中,调节ph到7.5~8.5,50~80℃加热进行氧化脱色;每个步骤结束后用去离子水洗至中性,最后将氧化脱色后产物进行干燥,得到纯化后的甲壳素粉末;更优选地,步骤(1)包括:将虾壳原料浸泡于2~8wt%naoh溶液中,在室温下搅拌24~72h除去蛋白质;然后分散到3~10wt%hcl溶液中室温搅拌24~72h除去残留的矿物质;再然后分散到2~6wt%h2o2溶液中,调节ph到7.8~8.2,50~80℃加热4~12h进行氧化脱色;每个步骤结束后用去离子水洗至中性,最后将氧化脱色后产物进行干燥,得到纯化后的甲壳素粉末。
14、根据本发明一种优选实施方式,步骤(2)包括:将纯化后的甲壳素粉末分散在naoh/尿素水溶液中,甲壳素浓度为0.5~8%;将上述溶液转移至冷肼中冷冻,然后在室温下快速搅拌至溶液解冻,离心得到澄清的甲壳素溶液;取甲壳素溶液于三口烧瓶中,10-20℃下逐滴滴加丙烯酰胺后搅拌反应,反应结束后,用浓hcl将反应物中和至弱碱性,装入透析袋对水透析,冷冻干燥后得到白色海绵状丙烯酰胺改性甲壳素ct-am;将ct-am溶于naoh水溶液中,室温搅拌进行水解;用浓hcl将水解液中和至弱碱性,装入透析袋对水透析,冷冻干燥后得到白色海绵状最终产物羧乙基甲壳素cect;更优选地,步骤(2)包括:将纯化后的甲壳素粉末分散在10~12wt%naoh/3~5wt%尿素水溶液中,甲壳素浓度为0.5~8%;将上述溶液转移至-40℃冷肼中冷冻2~12h后在室温下快速搅拌至溶液解冻,离心得到澄清的甲壳素溶液;取300g甲壳素溶液于500ml三口烧瓶中,15℃下逐滴滴加6.3~37.8g丙烯酰胺后搅拌反应2~24h,反应结束后,用浓hcl将反应物中和至弱碱性,装入mwco 8000~14000的透析袋对水透析3~5天,冷冻干燥后得到白色海绵状丙烯酰胺改性甲壳素ct-am;将ct-am溶于3~5m naoh水溶液中,室温搅拌6~24h进行水解;用浓hcl将水解液中和至弱碱性,装入mwco 8000~14000透析袋对水透析4~6天,冷冻干燥后得到白色海绵状最终产物羧乙基甲壳素cect。
15、根据本发明一种优选实施方式,步骤(3)包括:在冰水浴条件下,将环糊精βcd溶于naoh水溶液,然后加入对甲苯酰氯;搅拌反应后过滤除去滤渣,滴加hcl中和至弱碱性后继续搅拌;过滤收集沉淀,分别用去离子水、丙酮洗涤后真空干燥重结晶;然后将重结晶得到的ots-βcd溶解在1,6-己二胺中,75-85℃的氮气氛下搅拌;旋蒸浓缩后,在丙酮重结晶,真空干燥得到白色粉末βcd-had;然后,将edc和nhs引入含有βcd-had和mes的cect溶液中,搅拌反应后对水透析,冷冻干燥后得到cect-βcd;更优选地,步骤(3)包括:在冰水浴条件下,将11.1~66.6mmol环糊精βcd溶于0.2~1.2mmol naoh水溶液,然后加入对5.6~33.9mmol甲苯酰氯;搅拌反应0.5~2h后过滤除去滤渣,滴加hcl中和至弱碱性后继续搅拌0.5~2h;过滤收集沉淀,分别用去离子水、丙酮洗涤后真空干燥重结晶两次;然后将重结晶得到的1.9~11.6mmol ots-βcd溶解在100~400ml的1,6-己二胺中,75-85℃的氮气氛下搅拌6~48h;旋蒸浓缩后,在丙酮重结晶,真空干燥得到白色粉末βcd-had;然后,将0.4~4.8mmoledc和0.4~4.8mmol nhs引入含有1.5~9.0mmolβcd-had和2.5~15mmol mes的1.5~9.0mmol cect溶液中,搅拌反应6~48小时后装入mwco 3000~4000透析袋对水透析,冷冻干燥后得到cect-βcd。
16、根据本发明一种优选实施方式,步骤(4)包括:向1.5~9.0mmol cect溶液中加入732型氢离子交换树脂,搅拌反应6~48h后过滤,滴加四丁基氢氧化铵中和后冻干得到甲壳素铵盐,将甲壳素铵盐溶于二甲基亚砜中,引入3~12.0mmol金刚烷胺和0.5~3mmol无水三乙胺,搅拌反应6~48小时后装入mwco 3000~4000透析袋对水透析,冷冻干燥后得到cect-ad。
17、根据本发明一种优选实施方式,步骤(5)包括:取1.2~4.8mg cect-ad溶于1ml超纯水中,取2.4~9.6mg cect-βcd溶于1ml超纯水中;然后在剧烈搅拌下,利用微量进样器将cect-βcd水溶液缓慢加入至cect-ad水溶液中,继续剧烈搅拌0.5~12h,组装得到超分子甲壳素纳米颗粒snps。
18、本发明的第二方面提供由上述制备方法制得的甲壳素纳米颗粒。
19、本发明的第三方面提供上述甲壳素纳米颗粒作为药物载体的应用。应用时,cect-ad和cect-βcd不预先进行组装,而是先将cect-ad与药物混合,再组装cect-βcd。
20、本发明的第四方面提供一种载药甲壳素纳米颗粒,包括上述甲壳素纳米颗粒与药物;所述药物为非水溶性药物,优选为姜黄素。
21、本发明的第五方面提供所述载药甲壳素纳米颗粒的制备方法,包括以下步骤:
22、(a)根据上述的方法制备cect-βcd和cect-ad;
23、(b)在剧烈搅拌下,将药物加入至cect-ad水溶液中,得到cect-ad/药物混合溶液;然后在剧烈搅拌下,将cect-βcd水溶液缓慢加入至cect-ad/药物混合溶液中,继续剧烈搅拌、透析、冷冻干燥,得到载药甲壳素纳米颗粒。
24、根据本发明一种优选实施方式,步骤(b)包括:在剧烈搅拌下,将2~10mg ml-1药物加入至cect-ad水溶液中,继续剧烈搅拌0.5~6h,得到cect-ad/药物混合溶液;然后在剧烈搅拌下,利用微量进样器将cect-βcd水溶液缓慢加入至cect-ad/药物混合溶液中,继续剧烈搅拌0.5~6h;最后将混合液装入mwco 3000~4000透析袋对超纯水透析2~4天,冷冻干燥后即得载药甲壳素纳米颗粒。
25、本发明以羧乙基甲壳素接枝金刚烷(cect-ad)和主体聚合物羧乙基甲壳素接枝环糊精(cect-βcd),然后在水介质中通过二者的主客体作用组装构建纳米颗粒,通过进一步优化主客体浓度、甲壳素接枝率和总固含量等参数,构建出高效封装姜黄素、强稳定性的递送平台,实现对姜黄素药物高效率的包封。并且,本发明阐明了纳米颗粒电荷、粒径等因素对负载疏水药物姜黄素的影响机制,以及对姜黄素的保护机制,为设计更先进疏水药物递送平台提供理论和实践基础。
26、本发明拓宽生物质废弃物开发利用的新思路和新方法,为食品科技助力水产品及其加工副产物的减损增效提供科学依据和指导意义,有利于满足绿色化学循环转化的需求,实现经济效益、生态效益和社会效益一举多得。
27、本发明的其它特征和优点将在随后具体实施方式部分予以详细说明。
- 还没有人留言评论。精彩留言会获得点赞!