一种卡非佐米环糊精包合物及其制备方法和用途与流程
本发明属于生物医药,涉及一种卡非佐米环糊精包合物及其制备方法和用途。
背景技术:
1、水难溶性药物(例如卡非佐米)由于存在水溶性差、溶出速率慢和生物利用度低等缺点导致了其在医药领域的应用受限。提高水难溶性物质溶解性的方法很多,例如将难溶性药物制成固体分散体、环糊精包合物或药物纳米晶体等,其中环糊精包合物技术应用较为广泛,其不仅可以应用于口服和胃肠外药物制剂(静脉注射、肌肉注射和皮下注射)中,还可用于眼科制剂(局部给药)领域,成为近年来的研究热点之一。
2、环糊精(cyclodextrins,简称cds)是由至少6个d-吡喃葡萄糖单元通过α-(1,4)糖苷键连接形成的环状低聚糖,其安全性良好,通常被认为是基本无毒和无刺激的材料。最常见的3种天然环糊精为α-cds、β-cds和γ-cds,分别含有6、7和8个d-吡喃葡萄糖单元,其中β-cds的生产成本最低,但由于其溶解性很差,临床药品中一般使用的是溶解性更好的环糊精衍生物,例如羟丙基-β-环糊精和磺丁基-β-环糊精。cds是“桶状”或“锥形”环状分子,具有刚性结构和中心空腔,不同类型的cds分子空腔大小不同,α-cds、β-cds和γ-cds的内腔直径分别为和cds分子的羟基排列方式导致其cds内部空腔的表面具有疏水性,环面外部具有亲水性,允许其在空腔内容纳客体分子,并通过氢键、分子间作用力等和形状大小合适的疏水性药物形成包合物,由于药物的疏水部位处于环糊精空腔内,因此当将难溶性药物(例如卡非佐米)制成环糊精包合物时会显著提高药物的溶解性。
3、传统的环糊精包合物制备方法主要包括:研磨法、喷雾干燥法、溶剂蒸发法、共沉淀法、揉捏法、热熔挤压法、超临界二氧化碳法、冷冻干燥法及微波辐射法等,但这些传统工艺存在制备时间长、残留有机溶剂难以去除、封装效率低、用于大规模工业化制剂生产的成本较高或不适用于热稳定性差的药物等缺点。冷冻干燥法一般是将药物加入环糊精的水溶液中,磁力搅拌24小时后,将混合物通过冷冻干燥获得药物环糊精包合物,该法优势是制备过程温度可控,适用于热稳定性差的药物,操作简单,生产成本低,适用于大规模工业化制剂生产,然而该法所述的药物环糊精包合物溶液的制备时间较长,通常在24小时以上,这一缺陷仍有待克服。
4、cn1706501a公开了一种亲脂性药物环糊精包合物的制备方法,制备工艺过程如下:①分别将亲脂性药物和环糊精溶于叔丁醇和水相中;②混合上述两种溶液,得到单相溶液;③将此溶液进行干燥,得到药物环糊精包合物的干粉。该方法采用的制备体系为叔丁醇-水共溶,存在残留叔丁醇有机溶剂的问题。
5、cn107693772a公开了一种蛋白酶抑制剂环糊精组合物的制备方法,根据其实施例1记载,该方法在制备药物混悬液时将磺丁基醚β-环糊精、注射用水和卡非佐米原料药一同在高剪切混合器中实施混合。本发明的发明人重复了该方法并发现存在以下缺陷:
6、1、磺丁基醚β-环糊精、注射用水和卡非佐米原料药一同在高剪切混合器中制备药物混悬液时,药液体系产生了大量的黏稠性气泡,从而影响卡非佐米的溶解,增加药物溶解时长。不仅如此,产生的气泡还会占用配液罐体积,若进行大批量生产,就要在原有批量的基础上采用体积更大、对搅拌器要求更高的配液罐。cn107693772a披露的方法整个过程都需要高剪切和低剪切均质,其采用的配液罐需额外定制高速剪切仪和低剪切叶轮,大大增加了生产成本。
7、2、cn107693772a的配液过程较复杂,根据其实施例1记载,该专利配制批量为400l,需要先将100kg磺丁基醚β环糊精溶于水后,再加入卡非佐米混合搅拌,已知溶解100kg磺丁基醚β环糊精所需时间很长,当此法用于工业生产时也会大大增加时间成本。
8、3、cn107693772a制备得到的卡非佐米环糊精包合物含有氯醇降解产物cdp。
技术实现思路
1、本发明旨在至少解决现有技术中存在的技术问题之一。为此,本发明的目的在于提供一种卡非佐米环糊精包合物及其制备方法和用途。本发明在保证制备得到的产品和原研市售品(参比制剂)结构特性一致的同时,进一步提高了药物的溶解效果以及环糊精和卡非佐米形成包合物时的结合力和稳定性;相较于现有技术,本发明用于大批量生产时,配液时间更短;配液罐无需额外定制搅拌仪器,生产成本更低;采用本发明方法制备的卡非佐米环糊精包合物长期稳定性和光照稳定性良好,复溶时间、水分含量、单杂及总杂含量均远远低于注射用卡非佐米质量标准限度,且无cdp的生成。
2、本发明提供了一种卡非佐米环糊精包合物的制备方法,包括如下步骤:
3、(1)将卡非佐米均匀分散于水中,得到混悬液;(2)将环糊精、酸和水加入到步骤(1)所得混悬液中,搅拌溶解,收集包合物。
4、以下实施例2和对比例1、2通过平行实验对比可以看出,本发明步骤(1)组分为卡非佐米+水,步骤(2)搅拌4h时卡非佐米浓度就已经达到饱和(5.4mg/ml),大大缩短了配液时长,且已知将药物浓度提升至饱和可在一定程度上提高成品收率。
5、若步骤(1)组分为水+卡非佐米+磺丁基β环糊精,即使将步骤(2)搅拌时间延长至19h,卡非佐米的浓度也仅为4.4mg/ml;若步骤(1)组分为水+卡非佐米+无水枸橼酸,即使将步骤(2)搅拌时间延长至24h,卡非佐米的浓度也仅为3.3mg/ml,均未达到卡非佐米浓度在5.0mg/ml以上的标准。
6、经发明人实验考察,环糊精和枸橼酸在高剪切分散乳化机中搅拌时均很容易产生气泡,产生的气泡一方面会占用搅拌罐体积,当大批量生产时,就需要在原有批量的基础上采用体积更大、对搅拌器要求更高的配液罐,从而大大增加生产成本;另一方面,产生的气泡会在液面中上升并聚集在液面上,最终会导致分散效果不佳,影响药物的溶解,从而增加药物溶解时长。
7、本发明步骤(1)组分仅为卡非佐米+水,避免了步骤(1)采用高剪切分散乳化机搅拌时产生气泡,步骤(2)无需继续高速剪切均质,整个制备过程均未产生气泡,一方面不会占用额外的搅拌器体积,进行大批量生产时采用的配液罐无需额外定制搅拌仪器,大大节约了生产成本;另一方面,由于未产生气泡,使得分散效果较好,大大缩短了药物溶解时长。
8、进一步地,步骤(1)中卡非佐米:水的质量比为1:20~1:100。
9、优选地,步骤(1)中卡非佐米:水的质量比为1:40~1:80。
10、进一步优选地,步骤(1)中卡非佐米:水的质量比为1:60。
11、进一步地,步骤(1)在高剪切分散乳化机中制备混悬液。
12、进一步地,卡非佐米:环糊精的质量比为1:20~1:60。
13、优选地,卡非佐米:环糊精的质量比为1:40~1:60。
14、进一步优选地,卡非佐米:环糊精的质量比为1:50。
15、进一步地,步骤(2)中加入环糊精:水的质量比为1:(1.74~1.80)。
16、优选地,步骤(2)中加入环糊精:水的质量比为1:(1.75~1.77)。
17、进一步优选地,步骤(2)中加入环糊精:水的质量比为1:1.76。
18、进一步地,所述环糊精为水溶性环糊精。
19、优选地,所述环糊精为α环糊精、β环糊精、γ环糊精中至少一种。
20、优选地,所述环糊精为羟丙基β环糊精、磺丁基β环糊精中至少一种。
21、进一步优选地,所述环糊精为磺丁基β环糊精。
22、优选地,所述环糊精的氯化钠含量≤0.2%。
23、进一步优选地,所述环糊精的氯化钠含量≤0.005%。
24、进一步地,卡非佐米:酸的质量比为1:(1~1.25)。
25、优选地,卡非佐米:酸的质量比为1:1。
26、进一步地,步骤(2)所述酸为不含氯离子的酸。
27、优选地,所述酸为枸橼酸、醋酸、磷酸中至少一种。
28、进一步优选地,所述酸为枸橼酸。
29、进一步地,步骤(2)中所述酸以水溶液的形式加入;步骤(2)中所述环糊精在加入混悬液之前未经溶解。
30、相较于现有技术需要先将环糊精溶于水,再加入卡非佐米搅拌溶解,本发明无须事先制备环糊精水溶液,节约了环糊精的溶解时长,进而缩短了配液时长。
31、进一步地,步骤(1)在搅拌转速为2000~6000rpm的条件下进行分散。
32、优选地,步骤(1)搅拌转速为4000~6000rpm。
33、进一步优选地,步骤(1)搅拌转速为4000rpm。
34、进一步地,步骤(1)搅拌0.5~4h完成分散。
35、进一步地,步骤(2)搅拌转速为150~450rpm。
36、优选地,步骤(2)搅拌转速为300~450rpm。
37、进一步优选地,步骤(2)搅拌转速为300rpm。
38、进一步地,步骤(2)搅拌2h以上。根据本发明的一些具体实施例,步骤(2)搅拌2h时,卡非佐米浓度就达到了在5.0mg/ml以上的标准。
39、优选地,步骤(2)搅拌6h以上。
40、进一步优选地,步骤(2)搅拌6h。
41、进一步地,步骤(2)所述搅拌持续至卡非佐米浓度在5.0mg/ml以上。对于相同罐装量的玻璃瓶药液,药物浓度越高,罐装体积越小,冻干时间越短。本发明参考原研药品罐装药液浓度,将步骤(2)搅拌后卡非佐米所要达到的浓度标准定为在5.0mg/ml以上。
42、进一步地,步骤(1)、(2)的温度为2~10℃。
43、优选地,温度为2~8℃。
44、进一步优选地,温度为5℃。
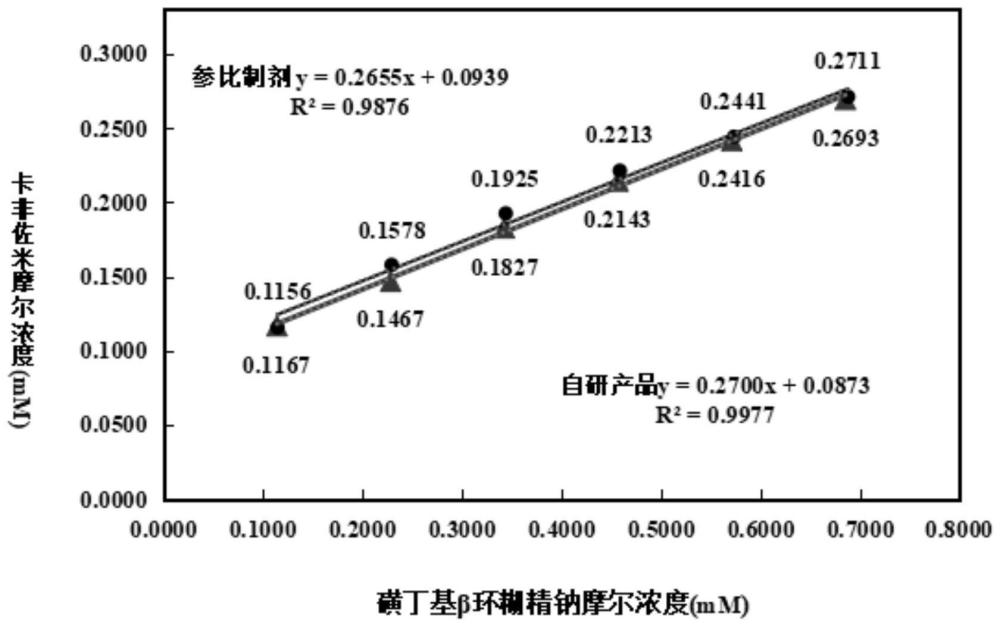
45、进一步地,步骤(2)在搅拌溶解后还包括调节ph值的步骤。
46、优选地,调节ph值至3.0~4.0。在上述ph值条件下,有助于抑制卡非佐米的环氧环水解开环、生成降解杂质。
47、优选地,用氢氧化钠水溶液调节ph值。
48、优选地,所述氢氧化钠水溶液的浓度为5%(w/w)。
49、进一步地,调节ph值后还包括定重的步骤;
50、优选地,补加水定重至卡非佐米的浓度为5mg/ml。
51、进一步地,还包括冷冻干燥的步骤。
52、本发明还提供了按照前述制备方法得到的卡非佐米环糊精包合物。
53、本发明还提供了一种卡非佐米环糊精包合物。
54、进一步地,其包合稳定常数不低于4000mm-1。
55、优选地,包合稳定常数为4200~4250mm-1。
56、环糊精包合物的包合稳定常数(k值)是决定环糊精包合性质的一个重要参数,也是环糊精应用于药学研究过程中的一个必不可少的参数。通过测定k值能对包合平衡作出定量的描述,其大小反映了环糊精与药物分子形成包合物时结合力的强弱以及稳定性。采用本发明方法制备得到的包合物k值(4237mm-1)高于参比制剂(3850mm-1),表明本发明包合物稳定性和环糊精与药物分子的结合力都强于参比制剂。
57、进一步地,其不含cdp。
58、在酸性条件下卡非佐米的环氧环可能会水解,然后在氯化钠存在下发生亲核反应产生下所示的降解产物氯醇加合物(cdp)。本发明通过优化制备工艺,能够有效抑制卡非佐米水解及与氯化钠发生亲核反应,使得本发明卡非佐米磺丁基β环糊精包合物中不含氯醇加合物(cdp)。
59、
60、进一步地,其水分含量≤2.0%。采用本发明制备方法能够将卡非佐米环糊精包合物的水分含量控制在2.0%以下,有助于进一步抑制卡非佐米的环氧环水解开环、生成降解杂质。
61、进一步地,其单个杂质含量≤0.80%,总杂含量≤5.0%。
62、优选地,其单个杂质≤0.14%,总杂含量≤0.38%。
63、采用本发明方法制备的卡非佐米磺丁基β环糊精包合物中单杂及总杂含量均显著低于注射用卡非佐米质量标准限度。
64、本发明还提供了前述卡非佐米环糊精包合物在制备治疗肿瘤的药物中的用途。
65、本发明提供了一种卡非佐米环糊精包合物及其制备方法和用途,至少具有以下有益技术效果:
66、1、本发明方法相较于传统的水难溶性药物环糊精包合物制备工艺,制备得到的产品无有机溶剂残留、用于大规模工业化制剂生产的成本较低,且可用于热稳定性差的药物β环糊精包合物的制备。
67、2、本发明方法配液时间短,且用于制备大批量卡非佐米环糊精包合物时,采用的配液罐无需额外定制搅拌仪器,大幅降低了生产成本。
68、3、相较于现有技术,本发明无须事先制备环糊精水溶液,节约了环糊精的溶解时长。
69、4、本发明通过优化制备工艺,在保证得到的产品和原研市售品结构特性一致的同时,进一步提升了药物的溶解效果及环糊精和卡非佐米形成包合物时的结合力和稳定性。
70、5、采用本发明方法制备得到的卡非佐米环糊精包合物长期稳定性和光照稳定性良好,其复溶时间、水分含量、单杂及总杂含量均显著低于注射用卡非佐米质量标准限度,并且无降解产物氯醇加合物的产生。
- 还没有人留言评论。精彩留言会获得点赞!