一种红细胞膜基-聚多巴胺纳米递送载体及其制备方法
本发明涉及纳米药物制备,更具体的说是涉及一种可介导光热疗、化疗、化学动力学治疗等多手段协同的红细胞膜基-聚多巴胺纳米递送载体及其制备方法。
背景技术:
1、癌症作为一种严重威胁人类健康的世界公共卫生疾病,成因复杂且因癌细胞会不断进化、转移,至今无法得到完全治愈。目前,癌症治疗方法包括手术治疗、化疗、放射治疗、免疫治疗、光热治疗(photothermal therapy,ptt)、光动力治疗(photodynamic therapy,pdt)和化学动力学治疗(chemodynamic therapy,cdt)等。然而,单一疗法尤其是化疗会对机体正常细胞造成不必要损伤,引起不良反应并产生耐药性等问题。因此,引入新型辅助治疗方法、协同治疗可有效改善单一化疗存在的问题,提高疗效。此外,开发绿色安全的新型药物递送载体为有效降低化疗药物不良反应、增强疗效提供了一种可行的方案。使用纳米载体对化疗药物与光敏剂等同时递送可达到协同治疗效果,有效延长各类治疗剂在体内的循环时间,并到达更深层肿瘤组织,避免其被过早清除,经表面修饰后的纳米载体还能有效靶向肿瘤细胞,产生更好的治疗效果。
2、ptt是利用光热转换剂(photothermal conversion agents,ptas),在光照下,吸收光能产热致使肿瘤细胞坏死。但大部分小分子光敏剂都有溶解度差、急性毒性大、清除速度快等缺陷。而介孔聚多巴胺(mpda)不仅自身具备独特的光热转换性能,其表面还可进行功能化修饰,特殊的介孔空腔结构可对药物进行有效负载,从而实现协同治疗。
3、以纳米材料为基础的核/壳结构型载体在药物递送等生物医学领域已有广泛深入的研究,且该类系统可与其它辅助疗法结合,发挥化疗协同作用。mpda具有较强的光热稳定性和优异的体内外光热转换能力,同时,其载药量高、易于功能化修饰,化疗药物可有效负载于mpda的空腔和表面。以mpda为载体,可将药物准确地递送到肿瘤组织,减少过早泄露,实现精准释放,更好地发挥药效。在808nm波长的近红外(nir)光照下,随着肿瘤部位温度升高,促使药物从载体中释放,提高肿瘤细胞摄取率。因此,利用mpda优异的光热转换与载药性能进行靶向协同治疗具有更好的效果。
4、以红细胞膜(rbcm)作为涂层构建药物载体已被证实是实现协同治疗的一种可靠选择。rbcm上存在丰富的膜蛋白。其中,膜蛋白cd47能够与吞噬细胞表达的信号调节蛋白α(sirpα)相互作用,并发出“不要吃我”的信号,从而抑制巨噬细胞吞噬并延长自身在体内的循环时间,提高载体稳定性,增强其在肿瘤细胞的聚集,无脱靶毒性。同时,作为内源性生物基材料,由rbcm制得的仿生型载体具有良好的生物相容性,开发应用潜力极大。
5、载体构建时,cu2+的引入会增强mpda的光热特性,且使纳米载体具有cdt疗效,在肿瘤微酸环境中,与过量h2o2反应,进行类芬顿反应,生成大量ros以辅助杀死肿瘤细胞,具有优异的协同治疗作用。
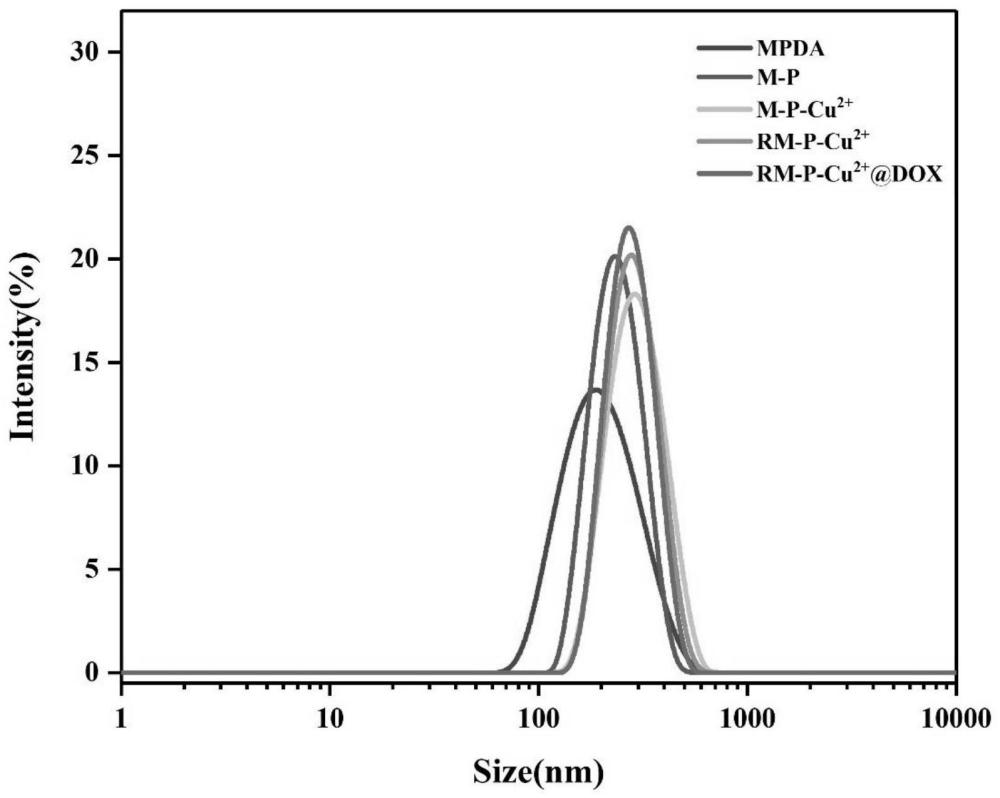
6、在抗癌药物中,阿霉素(dox)是临床中最常用的化疗药物之一,对多种实体瘤具有优异的杀灭作用,以mpda载体负载dox,可有效延长体内循环时间,提高肿瘤靶向性,降低对正常组织和细胞的损伤。此外,纳米载体对其包覆率较高。在nir照射下,mpda升温,触发dox在肿瘤靶点定位集中释放。
技术实现思路
1、有鉴于此,本发明制备了一种新型的氧化还原敏感型纳米载体(mpda-p-cu2+)。将rbcm修饰在mpda表面增加其肿瘤靶向性与生物相容性。以dox为模型药物,将其包裹在纳米复合材料中,可促进其在肿瘤部位积聚,有效降低毒副作用。
2、使用ft-ir、uv-vis、tem、粒径、zeta电势和xps等技术确定纳米载体的形态结构,进行详细表征。考察mpda、mpda-p和mpda-p-cu2+的光热转换性能。
3、材料合成后表征的主要目的是考察相关基团是否修饰成功,以及修饰后载体性质的变化,并考察其载药量、包封率、体外释放率等。
4、以人乳腺癌mcf-7细胞为模型,考察原始型mpda、m-p-cu2+@dox、mpda-p@dox和rm-p-cu2+等样品在808nmnir照射下的细胞毒性、细胞摄取等。
5、为了实现上述目的,本发明采用如下技术方案:
6、一种红细胞膜基-聚多巴胺纳米递送载体的制备方法,包括以下步骤:
7、(1)使用一锅合成法合成mpda,以自身丰富的官能团连接盐酸多巴胺(pda)并对cu2+进行金属螯合,制备了一种新型的氧化还原敏感型纳米载体(mpda-p-cu2+);
8、步骤(1)中,合成的mpda粒径约为180nm,mpda通过以下步骤合成:取表面活性剂f-127与1,3,5-三甲苯(tmb)置于无水乙醇和h2o中进行超声,之后加入氨丁三醇(tris)和盐酸多巴胺(pda)搅拌24h,对混合液进行离心处理,使用乙醇和丙酮洗涤纳米颗粒,即得mpda;
9、f-127:tmb:tris:pda的质量比为36:36:9:6;
10、将mpda与pda反应制备mpda-p,随后加入二水合氯化铜(cucl2·2h2o)和pda进行负载,8h后离心洗涤,得mpda-p-cu2+;
11、mpda:pda的质量比为5-15:1,mpda-p:cucl2·2h2o的质量比为3-10:1;
12、(2)以mpda-p-cu2+负载药物,使用红细胞膜(rbcm)包覆mpda-p-cu2+以获得对肿瘤细胞的靶向性,延长药物在体内的循环时间,制成rm-p-cu2+@dox复合纳米载药系统;
13、mpda-p-cu2+:rbcm的质量比为8-15:1,rm-p-cu2+:药物的质量比为2-3:1。
14、进一步的,,步骤(1)所述mpda的制备方法包括以下步骤:
15、采用一锅法合成mpda纳米颗粒;首先将0.36g f127和0.36g tmb溶解于h2o(65ml)和乙醇(60ml)的混合液中;搅拌30min后,向混合物中加入溶于10ml h2o的90mg tris溶液,再添加60mg盐酸多巴胺;反应所得混合物在室温下搅拌24h,离心以分离产物;用乙醇和丙酮清洗离心后的颗粒;通过提取去除模板,将样品在乙醇和丙酮(v/v=2:1)的混合溶液中通过超声处理三次,每次30分钟;最终产品分散保存在乙醇中,以备后续使用。
16、进一步的,,步骤(1)所述rbcm的制备方法包括以下步骤:
17、首先通过小鼠眼窦获得全血,将新鲜血液收集在肝素涂层的血液收集管中,在4℃下以1500rpm离心10min以分离血浆;将所得rbc用pbs/生理盐水洗涤多次,再将rbc收在4℃的超纯水中悬浮4h,每间隔1h手动震摇离心管加速rbc涨破;随后以15000rpm离心5min后去除血红蛋白,用超纯水洗涤rbcm数次,并使用0.45μm和0.2μm过滤器依次滤过,直至上清液无色,沉淀为淡粉色后,使用超声波细胞破碎仪在12%功率下对收集的红细胞鬼影进行5min的超声波处理,开5s,关5s;
18、将所得rbcm储存在含有蛋白酶抑制剂(2mm)的pbs(ph=7.4)中,温度为-80℃。
19、进一步的,,步骤(1)所述mpda-p的制备方法包括以下步骤:
20、将10mg由(1)合成的mpda溶于1ml纯水中,取5mg pda加入圆底烧瓶中,37℃反应6h,再将混合液离心,洗涤至上清无色,放入冰箱备用。
21、进一步的,,步骤(1)所述mpda-p-cu2+的制备方法包括以下步骤:
22、向圆底烧瓶中加入10mg mpda-p,超纯水分散后缓慢滴入由tris-hcl(ph 5.8,10mm)配置的1mg/ml pda和1.74mg/ml cucl2·2h2o后,在1200rpm转速下45℃反应12h;反应结束后,将混合溶液离心洗涤,并冷冻干燥。
23、进一步的,,步骤(1)所述rm-p-cu2+的制备方法包括以下步骤:
24、通过超声细胞破碎仪将制备好的rbcm包裹mpda-p-cu2+,以供进一步使用,再将其与rbcm通过avanti微型挤出机(avanti polarlipids)以200nm、100nm的聚碳酸酯膜挤压10次,获得最终纳米颗粒。
25、进一步的,,步骤(2)中,红细胞膜提取全程保持洁净,通过细胞破碎提取得到;所述负载药物可为疏水性化合物或多肽、蛋白质、大分子多醣、维生素、谷胱甘肽任意一种。
26、进一步的,所述负载药物为阿霉素(dox)。
27、进一步的,mpda:pda的质量比为10:1,mpda-p:cucl2·2h2o的质量比为5:1,mpda-p-cu2+:rbcm的质量比为10:1,rm-p-cu2+:药物的质量比为2:1。
28、一种功能化修饰的氧化还原敏感型红细胞膜基-聚多巴胺纳米递送载体,其粒径范围在250-280nm。
29、经由上述的技术方案可知,与现有技术相比,本发明的有益效果为:
30、①mpda具有粘附性、较好的生物相容性、可降解性、光热转换能力等,且其结构简单、细胞毒性低,具有丰富的表面积,其介孔空腔和疏水性苯环结构可以实现对dox等药物的有效包封和缓释,结构中存在丰富的官能团,易于功能化修饰,从而增强对肿瘤细胞的靶向性。
31、②rbcm的修饰使mpda具有良好的生物相容性,并有效延长在体内的循环时间。通过高渗透长滞留(epr)效应更好地聚集到肿瘤部位,有效增强药物靶向性,降低潜在毒性并实现特异性蓄积。
32、③cu2+在肿瘤微酸环境中可激活类芬顿反应(fenton-like reactions),催化过量h2o2生成活性氧(ros),发挥cdt疗效,并增强ptt的协同作用。
33、④rm-p-cu2+具有良好的氧化还原响应性,pda层具有良好的堵孔作用,降低药物在非靶点的释放,且在肿瘤微酸环境中发生连接键断裂,实现肿瘤响应性释放dox,使递药系统更好地实现协同治疗。
- 还没有人留言评论。精彩留言会获得点赞!