一种载药聚多巴胺包覆纳米纤维敷料及其制备方法
1.本发明属于伤口敷料技术领域,尤其涉及一种基于表面化学改性技术制备纳米纤维敷料的方法。
背景技术:
2.当人体组织受到创伤后,细菌感染是导致伤口不能及时愈合的主要因素。因此,使用抗菌型敷料来预防和治疗伤口成为主要手段。目前临床上所使用的抗菌敷料主要以高毒性的银离子作为抗菌成分,容易引起银中毒、过敏以及肝损伤等不良反应。所以具有抑菌生物活性的敷料对于临床的创伤愈合具有重要意义。近年来的研究也开发出如水凝胶、薄膜、纳米纤维膜等一些创伤敷料。通过静电纺丝技术来制备得到的纳米纤维膜具有高的比表面积、高孔隙率等特性,以及还具有类似于细胞外基质的三维结构,这对细胞粘附和增殖至关重要。
3.ε-聚赖氨酸是一种具有广谱抗菌特性的阳离子多肽。它是一种可生物降解的聚合物,对细胞毒性小,因此在食品和生物医学领域得到了广泛的应用。ε-聚赖氨酸的抗菌活性可能是由于其在静电力作用下与带负电荷的细菌细胞结合,破坏细胞膜,最终导致细菌细胞死亡。
4.传统的抗菌纳米纤维膜会将抗菌药物混在纺丝溶液里一起纺丝。这种方式可能存在纺丝困难以及由于高压的作用下导致抗菌药物的活性下降。并且将药物负载在纳米纤维内部后,抗菌药物不能直接与伤口细菌作用,而通过表面化学改性技术可以将药物负载在纤维膜表面,使伤口组织处的抑菌效果更好。聚多巴胺是在碱性环境下,多巴胺发生自聚合形成的一种具有生物相容性好、粘接性能强、易于功能化等特点的物质。在聚多巴胺功能化材料的表面后,可以与含有氨基基团或者硫醇基团的药物发生共价结合,使得药物固定在材料表面。此外,聚多巴胺还具有抗氧化和光热特性。聚多巴胺作为抗氧化剂可以清除伤口处过量的活性氧,从而加快伤口愈合。并且聚多巴胺在近红外激光的照射下产生热,从而可以进一步的杀死细菌。
技术实现要素:
5.有鉴于此,本发明提供了一种基于表面化学改性技术制备纳米纤
6.维敷料的方法。该纳米纤维膜具有高抑菌活性以及抗氧化活性。
7.本发明提供了一种载药聚多巴胺包覆纳米纤维敷料,由聚己内酯经静电纺丝得到纳米纤维膜基体材料,再通过聚多巴胺的功能化将ε-聚赖氨酸固定在纤维膜表面。
8.本发明的具体技术方案如下:
9.s1)将聚己内酯、三氯甲烷和甲醇混合溶解,得到聚己内酯溶液。将所述纺丝溶液进行静电纺丝,得到纳米纤维基底材料;
10.s2)将纳米纤维膜加入到多巴胺的tris-hcl缓冲液中反应;
11.s3)将上述s2)纳米纤维膜加入到ε-聚赖氨酸的tris-hcl缓冲液反应得到最终的
纳米纤维膜;
12.作为本发明的进一步改进,步骤一具体为:取分子量为70000~90000的聚己内酯加入至三氯甲烷/甲醇中,三氯甲烷与甲醇体积比为2∶1,在磁力搅拌的条件下进行搅拌,搅拌的转速为300~400rpm,搅拌的时间为6~12h,得到12%(w/v)聚己内酯溶液。将聚己内酯溶液静电纺丝得到聚己内酯纳米纤维膜。
13.作为本发明的进一步改进,步骤二具体为:剪取2~2.5
×
2~2.5cm纳米纤维膜,称量50mg纳米纤维膜,浸渍在10-20ml无水乙醇中30s。称量0.1g多巴胺置于50ml tris-hcl缓冲液中,待多巴胺完全溶解后,加入无水乙醇处理后的纤维膜,在磁力搅拌的条件下进行搅拌,搅拌的转速为300rpm。反应温度为25℃,反应4-12h。将第三步反应后的纳米纤维膜加入到100ml的去离子水中,在磁力搅拌的条件下进行搅拌,搅拌的转速为450rpm,搅拌12h。
14.作为本发明的进一步改进,步骤三具体为:称量1.5-3gε-聚赖氨酸,置于50mltris-hcl缓冲液中,待ε-聚赖氨酸完全溶解后,水洗后的纳米纤维膜,在磁力搅拌的条件下进行搅拌,搅拌的转速为300rpm。反应温度为25-37℃,反应12-24h。将反应结束后的纤维膜在去离子水中清洗三次。将纳米纤维膜放置在真空烘箱内,真空状态下,30℃下干燥24h。最终得到载药聚多巴胺包覆纳米纤维敷料。
15.聚己内酯作为载药聚多巴胺包覆纳米纤维敷料的基底材料,具有合适的机械性能和生物相容性,广泛用于组织工程领域。本发明将聚己内酯作为基底材料,其疏水性可以使得在后续的化学改性中避免发生溶胀或者水解。并且聚己内酯有很强的疏水性,在伤口愈合过程中影响细胞的黏附和生长。
16.本发明的创新之处如下,本发明通过聚多巴胺功能化聚己内酯纳米纤维,使得ε-聚赖氨酸能够通过简单、无毒的过程负载在纳米纤维膜的表面,使其更好的与伤口处的细菌接触并杀死细菌。并且聚多巴胺还具有光热特性,通过近红外激光照射,产生热量,杀死细菌。聚多巴胺具备的抗氧化能力也可以降低伤口处过量的活性氧,从而加快伤口的愈合。本发明首次将聚多巴胺的光热特性和抗氧化能力共同运用在伤口愈合领域,并且可以和药物共同作用,大大加快伤口愈合速度。
附图说明
17.图1为本发明实施例1载药聚多巴胺包覆纳米纤维敷料的扫描电镜图其中,(a)为实例1聚己内酯纳米纤维,(b)为实施例1包覆聚多巴胺的纳米纤维;(c)为实施例1载药聚多巴胺包覆纳米纤维敷料;
18.图2为本发明实施例1载药聚多巴胺包覆纳米纤维敷料的红外光谱图;
19.图3为本发明实施例1载药聚多巴胺包覆纳米纤维敷料的水接触角图,其中,(a)为实例1聚己内酯纳米纤维的水接触角图,(b)为实施例1包覆聚多巴胺的纳米纤维的水接触角图;(c)为实施例1载药聚多巴胺包覆纳米纤维敷料的水接触角图;
20.图4为本发明实施例1载药聚多巴胺包覆纳米纤维敷料的抗氧化效率图;
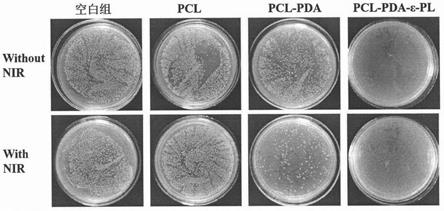
21.图5为本发明实施例1载药聚多巴胺包覆纳米纤维敷料对大肠杆菌的抑菌效果图。
具体实施方式
22.本发明提供了一种载药聚多巴胺包覆纳米纤维敷料及其制备方法,该发明通过简
单的化学改性技术将抗菌药物ε-聚赖氨酸负载在纳米纤维上,采用的聚多巴胺还具有抗氧化特性以及光热特性。用于解决伤口愈合过程中,伤口收到细菌感染而不能快速愈合的问题。
23.以下通过实施例对本发明进一步详细说明:
24.实施例1
25.(1)配制纺丝溶液:取分子量为70000~90000的聚己内酯加入至三氯甲烷/甲醇中,三氯甲烷与甲醇体积比为2∶1,在磁力搅拌的条件下进行搅拌,搅拌的转速为300~400rpm,搅拌的时间为6~12h,聚己内酯的溶液浓度为12%(w/v)。
26.(2)将纺丝溶液进行进行静电纺丝,得到载药聚多巴胺包覆纳米纤维敷料的基体材料。
27.静电纺丝过程如下:
28.第一步:调节操作室内环境温湿度,确保纺丝环境温度在20℃~40℃,湿度在50%~70%的范围内。
29.第二步:取硅油纸一张,将硅油纸粘贴在滚筒收集器上,完全覆盖滚筒收集器,滚筒收集器的直径为10cm。
30.第三步:取一根1mm内径硅胶管,在硅胶管两端分别套上鲁尔接头,并且一端接上内径为22g针头,另一端接上5ml注射器。
31.第四步:用5ml注射器吸取5ml纺丝溶液,用手慢慢推动注射器,直到有少许的纺丝液从针头溢出即可。
32.第五步:将装有纺丝液的注射器安装在推进器上,注意推进器要顶住注射器的末端。
33.第六步:将滚筒注射器置于注射泵和高压直流电源之间,针头距离滚筒15cm。高压直接电源的正极接针头,负极接滚筒收集器。
34.第七步:打开注射泵电源,调节纺丝速度为5ml/h。
35.第八步:打开高压直流电源,旋转调压旋钮,调节电压17kv。
36.第九步:开启滚筒收集器旋转按钮,滚筒转动速率为2r/s。
37.第十步:静电纺丝25min。
38.第十一步:纺丝结束时,先将高压直流电源的电压调到零,然后关闭高压直流电源,接着关闭注射泵,拔下二者电源插头。取下纺有纳米纤维膜的硅油纸。
39.(3)纳米纤维膜表面化学改性
40.第一步:将上述纳米纤维膜放置在真空烘箱内,真空状态下,40℃下干燥12h。
41.第二步:剪取2~2.5
×
2~2.5cm纳米纤维膜,称量50mg纳米纤维膜,浸渍在10-20ml无水乙醇中30s。
42.第三步:称量0.1g多巴胺置于50ml tris-hcl缓冲液中,待多巴胺完全溶解后,加入第二步的无水乙醇处理后的纤维膜,在磁力搅拌的条件下进行搅拌,搅拌的转速为300rpm。反应温度为25℃,反应12h。
43.第四步:将第三步反应后的纳米纤维膜加入到100ml的去离子水中,在磁力搅拌的条件下进行搅拌,搅拌的转速为450rpm,搅拌12h。
44.第五步:称量2.5gε-聚赖氨酸,置于50mltris-hcl缓冲液中,待ε-聚赖氨酸完全溶
解后,加入第四步的水洗后的纳米纤维膜,在磁力搅拌的条件下进行搅拌,搅拌的转速为300rpm。反应温度为37℃,反应24h。
45.第六步:将反应结束后的纤维膜在去离子水中清洗三次。将纳米纤维膜放置在真空烘箱内,真空状态下,30℃下干燥24h。最终得到载药聚多巴胺包覆纳米纤维敷料。
46.实施例2
47.(1)配制纺丝溶液:取分子量为70000~90000的聚己内酯加入至三氯甲烷/甲醇中,三氯甲烷与甲醇体积比为2∶1,在磁力搅拌的条件下进行搅拌,搅拌的转速为300~400rpm,搅拌的时间为6~12h,聚己内酯的溶液浓度为12%(w/v)。
48.(2)将纺丝溶液进行进行静电纺丝,得到载药聚多巴胺包覆纳米纤维敷料的基体材料。
49.静电纺丝过程如下:
50.第一步:调节操作室内环境温湿度,确保纺丝环境温度在20℃~40℃,湿度在50%~70%的范围内。
51.第二步:取硅油纸一张,将硅油纸粘贴在滚筒收集器上,完全覆盖滚筒收集器,滚筒收集器的直径为10cm。
52.第三步:取一根1mm内径硅胶管,在硅胶管两端分别套上鲁尔接头,并且一端接上内径为22g针头,另一端接上5ml注射器。
53.第四步:用5ml注射器吸取5ml纺丝溶液,用手慢慢推动注射器,直到有少许的纺丝液从针头溢出即可。
54.第五步:将装有纺丝液的注射器安装在推进器上,注意推进器要顶住注射器的末端。
55.第六步:将滚筒注射器置于注射泵和高压直流电源之间,针头距离滚筒15cm。高压直接电源的正极接针头,负极接滚筒收集器。
56.第七步:打开注射泵电源,调节纺丝速度为5ml/h。
57.第八步:打开高压直流电源,旋转调压旋钮,调节电压17kv。
58.第九步:开启滚筒收集器旋转按钮,滚筒转动速率为2r/s。
59.第十步:静电纺丝25min。
60.第十一步:纺丝结束时,先将高压直流电源的电压调到零,然后关闭高压直流电源,接着关闭注射泵,拔下二者电源插头。取下纺有纳米纤维膜的硅油纸。
61.(3)纳米纤维膜表面化学改性
62.第一步:将上述纳米纤维膜放置在真空烘箱内,真空状态下,40℃下干燥12h。
63.第二步:剪取2~2.5
×
2~2.5cm纳米纤维膜,称量25mg纳米纤维膜,浸渍在10-20ml无水乙醇中30s。
64.第三步:称量0.05g多巴胺置于25ml tris-hcl缓冲液中,待多巴胺完全溶解后,加入第二步的无水乙醇处理后的纤维膜,在磁力搅拌的条件下进行搅拌,搅拌的转速为300rpm。反应温度为25℃,反应12h。
65.第四步:将第三步反应后的纳米纤维膜加入到100ml的去离子水中,在磁力搅拌的条件下进行搅拌,搅拌的转速为450rpm,搅拌12h。
66.第五步:称量1.25gε-聚赖氨酸,置于25ml tris-hcl缓冲液中,待ε-聚赖氨酸完全
溶解后,加入第四步的水洗后的纳米纤维膜,在磁力搅拌的条件下进行搅拌,搅拌的转速为300rpm。反应温度为37℃,反应24h。
67.第六步:将反应结束后的纤维膜在去离子水中清洗三次。将纳米纤维膜放置在真空烘箱内,真空状态下,30℃下干燥24h。最终得到载药聚多巴胺包覆纳米纤维敷料。
68.实施例3
69.(1)配制纺丝溶液:取分子量为70000~90000的聚己内酯加入至三氯甲烷/甲醇中,三氯甲烷与甲醇体积比为2∶1,在磁力搅拌的条件下进行搅拌,搅拌的转速为300~400rpm,搅拌的时间为6~12h,聚己内酯的溶液浓度为12%(w/v)。
70.(2)将纺丝溶液进行进行静电纺丝,得到载药聚多巴胺包覆纳米纤维敷料的基体材料。
71.静电纺丝过程如下:
72.第一步:调节操作室内环境温湿度,确保纺丝环境温度在20℃~40℃,湿度在50%~70%的范围内。
73.第二步:取硅油纸一张,将硅油纸粘贴在滚筒收集器上,完全覆盖滚筒收集器,滚筒收集器的直径为10cm。
74.第三步:取一根1mm内径硅胶管,在硅胶管两端分别套上鲁尔接头,并且一端接上内径为22g针头,另一端接上5ml注射器。
75.第四步:用5ml注射器吸取5ml纺丝溶液,用手慢慢推动注射器,直到有少许的纺丝液从针头溢出即可。
76.第五步:将装有纺丝液的注射器安装在推进器上,注意推进器要顶住注射器的末端。
77.第六步:将滚筒注射器置于注射泵和高压直流电源之间,针头距离滚筒15cm。高压直接电源的正极接针头,负极接滚筒收集器。
78.第七步:打开注射泵电源,调节纺丝速度为5ml/h。
79.第八步:打开高压直流电源,旋转调压旋钮,调节电压17kv。
80.第九步:开启滚筒收集器旋转按钮,滚筒转动速率为2r/s。
81.第十步:静电纺丝25min。
82.第十一步:纺丝结束时,先将高压直流电源的电压调到零,然后关闭高压直流电源,接着关闭注射泵,拔下二者电源插头。取下纺有纳米纤维膜的硅油纸。
83.(3)纳米纤维膜表面化学改性
84.第一步:将上述纳米纤维膜放置在真空烘箱内,真空状态下,40℃下干燥12h。
85.第二步:剪取2~2.5
×
2~2.5cm纳米纤维膜,称量50mg纳米纤维膜,浸渍在10-20ml无水乙醇中30s。
86.第三步:称量0.1g多巴胺置于50ml tris-hcl缓冲液中,待多巴胺完全溶解后,加入第二步的无水乙醇处理后的纤维膜,在磁力搅拌的条件下进行搅拌,搅拌的转速为300rpm。反应温度为25℃,反应4h。
87.第四步:将第三步反应后的纳米纤维膜加入到100ml的去离子水中,在磁力搅拌的条件下进行搅拌,搅拌的转速为450rpm,搅拌12h。
88.第五步:称量2.5gε-聚赖氨酸,置于50ml tris-hcl缓冲液中,待ε-聚赖氨酸完全
溶解后,加入第四步的水洗后的纳米纤维膜,在磁力搅拌的条件下进行搅拌,搅拌的转速为300rpm。反应温度为37℃,反应24h。
89.第六步:将反应结束后的纤维膜在去离子水中清洗三次。将纳米纤维膜放置在真空烘箱内,真空状态下,30℃下干燥24h。最终得到载药聚多巴胺包覆纳米纤维敷料。
90.实施例4
91.采用扫描电子显微镜对对实施例1中得到的载药聚多巴胺包覆纳米纤维敷料进行分析,结果请参阅图1,图1为本发明实施例1载药聚多巴胺包覆纳米纤维敷料的扫描电镜图,其中,(a)为实施例1聚己内酯纳米纤维膜,(b)为实施例1聚己内酯-聚多巴胺纳米纤维膜,(c)为实施例1载药聚多巴胺包覆纳米纤维敷料,结果表明本发明载药聚多巴胺包覆纳米纤维敷料的纳米纤维直径集中在500~800nm。
92.实施例5
93.采用红外光谱仪对实施例1中得到的载药聚多巴胺包覆纳米纤维敷料进行分析,结果请参阅图2,图2为本发明实施例1载药聚多巴胺包覆纳米纤维敷料、聚己内酯-聚多巴胺纳米纤维膜和聚己内酯纳米纤维膜的红外光谱图。通过红外光谱图看出,聚多巴胺以及ε-聚赖氨酸都成功的反应到聚己内酯纳米纤维上。
94.实施例6
95.采用视频光学接触角测量仪对实施例1中得到的载药聚多巴胺包覆纳米纤维敷料进行分析,结果请参阅图3,图3为本发明实施例1载药聚多巴胺包覆纳米纤维敷料、聚己内酯-聚多巴胺纳米纤维膜和聚己内酯纳米纤维膜的水接触角图,其中,(a)为实施例1聚己内酯纳米纤维膜的水接触角图,(b)为实施例1聚己内酯-聚多巴胺纳米纤维膜的水接触角图,(c)为实施例1载药聚多巴胺包覆纳米纤维敷料的水接触角图,结果表明包覆了聚多巴胺后的纳米纤维膜亲水性增强,含有ε-聚赖氨酸载药聚多巴胺包覆纳米纤维敷料的亲水性进一步增强。
96.实施例7
97.采用dpph自由基清除实验对实施例1中得到的载药聚多巴胺包覆纳米纤维敷料进行实验。用紫外分光光度计进行分析。图4为本发明实施例1载药聚多巴胺包覆纳米纤维敷料、聚己内酯-聚多巴胺纳米纤维膜和聚己内酯纳米纤维膜的抗氧化效率图。根据图4,看出包覆上聚多巴胺之后,具有较高的抗氧化效率。
98.实施例8
99.通过平板涂布法对实施例1中得到的载药聚多巴胺包覆纳米纤维敷料进行抑菌分析。
100.第一步:剪取直径2cm载药聚多巴胺包覆纳米纤维敷料,加入到12孔板中
101.第二步:使用生理盐水配制1
×
107cfu/ml的细菌悬液,将1ml细菌悬液加入到放置有载药聚多巴胺包覆纳米纤维敷料12孔板中。
102.第三步:使用808nm近红外激光照射10min,照射功率为0.6w/cm2,控制组不照射,作为对比。
103.第四步:将12孔板放置37℃培养箱内培养4h
104.第五步:将培养结束后的12孔板内的细菌悬液用生理盐水稀释1000倍,取50μl稀释细菌悬液涂布在营养琼脂上,倒置放入37℃恒温培养箱培养12h。
105.第六步:观察对照组和实验组的营养琼脂上菌落。
106.结果请参阅图5,图5为本发明实施例1载药聚多巴胺包覆纳米纤维敷料对大肠杆菌的抑菌效果图。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1