一种3D导电细胞培养支架及其制备方法与流程
本发明属于生物医学材料技术领域,涉及一种3d导电细胞培养支架及其制备方法。
背景技术:
三维细胞培养培养技术(tdcc)是指将具有三维结构不同材料的载体与各种不同种类的细胞在体外共同培养,使细胞能够在载体的三维立体空间结构中迁移、生长,构成三维的细胞载体复合物的一种技术。相比于传统二维平面培养,三维培养方式更接近细胞在天然细胞外基质中的生长状态并且维持细胞的功能化表达水平,从而能够在体外模拟生物体内细胞生长状态。因此,三维培养技术能够在药物筛选以及细胞毒性检测过程中使结果更加精确,可靠。
三维纳米纤维支架因其拥有与天然细胞外基质相似的结构(hogrebenj,etal.biomaterialmicroarchitecture:apotentregulatorofindividualcellbehaviorandmulticellularorganization[j].journalofbiomedicalmaterialsresearchparta,2016.)而被广泛应用于细胞三维培养技术的研究中。静电纺丝技术作为纳米纤维最理想的制备方式,可用于制备三维纳米纤维支架。目前基于静电纺丝技术的三维纳米纤维支架的制备策略主要有:添加三维辅助接收装置;纺丝过程中添加制孔剂;叠加静电纺丝纳米纤维膜;利用聚合物本身性质在纺丝过程的自组装效应(sunb,etal.advancesinthree-dimensionalnanofibrousmacrostructuresviaelectrospinning[j].progressinpolymerscience,2014,39(5):862-890.)。但上述方法制备的三维纳米纤维支架的孔径过小(<5μm),细胞无法顺利穿透迁移至支架内部形成均一培养体系,因此,细胞仍是以近似二位平面培养的方式生长在纳米纤维支架表面,无法模拟细胞在天然生物体内的存在状态。
电刺激培养细胞对多功能干细胞定向分化,神经细胞突触延长等方面有十分显著的促进作用,将电刺激与细胞三维培养支架结合,能够赋予细胞类似天然细胞外基质生长环境的同时引入电刺激,使两者共同作用于细胞达到协同促进的作用(1.tianhc,etal.grapheneoxidedopedconductingpolymernanocompositefilmforelectrode-tissueinterface.[j].biomaterials,2014,35(7):2120-2129.;2.chenc,etal.biointerfacebycellgrowthongrapheneoxidedopedbacterialcellulose/poly(3,4-ethylenedioxythiophene)nanofibers[j].acsappliedmaterials&interfaces,2016,8(16):10183.)。现有的三维导电支架普遍只具有宏观三维结构,实施电刺激诱导时两者的协同促进作用无法得到体现(chenc,etal.three-dimensionalbc/pedotcompositenanofiberswithhighperformanceforelectrode–cellinterface[j].acsappliedmaterials&interfaces,2015,7(51):28244.)。因此有必要制备具有适宜细胞迁移孔径的三维纳米纤维支架。
技术实现要素:
本发明的目的在于提供一种具有10微米以上孔径、良好导电性和生物相容性的聚丙烯腈/fe3o4/聚乙烯二氧噻吩/氧化石墨烯纳米的3d导电细胞培养支架及其制备方法。
实现本发明目的的技术方案如下:
一种3d导电细胞培养支架,通过先将聚丙烯腈与fe3o4通过静电纺丝技术以特定接收装置,制得高度离散的聚丙烯腈/fe3o4纳米纤维支架,随后利用原位聚合在支架纤维表面包裹聚乙烯二氧噻吩(pedot),利用氧化石墨烯与pedot之间的静电吸附,在3d支架最外层负载氧化石墨烯,具体制备步骤如下:
步骤1,聚丙烯腈/fe3o4静电纺丝液制备:
将fe3o4纳米颗粒置于n’n-二甲基甲酰胺中,超声分散均匀,加入与fe3o4等质量的tritonx-100,再次超声分散均匀,加入聚丙烯腈原丝,超声溶解,过夜,得到聚丙烯腈/fe3o4静电纺丝液,其中fe3o4浓度为0.037~0.042g/ml;
步骤2,蓬松态聚丙烯腈/fe3o4纳米纤维的制备:
将聚丙烯腈/fe3o4静电纺丝液利用湿法静电纺丝技术制备纳米纤维,以底部带有磁铁且水深为8~10mm的培养皿为接收器,纳米纤维经真空冷冻干燥,即得到蓬松态聚丙烯腈/fe3o4纳米纤维;
步骤3,蓬松态聚丙烯腈/fe3o4/pedot的制备:
将蓬松态聚丙烯腈/fe3o4纳米纤维置于乙烯二氧噻吩与三氯化铁的混合乙醚溶液中,冰水浴下,超声密闭反应,反应结束后,乙醇反复洗涤,以水置换支架中的乙醇,经真空冷冻干燥,即得到蓬松态聚丙烯腈/fe3o4/pedot纳米纤维;
步骤4,氧化石墨烯分散液的制备:
将氧化石墨烯在水中超声分散,得到氧化石墨烯分散液;
步骤5,聚丙烯腈/fe3o4/pedot/氧化石墨烯3d导电支架的制备:
将蓬松态聚丙烯腈/fe3o4/pedot纳米纤维置于氧化石墨烯分散液中,剧烈振荡,静置过夜后,水洗除去未负载的石墨烯片层,即得到聚丙烯腈/fe3o4/pedot/氧化石墨烯3d导电支架。
优选地,步骤1中,所述的聚丙烯腈浓度为0.125~0.15g/ml,fe3o4超声分散时间为0.8~1h,tritonx-100超声分散时间为0.8~1h,聚丙烯腈原丝超声分散时间为1.5~2h。
优选地,步骤2中,所述的磁铁为钕铁硼磁铁,纺丝电压为15~16kv,纺丝液流速为0.5~0.8ml/h,接收距离为10~12cm。
优选地,步骤3中,所述的乙烯二氧噻吩的浓度为0.015~0.02g/ml,氯化铁的浓度为0.02~0.03g/ml。
优选地,步骤3中,蓬松态聚丙烯腈/fe3o4纳米纤维先分散于乙烯二氧噻吩溶液中,再加入与乙烯二氧噻吩等体积的氯化铁溶液。
优选地,步骤3中,所述的水与乙醇置换采用梯度置换,水与乙醇比例依次为1:9,3:7,5:5,7:3,9:1。
优选地,步骤4中,所述的氧化石墨烯分散液的浓度为0.5~1.5mg/ml。
与现有技术相比,本发明的具有以下优点:
(1)本发明的蓬松态聚丙烯腈/fe3o4纳米纤维密度为0.7718mg/cm3,属超轻材料,纤维之间平均孔径达13.8μm,具有内外高度连通的三维多孔结构,细胞能顺利迁移至支架内部形成均一的细胞-3d培养体系;
(2)pedot表面所带的正电荷与氧化石墨烯表面所带负电荷相互吸引,使石墨烯片层牢固的附着在纤维最外层,不易脱落,不会对细胞造成潜在毒性,pedot的引入赋予3d支架良好导电性,为天然生物体内细胞对微电流刺激响应在体外模型的构建提供支撑材料,支架最外层负载的氧化石墨烯具有良好的生物相容性,有利于细胞黏附、生长和增殖。
附图说明
图1为蓬松态聚丙烯腈/fe3o4纳米纤维水相分散实物图。
图2为蓬松态聚丙烯腈/fe3o4纳米纤维扫描电镜图。
图3为聚丙烯腈/fe3o4/pedot/氧化石墨烯3d导电细胞培养支架的扫描电镜图。
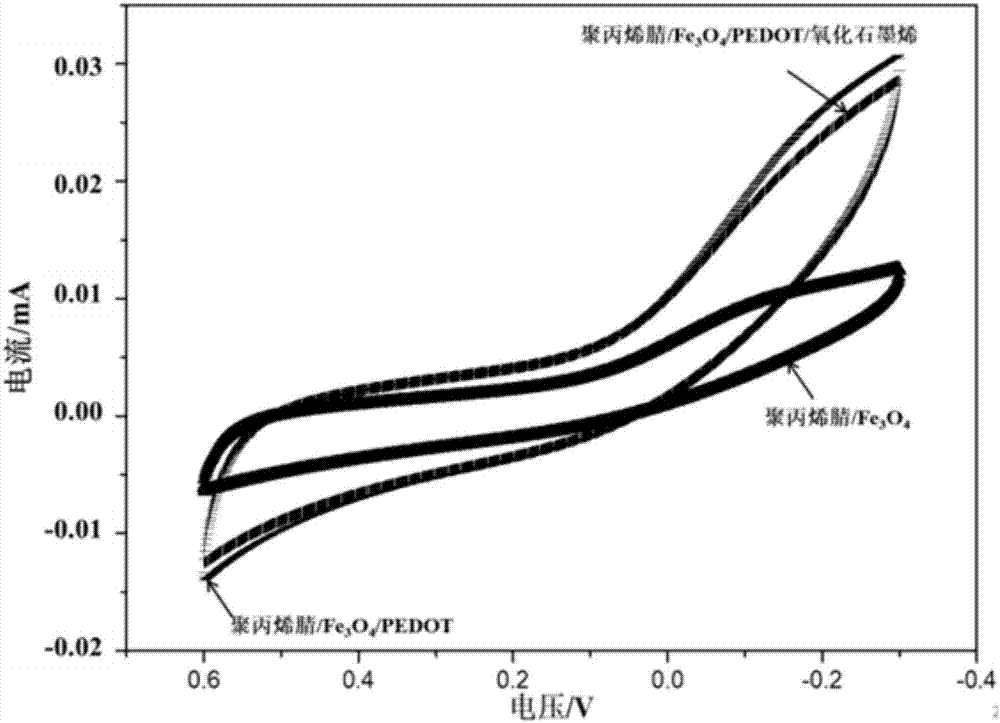
图4为蓬松态的聚丙烯腈/fe3o4纳米纤维、聚丙烯基/fe3o4/pedot纳米纤维以及聚丙烯腈/fe3o4/pedot/氧化石墨烯3d导电细胞培养支架的循环伏安特性曲线。
图5为3d导电支架培养rgc-5的三维共聚焦扫描图。
图6为3d导电支架培养hepg-2的扫描电镜图。
图7为对比例1和2制备的聚丙烯腈/fe3o4纳米纤维扫描电镜图。
具体实施方式
下面结合具体实施例和附图对本发明作进一步详述。
实施例1
(1)量取3mln,n-二甲基甲酰胺于螺口瓶中,称取0.117gfe3o4纳米颗粒置于n,n-二甲基甲酰胺中,超声分散1h;称取与fe3o4等质量的tritonx-100于上述已超声分散的fe3o4分散液中,继续超声分散1h;称取0.45g聚丙烯腈原丝加入分散液中,超声1.5h后静置过夜即得纺丝液。
(2)搭建纺丝装置,用装有8mm深超纯水,直径为22cm的培养皿作为接收装置,在培养皿底部放置钕铁硼磁铁(10cm*10cm*1cm)。具体电纺参数:10cm21#平头针;流量0.5ml/h;接收距离12cm;电压15kv;纺丝时间12min。图1为纳米纤维支架在水中分散实物图。
(3)收集水浴中的纳米纤维于离心管中,向其中加入两滴乙醇振荡均匀后冷冻干燥60h,即得蓬松态聚丙烯腈/fe3o4纳米纤维。图2为蓬松态聚丙烯腈/fe3o4纳米纤维扫描电镜图,从图2中看出纤维因负载有fe3o4纳米颗粒而使表面较为粗糙,并且fe3o4均匀地分散于纤维中,未出现团聚现象;纤维支架孔径在10μm以上,该尺寸孔径有利于细胞顺利迁移至支架内部,形成均匀的细胞生长体系。
(4)配置20ml浓度为0.017g/ml乙烯二氧噻吩的乙醚溶液,将(3)中制备的3d纳米纤维支架置于乙醚溶液中振荡分散,配置20ml浓度为0.02g/ml三氯化铁的乙醚溶液加入乙烯二氧噻吩的乙醚溶液中,冰水浴中超声反应25min。待反应完成后用乙醇反复洗涤纳米纤维支架直至完全除尽三氯化铁,然后用水-乙醇混合液梯度洗脱纳米纤维支架(v超纯水:v乙醇分别为1:9;3:7;5:5;7:3;9:1),将洗脱后的纳米纤维支架冷冻干燥60h,即得蓬松态聚丙烯基/fe3o4/pedot纳米纤维导电支架。
(5)量取8ml水于螺口瓶中,向其中加入8mg氧化石墨烯超声分散2h即得氧化石墨烯水溶液。
(6)将(4)中所制备的支架置于氧化石墨烯水溶液中,用力振荡至支架均匀分散于氧化石墨烯水溶液中,静置过夜。用水洗尽未吸附氧化石墨烯,冷冻干燥24h即得聚丙烯腈/fe3o4/pedot/氧化石墨烯3d导电支架。图3为3d导电支架的扫描电镜图,箭头所指为氧化石墨烯片层。由图中看出石墨烯片层紧密包裹于纳米纤维外层,并且无氧化石墨烯填充于纳米纤维交叉所构成的微孔中,因此不会影响3d导电支架微孔内外连通性,保证细胞能够顺利迁移至支架内部。
(7)分别将蓬松态的聚丙烯腈/fe3o4纳米纤维、聚丙烯基/fe3o4/pedot纳米纤维以及3d导电支架分散于pbs缓冲液中,以此作为工作电极,铂电极为对电极,甘汞电极为参比电极,于pbs(0.1m,ph=7.4)中采用循环伏安法检测该支架电性能,扫描电压:-0.4~0.6v;扫描速率100mv/s,所测试循环伏安特性曲线如图4所示。由于四氧化三铁纳米颗粒具有导电性,因此聚丙烯腈/fe3o4纳米纤维呈现一定的电化学性能,当通过原位聚合反应在纤维表面负载pedot后其导电率增加,循环伏安电流明显提高;当负载不良导电体氧化石墨烯后,循环伏安电流原先差距不大因此仍显示出良好的导电性。
实施例2
本实施例与实施例1基本相同,唯一不同的在于fe3o4掺入量为0.1125g,氧化石墨烯水溶液配置中,氧化石墨烯加入量为4mg,制得的3d导电支架的性能与实施例1基本相同。
实施例3
本实施例与实施例1基本相同,唯一不同的在于乙烯二氧噻吩浓度为0.02g/ml,氧化石墨烯水溶液配置中,氧化石墨烯加入量为12mg,制得的3d导电支架的性能与实施例1基本相同。
实施例4
视网膜神经节细胞三维培养
(1)将实施例1制备的3d导电支架置于75%乙醇中浸泡灭菌8h,然后用pbs冲洗导电支架4次完全除尽乙醇。
(2)称取0.1g琼脂糖粉末置于7mlpbs缓冲液中,高压灭菌后于120℃融化,趁热将琼脂糖溶液均匀铺在48孔板底部,待琼脂糖冷却凝固后向其中加入已灭菌的3d导电支架,向其中加入500μl含15%fbs的dmem完全培养基后将培养板置于co2培养箱中孵育过夜。
(3)除去3d导电支架中的培养基,将分散均匀的视神经节细胞(rgc-5)细胞悬液加入3d导电支架中,细胞量为5000个/孔,向培养板中补充加入培养基至500μl/孔后置于co2培养箱中培养5天。细胞每24小时换液一次。
(4)将培养5天rgc-5细胞的3d导电支架取出点板,向其中加入20μl浓度为2μmol/l的calcein-am溶液避光染色15min后于三维共聚焦扫描显微镜下观察细胞与纤维形态。每观察15min向3d支架中补充加入20μl培养基。图4为3d导电支架与细胞的三维共聚焦扫描显微镜图,从图中可以明显看出细胞紧密的粘附在3d导电支架上,细胞膜蛋白将纳米纤维包裹于其中使得细胞沿纳米纤维的方向伸展增殖,从而构成广泛的细胞-纳米纤维复合网络。
肝癌细胞的三维培养
(1)将实施例1中所制备的3d导电支架置于75%乙醇中浸泡灭菌8h,然后用pbs冲洗导电支架4次完全除尽乙醇。
(2)称取0.1g琼脂糖粉末置于7mlpbs缓冲液中,高压灭菌后于120℃融化,趁热将琼脂糖溶液均匀铺在24孔板底部,待琼脂糖冷却凝固后向其中加入已灭菌的3d导电支架,向其中加入1ml含10%fbs的dmem完全培养基后将培养板置于co2培养箱中孵育过夜。
(3)除去3d导电支架中的培养基,将分散均匀的肝癌细胞(hepg2)悬液加入3d导电支架中,细胞量为2x105个/孔,向培养板中补充加入培养基至1ml/孔后置于co2培养箱中培养3天。细胞每24小时换液一次。
(4)细胞培养3天后除去培养板中的培养基用pbs缓冲液洗涤3d导电支架3次,向导电支架中加入1ml2.5%戊二醛的pbs溶液,密封后于4℃下避光静置4h以固定细胞。
(5)除去导电支架中戊二醛溶液,用pbs洗涤3次后用乙醇/水的混合液梯度洗脱(v乙醇:v水=1:9,2:8,3:7,5:5,7:3,9:1,10:0)。冷冻干燥后喷金于扫描电镜下观察细胞形态。图6为hepg2扫描电镜图,图中细胞黏附于3d导电支架上,并且形成明显的细胞聚集体,这有利于肝癌细胞体外培养功能化的保持,从而为肝癌体外研究模型的构建提供理想支架材料。
对比例1:聚丙烯腈/fe3o4纳米纤维的制备
(1)量取3mln,n-二甲基甲酰胺于螺口瓶中,称取0.135gfe3o4纳米颗粒置于n,n-二甲基甲酰胺中,超声分散1h;称取与fe3o4等质量的tritonx-100于上述已超声分散的fe3o4分散液中,继续超声分散1h;称取0.45g聚丙烯腈原丝加入分散液中,超声1.5h后静置过夜即得纺丝液。
(2)搭建纺丝装置,用装有8mm深超纯水,直径为22cm的培养皿作为接收装置,在培养皿底部放置钕铁硼磁铁(10cm*10cm*1cm)。具体电纺参数:10cm21#平头针;流量0.5ml/h;接收距离12cm;电压15kv;纺丝时间12min。在纺丝过程中,由于fe3o4掺入量过大,使纤维被磁铁迅速吸引至接收器底部,因此纤维在水中堆积时受磁力影响而被压缩,图7a为所制备聚丙烯腈/fe3o4纳米纤维扫描电镜图,从图中可以看出,纤维之间孔径大多在5μm,并且纤维表面粗糙度明显提高,出现了fe3o4团聚的现象,因此该纳米纤维不宜用作细胞三维培养的支撑材料。
对比例2:聚丙烯腈/fe3o4纳米纤维的制备
(1)量取3mln,n-二甲基甲酰胺于5ml螺口瓶中,称取0.09gfe3o4纳米颗粒置于n,n-二甲基甲酰胺中,超声分散1h;称取与fe3o4等质量的tritonx-100于上述已超声分散的fe3o4分散液中,继续超声分散1h;称取0.45g聚丙烯腈原丝加入分散液中,超声1.5h后静置过夜即得纺丝液。
(2)搭建纺丝装置,用装有8mm深超纯水,直径为22cm的培养皿作为接收装置,在培养皿底部放置钕铁硼磁铁(10cm*10cm*1cm)。具体电纺参数:10cm21#平头针;流量0.5ml/h;接收距离12cm;电压15kv;纺丝时间12min。在纺丝过程中,由于fe3o4掺入量少,使纤维所受到的磁力无法克服水的表面张力,因此纤维只能在水面堆积,无法在水中形成离散的纳米纤维结构。图7b为所制备聚丙烯腈/fe3o4纳米纤维扫描电镜图,图中纤维表面较为光滑,并且有fe3o4分布在纤维上,但纤维之间的孔径大多在5μm,并且出现纤维缠绕现象,因此该纤维不宜用作细胞三位培养支撑材料。
- 还没有人留言评论。精彩留言会获得点赞!