神经阻滞置管模型的制备方法与流程
本发明涉及一种神经阻滞置管模型的制备方法。
背景技术:
随着医学的发展,超声可视化的出现让区域神经阻滞日渐成为至关重要的一种麻醉方法。但是,要熟练掌握超声引导下神经阻滞,一个刚开始学习的临床麻醉工作者需要在带教老师的指导下观看并完成一定数量的实践操作,其中,神经阻滞置管技术更为复杂。如果直接在患者身上进行教学,可能会带来一系列问题,诸如给患者造成心理和生理上的创伤,而学员也会因为焦虑增加操作的失败率,导致临床培训周期较长,学习效果欠佳。模拟教学可以解决以上问题,外科腔镜手术的模拟教学已经成为一种重要的教学模式,但目前国内的神经阻滞模拟教学仍停留在猪肉、豆腐等模具,其可以指导超声引导下神经阻滞的进针路径,还没有一种简单有效的神经阻滞置管模型。
技术实现要素:
本发明要解决的技术问题是提供一种神经阻滞置管模型的制备方法。
为了解决上述技术问题,本发明提供一种神经阻滞置管模型的制备方法,包括以下步骤:
1)、挑选猪肉块:
该猪肉块为:包括上下两层的精肉层---精肉层Ⅰ和精肉层Ⅱ,在精肉层Ⅰ和精肉层Ⅱ之间为筋膜层,精肉层Ⅰ位于整个猪肉块的最上层,精肉层Ⅰ的厚度为1.5~2.5cm;
2)、准备两根橡胶管,橡胶管的长度大于猪肉块的长度;
对其中一根橡胶管进行如下操作:
先在橡胶管的内腔中装入与橡胶管等长的钡线,然后向橡胶管的内腔填充超声耦合剂,直至橡胶管的内腔充满超声耦合剂,最后将橡胶管的两端作封闭处理;
对另一根橡胶管进行如下操作:
直接向橡胶管的内腔填充超声耦合剂,直至橡胶管的内腔充满超声耦合剂,最后将橡胶管的两端作封闭处理;
3)、将精肉层Ⅰ与筋膜层相分离(部分分离即可),掀开精肉层Ⅰ,将步骤2)所得的两根橡胶管并列放入精肉层Ⅰ与筋膜层的分离处;将这两根橡胶管与筋膜层相固定;最后合上精肉层Ⅰ,得神经阻滞置管模型;
或者,将精肉层Ⅱ与筋膜层相分离(部分分离即可),掀开精肉层Ⅱ,将步骤2)所得的两根橡胶管并列放入精肉层Ⅱ与筋膜层的分离处;将这两根橡胶管与筋膜层相固定;最后合上精肉层Ⅱ,得神经阻滞置管模型;
两根橡胶管之间的间距为≤0.5cm,即,两根橡胶管也可以无间隙的并列。
作为本发明的神经阻滞置管模型的制备方法的改进:
猪肉块的长×宽×厚度为(15±1)cm×(12±1)cm×(5±0.5)cm。
作为本发明的神经阻滞置管模型的制备方法的进一步改进:
每根橡胶管的长度为20~25cm。
作为本发明的神经阻滞置管模型的制备方法的进一步改进:
方案一、两根橡胶管的直径(内腔直径)均为0.5cm或者均为0.8cm;
方案二、其中一根橡胶管直径(内腔直径)为0.5cm,另一根橡胶管直径(内腔直径)为0.8cm;在直径为0.5cm的橡胶管内装入钡线。
优先上述方案二。原因如下:直径为0.8cm的橡胶管代表血管,直径为0.5cm的橡胶管代表神经(钡线在超声上的显像类似神经结构);这样的设置更接近临床上动脉较神经粗大的情境。有利于帮助学员更快的识别神经位置,并成功将导管置入神经周围的间隙。
作为本发明的神经阻滞置管模型的制备方法的进一步改进:
沿着猪肉的宽度对精肉层Ⅰ与筋膜层进行分离,或者,沿着猪肉的宽度对精肉层Ⅱ与筋膜层进行分离;
分离7~8cm的长度即可。
作为本发明的神经阻滞置管模型的制备方法的进一步改进:
在所述超声耦合剂中添加占超声耦合剂重量1%的染料(染料例如为彩色墨水),得含有染料的超声耦合剂;
向橡胶管的内腔填充含有染料的超声耦合剂,直至橡胶管的内腔充满含有染料的超声耦合剂。
染料的作用是:实际使用时,在学员错误的将针尖扎入橡胶管(模拟的神经和血管)时,彩色耦合剂(含有染料的超声耦合剂)会沿穿刺针渗出,有利于帮助判断学员是否发生误穿血管或损伤神经。
作为本发明的神经阻滞置管模型的制备方法的进一步改进:
橡胶管选用硅胶管。
作为本发明的神经阻滞置管模型的制备方法的进一步改进:
利用密封帽对橡胶管的两端作封闭处理。
在本发明中,对精肉层Ⅱ之下无特殊要求;例如在精肉层Ⅱ可以为脂肪层,脂肪层的厚度通常≤3cm。
在本发明中,选用的猪肉块带有筋膜层的精肉,采用在精肉层和筋膜层之间设置橡胶管,且使橡胶管与筋膜层相固定,其优点是:筋膜在反复操作后仍可保持结构完整,而肌肉通常会有肌纤维断裂,不利于长期使用。
在本发明中,猪肉选用新鲜或解冻后的生猪肉(冷冻20℃保存,再次使用时自然解冻)。
本发明的技术优势为:
1、该模型具有制作简单、可重复性强、使用较为持久、成本低廉的特点,操作过程与临床实际操作的手感接近,培训过程形象逼真,且培训效果佳。
2、不但能实现超声引导下穿刺追踪针尖位置,还能实现用于超声引导下神经阻滞置管技术的培训。
附图说明
下面结合附图对本发明的具体实施方式作进一步详细说明。
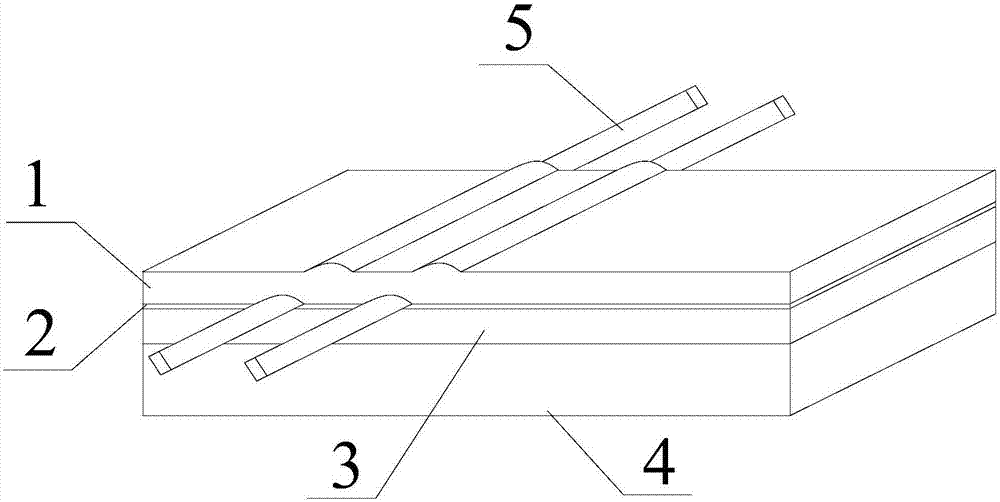
图1为本发明的神经阻滞置管模型的结构示意图;
图2为图1中的猪肉块的结构示意图;
图3为图1中的其中一根橡胶管5的剖视结构示意图;
图4为本发明的神经阻滞置管模型的安装过程的示意图。
具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此。
实施例1、一种神经阻滞置管模型的制备方法,依次进行以下步骤:
1)、挑选猪肉块:
猪肉块的大小为:长×宽×厚度为(15±1)cm×(12±1)cm×(5±0.5)cm;
该猪肉块包括上下两层的精肉层---精肉层Ⅰ1和精肉层Ⅱ3,在精肉层Ⅰ1和精肉层Ⅱ3之间为筋膜层2,精肉层Ⅰ1位于整个猪肉块的最上层,精肉层Ⅰ的厚度为2cm。
精肉层Ⅱ3之下无特殊要求;例如在精肉层Ⅱ3下可以为脂肪层4,脂肪层4的厚度通常≤3cm。
2)、准备两根橡胶管5,每根橡胶管5的长度为20~25cm。其中一根橡胶管5的直径(内腔直径)为0.5cm,另一根橡胶管5的直径(内腔直径)为0.8cm。
对直径为0.5cm的橡胶管5进行如下操作:
先在橡胶管5的内腔中装入与橡胶管5等长的钡线51,然后向橡胶管5的内腔填充超声耦合剂(或者含有染料的超声耦合剂),直至橡胶管5的内腔充满超声耦合剂(或者含有染料的超声耦合剂),最后将橡胶管5的两端作封闭处理。
钡线51的安装方式可依照如下方法进行:
将导引线放入橡胶管5,使导引线完全进入橡胶管5,将导引线捆绑钡线51,从而牵引钡线51进入橡胶管5内。等钡线全部进入橡胶管5内后,再向橡胶管5的内腔中填充超声耦合剂(或者含有染料的超声耦合剂)。钡线在超声上的显像类似神经结构。
对直径为0.8cm的橡胶管5进行如下操作:
直接向橡胶管5的内腔填充超声耦合剂(或者含有染料的超声耦合剂),直至橡胶管5的内腔充满超声耦合剂(或者含有染料的超声耦合剂),最后将橡胶管5的两端作封闭处理;
备注说明:
在超声耦合剂中添加占超声耦合剂重量1%的染料(染料例如为彩色墨水),得含有染料的超声耦合剂。染料的作用是:实际使用时,在学员错误的将针尖扎入橡胶管5(模拟的神经和血管)时,彩色耦合剂(含有染料的超声耦合剂)会沿穿刺针渗出,有利于帮助判断学员是否发生误穿血管或损伤神经。
3)、沿着猪肉的宽度对精肉层Ⅰ1与筋膜层2进行分离,分离7~8cm的长度即可(即,精肉层Ⅰ1与筋膜层2部分分离即可)。
掀开精肉层Ⅰ1,将步骤2)所得的两根橡胶管5并列放入精肉层Ⅰ1与筋膜层2的分离处;将这两根橡胶管5与筋膜层2相固定(将橡胶管5两端分别用缝线与筋膜层2相固定);最后合上精肉层Ⅰ1,得神经阻滞置管模型;
两根硅胶管可以无间隙的并列设置,也可以保持一定的间距(是指两根硅胶管外表面之间的间隙),间距为≤0.5cm。
实验1、上述神经阻滞置管模型的使用方法,橡胶管5均选用硅胶管;具体如下:
a)、在模型上(即,在精肉层Ⅰ的上表面)放置线阵超声探头(6-13Hz);
b)、置入神经阻滞针:
神经阻滞针的针尖从精肉层Ⅰ1的上表面向下穿刺,直至针尖到达筋膜层2后方,神经(0.5cm硅胶管)和血管(0.8cm硅胶管)所在处周围。
c)、推注生理盐水判断针尖位置:
将注射器内5ml生理盐水快速推注后,可在超声下看到神经阻滞针尖端有逐渐扩大的低回声液性暗区,包绕神经(0.5cm硅胶管)周围,呈“甜甜圈”的征象。证明穿刺针尖端位于神经周围,可以进行阻滞导管的放置。
备注说明:
需要在目标置管处投影的正上方进行注射,但是选择非投影处也可能发生,在模拟教学过程中,这也是考核学员的一个因素,如果学员选点不合适,会对其扣分。
上述推注生理盐水后,在要置管的靶点形成液体的腔隙,有利于置管。
注射结束时,将注射器去除,仅保留穿刺针。
实际手术时,神经阻滞针的针尖位置要在神经周围,才可以置管,否则置管会困难,临床上麻醉和镇痛的效果就会差。
d)、退出针芯置入导管:
从步骤b)所述的神经阻滞针中退出针芯,再相应的置入导管;
导管置入深度为3-5cm(导管进入包被神经和血管表面的筋膜后,在神经周围走行的距离);
导管的外表面设有套管,套管上有刻度,根据刻度可以知道神经(0.5cm硅胶管)与进针点之间的距离。
e)、退出套管:
退出位于导管的外表面的套管;
f)、安装连接器:
连接器一端连接导管,一端连接注射器。
g)、通过注射器给导管推注液体(例如生理盐水或自来水)判断导管是否在目标位置:
当使用注射器快速推注生理盐水后,可在超声下看到神经阻滞导管尖端有逐渐扩大的低回声液性暗区,包绕神经(0.5cm硅胶管)。证明导管尖端位于神经(0.5cm硅胶管)周围,即置管靶点。
h)、验证:
打开模型,看到神经阻滞导管走行在神经周围,深度3~5cm时,能得出置管位置正确的结论;
反之,如果是神经阻滞导管穿出筋膜、进入肌肉或打折(导管未保持直行,而是朝反方向走行,甚至打结),深度<3cm,>5cm时,能得出置管失败的结论。
备注说明:深度过浅,导管容易退出到肌肉内部,过深,导管容易发生打折或走行到其他结构中的风险。在临床上尽量避免过深或过浅,所以,教学时要强调并作为失败的标准之一。
根据上述实验1,我们得知:利用本发明的模型进行演习时,是把导管沿着神经走行(硅胶管)放置;如果模型改成是在两块肌肉之间设置硅胶管,会导致出现如下问题:因为肌肉容易被穿刺针损伤,推注的生理盐水会进入肌肉,难以形成一个完整间隙,并且在置管时,导管容易被肌肉勾住,发生弯折,而筋膜可以更好的包裹生理盐水,形成了一个完整的间隙,有利于导管一直向前方走行。
而现有的模型没有使用带筋膜的肉类,注射液体后很快吸收,无法为置管过程提供一个理想的腔隙,因此,无法进行如本发明所述的神经阻滞导管的演习。
最后,还需要注意的是,以上列举的仅是本发明的若干个具体实施例。显然,本发明不限于以上实施例,还可以有许多变形。本领域的普通技术人员能从本发明公开的内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!