家蚕雌蛾的卵巢内受精过程及卵巢的模型展示方法
1.本发明涉及家蚕雌蛾的卵巢内受精过程及卵巢的模型展示方法的技术。
背景技术:
2.家蚕是一种重要的鳞翅目模式昆虫,以卵生的形式繁殖,对卵巢的研究有利于了解雌雄蛾交配后母体内的生殖生理全过程。目前,人们主要是通过解剖学对蚕蛾的生殖器官进行了详细的观察,推测生殖发生过程,但缺乏直接观察证据。
技术实现要素:
3.本发明目的是提供一种家蚕雌蛾的卵巢内受精过程及卵巢的模型展示方法,使用简单,操作方便,清晰地观察组织器官卵巢的内部情况,获得直接观察证据。
4.本发明的目的通过以下技术方案来实现。
5.一种家蚕雌蛾的卵巢内受精过程及卵巢的模型展示方法,其特征在于所述家蚕雌蛾的卵巢内受精过程及卵巢的模型展示方法包括下列步骤:
6.卵巢样本获取:选取交配后的雌蛾,使其卵巢管完全暴露出来,夹住卵巢,漂洗,直至卵巢管基本分开,剪断卵巢管,清除杂物,并除去附腺和卵巢管,保留中输卵管、侧输卵管、受精囊和交配囊;
7.卵巢样本透明:将获取的卵巢置入离心管内,并加入丙烯酰胺水凝胶溶液,并于恒温震荡器中震荡,在规定的间隔时间内更换一次丙烯酰胺水凝胶溶液并震荡,而后将丙烯酰胺水凝胶溶液换成sds清除液,再进行震荡,最后得到透明完成之后的卵巢样本;
8.对透明完成之后的卵巢样本进行dapi染色:将透明完成之后的卵巢样本取出,并分组,然后分别置于离心管中,并加入pbt进行震荡,震荡设定的时间段后更换管内pbt,再次震荡,再用dapi溶液染色,染色时避光震荡,染色结束后,吸出染色液,加入pbt溶液进行清洗,要求继续避光震荡,最后将卵巢样本置于载玻片上,滴甘油,并在荧光显微镜下观察;
9.sds清除液,通过sds粉末、硼酸粉末溶于蒸馏水,并用氢氧化钠溶液调节ph值得到的碱性溶液,所述sds为十二烷基硫酸钠;
10.pbt是triton x-100的pbs溶液,1ml triton x-100、99ml pbs;
11.dapi,是指4',6-二脒基-2-苯基吲哚,具体见zink daniele,sadoni nicolas,stelzer ernst.visualizing chromatin and chromosomes in living cells.[j].methods,2003,29(1),无具体化学方程式,用于强力结合dna的荧光染料,dna即脱氧核糖核酸,deoxyribonucleic acid。
[0012]
将透明完成之后的卵巢样本与未进行透明处理卵巢进行对比观察,未进行透明处理卵巢,整体呈现出原本的白色,在有卵的位置隐隐透着淡黄色无法看清卵在卵巢内的状态与轮廓,仅能通过颜色差异辨认卵的位置,在丙烯酰胺水凝胶溶液处理后,观察到组织已有了初步透明,但整体还是较模糊,卵巢表面呈现出毛玻璃质感,在解剖镜的灯光照射下,观察卵的轮廓,依卵的倾斜方向与受精囊管对比,判断所述卵巢样本内的卵是否处于正在
受精的状态,并对所述卵巢样本进行逐一观察筛选确认。透明操作完成之后,卵巢更加透明,透过卵巢表皮观察内部的卵。
[0013]
在荧光显微镜观察时,通过荧光显微镜,清晰观察到在卵和受精囊管之间有一条高亮的蓝色条带,在卵的周边,观察到少量蓝色亮斑;判断出这是在受精囊排出精子受精时,大部分精子向卵孔运动,经过dapi染色并在紫外光的激发下呈现出蓝色的高亮条带,而部分无法入卵的精子向卵周围扩散,在被染色、激发后呈现出高亮蓝斑。
[0014]
利用3dsmax对卵巢结构进行绘制,即绘制雌蚕蛾的卵巢由受精囊、交配囊、两个附腺、受精囊腺、中输卵管、两根侧输卵管、八根卵巢管、交配囊与中输卵管之间的精子导管组成,八根卵巢管分别在两根侧输卵管的一端接合,两根侧输卵管再和中输卵管接合;受精囊连接在中输卵管的中部,连接管上还有受精囊腺;交配囊与产卵孔直接相连,在交配囊与中输卵管之间有一根细小的精子导管,这根导管使得精子的二次补充成为可能;并制作受精动画视频。即在雌雄蛾交配时,雄蛾将精子射入交配囊储存,一部分精子通过精子导管进入受精囊。雌蛾排卵时,八根卵巢管依次排卵,通过输卵管进入中庭,卵孔部分向受精囊方向倾斜,受精囊排出少量精子,部分精子进入卵孔,另一部分向周围溢出,进入卵孔的精子进而完成受精;最终完成家蚕雌蛾的卵巢内受精过程及卵巢的3d模型展示。
[0015]
所述水凝胶溶液,在配制所述水凝胶溶液时,将多聚甲醛溶于蒸馏水并加入pbs缓冲液,观察到大量多聚甲醛呈悬浮或沉淀状态。加入少许氢氧化钠颗粒,使多聚甲醛大量溶解;使用磁力加热搅拌器搅拌,然后溶液澄清,多聚甲醛完全溶解;再分别将丙烯酰胺、甲叉双丙烯酰胺、va-044引发剂加入溶液,配置完成的溶液于冷藏保存,常温下即可凝固,pbs即磷酸缓冲盐溶液,主要成分为na2hpo4、kh2po4、nacl和kcl,va-044即2,2-氮杂双(2-咪唑啉)二盐酸盐,分子式c
12
h
24
cl2n6。
[0016]
所述水凝胶溶液中丙烯酰胺8g、甲叉双丙烯酰胺0.08g、多聚甲醛8g、va-044 0.4g、10
×
pbs 50ml,最后定容至500ml。
[0017]
本发明与现有技术相比具有如下优点:
[0018]
本发明利用丙烯酰胺水凝胶溶液透明技术使卵巢透明,并用dapi染液对精子进行染色,使之踪迹显现,在荧光显微镜下观察精子从受精囊进入卵孔的过程;结合图像,得到精子的运行轨迹,并运用3dsmax绘制整个卵巢的三维结构及受精动画视频。
[0019]
本发明利用三维动画软件来模拟家蚕的生殖生理,运用这种新的表现形式,立体形象地展示了卵巢结构,与传统的文字图片录像等相比,更加直观明了形象逼真,更为昆虫的科普教学与研究展示提供新的表现形式。
附图说明
[0020]
图1为本发明家蚕雌蛾的卵巢内受精过程及卵巢的模型展示方法的卵巢三个阶段的透明程度的效果图;
[0021]
图2为本发明家蚕雌蛾的卵巢内受精过程及卵巢的模型展示方法中dapi染色后的效果图;
[0022]
图3为本发明家蚕雌蛾的卵巢内受精过程及卵巢的模型展示方法使用时的结构图。
具体实施方式
[0023]
下面结合附图对本发明作进一步详细描述。
[0024]
本发明家蚕雌蛾的卵巢内受精过程及卵巢的模型展示方法,包括下列步骤:
[0025]
卵巢样本获取:选取交配后的雌蛾,使其卵巢管完全暴露出来,夹住卵巢,漂洗,直至卵巢管基本分开,剪断卵巢管,清除杂物,并除去附腺和卵巢管,保留中输卵管、侧输卵管、受精囊和交配囊;
[0026]
卵巢样本透明:将获取的卵巢置入离心管内,并加入丙烯酰胺水凝胶溶液,并于恒温震荡器中震荡,在规定的间隔时间内更换一次丙烯酰胺水凝胶溶液并震荡,而后将丙烯酰胺水凝胶溶液换成sds清除液,再进行震荡,最后得到透明完成之后的卵巢样本;
[0027]
透明完成之后的卵巢样本进行dapi染色:将透明完成之后的卵巢样本取出,并分组,然后分别置于离心管中,并加入pbt进行震荡,震荡设定的时间段后更换管内pbt,再次震荡,再用dapi溶液染色,染色时避光震荡,染色结束后,吸出染色液,加入pbt溶液进行清洗,要求继续避光震荡,最后将卵巢样本置于载玻片上,滴甘油,并在荧光显微镜下观察。
[0028]
将透明完成之后的卵巢样本与未进行透明处理卵巢进行对比观察,未进行透明处理卵巢,整体呈现出原本的白色,在有卵的位置隐隐透着淡黄色无法看清卵在卵巢内的状态与轮廓,仅能通过颜色差异辨认卵的位置,在丙烯酰胺水凝胶溶液处理后,观察到组织已有了初步透明,但整体还是较模糊,卵巢表面呈现出毛玻璃质感,在解剖镜的灯光照射下,观察卵的轮廓,依卵的倾斜方向与受精囊管对比,判断所述卵巢样本内的卵是否处于正在受精的状态,并对所述卵巢样本进行逐一观察筛选确认。透明操作完成之后,卵巢更加透明,透过卵巢表皮观察内部的卵。
[0029]
在荧光显微镜观察时,通过荧光显微镜,清晰观察到在卵和受精囊管之间有一条高亮的蓝色条带,在卵的周边,观察到少量蓝色亮斑;判断出这是在受精囊排出精子受精时,大部分精子向卵孔运动,经过dapi染色并在紫外光的激发下呈现出蓝色的高亮条带,而部分无法入卵的精子向卵周围扩散,在被染色、激发后呈现出高亮蓝斑。
[0030]
利用3dsmax对卵巢结构进行绘制,即绘制雌蚕蛾的卵巢由受精囊、交配囊、两个附腺、受精囊腺、中输卵管、两根侧输卵管、八根卵巢管、交配囊与中输卵管之间的精子导管组成,八根卵巢管分别在两根侧输卵管的一端接合,两根侧输卵管再和中输卵管接合;受精囊连接在中输卵管的中部,连接管上还有受精囊腺;交配囊与产卵孔直接相连,在交配囊与中输卵管之间有一根细小的精子导管,这根导管使得精子的二次补充成为可能;并制作受精动画视频。即在雌雄蛾交配时,雄蛾将精子射入交配囊储存,一部分精子通过精子导管进入受精囊。雌蛾排卵时,八根卵巢管依次排卵,通过输卵管进入中庭,卵孔部分向受精囊方向倾斜,受精囊排出少量精子,部分精子进入卵孔,另一部分向周围溢出,进入卵孔的精子进而完成受精;最终完成家蚕雌蛾的卵巢内受精过程及卵巢的3d模型展示。
[0031]
所述水凝胶溶液将多聚甲醛溶于蒸馏水并加入pbs缓冲液,观察到大量多聚甲醛呈悬浮或沉淀状态,加入少许氢氧化钠颗粒,使多聚甲醛大量溶解;使用磁力加热搅拌器搅拌,然后溶液澄清,多聚甲醛完全溶解;再分别将丙烯酰胺、甲叉双丙烯酰胺、va-044引发剂加入溶液,配置完成的溶液于冷藏保存,常温下即可凝固。
[0032]
下面更加详细描述:
[0033]
家蚕雌蛾的卵巢由交配囊、中输卵管、受精囊、受精囊腺、附腺、侧输卵管、卵巢管、
交配囊与中输卵管之间的精子导管组成,中输卵管连接了两根侧输卵管,而两根侧输卵管上分别各连接了4根卵巢管。雌雄蛾交配时,雄蛾生殖器伸入交配囊并射入精子。随后,精子通过交配囊口部与主输卵管连接的精子导管进入受精囊。排卵时,8根卵巢管依次排卵,卵进入中庭时顶部卵孔向受精囊倾斜,受精囊在肌肉的作用下排出部分精子从卵孔入卵完成受精。
[0034]
目前关于家蚕交配后卵巢内生殖生理活动的了解主要源于家蚕卵巢结构的解剖学观察,本发明借助清晰脂质交换丙烯酰胺杂交精细成像相容性组织水凝胶技术(clear lipid-exchanged acrylamide-hybridized rigid imaging-compatible tissue-hydrogel,简称clarity水凝胶透明技术)与dapi染色技术对该过程进行证明,并利用3dsmax直观三维展示。而在鳞翅目昆虫的研究中,还没有过组织透明的先例。
[0035]
clarity水凝胶透明技术是一种组织透明技术。生物体内的组织器官均以脂质、蛋白质、水为主要组成物质,三者拥有相差显著的折光率,组合在一起时阻断了大多数透射光,这才使得组织器官能够通过反射光被我们观察。当需要观察组织器官的内部状态时,除了解剖,还可以通过减少主要组成物质之间的折光率差异来达到透明的效果。组织蛋白是组织结构的主要形态物质,而水是支持组织形态的重要物质,因此,只能通过处理脂质来达到目的。clarity透明技术就是利用以丙烯酰胺为主体的水凝胶替换组织中的脂质,使组织器官呈现透明的状态,结合其他的染色技术,可以清晰地观察组织器官的内部情况。
[0036]
dapi:
[0037]
即是4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole),是一种能强力结合dna的荧光染料,因为可以透过完整细胞膜,故可用于活细胞和固定细胞的染色。当dapi与双链dna结合时,在荧光显微镜观察下,dapi染剂在358nm(紫外线)处有一个最大吸收峰,并在461nm(蓝)处有一个最大发射峰,其发射光的波长范围含盖了蓝色至青绿色,因此在荧光显微技术中dapi被紫外线照亮且被蓝或青色滤镜检出。
[0038]
3dsmax是由discreet logic公司开发的基于pc平台的三维动画制作软件,主要被广泛应用于广告、影视、工业设计、建筑设计、三维动画、多媒体制作、游戏、以及工程可视化等领域。1999年,autodesk收购了discreet logic公司,并将其与自家负责3ds发行的kinetix分部合并为discreet分部。随着软件不断地发展,凭借着其较高的性价比及简单的操作,在国内外都拥有众多使用者。
[0039]
本发明通过实验方法来描述技术方案的可行性。
[0040]
实验材料
[0041]
样本:处于交配后排卵期的雌蛾。
[0042]
仪器:解剖镜(nikon-sz1型解剖镜)、恒温震荡器(shaking incubator-lcd)、荧光显微镜(amg amf4032)、磁力加热搅拌器(ika c-mag hs7)
[0043]
药品:多聚甲醛粉末、丙烯酰胺粉末、甲叉双丙烯酰胺粉末、10
×
pbs缓冲溶液、va-044引发剂粉末、氢氧化钠颗粒、sds粉末、硼酸粉末、pbt溶液、5μg/ml dapi溶液。
[0044]
实验过程
[0045]
试剂配制:水凝胶溶液的配制:将8g多聚甲醛溶于450ml蒸馏水并加入50ml pbs缓冲液,观察到大量多聚甲醛呈悬浮或沉淀状态,加入少许氢氧化钠颗粒,由于多聚甲醛易溶于弱酸弱碱,多聚甲醛大量溶解。使用磁力加热搅拌器在60℃下搅拌,30min后溶液澄清,多
聚甲醛完全溶解。再分别将8g丙烯酰胺、0.08g甲叉双丙烯酰胺、0.4g va-044引发剂加入溶液。配置完成的溶液可于4℃冷藏保存,常温下即可凝固。
[0046]
sds清除液:将sds粉末40g、硼酸粉末12.4g、溶于蒸馏水1l,并用10mol/l氢氧化钠溶液调节ph值为8.5,sds是指十二烷基硫酸钠,分子式c
12
h
25
o4nas。
[0047]
实验操作:
[0048]
卵巢的获取:选取交配后6h的雌蛾,从第六腹节把雌蛾剪断,并置于解剖镜下,从背部剪开,逐渐将外表皮剥去,可以看到卵巢管完全暴露了出来。用镊子夹住卵巢,在水中漂洗,直至卵巢管基本分开。剪断多余卵巢管,可清楚看到交配囊、受精囊、附腺、中输卵管。清除多余杂物。进一步除去附腺和卵巢管,保留中输卵管、侧输卵管、受精囊和交配囊。
[0049]
卵巢的透明:将解剖得到的多个卵巢置入50ml离心管,并加入10倍体积丙烯酰胺水凝胶溶液。样本管于恒温震荡器中10℃,60r/min下震荡3天,每24h更换一次水凝胶溶液。3天后,将水凝胶溶液换成sds清除液,并在37℃,60r/min下震荡5天。
[0050]
卵巢的dapi染色:将透明完成之后的样本取出,3个一组,分别置于若干1ml离心管中,并加入pbt在80r/min下震荡5min,5min后更换管内pbt,再次震荡5min。再用5μg/ml的dapi溶液染色15min,染色时将离心管用锡箔纸包住,在80r/min下避光震荡。染色结束后,吸出染色液,加入1ml pbt溶液清洗三次,要求继续包在锡箔纸内震荡。最后将样本置于载玻片上,滴一滴甘油,并在荧光显微镜下观察。
[0051]
所述pbt是triton x-100的pbs溶液,1ml triton x-100、99ml pbs,所述dapi,是指4',6-二脒基-2-苯基吲哚,具体见zink daniele,sadoni nicolas,stelzer ernst.visualizing chromatin and chromosomes in living cells.[j].methods,2003,29(1),无具体化学方程式,用于强力结合dna即脱氧核糖核酸,deoxyribonucleic acid的荧光染料。所述pbs即磷酸缓冲盐溶液,主要成分为na2hpo4、kh2po4、nacl和kcl,va-044即2,2-氮杂双(2-咪唑啉)二盐酸盐,分子式c
12
h
24
cl2n6。
[0052]
实验结果
[0053]
卵巢透明观察:在对卵巢进行透明处理之前,卵巢整体呈现出原本的白色,在有卵的位置隐隐透着淡黄色。无法看清卵在卵巢内的状态与轮廓,仅能通过颜色差异辨认卵的位置。在水凝胶处理后,可以观察到组织已有了初步透明,但整体还是较模糊,卵巢表面呈现出毛玻璃质感。在解剖镜的灯光照射下,可以看出卵的轮廓,依卵的倾斜方向与受精囊管对比,判断样本内的卵是否处于正在受精的状态,并对样本进行逐一观察筛选确认。在sds处理后,便结束了整个实验透明操作,将此时的卵巢与之前卵巢进行对比观察,可见卵巢比前面更加透明。除卵以外,卵巢大体上已经透明完成。可以透过卵巢表皮清晰地观察内部的卵。
[0054]
三个阶段的透明程度具体对比如下图1所示,标示的是卵巢透明处理前1;标示的是卵巢水凝胶处理后2;标示的是卵巢sds处理后3。
[0055]
荧光显微镜观察:透明后的样本经过pbt清洗、dapi染色、pbt清洗后,在荧光显微镜下,样本受紫外线激发,发出蓝光。如图2,通过荧光显微镜,标示有卵4;溢出的精子5;精子带6。可以清晰观察到在卵和受精囊管之间有一条高亮的蓝色条带,在卵的周边,可以观察到少量蓝色亮斑。判断出这是在受精囊排出精子受精时,大部分精子向卵孔运动,经过dapi染色并在紫外光的激发下呈现出蓝色的高亮条带,而部分无法入卵的精子向卵周围扩
散,在被染色、激发后呈现出高亮蓝斑。
[0056]
蚕蛾卵巢三维结构绘制及受精动画视频:
[0057]
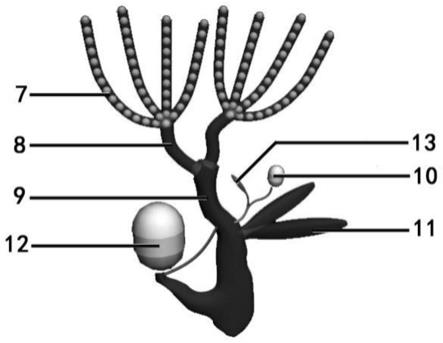
雌蚕蛾的卵巢由受精囊、交配囊、2个附腺、受精囊腺、中输卵管、2根侧输卵管、8根卵巢管、交配囊与中输卵管之间的精子导管组成,所述8根卵巢管分别在两根侧输卵管的一端接合,两根侧输卵管再和中输卵管接合;受精囊连接在中输卵管的中部,连接管上还有受精囊腺;交配囊与产卵孔直接相连,在交配囊与中输卵管之间有一根细小的精子导管,这根导管使得精子的二次补充成为可能。在雌雄蛾交配时,雄蛾将精子射入交配囊储存,一部分精子通过精子导管进入受精囊。雌蛾排卵时,8根卵巢管依次排卵,通过输卵管进入中庭,卵孔部分向受精囊方向倾斜,接受来自受精囊的精子,完成受精。
[0058]
经过3dsmax对卵巢结构进行绘制,如图3,标示有卵巢管7;侧输卵管8;中输卵管9;受精囊10;附腺11;交配囊12;受精囊腺13。
[0059]
结果分析:通过上述观察,我们可以得出结论:卵在排卵过程中,通过中庭时,卵孔向受精囊的方向倾斜。此时,受精囊排出少量精子,部分精子进入卵孔,另一部分向周围溢出,进入卵孔的精子进而完成受精。与人们对蚕蛾卵巢生殖生理的猜想一致,研究结果直接展示了蚕卵在卵巢内的受精过程,对生殖生理过程的假设和动画制作提供了事实依据。在动画中可以清楚看到卵在卵巢内的受精过程。但是精子是如何进入受精囊呢?交配囊和受精囊通过精子导管和受精囊管分别与中输卵管连接,但是在中输卵管中精子是如何从精子导管出口准确向受精囊管入口运动呢?这是今后要研究的问题。
[0060]
下面对相关技术内容进行进一步解释:
[0061]
不同的水凝胶配方透明效果与蛋白质损失程度均不一样,由于本发明的目的是观察透明后的卵巢结构,而结构中最主要的物质就是蛋白质,因此本发明选择蛋白质损失量最低的水凝胶配方,通过“4种不同浓度的水凝胶在小鼠脑、肝、肾组织透明化中的应用效果比较”,a4b4p4组的蛋白质损失量是最低的。因此选择了a4b3.2p4的水凝胶:丙烯酰胺8g、甲叉双丙烯酰胺0.08g、多聚甲醛8g、va-044 0.4g、10
×
pbs 50ml,最后定容至500ml。
[0062]
其中成分丙烯酰胺、甲叉双丙烯酰胺、多聚甲醛、va-044、pbs作用:
[0063]
丙烯酰胺为聚合链单体;
[0064]
甲叉双丙烯酰胺为交联剂,使得多条丙烯酰胺聚合链交联起来,形成立体结构;
[0065]
甲醛:交联组织,将水凝胶单体与包括蛋白质、核酸和小分子在内的生物分子共价连接;
[0066]
va-044:热引发剂,聚合水凝胶单体,使组织和水凝胶成为一个杂交结构,在物理上支持组织结构;
[0067]
pbs:缓冲液;
[0068]
甲叉双丙烯酰胺较低时,水凝胶的交联度较低,形成的水凝胶孔隙较大,有利于清除液进入组织,清除脂质,达到更好的透明效果,但是如果甲叉双丙烯酰胺过低,交联作用太弱,则无法较好的支持组织结构,使蛋白质损失加大。故本发明采取了a4b3.2p4(丙烯酰胺4%,甲叉双丙烯酰胺0.04%,多聚甲醛4%)的比例,达到理想效果。
[0069]
对于是否透明是一个比较模糊的概念,不能确定透光度达到了多少才能叫做透明,其次,组织透明实验只能分成不同的浓度点去做。
[0070]
本发明将clarity水凝胶透明技术、三维模型与鳞翅目昆虫的组织器官研究结合
起来,是一次史无前例的创新,为蚕蛾卵巢结构研究展示逼真的图像和动画,为其他鳞翅目昆虫的结构研究提供参考。clarity水凝胶透明技术是用凝固的丙烯酰胺对组织内的脂质进行替换,实现组织透明的技术,基于蚕蛾卵巢的形态较小,并有着相对于脑、肝、肾、肠道更加复杂的结构。较小的体型导致卵巢无法像大块状组织一样进行切片处理;复杂的结构使得卵巢在凝固之后难以从水凝胶中分离出来。根据以上两点,尝试在无法凝固的10℃下用水凝胶溶液对组织进行处理,最后仍然完成了透明。目前现有的教学资源主要是图文、录像等资源。传统的图片文字等教学方式抽象且不易理解,而三维动画模型能够形象全面地将知识点经行表现,通过三维模型的多角度观察我们能够发现通过图片录像等不轻易观察到的问题,利于激发学生学习兴趣,探究科学问题。
[0071]
以上产品实施例是本发明较优选具体实施方式的一种,本领域技术人员在本技术方案范围内进行通常变化和替换应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1