制备端脑或其前体组织的方法与流程
本发明涉及用于在体外诱导多能干细胞分化成端脑或其前体组织的技术。
背景技术:
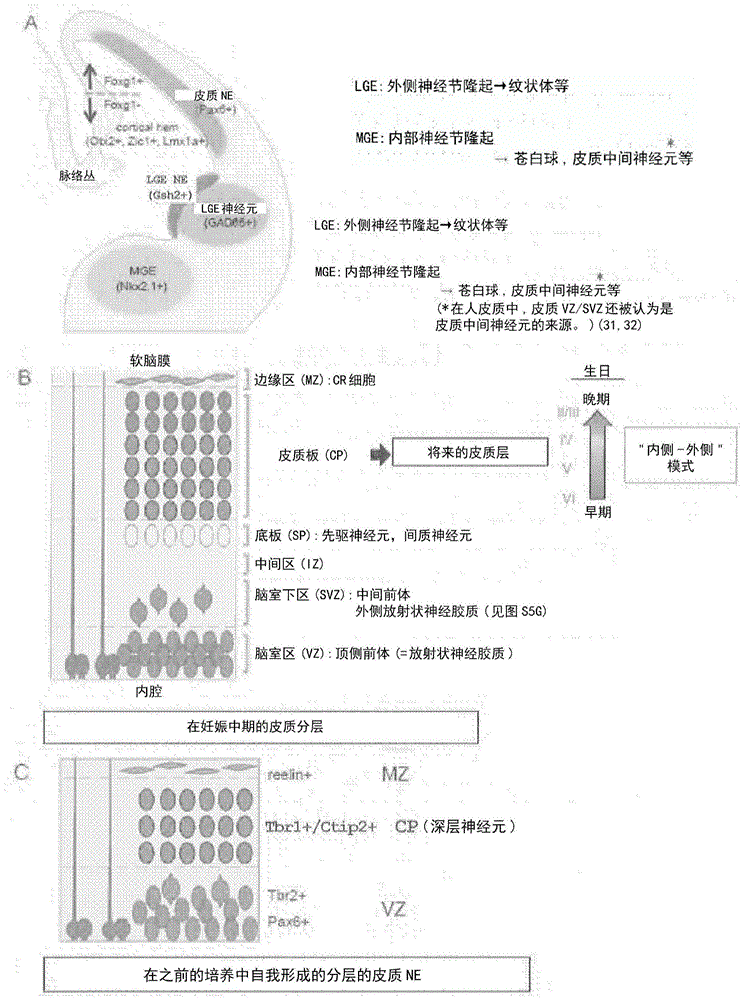
哺乳动物皮质具有在胎儿皮质形成过程中逐渐形成的多层结构(i–vi层)(非专利文献1)。皮质由背侧端脑(或大脑皮质)的神经上皮产生,并且随后外翻以在每个侧面侧形成半球状脑室(图17a)(非专利文献2)。皮质的背尾(dorsocaudal)侧侧连皮质缘(corticalhem),而其腹吻(ventrorostral)侧通过原脑皮质与外侧神经节隆起(lge;纹状体原基)和隔膜邻接。在于成年人中发现的六个层中,存在第i层[其胎儿原基称为边缘区(mz);图17b],因为该最浅表层主要由主要来源于相邻组织如皮质缘和隔膜的reelin阳性cajal-retzius细胞构成(非专利文献3)(在人皮质的情形中,一些reelin阳性细胞还似乎直接来源于皮质神经上皮)(非专利文献4)。其余的皮质层具有特有的时空间协调的神经元产生的模式,称为“内-外(inside-out)”模式;层越深,神经元越早由皮质前体产生(图17b)(非专利文献5,6)。
与可用的关于小鼠皮质形成的大量信息相反,由于有限的对人胎儿脑组织的接近,关于早期皮质形成的详细理解仍然是难懂的。在我们之前的研究中,我们建立了重现皮质形成的早期步骤的小鼠和人es细胞团聚体的3d培养方法(sfebq法)(非专利文献7–9)。已经报道,该方法也成功地用于人ips细胞培养(非专利文献10)。在该自我组织的悬浮的hesc来源的团聚体内,到培养第40–45天时,皮质神经上皮自形成并且自发地发展脑室区、皮质板和边缘区。该皮质神经上皮在多个方面仍然是不成熟的,模拟妊娠期前三个月期间的人皮质形成(图17c)(非专利文献7)。
近来,已经报道了诱导来源于人多能干细胞的具有多层结构的大脑皮质组织内的外部放射状胶质(org)细胞的成功结果(非专利文献11)。该研究使用非选择性分化方法,其可以随机获得脑区的详细说明。这种分化方法特征在于在旋转烧瓶中旋转培养团聚体。
[文献列表]
[非专利文献]
非专利文献1:molyneauxbj,arlottap,menezesjr,macklisjd.(2007)neuronalsubtypespecificationinthecerebralcortex(大脑皮质中的神经元亚型详细说明).natrevneurosci.8:427-437。
非专利文献2:hebertjm,fishellg.(2008)thegeneticsofearlytelencephalonpatterning:someassemblyrequired(早期端脑模式的遗传性:需要一些组装).natrevneurosci9:678-685。
非专利文献3:biellef,等(2005)multipleoriginsofcajal-retziuscellsatthebordersofthedevelopingpallium(在发育的外套膜边界的cajal-retzius细胞的多种来源).natneurosci.8:1002-1012。
非专利文献4:bystroni,blakemorec,rakicp.(2008)developmentofthehumancerebralcortex:bouldercommitteerevisited(人大脑皮质的发育:bouldercommittee重新审视).natrevneurosci.9:110-122。
非专利文献5:rakicp.(1974)neuronsinrhesusmonkeyvisualcortex:systematicrelationbetweentimeoforiginandeventualdisposition(恒河猴视皮质中的神经元:开始时间和最终处理之间的系统相关性).science.183:425-427。
非专利文献6:shenq.等(2006)thetimingofcorticalneurogenesisisencodedwithinlineagesofindividualprogenitorcells(皮质神经发生的时间在个体祖细胞的谱系内编码).natneurosci9:743-751。
非专利文献7:eirakum.等(2008)self-organizedformationofpolarizedcorticaltissuesfromescsanditsactivemanipulationbyextrinsicsignals(由esc自我组织形成极化皮质组织及其通过外部信号的活性操作).cellstemcell3:519-532。
非专利文献8:watanabek.等.(2005)directeddifferentiationoftelencephalicprecursorsfromembryonicstemcells(由胚胎干细胞定向分化端脑前体).natneurosci8:288-296。
非专利文献9:nasum,等(2012)robustformationandmaintenanceofcontinuousstratifiedcorticalneuroepitheliumbylaminin-containingmatrixinmouseescellculture(在小鼠es细胞培养物中,通过包含层粘连蛋白的基质,稳健形成并维持连续的分层的皮质神经上皮).plosone7:e53024。
非专利文献10:marianij.等.(2012)modelinghumancorticaldevelopmentinvitrousinginducedpluripotentstemcells(使用诱导的多能干细胞在体外建模人皮质发育).procnatlacadsciusa.109:12770-12775。
非专利文献11:lancasterm.等.(2013)cerebralorganoidsmodelhumanbraindevelopmentandmicrocephaly(大脑细胞器建模人脑发育和小头病).procnatlacadsciusa.109:12770-12775。
发明概述
发明解决的问题
本发明的目的是提供一种在体外从哺乳动物多能干细胞诱导更成熟的端脑或其前体组织的技术。
解决问题的手段
本发明人已经进行了大量研究,并且通过优化诱导人立体大脑皮质的自我组织的方法中的培养条件,长期成功地获得了更有选择性的立体大脑皮质诱导。使用该方法,在自我组织的大脑皮质中成功地自发形成在体内在胚胎中观察到的背-腹极性和前-后极性。另外,使用外源性信号传导因子,成功地进行了沿着背-腹轴或前-后轴的具体的神经区的分化的选择性诱导,与在体内观察到的位置关系相一致的具有相邻的组织的大脑皮质组织的连续的立体形成,以及皮质周边组织的选择性自我组织。
此外,通过连续地培养大脑皮质组织,沿着从表层部分到深层部分的轴成功地立体形成在人妊娠中期三个月的大脑皮质中观察到的多层结构(脑室区、脑室下区、外侧脑室下区、中间区、底板(subplate)、深层皮质板、表层皮质层、边缘区)。
此外,通过改进培养条件,成功地进行了除大脑皮质之外的组织(如基底神经节,海马,脉络丛等)的立体诱导。
基于上文提及的发现,本发明人已经进行了进一步的研究并且完成了本发明。
因此,本发明如下所述:
[1]制备包含端脑或其部分组织或其前体组织的细胞团聚体的方法,所述方法包括:通过在存在wnt信号抑制剂和tgfβ信号抑制剂的情况下悬浮培养多能干细胞的团聚体而获得端脑标记阳性的团聚体,并且进一步在高氧分压条件下悬浮培养所述端脑标记阳性的团聚体。
[2][1]的制备方法,其中所获得的细胞团聚体包含选自由下述组成的组的端脑部分组织:大脑皮质、基底神经节、海马和脉络丛或其前体组织。
[3][1]或[2]的制备方法,其中在高氧分压条件下的悬浮培养在存在wnt信号增强剂的情况下进行。
[4][1]或[2]的制备方法,其中在高氧分压条件下的悬浮培养在存在wnt信号增强剂和骨形态发生因子信号转导途径激活物质的情况下进行。
[5]制备包含端脑或其部分组织或其前体组织的细胞团聚体的方法,所述方法包括:
(i)通过在存在wnt信号抑制剂和tgfβ信号抑制剂的情况下,悬浮培养多能干细胞的团聚体而获得端脑标记阳性的团聚体,
(ii)在存在wnt信号增强剂和骨形态发生因子信号转导途径激活物质的情况下,进一步悬浮培养(i)中获得的端脑标记阳性的团聚体,和
(iii)在不存在wnt信号增强剂和骨形态发生因子信号转导途径激活物质的情况下,进一步悬浮培养(ii)中获得的细胞团聚体。
[6][5]的制备方法,其中所制备的细胞团聚体包含在连续的神经上皮中的大脑皮质组织或其前体组织、脉络丛组织或其前体组织以及海马组织或其前体组织。
[7][5]的制备方法,其中所制备的细胞团聚体包含在连续的神经上皮中的含有齿状回组织或其前体组织和阿蒙角组织(ammon’shorntissue)或其前体组织的海马组织或其前体组织。
[8][7]的制备方法,其中所述海马组织或其前体组织还包含在连续的神经上皮中的皮质缘(corticalhem)。
[9][5]的制备方法,其中所制备的细胞团聚体包含阿蒙角组织或其前体组织。
[10][5]的制备方法,其中(ii)和(iii)中的悬浮培养在高氧分压条件下进行。
[11][1]或[2]的制备方法,其包括用shh信号激动剂处理所述细胞团聚体。
[12][1]或[2]的制备方法,其包括用fgf8处理所述细胞团聚体。
[13][2]的制备方法,其中所获得的细胞团聚体包含具有多层结构的大脑皮质组织或其前体组织,所述多层结构从表层部分到深层部分包括边缘区、皮质板(corticalplate)、底板、中间区、脑室下区和脑室区。
[14][11]的制备方法,其中所获得的细胞团聚体包含基底神经节或其前体组织。
[15][12]的制备方法,其中所获得的细胞团聚体包含吻侧大脑皮质(rostralcerebralcortex)或其前体组织。
[16][1]-[15]中任一项的制备方法,其中所述多能干细胞是胚胎干细胞或诱导的多能干细胞。
[17][1]-[16]中任一项的制备方法,其中所述多能干细胞来源于人。
[18][1]-[17]中任一项的制备方法,其中所述悬浮培养在不存在饲养细胞的情况下进行。
[19]通过[1]-[18]中任一项的制备方法获得的细胞团聚体。
[20]制备成熟的海马神经元的方法,所述方法包括将通过[1]-[18]中任一项的制备方法获得的包含海马或其前体组织的细胞团聚体分散,并且进一步对所分散的细胞进行粘附培养(adhesionculture),从而从所述细胞诱导成熟的海马神经元。
发明的效果
按照本发明,可以长期由多能干细胞选择性诱导端脑或其部分组织(大脑皮质、基底神经节、海马、脉络丛等)、或其前体组织。
按照本发明,可以由多能干细胞选择性诱导具有背-腹和前-后轴极性的大脑皮质组织或其前体组织。
按照本发明,可以由多能干细胞选择性诱导具有妊娠中期三个月的多层结构的大脑皮质组织或其前体组织。
按照本发明,可以由多能干细胞在连续的神经上皮中自发组织作为相邻的组织的大脑皮质组织或其前体组织、脉络丛组织或其前体组织和海马组织或其前体组织。
按照本发明,可以由多能干细胞诱导在连续的神经上皮中的包含齿状回组织或其前体组织和阿蒙角组织或其前体组织的海马组织或其前体组织。
按照本发明,可以由多能干细胞在人脑室下区外侧特异性诱导具有外侧放射状(org)胶质细胞的特征的神经元前体细胞,所述神经元前体细胞在人胎儿大脑皮质中大量存在,而在小鼠大脑皮质中不存在。
附图简述
图1显示诱导人多能干细胞分化成皮质前体组织。(a)在第26天在细胞团聚体中的foxg1::venus表达。(b)在第34天在团聚体中细胞的foxg1::venus表达。(c)在细胞团聚体内部形成的具有脑室样腔体的半球神经上皮样结构。(d)神经上皮结构的内腔侧中的pax6表达。(e)神经上皮结构的内腔侧中的sox2表达。(f)神经上皮结构的最内腔侧中的磷酸化的组蛋白h3(ph3)的表达。(g)类似于脑室区的细胞层的外侧中的tuj1表达。(h)类似于脑室区的细胞层的外侧中的ctip2表达。(i)类似于脑室区的细胞层的外侧中的reelin阳性的cajal-retzius细胞的出现。(j)接近团聚体表层的层粘连蛋白表达。
图2显示诱导人多能干细胞分化成基底神经节前体组织。(a)端脑神经上皮中形成的表达gsh2的lge。(b)lge神经上皮下存在的gad65阳性的gaba能(gabaergic)神经元。(c)在端脑神经上皮中形成的表达nkx2.1的mge。(d)在形成mge的细胞团聚体中的pax6表达。
图3显示大脑皮质和基底神经节的连续的立体形成。(a)在端脑神经上皮中形成的表达gsh2的lge。(b)在端脑神经上皮中形成的lge中的gad65表达。(c)与lge神经上皮连续形成的pax阳性的皮质神经上皮。
图4显示由人多能干细胞向脉络丛组织的分化诱导。(a)在由多能干细胞诱导的脉络丛组织中的ttr和lmx1a表达。(b)在由多能干细胞诱导的脉络丛组织中的otx2表达。没有观察到foxg1::venus表达。
图5显示人多能干细胞向皮质缘的分化诱导。(a)在由多能干细胞诱导的皮质缘中的lmx1a表达。没有观察到ttr表达。(b)在由多能干细胞诱导的皮质缘中的otx2表达。形成主要由foxg1::venus弱阳性的神经上皮构成的团聚体。
图6显示脉络丛、海马前体组织和皮质前体组织的连续形成。(a)包含foxg1::venus阳性神经上皮和foxg1::venus阴性神经上皮的细胞团聚体。(b)在包含脉络丛、海马前体组织和皮质前体组织的细胞团聚体中的bf1(foxg1)::venus表达。(c)在包含脉络丛、海马前体组织和皮质前体组织的细胞团聚体中的lmx1a和lef1的表达。
图7显示人多能干细胞向海马前体组织的分化诱导。(a-d)在第61天在细胞团聚体中,bf1(foxg1)::venus(a),lmx1a(b),prox1zbtb20(c)和nrp2(d)的表达。(e-h)在第75天在细胞团聚体中,foxg1::venus、lmx1a和lef1(e),zbtb20(f),prox1(g)和prox1与zbtb20(h)的表达。
图8显示由人es细胞诱导的3d海马组织的平板分散培养。(a)具有神经元树突的map2阳性细胞中的海马标记zbtb20的表达。(b)zbtb20阳性细胞中的bf1(foxg1)::venus表达。(c)具有胶质细胞样形态的zbtb20阳性细胞中的星形胶质细胞标记gfap的表达。(d)在分散培养中,在海马区中,齿状回颗粒细胞标记prox1和ca3锥体细胞标记ka1的表达模式。在具有5-10μm的细胞体直径的致密细胞中观察到prox1表达,并且在具有锥体细胞样形态和10-20μm的细胞体直径的大细胞中观察到ka1表达。(e)在图d的细胞中的bf1(foxg1)::venus表达。条:200μm(a,b),100μm(c),10μm(d,e)。
图9显示长期分散培养后海马前体组织的钙成像和电生理学分析。(a-a’)显示在钙成像中的信号表达图像及其亮视野图像。(b)显示在相应的细胞中的钙信号的各种时程响应模式。(c-c’)电生理检测中的亮视野图像。(d)钠-钾电流响应。(e)诱导的动作电位。(f)sepsc及dnqx对其的抑制。条:50μm(c,c’)。
图10显示人多能干细胞向具有妊娠中期三个月型多层结构的皮质前体组织的分化诱导。(a和a’)第70天人多能干细胞来源的皮质神经上皮的切片。a’显示ctip2和pax6免疫染色。甚至在低放大倍数图像中也能观察到脑室区(pax6+)、脑室下区、中间区和皮质板(ctip2+)的明显分离。(b-h”)具有区特异性标记的第70天皮质的免疫染色。(i)第70和91天,皮质神经上皮(皮质ne)的总厚度和脑室区(vz)和皮质板(cp)的厚度。(j-p)具有区特异性标记的第91天皮质神经上皮的免疫染色。(q)在hesc来源的皮质神经上皮的长期培养物中观察到的层状结构的示意图。
图11显示在大脑皮质中的自发轴形成和通过外源性因子的控制。(a-f)显示在第42天在细胞团聚体中,coup-tf1的表达(a),lhx2的表达(b),coup-tf1与lhx2的表达(c),coup-tf1与zic1的表达(d),coup-tf1和otx2的表达(e),couptf1与磷酸化的erk的表达(f)。(g)用fgf8b处理减弱couptf1表达。(h)通过fgf8b处理增加sp8在整个脑室区的表达。(i)fgf8b处理改变coup-tf1和sp8表达模式。
图12显示由hesc自我组织的皮质神经上皮中的轴极性。(a)在第26天用foxg1::venus显现的包含皮质神经上皮的hesc团聚体。(b)关于foxg1::venus阳性群体的代表性的facs分析。(c–j)由foxg1::venushesc自我形成的半球皮质结构的免疫染色。vz,脑室区。(k–n)在hesc来源的皮质神经上皮中观察到的轴极性自我形成。皮质缘样组织(otx2+;m)位于对于背尾侧标记coup-tf1(k)和lhx2强烈一侧的皮质神经上皮的旁侧区。在与coup-tf1表达(n)相对的一侧观察到更高水平的perk信号。表达的梯度和极性用三角表示。箭头,脑室区(vz)(注意:在脑室区观察到标记表达的梯度)。(o和p)fgf8处理抑制couptf1并且扩大腹吻侧标记sp8的表达。(刻度条,在a中为1mm;在c–p中为200μm。)核复染(蓝色),dapi。
图13显示在自我组装的皮质神经上皮中不对称的弯曲形态发生(roundingmorphogenesis)。(a–i)hesc来源的皮质神经上皮的弯曲形态发生的不对称的进展。箭头在a中表示皮质神经上皮结构域的边界,在b–d中表示卷曲的上皮(rollingepithelium)。箭头在e中表示卷曲的上皮。箭头在f–i中表示神经上皮的弯曲运动。(j–l)rock抑制剂y-27632对皮质神经上皮的卷曲的作用。(l)使用rock抑制剂减弱卷曲的形态发生。在使用费舍尔精确检验(fisher’sexacttest)的相依表分析(2×2)中,***p<0.001。处理组,n=187个神经上皮结构域;对照组,n=130。(m和n)在具有强otx2和coup-tf1(背侧和尾侧标记)表达的一侧优先观察到卷曲形状。(o–q)在第35天,皮质(pax6+)和lge(gsh2+;在下面具有gad65+gaba能神经元)的神经上皮结构的邻接形成。接触lge结构域的皮质侧与具有强卷曲(箭头)的一侧相对。(r)在第24天,在hesc来源的皮质神经上皮中的细胞核动态迁移(interkineticnuclearmigration)(两光子成像)。以pax6::venus报道子hesc与未标记的hesc的部分混合可视化。从顶端分裂的前体产生具有顶端和基底突起的两个子细胞。(刻度条,在a中为200μm;在b-h和j–n中为100μm;在o–q中为200μm。)核复染(蓝色),dapi。
图14显示在hesc来源的皮质神经上皮中多个区的自我形成。(a和a’)第70天hesc来源的皮质神经上皮的切片。甚至在低放大倍数观察下也能观察到脑室区(pax6+)、脑室下区、中间区和皮质板(ctip2+)的明显分离。(b-h”)具有区特异性标记的第70天皮质神经上皮免疫染色。(i)在第70和91天,皮质神经上皮(皮质ne)的厚度和脑室区(vz)和皮质板(cp)的厚度。**p<0.01;***p<0.001,在第70天皮质神经上皮样品和第91天皮质神经上皮样品之间(分别为n=6)的studentt检验。(j–o)具有区特异性标记的第91天皮质神经上皮的免疫染色。(p)在hesc来源的皮质神经上皮的长期培养物中观察到的层状结构的示意图。(刻度条,在a中为400μm;在b–h”中为50μm;在j–o中为100μm。)图中的条,sem。核复染(蓝色),dapi。
图15显示在皮质板中satb2+和brn2+皮质神经元的偏向基底侧的定位。(a–h)在第91天培养物中,对satb2和brn2(表层标记)为阳性的皮质神经元优先定位在hesc来源的皮质板的基底(表层)部分。大部分基底定位的satb2+细胞对深层标记tbr1是阴性的。(h)皮质板内的标记阳性神经元的分布。对于相对位置,皮质板的顶部边界和基底边界分别限定为0和100。***p<0.001。mann-whitney检验。红线:中值。计数的神经元:tbr1+(n=105),satb2+(n=58),ctip2+(n=87),和brn2+(n=86)。(i–l)使用edu(第50天;红色;n=36)和brdu(第70天;白色;n=53)的双脉冲标记研究。在第91天通过免疫染色进行分析。如在h中那样进行统计学分析。(m–o)在第112天,成熟的皮质神经元标记camkiiα优先在位于皮质板深层部分的tbr1+神经元中表达。在第78–112天期间,将皮质神经元在transwell滤器上培养,以支持成熟神经元的存活。(o)如在h中那样进行绘图。***p<0.001。kruskal-wallis检验,利用hoc后多重比较检验(posthocmultiplecomparisontest)。计数的神经元数目:tbr1+(n=293),satb2+(n=177),和camkiiα+(n=132)。(p)在第91和112天,在hesc来源的皮质神经上皮内的神经元分布的示意图。(刻度条,在a–c,e–g和i–k中为100μm;在d中为50μm;在m和n中为200μm。)核复染(蓝色),dapi。
图16显示org样前体的外观。(a–f)在第70天(c)和第91天(d–f)hesc来源的皮质神经上皮中,具有垂直(分裂角度为60–90°)和非垂直(0–30°和30–60°)分裂(a和b)的顶部神经干细胞/前体的百分比。p-波形蛋白,m-期标记。箭头,粒周蛋白。分析的细胞:n=42(第70天)和n=33(第91天)。(g–i)在第91天培养物的svz中,基底神经干细胞/前体(pax6+,sox2+)和中间神经干细胞/前体(tbr2+)。(h)在皮质板中,所有神经干细胞/前体(sox2+和/或tbr2+)内的sox2+/tbr2-和sox2-/tbr2+神经干细胞/前体的百分数。从第70天到第91天,sox2+/tbr2-神经干细胞/前体的百分比增加,而sox2-/tbr2+神经干细胞/前体成比例减少。***p<0.001,在第70天和第91天样品之间的studentt检验。每天计数来自四个皮质神经上皮结构域的脑室区外的神经干细胞/前体。(i)在第91天,与sox2-/tbr2+神经干细胞/前体(右侧)相比,sox2+/tbr2-神经干细胞/前体倾向于定位在离脑室表面更远处。***p<0.001,mann-whitney检验。红线,中值。(j–m)pax6+p-波形蛋白+神经干细胞/前体具有向软脑膜延伸的基底突起而没有顶部突起(j和j’),而这些神经干细胞/前体是tbr2阴性的(k和k’)。这些具有基底突起的神经干细胞/前体中大部分(>70%)表现出水平型的分裂角(60–90°;l和m)(n=37)。(刻度条,在d中是100μm;在e中是25μm;在g、j和k中是50μm;在l中是10μm)图中的条,sem。核复染(蓝色),dapi。
图17显示胎儿皮质神经上皮的发育。(a)发育中的胎儿端脑的示意图。(b)在人妊娠中期三个月初期(大约是胚胎第13周)胎儿皮质神经上皮的分层结构的示意图。(c)在之前的hesc自我组织培养物中产生的层状皮质神经上皮结构的示意图。该结构与在妊娠前三个月过程中的人皮质构造相似。
图18显示hesc来源的皮质神经上皮的轴极性。(a)改进的培养方法的示意图。(a’)在第7天hesc团聚体形成的比较。(上图)本发明人之前的培养物;(下图)改进的培养物,其促进由解离的hesc形成不分裂的、平滑的团聚体。(b)包含具有foxg1::venus信号的神经上皮的hesc团聚体的百分数(第26天)。***p<0.001,studentt检验。(c)关于foxg1::venus+群体的代表性的facs分析。灰色,对照(第1天培养物);红色,在之前的条件下的第34天培养物。(d)第42天皮质神经上皮的皮质板中的tbr1的免疫染色信号。(e和f)在小鼠胎儿端脑中区域标记的定位(foxg1+;e)。皮质神经上皮中的coup-tf1表达在背尾侧区域中强,但在腹吻侧区域中弱(f)。(g)couptf1和lhx2的双重免疫染色表明它们的表达模式有类似的偏向。(h–j)小鼠端脑在e12.5的矢状旁区切片(parasagittalsection)。gsh2,lge(外侧神经节隆起)标记(h);lmx1a,皮质缘和脉络丛标记(h);otx2和zic1,皮质缘标记(i和j)。(k)coup-tf1和zic1的双重免疫染色表明,皮质缘标记zic1在皮质神经上皮旁侧的组织中在具有强coup-tf1表达的一侧上表达。(l)fgf8处理(第24–42天)对couptf1和sp8表达的作用。在皮质神经上皮的横截面(在最长轴位置)中计数极化表达(黑色)、广泛表达(boardexpression)(灰色)和不可检测的信号(空白)的百分数。由于以这种方式计数,极化表达模式的百分数可能略微被低估。(刻度条,在a’和b中为1mm;在d、g和i–k中为200μm;在e、f和h为500μm。)图中的条,sem。
图19显示皮质神经上皮中的弯曲形态发生和顶部分裂。(a)在hesc团聚体中皮质神经上皮结构域的自发弯曲形态发生:(上图)第24天;(下图)第27天。apkc,顶部标记。(b)在来源于hesc的foxg1+端脑神经上皮中,pax6+(皮质)和gsh2+(外侧神经节隆起)神经上皮的百分比。用中等浓度的sag(30nm;第15–21天;灰色柱)处理部分抑制了pax6+神经上皮的百分比并且增加了gsh2+神经上皮的百分比。在该条件下,相对大的pax6+ne和gsh2+ne结构域通常并排出现。在500nm,sag处理有效地抑制pax6和gsh2二者的表达。**p<0.01和***p<0.001,dunnett’s检验。(c)在用500nmsag处理的皮质神经上皮中内侧神经节隆起标记nkx2.1的表达。nkx2.1+神经上皮典型地占40–50%的foxg1+端脑ne。(d)与胎儿皮质相比的hesc培养物中的皮质形态发生的示意图。(e)在第28–29天,内腔(顶部)表面附近的顶部前体的对称分裂,其接近内腔表面,之后其细胞以垂直分裂角(定义见图14)分裂并且一起向基底侧移动。通过pax6::venushesc(与wthesc部分混合)可视化。(刻度条,在a和c中为200μm)图中的条,sem。
图20显示hesc来源的皮质神经上皮中的底板形成。(a–e)第70天hesc来源的皮质神经上皮的免疫染色。(a和b)甚至通过用乙酰化的微管蛋白(actubulin;稳定的微管)、dapi(核染色)和nestin(神经前体的中间体纤丝)简单染色,也可以在皮质神经上皮中观察到清楚的形态区分离。(c–e)皮质神经上皮的钙网膜蛋白神经元(c)、map2+早期神经突(d)和中间区中的cspg积聚(e)高放大倍数视图。(f)在e14.5小鼠胎儿皮质中的区域标记免疫染色。(g)第70天hesc来源的皮质神经上皮的免疫染色。没有观察到皮质板中gad65+中间神经元的实质性积聚或tag1+离皮质轴突。(h–j)第91天hesc来源的皮质神经上皮的免疫染色。皮质神经上皮发育良好,并且分层的结构变得厚得多(h和i)。皮质板包含一定数量的brn2+表层神经元(j)。(k)在第112天hesc来源的皮质神经上皮中的tbr1的免疫染色信号。(l和m)在第112天hesc来源的皮质神经上皮的皮质板中的成熟的皮质神经元标记camkiiα的表达。这些camkii神经元中的大部分共表达tbr1(l)但不表达satb2(m)。(刻度条,在a,b,g,l和m中为50μm;在c–e中为20μm;在f和h–j中为100μm;在k中为200μm。)
图21显示在osvz中的org样神经干细胞/前体。(a–c)在第91天,在hesc来源的皮质神经上皮内的顶部和基底(svz)神经干细胞/前体中的pax6和sox2的免疫染色。大部分sox2阳性细胞表达pax6(c)。(d–f)notch信号抑制对神经干细胞/前体和神经元标记在皮质神经上皮中表达的作用。notch抑制剂处理(10μmdapt,第70–77天)增加sox2-tbr2+中间体神经干细胞/前体,而在处理后,sox2+tbr2-细胞很少保留(d和e)。dapt处理也增加satb2+神经元(d和e)。在处理后也观察到皮质神经上皮厚度的增加(f)。***p<0.001,用dapt(n=6)和不用dapt(n=5)处理之间的studentt检验。(g)在人胎儿外部svz中的org神经干细胞/前体的示意图。(h和h’)在svz中的磷酸-波形蛋白+神经干细胞/前体表达sox2。(i)在svz中的磷酸-波形蛋白+神经干细胞/前体具有向软膜表面延伸的长的顶部突起。(j)具有基底突起的磷酸-波形蛋白+svz神经干细胞/前体在神经元中携带粒周蛋白+中心体。在有丝分裂过程中,对于分裂的细胞发现两个粒周蛋白+中心粒。(k–k″)与org样神经干细胞/前体不同,在hesc来源的皮质神经上皮中没有tbr2+磷酸-波形蛋白+神经干细胞/前体具有基底突起(也不具有顶部突起)。(刻度条,在a–e中为100μm;在h–k中为25μm。)
实施方案描述
本发明提供制备包含端脑或其部分组织或其前体组织的细胞团聚体的方法,所述方法包括:通过在存在wnt信号抑制剂和tgfβ信号抑制剂的情况下悬浮培养多能干细胞的团聚体而获得端脑标记阳性的团聚体,并且进一步悬浮培养所述端脑标记阳性的团聚体。进一步的悬浮培养优选地在高氧分压条件下进行。
在下文中详细地阐释本发明。
(1)多能干细胞
“多能干细胞”是指具有分化成组成机体的全部细胞的潜力(多能性)和通过细胞分裂产生具有相同的分化能力的子细胞的潜力(自我复制能力)两者的细胞。
多能性可以通过将评价靶标的细胞移植到裸鼠中,并且检测存在或不存在包含三胚层(外胚层、中胚层、内胚层)的各细胞的畸胎瘤的形成而进行评价。
多能干细胞的实例包括胚胎干细胞(es细胞),胚胎生殖细胞(eg细胞),诱导的多能干细胞(ips细胞)等,并且多能干细胞没有限制,只要其具有多能性和自我复制能力即可。在本发明中,优选使用胚胎干细胞或诱导的多能干细胞。
胚胎干细胞(es细胞)可以这样建立:例如,培养预先植入早期胚胎、构成早期胚胎的内部细胞团、单个分裂球等(manipulatingthemouseembryoalaboratorymanual(操作小鼠胚胎:实验室手册),第二版,coldspringharborlaboratorypress(1994);thomson,j.a.等,science,282,1145-1147(1998))。作为早期胚胎,可以使用通过核移植体细胞的细胞核制备的早期胚胎(wilmut等(nature,385,810(1997)),cibelli等(science,280,1256(1998)),akirairitani等(tanpakushitsukakusankoso,44,892(1999)),baguisi等(naturebiotechnology,17,456(1999)),wakayama等(nature,394,369(1998);naturegenetics,22,127(1999);proc.natl.acad.sci.usa,96,14984(1999)),rideoutiii等(naturegenetics,24,109(2000),tachibana等(humanembryonicstemcellsderivedbysomaticcellnucleartransfer(通过体细胞核转移衍生的人胚胎干细胞),cell(2013),出版中))。作为早期胚胎,还可以使用单性生殖的胚胎(kim等(science,315,482-486(2007)),nakajima等(stemcells,25,983-985(2007)),kim等(cellstemcell,1,346-352(2007)),revazova等(cloningstemcells,9,432-449(2007)),revazova等(cloningstemcells,10,11-24(2008))。
通过细胞融合es细胞和体细胞获得的融合es细胞也包括在用于本发明的方法的胚胎干细胞中。
胚胎干细胞可以从适当的组织获得,并且可以购买商业化产品。例如,人胚胎干细胞khes-1、khes-2和khes-3可从instituteforfrontiermedicalsciences,kyotouniversity获得。
胚胎生殖细胞(eg细胞)可以通过在存在lif、bfgf、scf等的条件下培养原始生殖细胞而建立(matsui等,cell,70,841-847(1992),shamblott等,proc.natl.acad.sci.usa,95(23),13726-13731(1998),turnpenny等,stemcells,21(5),598-609,(2003))。
诱导的多能干细胞(ips细胞)是指通过使体细胞(例如,成纤维细胞、皮肤细胞、淋巴细胞等)与核重编程因子接触而人工获得多能性和自我复制能力的细胞。ips细胞首次是通过包括向体细胞(例如,成纤维细胞、皮肤细胞等)中引入由oct3/4、sox2、klf4和c-myc组成的核重编程因子的方法而发现的(cell,126:p.663-676,2006)。然后,多位研究者在重编程因子的组合和所述因子的引入方法方面进行了多种改进,并且已经报道了诱导的多能干细胞的多种制备方法。
核重编程因子可以用任意物质配置,诸如蛋白质因子或编码其的核酸(包括结合在载体中的形式),或低分子量化合物,只要其是能够由体细胞(诸如成纤维细胞等)诱导具有多能性和自我复制能力的细胞的物质即可。当核重编程因子是蛋白质因子或编码其的核酸时,优选的核重编程因子由下述组合示例(下文,仅显示蛋白质因子的名称)。
(1)oct3/4,klf4,sox2,c-myc(其中sox2可被sox1,sox3,sox15,sox17或sox18替换。klf4可被klf1,klf2或klf5替换。此外,c-myc可被t58a(活性形式突变体),n-myc或l-myc替换。)
(2)oct3/4,klf4,sox2
(3)oct3/4,klf4,c-myc
(4)oct3/4,sox2,nanog,lin28
(5)oct3/4,klf4,c-myc,sox2,nanog,lin28
(6)oct3/4,klf4,sox2,bfgf
(7)oct3/4,klf4,sox2,scf
(8)oct3/4,klf4,c-myc,sox2,bfgf
(9)oct3/4,klf4,c-myc,sox2,scf
在这些组合中,当考虑使用获得的用于治疗性应用的ips细胞时,优选三种因子oct3/4、sox2和klf4的组合。另一方面,当不考虑使用用于治疗性应用的ips细胞时(例如,用作药物发现筛选等的研究工具),优选由oct3/4、klf4、sox2和c-myc组成的四种因子或通过向其中加入lin28或nanog的5种因子。
ips细胞优选地用于自体移植。
本发明中还可以使用通过已知的基因改造方法修饰染色体中的基因而获得的多能干细胞。多能干细胞可以是这样的细胞,其中通过已知的方法将标记基因(例如,荧光蛋白,如gfp等)以符合阅读框的方式敲入到编码分化标记的基因中,通过使用标记基因的表达作为指标,可以鉴定所述细胞已经达到相应的分化阶段。
作为多能干细胞,可以使用温血动物多能干细胞,优选哺乳动物多能干细胞。哺乳动物包括,例如,实验动物,包括啮齿动物,如小鼠、大鼠、仓鼠和豚鼠,和兔;家养动物,如猪、牛、山羊、马和绵羊;伴生动物,如狗和猫;灵长类动物,如人、猴子、猩猩和黑猩猩。多能干细胞优选是啮齿动物(小鼠、大鼠等)或灵长类动物(人等)的多能干细胞,最优选是人多能干细胞。
多能干细胞可以通过本身已知的方法培养维持。例如,从临床应用方面来看,多能干细胞优选地通过使用血清替代物(如knockouttmserumreplacement(ksr)等)的无血清培养或无饲养细胞的细胞培养而维持。
用于本发明的多能干细胞优选是分离的。“分离的”意指已经进行了去除除靶细胞或成分之外的因子的操作,并且所述细胞或成分不再以天然状态存在。“分离的人多能干细胞”的纯度(人多能干细胞占总细胞数的百分数)通常不小于70%,优选不小于80%,更优选不小于90%,更优选不小于99%,最优选为100%。
(2)形成多能干细胞团聚体
多能干细胞团聚体可以通过在与培养容器不粘附的条件下培养(即,悬浮培养)分散的多能干细胞,并且组装多个多能干细胞以允许团聚体形成而获得。
用于团聚体形成的培养容器没有特别的限制,并且其实例包括烧瓶、组织培养烧瓶、皿、培养皿、组织培养皿、多联培养皿(multi-dishes)、微板、微孔板、微孔、多联平板(multi-plates)、多孔板、室载玻片、培养皿、管、托盘、培养袋和旋转瓶。为了能够在非粘附条件下培养,培养容器优选是非细胞粘附性的。可用的非细胞粘附性的培养容器包括其表面已被人工处理成细胞不粘附的培养容器,其表面没有进行提高细胞粘附性的人工处理(例如,利用胞外基质等的包被处理)的培养容器等。
用于团聚体形成的培养基可以使用用于培养动物细胞的培养基作为基础培养基而制备。所述基础培养基没有特别限制,只要其可以用于培养动物细胞即可,并且可以是bme培养基,bgjb培养基,cmrl1066培养基,glasgowmem培养基,improvedmemzincoption培养基,imdm培养基,medium199培养基,eaglemem培养基,αmem培养基,dmem培养基,ham培养基,ham’sf-12培养基,rpmi1640培养基,fischer’s培养基,它们混合的培养基等。
为了避免对多能干细胞分化诱导成端脑或其部分组织或其前体组织的不利影响,用于团聚体形成的培养基优选是无血清培养基。无血清培养基意指不含未调节的或未纯化的血清的培养基。包含来源于血液的纯化的成分和来源于动物组织的成分(例如,细胞因子)的培养基对应于无血清培养基。
用于团聚体形成的培养基可以包含血清替代物。所述血清替代物可以是,例如,适当地包含清蛋白、转铁蛋白、脂肪酸、胶原前体、痕量元素、2-巯基乙醇或3’-硫代甘油或它们的等价物等的血清替代物。例如,所述血清替代物可以通过wo98/30679中所述的方法制备。为了促进本发明方法更容易实施,可以使用可商购获得的血清替代物。此类可商购获得的血清替代物的实例包括knockoutserumreplacement(ksr,由invitrogen生产)、chemically-definedlipidconcentrated(由gibcocompany生产)和glutamax(由gibcocompany生产)。
用于团聚体形成的培养基包含其他添加剂,只要没有不利影响多能干细胞向端脑或其部分组织或其前体组织的分化诱导即可。添加剂的实例包括,但不限于,胰岛素、铁源(例如,转铁蛋白等)、矿物质(例如,硒酸钠等)、糖类(例如,葡萄糖等)、有机酸(例如,丙酮酸、乳酸等)、血清蛋白(例如,清蛋白等)、氨基酸(例如,l-谷氨酰胺等)、还原剂(例如,2-巯基乙醇等)、维生素(例如,抗坏血酸、d-生物素等)、抗生素(例如,链霉素(streptomycin),青霉素(penicillin),庆大霉素(gentamicin)等)、缓冲剂(例如,hepes等)等。
用于团聚体形成的培养基可以是下述用于诱导多能干细胞分化为端脑或其部分组织或其前体组织的培养基。
为了形成多能干细胞团聚体,从传代培养物收集多能干细胞,并且将其分散为单细胞状态或接近单细胞状态。将多能干细胞用适当的细胞解离溶液分散。细胞解离溶液的实例包括edta;蛋白酶,如胰蛋白酶,胶原酶iv,金属蛋白酶等,它们单独使用或以适当的组合使用。其中,优选表现低细胞毒性的细胞解离溶液,并且此种细胞解离溶液的实例包括可商购的产品如dispase(eidia),tryple(invitrogen),accutase(millipore)等。将分散的多能干细胞悬浮在上文提及的培养基中。
为了抑制由分散引起的多能干细胞(特别是人多能干细胞)的细胞死亡,优选地从一开始培养起就添加rho相关性卷曲螺旋激酶(rho-associatedcoiled-coilkinase,rock)的抑制剂(jp-a-2008-99662)。例如,在自培养开始起的15天内,优选10天内,更优选6天内添加rock抑制剂。rock抑制剂的实例包括y-27632((+)-(r)-反式-4-(1-氨基乙基)-n-(4-吡啶基)环己烷甲酰胺二盐酸盐)等。用于悬浮培养的rock抑制剂的浓度是能够抑制由分散引起的多能干细胞的细胞死亡的浓度。例如,对于y-27632,该浓度通常为约0.1-200μm,优选地约2-50μm。在其添加期中,rock抑制剂的浓度可以变化并且,例如,在后半时间段中,所述浓度可以减半。
将分散的多能干细胞的悬浮液接种在上文提及的培养容器中,并且将分散的多能干细胞在不与细胞培养容器粘附的条件下培养,由此多个多能干细胞组装形成团聚体。在这种情形中,分散的多能干细胞可以被接种在比较大的培养容器如10-cm培养皿中,以在一个培养区室中同时形成多个多能干细胞团聚体。然而,团聚体的尺寸、以及其中包含的多能干细胞的数目可以广泛变化,并且所述变化可能引起多能干细胞向端脑或其部分组织或其前体组织的分化水平的差异,其又可能降低分化诱导的效率。因此,优选的是在一个培养区室中快速凝聚分散的多能干细胞以形成一个团聚体。用于快速凝聚分散的多能干细胞的方法的实例包括下述方法:
(1)一种方法,所述方法包括将分散的多能干细胞封入具有比较小的体积(例如,不大于1ml,不大于500μl,不大于200μl,不大于100μl)的培养区室中以在该区室中形成一个团聚体。优选地,在封入分散的多能干细胞后,将所述培养区室静置。所述培养区室的实例包括,但不限于,多孔板(384孔,192孔,96孔,48孔,24孔等)中的孔,微孔,室载玻片等,管,悬滴法中的一滴培养基等。封在所述区室中的分散的多能干细胞由于重力沉淀于一点,或者细胞彼此粘附从而在一个培养区室中形成一个团聚体。多孔板、微孔、室载玻片、管等的底部的形状优选是u型底或v型底,以促使分散的多能干细胞沉淀于一点。
(2)一种方法,所述方法包括将分散的多能干细胞放置在离心管中,将其离心,以允许多能干细胞沉淀在一个点上,由此在该管中形成一个团聚体。
接种在一个培养区室中的多能干细胞的数目没有特别的限制,只要每个培养区室形成一个团聚体,并且可以通过本发明的方法诱导在所述团聚体中的多能干细胞向端脑或其部分组织或其前体组织的分化即可。通常,将约1×103-约5×104,优选地约1×103-约2×104,更优选地约2×103-约1.2×104个多能干细胞接种在一个培养区室中。然后,通过快速凝聚所述多能干细胞,每个培养区室形成一个通常由约1×103-约5×104、优选地约1×103-约2×104、更优选地约2×103-约1.2×104个多能干细胞构成的细胞团聚体。
团聚体形成所需的时间可以适当地确定,只要每个区室形成一个团聚体,并且可以通过本发明的方法诱导在所述团聚体中的多能干细胞向大脑皮质或其前体组织的分化即可。通过缩短时间,向目标大脑皮质组织或其前体组织的分化的有效诱导是预期的,并且因此,所述时间优选更短。优选地,多能干细胞团聚体在24小时内形成,更优选地在12小时内形成,更优选在6小时内形成,最优选地在2-3小时内形成。团聚体形成所需的时间可以通过由本领域技术人员选择用于细菌聚集的工具、离心条件等而适当地进行调节。
可以适当地设置其他培养条件如团聚体形成时的培养温度和co2浓度。培养温度没有特别限制,并且,例如,为约30-40℃,优选地约37℃。co2浓度例如为约1-10%,优选地约5%。
此外,制备在相同培养条件下的多个培养区室,并且在每个培养区室中形成一个多能干细胞团聚体,由此可以获得性质均一的多能干细胞团聚体群体。多能干细胞团聚体是否是性质均一的可以基于团聚体团的尺寸和其中的细胞数目、宏观形态、微观形态及其通过组织染色分析的同质性、分化和未分化标记的表达及其同质性、分化标记表达的调控及其同步性、团聚体间分化效率的再现性等进行评价。在一个实施方案中,用于本发明的方法中的多能干细胞团聚体的群体在团聚体中包含均一数量的多能干细胞。在特定参数方面是“均一的”多能干细胞团聚体的群体意指其群体中的不少于90%的总团聚体落在该团聚体群体中所述参数的平均值±10%、优选±5%的范围内。
(3)诱导端脑或其部分组织或其前体组织
本发明的制备方法包括在存在wnt信号抑制剂和tgfβ信号抑制剂的情况下悬浮培养多能干细胞的团聚体而获得端脑标记阳性的团聚体(第一培养步骤),并且进一步悬浮培养所述端脑标记阳性的团聚体(第二培养步骤)。第二培养步骤中的悬浮培养优选地在高氧分压条件下进行。在第一培养步骤中,保证从多能干细胞向端脑区分化的方向,由此诱导端脑标记基因的表达。通过对得到的端脑标记阳性的团聚体进行第二培养步骤,诱导向端脑或其部分组织或其前体组织的进一步分化。
端脑标记的实例包括,但不限于,foxg1(也称为bf1),six3等。端脑标记阳性的团聚体包含表达至少一种端脑标记的细胞。在优选的实施方案中,端脑标记阳性的团聚体是foxg1阳性团聚体。在所述端脑标记阳性的团聚体中,例如,不少于30%,优选地不少于50%,更优选地不少于70%的包含在所述团聚体中的细胞是端脑标记阳性的。
端脑的部分组织包括,例如,大脑皮质、基底神经节、海马、脉络丛等。
按照本发明,端脑或其部分组织或其前体组织在多能干细胞的团聚体内自我组织。按照本发明的一个实施方案,在存在wnt信号抑制剂和tgfβ信号抑制剂的情况下悬浮培养多能干细胞的团聚体,从而产生端脑标记阳性的团聚体(例如,foxg1阳性团聚体),并且将所述端脑标记阳性的团聚体(例如,foxg1阳性团聚体)进一步悬浮培养(优选地在高氧分压条件下),由此在所述团聚体中形成端脑标记阳性的神经上皮样结构。在一个实施方案中,不少于70%的包含在所述含有神经上皮样结构的团聚体中的细胞是端脑标记阳性的(例如,foxg1阳性的)。在一个实施方案中,在团聚体中形成的神经上皮样结构显示在其内部具有脑室样腔的假复层的柱状上皮结构。在一个实施方案中,神经上皮结构在内腔侧具有pax6阳性的和sox2阳性的细胞层,并且在其最内部分包含磷酸化的组蛋白h3阳性的有丝分裂细胞。这些结构与人妊娠前三个月大脑皮质的脑室区相似。在一个实施方案中,在与脑室区相似的神经上皮样细胞层外侧,包含表达有丝分裂后神经元标记tuj1和早期皮质板标记ctip2和tbr1的细胞。这些可以包含reelin阳性的cajal-retzius细胞,其是大脑皮质的第i层和邻近表层的富含层粘连蛋白的层中的神经元。即,在优选的实施方案中,通过本发明的制备方法获得的团聚体可以包含皮质前体组织。
多能干细胞团聚体的“悬浮培养”是指在不粘附到培养容器的条件下在培养基中培养多能干细胞的团聚体。这能够允许在常规的粘附培养中难以实现的立体形成。
用于悬浮培养的培养基包含wnt信号抑制剂和tgfβ信号抑制剂。由于wnt信号抑制剂和tgfβ信号抑制剂的作用,可以有效地进行多能干细胞向端脑区的分化诱导。
wnt信号抑制剂没有特别限制,只要其能够抑制由wnt介导的信号转导即可。wnt信号抑制剂包括,但不限于,例如,iwr-1-endo(4-[(3ar,4s,7r,7as)-1,3,3a,4,7,7a-六氢-1,3-二氧-4,7-甲醇-2h-异吲哚-2-基]-n-8-喹啉基-苯甲酰胺),iwp-2,xav939,dkk1,cerberus蛋白,wnt受体抑制剂,可溶性wnt受体,wnt抗体,酪蛋白激酶抑制剂,和显性阴性wnt蛋白(dominantnegativewntprotein);特别地,iwr-1-endo是优选的。
tgfβ信号抑制剂没有特别限制,只要其能够抑制由tgfβ介导的信号转导即可。tgfβ信号抑制剂包括,但不限于,例如,sb431542(4-(5-苯并[1,3]二氧杂环戊烯-5-基-4-吡啶-2-基-1h-咪唑-2-基)-苯甲酰胺),ly-364947,sb-505,a-83-01等;特别地,优选sb431542。
优选的wnt信号抑制剂与tgfβ信号抑制剂的组合是iwr-1-endo和sb431542。
可以在能够在团聚体中诱导多能干细胞向端脑区的分化的范围内适当地确定培养基中wnt信号抑制剂和tgfβ信号抑制剂的浓度。当使用iwr-1-endo作为wnt信号抑制剂时,其浓度通常为0.1-50μm,优选为0.3-5μm。当使用sb431542作为tgfβ信号抑制剂时,其浓度通常为0.1-100μm,优选为1-10μm。
用于悬浮培养团聚体的培养基可以使用用于培养动物细胞的培养基作为基础培养基而制备。基础培养基没有特别限制,只要其可以用于培养动物细胞即可,并且可以是bme培养基,bgjb培养基,cmrl1066培养基,glasgowmem培养基,improvedmemzincoption培养基,imdm培养基,medium199培养基,eaglemem培养基,αmem培养基,dmem培养基,ham培养基,ham’sf-12培养基,rpmi1640培养基,fischer’s培养基,neurobasalmedium,它们混合的培养基等。优选地,使用glasgowmem培养基。
为了避免对多能干细胞向端脑或其部分组织或其前体组织的分化的诱导的不利影响,用于悬浮培养团聚体的培养基优选是无血清培养基。
用于悬浮培养团聚体的培养基可以包含血清替代物。所述血清替代物可以是,例如,适当地包含清蛋白、转铁蛋白、脂肪酸、胶原前体、痕量元素、2-巯基乙醇或3’-硫代甘油或它们的等价物等的血清替代物。例如,所述血清替代物可以通过wo98/30679所述的方法制备。为了促进本发明的方法更容易实施,可以使用可商购获得的血清替代物。此类可商购获得的血清替代物的实例包括ksr(knockoutserumreplacement)(由invitrogen生产)、chemically-definedlipidconcentrated(由gibcocompany生产)和glutamax(由gibcocompany生产)。
用于悬浮培养团聚体的培养基包含其他添加剂,只要没有不利地影响多能干细胞向端脑或其部分组织或其前体组织的分化诱导即可。添加剂的实例包括,但不限于,胰岛素、铁源(例如,转铁蛋白等)、矿物质(例如,硒酸钠等)、糖类(例如,葡萄糖等)、有机酸(例如,丙酮酸、乳酸等)、血清蛋白(例如,清蛋白等)、氨基酸(例如,l-谷氨酰胺等)、还原剂(例如,2-巯基乙醇等)、维生素(例如,抗坏血酸、d-生物素等)、抗生素(例如,链霉素,青霉素,庆大霉素等)、缓冲剂(例如,hepes等)等。
在一个实施方案中,为了避免对多能干细胞向端脑或其部分组织或其前体组织的分化诱导的不利影响,用于悬浮培养团聚体的培养基优选是添加了血清替代物(ksr等)的不含生长因子的化学成分确定的培养基(gfcdm)。“生长因子”在此处包括模式形成因子如fgf,wnt,nodal,notch,shh等;胰岛素和富含脂质的清蛋白。
可以适当地设置用于悬浮培养团聚体的其他培养条件如培养温度、co2浓度和o2浓度。培养温度没有特别限制,并且,例如,为约30-40℃,优选地约37℃。co2浓度例如为约1-10%,优选地约5%。o2浓度例如为约20%。
进行第一培养步骤达足够的时间以保证向端脑区的分化方向和诱导端脑标记阳性的团聚体(例如,foxg1阳性团聚体)。例如,可以通过rt-pcr或使用端脑标记特异性抗体的免疫组织化学来检测端脑标记阳性的团聚体。例如,将其进行至培养物中不少于50%、优选地不少于70%的细胞团聚体变为端脑标记阳性的。由于培养时间可能取决于多能干细胞的动物物种以及wnt信号抑制剂和tgfβ信号抑制剂的种类而变化,其通常不能特别指定。然而,当使用人多能干细胞时,例如,第一培养步骤为15–20天(例如,18天)。
在第二培养步骤中,对在第一培养步骤中获得的端脑标记阳性的团聚体进一步进行悬浮培养,由此获得包含端脑或其部分组织或其前体组织的细胞团聚体。第二培养步骤中的悬浮培养优选在高氧分压条件下进行。通过在高氧分压条件下进一步悬浮培养端脑标记阳性的团聚体,实现所述团聚体中包含的脑室区的长期维持培养,由此能够允许向端脑或其部分组织或其前体组织的有效分化诱导。
高氧分压条件意指超过空气中的氧分压(20%)的氧分压条件。在第二培养步骤中的氧分压例如为30-60%,优选地35-60%,更优选地38-60%。
用于第二培养步骤的培养基可以使用用于培养动物细胞的培养基作为基础培养基而制备,如用于第一培养步骤的培养基。所述基础培养基没有特别限制,只要其可以用于培养动物细胞即可,并且可以是bme培养基,bgjb培养基,cmrl1066培养基,glasgowmem培养基,improvedmemzincoption培养基,imdm培养基,medium199培养基,eaglemem培养基,αmem培养基,dmem培养基,ham培养基,ham’sf-12培养基,rpmi1640培养基,fischer’s培养基,它们混合的培养基等。优选使用dmem培养基。
在第二培养步骤中,用于第一培养步骤中的wnt信号抑制剂和tgfβ信号抑制剂不是必须的。在一个实施方案中,用于第二培养步骤中的培养基不包含wnt信号抑制剂和tgfβ信号抑制剂。
用于第二培养步骤中的培养基优选地包含n2补充剂(n2supplement)作为血清替代物以促进向端脑或其部分组织或其前体组织的分化诱导。n2补充剂是一种已知的血清替代组合物,其包含胰岛素、转铁蛋白、孕酮、腐胺和亚硒酸钠,并且可以从gibco/invitrogen等购买。添加的n2补充剂的量可以适当地确定,以便能够促进向端脑或其部分组织或其前体组织的分化诱导。
用于第二培养步骤的培养基优选地包含化学成分确定的脂质浓缩物(chemicallydefinedlipidconcentrate)以用于脑室区的长期维持培养。chemicallydefinedlipidconcentrate是一种包含胆甾醇、dl-α-生育酚、花生四烯酸、亚麻酸、亚油酸、肉豆蔻酸、油酸、棕榈酸、棕榈油酸和硬脂酸(其中每一种都是纯化的)的脂质混合物。chemicallydefinedlipidconcentrate可以是可商购的,并且例如可以从gibco/invitrogen等购买。
用于团聚体的悬浮培养的培养基可以包含其他的添加剂,只要没有不利的影响多能干细胞向端脑或其部分组织或其前体组织的分化诱导即可。添加剂的实例包括,但不限于,胰岛素、铁源(例如,转铁蛋白等)、矿物质(例如,硒酸钠等)、糖类(例如,葡萄糖等)、有机酸(例如,丙酮酸、乳酸等)、血清蛋白(例如,清蛋白等)、氨基酸(例如,l-谷氨酰胺等)、还原剂(例如,2-巯基乙醇等)、维生素(例如,抗坏血酸、d-生物素等)、抗生素(例如,链霉素,青霉素,庆大霉素等)、缓冲剂(例如,hepes等)等。
在一个实施方案中,为了避免对多能干细胞向端脑或其部分组织或其前体组织的分化诱导的不利影响,用于悬浮培养团聚体的培养基优选是添加了血清替代物(ksr等)的不含生长因子的化学成分确定的培养基(gfcdm)。“生长因子”在此处包括模式形成因子如fgf,wnt,nodal,notch,shh等;胰岛素和富含脂质的清蛋白。
在优选的实施方案中,用于第二培养步骤的培养基包含n2补充剂和chemicallydefinedlipidconcentrate。
在一个实施方案中,用于第二培养步骤的培养基是无血清培养基。
在一个实施方案中,用于第二培养步骤的培养基可以包含血清。血清可以有助于脑室区的长期维持培养。血清的实例包括,但不限于,fbs等。血清优选是失活的。培养基中血清的浓度可以在有助于脑室区的长期维持培养的范围内适当地调节,并且通常是1-20%(v/v)。
在一个实施方案中,用于第二培养步骤的培养基可以包含肝素。肝素可以有助于脑室区的长期维持培养。培养基中肝素的浓度可以在有助于脑室区的长期维持培养的范围内适当地调节,并且通常是0.5–50μg/ml,优选地1–10μg/ml(例如,5μg/ml)。
在一个实施方案中,用于第二培养步骤的培养基可以包含胞外基质成分。胞外基质成分可以有助于脑室区的长期维持培养。“胞外基质成分”是指通常在胞外基质中发现的多种成分。在本发明的方法中,优选基膜成分。主要的基膜成分的实例包括iv型胶原、层粘连蛋白、硫酸乙酰肝素蛋白聚糖和巢蛋白(entactin)。添加到培养基中的胞外基质成分可以是可商购的一种,并且例如,可以提及matrigel(bdbioscience)、人层粘连蛋白(sigmaltd.)等。matrigel是来源于engelbrethholmswarn(ehs)小鼠肉瘤的基膜制剂。matrigel的主要成分是iv型胶原、层粘连蛋白、硫酸乙酰肝素蛋白聚糖和巢蛋白。除了这些之外,还包含tgf-β、成纤维细胞生长因子(fgf)、组织纤溶酶原激活物和由ehs肿瘤天然产生的生长因子。matrigel的“生长因子减少的产物”具有比常规matrigel低的生长因子浓度,并且其标准浓度为:对于egf,<0.5ng/ml,对于ngf,<0.2ng/ml,对于pdgf,<5pg/ml,对于igf-1,5ng/ml,并且对于tgf-β,1.7ng/ml。在本发明的方法中,优选使用生长因子减少的产物。
培养基中胞外基质成分的浓度可以在有助于脑室区的长期维持培养的范围内适当地调节。当使用matrigel时,其通常以培养基的1/500-1/20、更优选地1/100的体积添加。
在一个实施方案中,用于第二培养步骤的培养基除了n2补充剂和chemicallydefinedlipidconcentrate之外还包含血清和肝素。在这一实施方案中,培养基还可以包含胞外基质。用于该实施方案的培养基适合用于长期观察向端脑或其部分组织或其前体组织的分化诱导。在该情形中,可以在整个第二培养步骤范围内使用包含n2补充剂、chemicallydefinedlipidconcentrate、血清和肝素(任选地,进一步包含胞外基质)的培养基,或者用于该实施方案的培养基可以仅在一部分时间使用。在一个实施方案中,在第二培养步骤中,先使用包含n2补充剂和chemicallydefinedlipidconcentrate而不包含血清、肝素和胞外基质的培养基,并且在过程中(例如,在foxg1阳性团聚体中形成具有大脑室样腔(假复层的柱状上皮)的半球神经上皮样结构的阶段后)可以更换成包含n2补充剂、chemicallydefinedlipidconcentrate、血清、肝素、(任选地,胞外基质)的培养基。
可以适当地设置第二培养步骤中的其他培养条件如培养温度和co2浓度。培养温度例如为约30-40℃,优选地约37℃。co2浓度例如为约1-10%,优选地约5%。
进行第二培养步骤达至少足以在foxg1阳性团聚体中形成具有大脑室样腔(假复层柱状上皮)的半球神经上皮样结构的时间。所述神经上皮样结构可以通过显微镜观察证实。由于培养时间可能取决于多能干细胞的动物物种、wnt信号抑制剂和tgfβ信号抑制剂的种类等而变化,其通常不能特别指定。然而,当使用人多能干细胞时,例如,第二培养步骤为至少15–20天(例如,17天)。
在本发明的方法中,可以通过长期进行第二培养步骤(例如,不少于20天,优选地不少于50天,更优选地不少于70天)而在细胞团聚体中诱导端脑的稳定的自我组织。当连续进行第二培养步骤时,包含在细胞团聚体中的端脑或其部分组织或其前体组织的分化阶段随时间进展而进行。因此,优选地连续进行第二培养步骤,直到达到需要的分化阶段。
在一个实施方案中,进行第二培养步骤直到在所述细胞团聚体中大脑皮质组织或其前体组织显示多层结构,所述多层结构从表层部分到深层部分包含边缘区、皮质板、底板、中间区、脑室下区和脑室区。重要地,在本发明的方法中,具有所述多层结构的大脑皮质或其前体组织是自我组织的。由于表现出多层结构所需的培养时间可能取决于多能干细胞的动物物种、wnt信号抑制剂和tgfβ信号抑制剂的种类等而变化,其通常不能指定。然而,当使用人多能干细胞时,例如,第二培养步骤进行不少于52天。通常,边缘区包含reelin阳性的cajal-retzius细胞和层粘连蛋白。皮质板包括tbr1阳性的ctip2阳性的深层皮质板,和包含表达satb2的神经元的表层皮质板,并且所述表层皮质板与边缘区接触。当皮质前体组织的分化还没有充分进行时,可能不能清楚地形成表层皮质板;然而,当所述分化充分进行时(例如,在不少于73天的第二培养步骤后),清楚地形成深层皮质板和表层皮质板。底板在紧接皮质板的下方形成,并且包含具有许多神经突的钙网膜蛋白阳性的和map2阳性的细胞。中间区是在脑室下区与皮质板之间的层,并且具有稀少的细胞。脑室下区特征在于是tbr2阳性的。脑室区特征在于是sox2阳性的和pax6阳性的。在一个实施方案中,进行第二培养步骤直到在细胞团聚体中大脑皮质组织或其前体组织表现出从表层部分到深层部分包含边缘区、表层皮质板、深层皮质板、底板、中间区、外脑室下区、脑室下区和脑室区的多层结构(例如,不少于73天)。所述多层结构体内见于人妊娠中期三个月期间的大脑皮质中。
有趣的是,当在本发明的方法中使用人多能干细胞时,在外脑室下区(osvz)中包含磷酸化的波形蛋白阳性的、tbr2阴性的、sox2阳性的、pax6阳性的神经干细胞/前体细胞。神经干细胞/前体细胞具有与外侧放射状胶质细胞(org)相同的特征,所述外侧放射状胶质细胞(org)在人胎儿大脑皮质中丰富存在,但在小鼠大脑皮质中几乎不存在。因此,按照本发明,可以在体外重现人特有的现象,即,在外脑室下区出现org样细胞。
重要地,在本发明的方法中,自发形成大脑皮质的背-腹和前-后轴。在一个实施方案中,例如,在第二培养步骤中获得的细胞团聚体中包含的皮质脑室区中,背尾侧标记(couptf1,lhx2等)的表达表现出在一侧较强而在相对一侧较弱的梯度,并且腹吻侧标记(例如,sp8)的表达表现出与背尾侧标记的梯度模式相反的梯度模式。备选地,在一个实施方案中,在与表达皮质缘标记(例如,zic1,otx2)的区域相邻处形成皮质脑室区中强表达背尾侧标记(例如,couptf1,lhx2)的区域。
团聚体的悬浮培养可以在存在或不存在饲养细胞的情况下进行,只要可以通过本发明的方法进行从多能干细胞到端脑或其部分组织或其前体组织的分化诱导即可。为了避免不确定的因子的污染,团聚体的悬浮培养优选地在不存在饲养细胞的情况下进行。
在本发明的方法中,用于团聚体的悬浮培养的培养容器没有特别限制。所述培养容器包括,例如,烧瓶、组织培养烧瓶、皿、培养皿、组织培养皿、多联培养皿、微板、微孔板、微孔、多联平板、多孔板、室载玻片、培养皿、管、托盘、培养袋和旋转瓶。为了能够在非粘附条件下培养,培养容器优选是非细胞粘附性的。可用的非细胞粘附性的培养容器包括其表面已经被人工处理成细胞不粘附的培养容器,其表面没有进行提高细胞粘附性的人工处理(例如,用胞外基质等的包被处理)的培养容器等。
作为用于悬浮培养团聚体的培养容器,可以使用透氧性培养容器。使用透氧性培养容器,可以改善向团聚体的氧供应,由此有助于脑室区的长期维持培养。特别地,在第二培养步骤中,由于细胞团聚体可能在尺寸上变大从而引起不能向团聚体内的细胞(例如,脑室区中的细胞)充分供氧的风险,所以优选使用透氧性培养容器。
在团聚体的悬浮培养中,团聚体可以进行静置培养,或可以通过旋转培养或摇动培养而故意移动,只要能够维持团聚体与培养容器的非粘附状态即可。然而,通过旋转培养或摇动培养而故意移动团聚体不是必要的。在一个实施方案中,在本发明的方法中的悬浮培养通过静置培养进行。静置培养是指用于在不故意移动团聚体的状态下培养团聚体的培养方法。可能发生的是,团聚体例如由于培养基随着培养基温度的局部变化对流而移动。然而,由于没有故意移动团聚体,所以此种情形也包括在本发明的静置培养中。静置培养可以在整个悬浮培养期间、或仅在部分时间进行。例如,静置培养可以在上文提及的第一培养步骤和第二培养步骤中的任一个中进行。在优选的实施方案中,静置培养可以在整个悬浮培养期间进行。静置培养不需要装置,并且预计对细胞团聚体造成的损伤较小,并且,由于培养基的量可以是少的,而是有利的。
在优选的实施方案中,在包含wnt信号抑制剂和tgfβ信号抑制剂的培养基中悬浮培养多能干细胞团聚体的性质均一的群体。使用多能干细胞团聚体的性质均一的群体,可以将团聚体之间向端脑或其部分结构或其前体组织的分化水平的差异抑制到最小,并且可以提高目标分化诱导的效率。多能干细胞团聚体的性质均一的群体的悬浮培养包括下述实施方案。
(1)准备多个培养区室,并且接种多能干细胞团聚体的性质均一的群体,以使一个培养区室中包含一个多能干细胞团聚体(例如,在96孔板的每个孔中放置一个多能干细胞团聚体)。在每个培养区室中,在包含wnt信号抑制剂和tgfβ信号抑制剂的培养基中悬浮培养一个多能干细胞团聚体。
(2)接种多能干细胞团聚体性质均一的群体,以使一个培养区室中包含多个多能干细胞团聚体(例如,在10cm皿中放置多个多能干细胞团聚体)。在培养区室中,在包含wnt信号抑制剂和tgfβ信号抑制剂的培养基中悬浮培养多个多能干细胞团聚体。
可以使用实施方案(1)和(2)中的任一个用于本发明的方法,并且在培养过程中可以改变实施方案(从实施方案(1)变为实施方案(2),或从实施方案(2)变为实施方案(1))。在一个实施方案中,在第一培养步骤使用(1)的实施方案,并且在第二培养步骤使用(2)的实施方案。
如前文提及的,由于在本发明的方法中在细胞团聚体中诱导了端脑的自我组织,所以包含在所述细胞团聚体中的端脑或其部分组织或其前体组织的分化阶段随着时间进展而进行。因此,优选地,根据目标端脑或其部分组织或其前体组织,适当地调节培养时间和培养条件。在下述(4)-(11)中,阐释本发明的一个实施方案,其是示例本发明,并不是限制本发明。(4)诱导脉络丛
在本发明方法的第二培养步骤中,在存在wnt信号增强剂和骨形态发生因子信号转导途径激活物质的情况下,进行悬浮培养,由此可以在细胞团聚体中诱导脉络丛或其前体组织。
wnt信号增强剂没有特别限制,只要在用于上文提及的方法中时,能够诱导脉络丛或其前体组织即可。例如,可以提及gsk-3β抑制剂,重组wnt3a,wnt激动剂(化合物),dkk(wnt抑制蛋白的抑制剂),r-spondin等。gsk-3β抑制剂的实例包括chir99021(6-[[2-[[4-(2,4-二氯苯基)-5-(5-甲基-1h-咪唑-2-基)-2-嘧啶基]氨基]乙基]氨基]-3-吡啶甲腈),肯帕罗酮(kenpaullone),6-溴靛玉红-3’-肟(bio)等。wnt信号增强剂优选地是gsk-3β抑制剂,更优选地是chir99021。
当用于上文提及的方法中时,wnt信号增强剂的浓度没有特别限制,只要能够诱导脉络丛或其前体组织即可。当使用chir99021时,其通常为约0.1μm–30μm,优选地约1μm–10μm(例如,3μm)。
在本说明书中,所述骨形态发生因子信号转导途径激活物质是激活当骨形态发生因子与受体结合后传递信号的途径的任意物质。骨形态发生因子信号转导途径激活物质的实例包括bmp2,bmp4,bmp7,gdf5等。优选地,所述骨形态发生因子信号转导途径激活物质是bmp4。尽管在下文中主要描述bmp4,但是用于本发明的骨形态发生因子信号转导途径激活物质不限于bmp4。bmp4是一种已知的细胞因子,并且其氨基酸序列也是已知的。用于本发明的bmp4是哺乳动物bmp4。哺乳动物的实例包括实验动物如啮齿动物如小鼠、大鼠、仓鼠、豚鼠等,兔等;家养动物,如猪、牛、山羊、马、绵羊等;伴生动物,如狗、猫等;和灵长类动物,如人、猴、猩猩、黑猩猩等。bmp4优选地是啮齿动物(小鼠、大鼠等)或灵长类动物(人等)的bmp4,最优选地是人bmp4。人bmp4意指具有在人体中天然表达的bmp4的氨基酸序列的bmp4。人bmp4代表性的氨基酸序列的实例包括ncbi登记号np_001193.2(2013年6月15日更新),np_570911.2(2013年6月15日更新),np_570912.2(2013年6月15日更新),通过从这些氨基酸序列中的每一个去除n-端信号序列(1-24)获得的氨基酸序列(成熟形式的人bmp4氨基酸序列),等等。
骨形态发生因子信号转导途径激活物质在培养基中的浓度可以在能够在团聚体中诱导多能干细胞向脉络丛或其前体组织分化的范围内适当地确定。当使用bmp4作为骨形态发生因子信号转导途径激活物质时,其浓度通常为0.05-10nm,优选地0.1–2.5nm(例如,0.5nm)。
在优选的实施方案中,用于向脉络丛或其前体组织诱导的培养基可以包含n2补充剂、chemicallydefinedlipidconcentrate、血清和肝素。
不需要在第二培养步骤中直到诱导成脉络丛或其部分组织的整个期间进行在包含wnt信号增强剂和骨形态发生因子信号转导途径激活物质(bmp4等)的培养基中的培养,并且仅需要在部分期间进行。例如,从第二培养步骤开始起不少于3天的在包含wnt信号增强剂和骨形态发生因子信号转导途径激活物质(bmp4等)的培养基中的悬浮培养足以诱导脉络丛或其前体组织,然后,可以在将培养基更换成不含wnt信号增强剂和骨形态发生因子信号转导途径激活物质(bmp4等)的培养基后继续悬浮培养。
此处,由于在包含wnt信号增强剂和骨形态发生因子信号转导途径激活物质(bmp4等)的培养基中的培养时间变长,可以诱导向脉络丛的选择性分化(即,在相同的细胞团聚体中不容易发生向除脉络丛以外的端脑组织(例如,大脑皮质,海马)的分化)。在一个实施方案中,可以在不少于80%的细胞团聚体群体中诱导脉络丛或其前体组织。在另一方面,当在包含wnt信号增强剂和骨形态发生因子信号转导途径激活物质(bmp4等)的培养基中的培养时间短时,在相同的细胞团聚体中容易发生向除脉络丛之外的端脑组织(例如,大脑皮质,海马)的分化,并且可以获得包含脉络丛或其前体组织以及在相同的细胞团聚体中的大脑皮质或其前体组织和/或海马或其前体组织的细胞团聚体(下文描述)。
诱导成脉络丛组织可以使用脉络丛标记(例如,ttr,lmx1a,otx2等)的表达、端脑标记(foxg1等)的不表达或褶皱的单层上皮的形态作为指标进行验证。诱导成脉络丛组织所需要的时间取决于培养条件以及多能干细胞来源的哺乳动物的种类而变化,并且通常不能指定。然而,当使用人多能干细胞时,例如,到从第二培养步骤开始起的第24天,在团聚体内部诱导出脉络丛组织。通过选择被证实具有由所获得的多个细胞团聚体诱导的脉络丛或其前体组织的细胞团聚体,可以获得包含脉络丛或其前体组织的细胞团聚体。
(5)诱导海马
在本发明方法的第二培养步骤中,在存在wnt信号增强剂的情况下进行悬浮培养,由此可以在细胞团聚体中诱导海马或其前体组织(皮质缘等)。
wnt信号增强剂没有特别限制,只要在用于上文提及的方法中时,能够诱导海马或其前体组织即可。例如,可以提及gsk-3β抑制剂,重组wnt3a,wnt激动剂(化合物),dkk(wnt抑制蛋白的抑制剂),r-spondin等。gsk-3β抑制剂的实例包括chir99021(6-[[2-[[4-(2,4-二氯苯基)-5-(5-甲基-1h-咪唑-2-基)-2-嘧啶基]氨基]乙基]氨基]-3-吡啶甲腈),肯帕罗酮,6-溴靛玉红-3’-肟(bio)等。wnt信号增强剂优选地是gsk-3β抑制剂,更优选地是chir99021。
当用于上文提及的方法中时,wnt信号增强剂的浓度没有特别限制,只要能够诱导海马或其前体组织即可。当使用chir99021时,其通常为约0.1μm–30μm,优选地约1μm–10μm(例如,3μm)。
在优选的实施方案中,用于向海马或其前体组织诱导的培养基可以包含n2补充剂、chemicallydefinedlipidconcentrate、血清和肝素。
不需要在第二培养步骤中在直到诱导成海马或其部分组织的整个期间进行在包含wnt信号增强剂的培养基中的培养,并且仅需要在部分期间内进行。例如,从第二培养步骤开始起不少于3天的在包含wnt信号增强剂的培养基中悬浮培养足以诱导海马或其前体组织,然后,可以在将培养基更换成不含wnt信号增强剂的培养基后继续悬浮培养。
此处,由于在包含wnt信号增强剂的培养基中的培养时间变长,所以可以诱导向海马的选择分化(即,在相同的细胞团聚体中不容易发生向除海马之外的端脑组织(例如,大脑皮质,脉络丛)的分化)。在一个实施方案中,可以在不少于80%的细胞团聚体群体中诱导海马或其前体组织。在另一方面,当在包含wnt信号增强剂的培养基中的培养时间短时,在相同的细胞团聚体中容易发生向除海马之外的端脑组织(例如,大脑皮质,脉络丛)的分化,并且可以获得包含海马组织或其前体组织以及在相同的细胞团聚体中的大脑皮质或其前体组织和/或脉络丛或其前体组织的细胞团聚体。
在一个实施方案中,用于向海马或其前体组织诱导的培养基不包含骨形态发生因子信号转导途径激活物质(bmp4等)。使用不含骨形态发生因子信号转导途径激活物质(bmp4等)的培养基,抑制向脉络丛的分化诱导,并且选择性诱导成海马组织或其前体组织变得可能。
在另一个实施方案中,用于向海马或其前体组织诱导的培养基可以包含骨形态发生因子信号转导途径激活物质(bmp4等)。在该情形中,分化的海马选择性下降,而在相同的细胞团聚体中容易发生向除海马之外的端脑组织(例如,脉络丛)的分化。
海马或其前体组织的诱导可以使用皮质缘标记(lmx1a,otx2等)的表达和端脑标记(foxg1等)的表达作为指标进行验证。诱导成海马或其前体组织所需要的时间取决于培养条件以及多能干细胞来源的哺乳动物的种类而变化,并且通常不能指定。然而,当使用人多能干细胞时,例如,到从第二培养步骤开始起的第24天,在团聚体内部诱导出海马或其前体组织。通过选择被证实具有由所获得的多个细胞团聚体诱导的海马或其前体组织的细胞团聚体,可以获得包含海马或其前体组织的细胞团聚体。
(6)诱导脉络丛、海马前体组织和皮质前体组织
在本发明方法的第二培养步骤中,在存在wnt信号增强剂和骨形态发生因子信号转导途径激活物质的情况下短暂进行悬浮培养,由此可以在一个细胞团聚体内诱导脉络丛(或其前体组织)、海马(或前体组织)和大脑皮质(或其前体组织)。
即,在第二培养步骤中,在存在wnt信号增强剂和骨形态发生因子信号转导途径激活物质的情况下进行悬浮培养,并且将得到的细胞团聚体在不存在wnt信号增强剂和骨形态发生因子信号转导途径激活物质的情况下进一步培养。结果,在包含在所得到的细胞团聚体中的连续的神经上皮中形成脉络丛(或其前体组织)、海马组织(或前体组织)和大脑皮质组织(或其前体组织)。在一个实施方案中,可以在不少于80%的细胞团聚体群体中的连续的神经上皮中诱导脉络丛(或其前体组织)、海马组织(或前体组织)和大脑皮质组织(或其前体组织)。
尽管不被理论束缚,由于包括通过用wnt信号增强剂和骨形态发生因子信号转导途径激活物质处理形成脉络丛组织和除去这些因子(通过添加促进,并且通过除去回弹(rebound))(诱导-逆转方法)的一系列的操作,被称为组织者活性(organizeractivity)的信号可以流动,并且可以实现脉络丛组织、皮质缘、齿状回组织和阿蒙角组织的适当的自我组织。
wnt信号增强剂没有特别限制,只要在用于上文提及的方法中时,能够在一个细胞团聚体中诱导脉络丛(或其前体组织)、海马(或前体组织)和大脑皮质(或其前体组织)即可,并且例如,可以提及gsk-3β抑制剂,重组wnt3a,wnt激动剂(化合物),dkk(wnt抑制蛋白的抑制剂),r-spondin等。gsk-3β抑制剂的实例包括chir99021,肯帕罗酮,6-溴靛玉红-3’-肟(bio)等。wnt信号增强剂优选地是gsk-3β抑制剂,更优选地是chir99021。
wnt信号增强剂的浓度没有特别限制,只要当用于上文提及的方法中时,能够在一个细胞团聚体中诱导脉络丛(或其前体组织)、海马(或前体组织)和大脑皮质组织(或其前体组织)即可。当使用chir99021时,其通常为约0.1μm–100μm,优选地约1μm–30μm(例如,3μm)。
骨形态发生因子信号转导途径激活物质的实例包括bmp2,bmp4,bmp7,gdf5等。优选地,骨形态发生因子信号转导途径激活物质是bmp4。
骨形态发生因子信号转导途径激活物质在培养基中的浓度没有特别限制,只要在用于上文提及的方法中时能够在一个细胞团聚体中诱导脉络丛(或其前体组织)、海马(或前体组织)和大脑皮质(或其前体组织)即可。当使用bmp4作为骨形态发生因子信号转导途径激活物质时,其浓度通常为0.05-10nm,优选地0.1-2.5nm(例如,0.5nm)。
在优选的实施方案中,用于本方法第二培养步骤的培养基可以包含n2补充剂、chemicallydefinedlipidconcentrate、血清和肝素。
由于在包含wnt信号增强剂和骨形态发生因子信号转导途径激活物质(bmp4等)的培养基中的培养时间取决于培养条件以及多能干细胞所来源的哺乳动物的种类而变化,并且通常是不能指定的。然而,当使用人多能干细胞时,其通常为1–7天,优选地2-4天(例如,3天)。
由于在去除wnt信号增强剂和骨形态发生因子信号转导途径激活物质(bmp4等)后的培养时间取决于培养条件以及多能干细胞所来源的哺乳动物的种类而变化,并且通常是不能指定的。然而,当使用人多能干细胞时,其通常不少于10天,优选地不少于14天。
在一个细胞团聚体中连续形成脉络丛(或其前体组织)、海马(或前体组织)和大脑皮质组织(或其前体组织)可以使用各组织的标记的表达作为指标进行验证。例如,以与体内相似的相互邻接的构型在相同的神经上皮上连续形成lmx1a阳性且foxg1阴性的脉络丛区、表达lmx1a和otx2的foxg1弱阳性的皮质缘区、lef1阳性且foxg1阳性的海马前体组织区和lef1阴性且foxg1阳性的皮质前体组织。
通过从所得到的细胞团聚体群体选择其中在连续的神经上皮中形成脉络丛(或其前体组织)、海马(或前体组织)和大脑皮质(或其前体组织)的细胞团聚体,可以获得目标细胞团聚体。
(7)海马组织中各区的连续立体形成
与(6)相似,在本发明方法的第二培养步骤中,在存在wnt信号增强剂和骨形态发生因子信号转导途径激活物质的情况下短暂进行悬浮培养,由此可以在一个细胞团聚体中诱导连续包含齿状回组织(或其前体组织)和阿蒙角组织(或其前体组织)的海马组织或其前体组织。从多能干细胞分化阿蒙角组织(或其前体组织)在此前尚未报道过。
即,在第二培养步骤,在存在wnt信号增强剂和骨形态发生因子信号转导途径激活物质的情况下进行悬浮培养,并且将得到的细胞团聚体在不存在wnt信号增强剂和骨形态发生因子信号转导途径激活物质的情况下在高氧分压条件下进一步培养。结果,在所得到的细胞团聚体中的连续的神经上皮中形成包含齿状回组织(或其前体组织)和阿蒙角组织(或其前体组织)的海马组织或其前体组织。另外,作为培养的结果,可以获得包含阿蒙角组织(或其前体组织)的细胞团聚体。
尽管不被理论束缚,由于包括通过用wnt信号增强剂和骨形态发生因子信号转导途径激活物质处理形成脉络丛组织和去除这些因子(通过添加促进,并且通过去除回弹(rebound))(诱导-逆转方法)的一系列的操作,被称为组织者活性的信号可以流动,并且可以实现脉络丛组织、皮质缘、齿状回组织和阿蒙角组织的适当的自我组织。
wnt信号增强剂没有特别限制,只要在用于上文提及的方法中时,能够在一个细胞团聚体中诱导齿状回组织(或其前体组织)和阿蒙角组织(或其前体组织)即可,并且例如可以提及gsk-3β抑制剂,重组wnt3a,wnt激动剂(化合物),dkk(wnt抑制蛋白的抑制剂),r-spondin等。gsk-3β抑制剂的实例包括chir99021,肯帕罗酮,6-溴靛玉红-3’-肟(bio)等。wnt信号增强剂优选地是gsk-3β抑制剂,更优选地是chir99021。
wnt信号增强剂的浓度没有特别限制,只要当用于上文提及的方法中时,能够在一个细胞团聚体中诱导齿状回组织(或其前体组织)和阿蒙角组织(或其前体组织)即可。当使用chir99021时,其通常为约0.1μm–30μm,优选地约1μm–10μm(例如,3μm)。
骨形态发生因子信号转导途径激活物质的实例包括bmp2,bmp4,bmp7,gdf5等。优选地,骨形态发生因子信号转导途径激活物质是bmp4。
骨形态发生因子信号转导途径激活物质在培养基中的浓度没有特别限制,只要在用于上文提及的方法中时能够在一个细胞团聚体中诱导齿状回组织(或其前体组织)和阿蒙角组织(或其前体组织)即可。当使用bmp4作为骨形态发生因子信号转导途径激活物质时,其浓度通常为0.05-10nm,优选地0.1-2.5nm(例如,0.5nm)。
在优选的实施方案中,用于本方法第二培养步骤的培养基可以包含n2补充剂、chemicallydefinedlipidconcentrate、血清和肝素。
在另一个优选的实施方案中,用于本方法第二培养步骤的培养基可以包含b27补充剂、l-谷氨酰胺和血清。
由于在包含wnt信号增强剂和骨形态发生因子信号转导途径激活物质(bmp4等)的培养基中的培养时间取决于培养条件以及多能干细胞所来源的哺乳动物的种类而变化,并且通常是不能指定的。然而,当使用人多能干细胞时,其通常为1–7天,优选地2-4天(例如,3天)。
由于去除wnt信号增强剂和骨形态发生因子信号转导途径激活物质(bmp4等)后的培养时间取决于培养条件以及多能干细胞所来源的哺乳动物的种类而变化,并且通常是不能指定的。然而,当使用人多能干细胞时,其通常不少于40天,优选地不少于51天。
在一个细胞团聚体中连续形成齿状回组织(或其前体组织)和阿蒙角组织(或其前体组织)可以使用各组织的标记的表达作为指标进行验证。例如,齿状回组织(或其前体组织)可以通过是lef1(海马前体组织标记)阳性、zbtb20阳性、prox1阳性等而被指示。阿蒙角(或其前体组织)可以通过是lef1(海马前体组织标记)阳性、zbtb20弱阳性等而被指示。
在一个实施方案中,除了齿状回组织(或其前体组织)和阿蒙角组织(或其前体组织),通过本发明的方法获得的细胞团聚体在所述细胞团聚体中的连续的神经上皮中还包含皮质缘。即,可以在连续的神经上皮中诱导包含齿状回组织(或其前体组织)、阿蒙角组织(或其前体组织)和皮质缘的海马组织或其前体组织。
在一个实施方案中,通过本发明的方法得到的细胞团聚体表现出表达强度梯度,其中,在lef1阳性神经上皮中,在邻近脉络丛(lmx1a阳性,foxg1阴性)或皮质缘(lmx1a阳性,foxg1弱阳性)的区域的部分(齿状回组织或其前体组织)中zbtb20的表达较强,而当所述部分远离所述区域时,zbtb20的表达变弱。
在另一个实施方案中,齿状回组织或其前体组织(例如,zbtb20阳性,prox1阳性)在阿蒙角组织或其前体组织(例如,zbtb20弱阳性)和皮质缘与脉络丛之间形成。即,齿状回组织(或其前体组织)、阿蒙角组织(或其前体组织)和皮质缘以与体内相似的相互邻接的位置在神经上皮中连续形成。
通过从得到的细胞团聚体群体中选择其中在连续的神经上皮中形成齿状回组织(或其前体组织)和阿蒙角组织(或其前体组织)的细胞团聚体,可以获得目标细胞团聚体。
(8)诱导基底神经节组织
在本发明的方法中,用sonichedgehog(shh)信号激动剂处理细胞团聚体,由此可以在所述细胞团聚体中诱导基底神经节或其前体组织。
shh信号激动剂没有特别限制,只要当用于上文提及的方法中时能够诱导基底神经节组织或其前体组织即可。例如,可以提及属于hedgehog家族的蛋白质(例如,shh),shh受体激动剂,purmorphamine,sag(n-甲基-n’-(3-吡啶基苄基)-n’-(3-氯苯并[b]噻吩-2-羰基)-1,4-二氨基环己烷)等。shh信号激动剂优选是sag。
shh信号激动剂的浓度没有特别限制,只要当用于上文提及的方法中时能够诱导基底神经节组织或其前体组织即可。当使用sag时,其通常为1nm–10μm。
当以比较低的浓度(例如,1nm–75nm,优选地25nm–50nm)使用sag时,在端脑神经上皮上优先诱导基底神经节的外侧神经节隆起(lge)。另一方面,当以比较高的浓度(例如,100nm–10μm,优选地250nm–1μm)使用sag时,在端脑神经上皮上优先诱导基底神经节的内侧神经节隆起(mge)。
要进行shh信号激动剂处理的细胞团聚体优选是端脑标记阳性的细胞团聚体。shh信号激动剂处理(在包含shh信号激动剂的培养基中培养)可以仅在第一培养步骤和第二培养步骤中的一个步骤中进行或在两个步骤中都进行。在包含shh信号激动剂的培养基中的培养可以在直到诱导出基底神经节组织的整个期间进行或可以仅在部分时间进行。
在一个实施方案中,shh信号激动剂处理从第一培养步骤的后期阶段到第二培养步骤的初期阶段短暂进行3-10天(例如,7天),其中在细胞团聚体中表达端脑标记。
基底神经节或其前体组织的诱导可以使用基底神经节组织标记的表达作为指标进行验证。可以提及gsh2和gad65作为外侧神经节隆起(lge)标记。可以提及nkx2.1作为内侧神经节隆起(mge)标记。
诱导基底神经节或其前体组织所需要的时间取决于培养条件以及多能干细胞所来源的哺乳动物的种类而变化,并且通常不能指定。然而,当使用人多能干细胞时,例如,到从第二培养步骤开始起的第24天,在团聚体内部诱导出基底神经节或其前体组织。在一个实施方案中,可以在不少于70%的细胞团聚体群体中诱导基底神经节或其前体组织。通过选择被证实具有由所获得的多个细胞团聚体诱导的基底神经节或其前体组织的细胞团聚体,可以获得包含基底神经节或其前体组织的细胞团聚体。
在优选的实施方案中,在一个细胞团聚体中,由本发明的方法诱导的基底神经节(或其前体组织)(例如,lge,mge)与大脑皮质(或其前体组织)连续形成。即,在包含在所得到的细胞团聚体中的连续的神经上皮中形成基底神经节(或其前体组织)(例如,lge,mge)和大脑皮质(或其前体组织)。在一个实施方案中,能够在不少于50%的细胞团聚体群体中的连续的神经上皮中诱导基底神经节(或其前体组织)(例如,lge,mge)和大脑皮质(或其前体组织)。
(9)大脑皮质中轴形成的外源调节
如前文提及的,在本发明的方法中,大脑皮质的背-腹轴和前-后轴是自发形成的。在一个实施方案中,在包含在第二培养步骤中得到的细胞团聚体中的皮质脑室区中,背尾侧标记(couptf1,lhx2等)的表达表现出梯度:在一侧较强而在对侧较弱,并且吻侧标记(例如,sp8)的表达表现出与背尾侧标记相反的梯度模式。通过与已知对于获得大脑皮质的吻侧特异性重要的fgf8反应,整个大脑皮质脑室区可以被吻侧化(rostralized)。
fgf8处理可以通过在第二培养步骤中使用包含fgf8的培养基而进行。培养基中fgf的浓度是足以用于吻侧化的浓度,并且通常是10–1000ng/ml,优选地50–300ng/ml。
fgf8处理在整个或部分的第二培养步骤中进行。
整个大脑皮质脑室区的吻侧化可以基于整个脑室区上背尾侧标记(couptf1,lhx2等)的表达的全面减弱、吻侧标记(例如,sp8)的全面增加等进行验证。这表示这样的可能性,即通过fgf8处理可以选择性控制并诱导沿着大脑皮质的背-腹轴的额叶、枕叶等区域。
(10)诱导海马神经元
将通过前文提及的(5)-(7)中任一项的方法得到的包含海马或其前体组织的细胞团聚体分散,并且对分散的细胞进一步在体外进行粘附培养,由此可以获得成熟的海马神经元。本发明还提供这样的海马神经元制备方法。
在所述制备方法中,优选地使用通过前文提及的(7)的方法获得的包含海马或其前体组织的细胞团聚体(包含连续含有齿状回组织(或其前体组织)和阿蒙角组织(或其前体组织)的海马组织或其前体组织的细胞团聚体)。
将包含海马或其前体组织的细胞团聚体用适当的细胞解离溶液处理,并且分散为单细胞状态或接近单细胞状态。细胞解离溶液的实例包括包含螯合剂(如edta等)、蛋白酶(木瓜蛋白酶、胰蛋白酶、胶原酶iv、金属蛋白酶等)等的生理水溶液,它们被单独使用或以适当的组合使用。
将分散的细胞悬浮在适当的用于培养细胞的培养基中,并且接种在培养容器中。作为培养容器,可以使用通常用于细胞粘附培养的粘附培养容器。所述培养容器的实例包括,但不限于,schale,培养皿,烧瓶,多孔板,室载玻片等。
为了改善对细胞的粘附性,培养容器的表面可以用胞外基质或聚合物包被,所述胞外基质如层粘连蛋白、纤连蛋白、胶原、基膜制剂等,所述聚合物如聚-l-赖氨酸、聚-d-赖氨酸、聚-l-鸟氨酸等。在一个实施方案中,培养容器的表面用层粘连蛋白和纤连蛋白直接或间接包被。间接的包被可以例如通过以下方式进行:先用聚-l-赖氨酸包被培养容器表面以形成聚-l-赖氨酸内涂层,并且在所述内涂层上涂覆层粘连蛋白和纤连蛋白。
用于分散的细胞的粘附培养的培养基可以使用用于培养动物细胞(优选神经元)的培养基作为基础培养基而制备。基础培养基没有特别限制,只要其能够用于培养动物细胞(优选神经元)即可,并且可以是dmem,ham’sf-12,neurobasal,imdm,m199,emem,αmem,fischer’smedium,这些的混合的培养基等。优选地,使用neurobasal。
为了促进海马神经元的成熟,培养基优选地包含b27补充剂作为血清替代物。b27补充剂是已知的组合物,其包含生物素、l-肉碱、皮质甾酮、乙醇胺、d(+)半乳糖、还原的谷胱甘肽、亚油酸、亚麻酸、孕酮、腐胺、乙酸视黄酯、硒、三碘-l-甲腺原氨酸、维生素e,乙酸维生素e、牛清蛋白、过氧化氢酶、胰岛素、超氧化物歧化酶、转铁蛋白等。为了避免抑制海马神经元的成熟,优选使用不含维生素a的b27补充剂,其是排除了乙酸视黄酯的所述组合物。以促进海马神经元成熟的方式适当地确定加入的b27补充剂的量。
在一个实施方案中,为了促进海马神经元的成熟,培养基可以包含bdnf。当包含bdnf时,培养基中bdnf的浓度没有特别限制,只要促进海马神经元的成熟即可。其通常不少于1ng/ml,优选地不少于10ng/ml,更优选地不少于20ng/ml。bdnf浓度的上限没有特别限制,只要促进海马神经元的成熟即可。由于即使在过量加入bdnf时活性也是饱和的,所以浓度通常为不超过1000ng/ml,优选地不超过100ng/ml。bdnf优选是分离的。
在一个实施方案中,为了促进海马神经元的成熟,培养基可以包含nt-3。当包含nt-3时,培养基中nt-3的浓度没有特别限制,只要促进海马神经元的成熟即可。其通常不少于1ng/ml,优选地不少于10ng/ml,更优选地不少于20ng/ml。nt-3浓度的上限没有特别限制,只要促进海马神经元的成熟即可。由于甚至当过量加入nt-3时,活性也是饱和的,所以浓度通常为不超过1000ng/ml,优选地不超过100ng/ml。nt-3优选是分离的。
在一个实施方案中,培养基可以包含血清。血清可以有助于海马神经元的成熟。血清的实例包括,但不限于,fbs等。血清优选是失活的。培养基中血清的浓度可以在能够长期有助于脑室区的成熟培养的范围内适当地调节。其通常是1-20%(v/v)。
在一个实施方案中,培养基可以包含其他添加剂,只要没有对海马神经元的成熟有不利的影响即可。添加剂的实例包括,但不限于,胰岛素、铁源(例如,转铁蛋白等)、矿物质(例如,硒酸钠等)、糖类(例如,葡萄糖等)、有机酸(例如,丙酮酸、乳酸等)、血清蛋白(例如,清蛋白等)、氨基酸(例如,l-谷氨酰胺等)、还原剂(例如,2-巯基乙醇等)、维生素(例如,抗坏血酸、d-生物素等)、抗生素(例如,链霉素,青霉素,庆大霉素等)、缓冲剂(例如,hepes等)等。
在优选的实施方案中,用于分散的细胞的粘附培养的培养基包含b27补充剂。所述b27补充剂优选是不含维生素a的。培养基可以进一步包含fbs和l-谷氨酰胺。
在另一个优选的实施方案中,用于分散的细胞的粘附培养的培养基包含b27补充剂、bdnf和nt-3。b27补充剂优选地是不含维生素a的。培养基可以进一步包含fbs和l-谷氨酰胺。
为了抑制分散的细胞的细胞死亡,可以从粘附培养开始起加入rho相关性卷曲螺旋激酶(rock)的抑制剂。例如,从培养开始起的15天内,优选地10天内,更优选地6天内,加入rock抑制剂。rock抑制剂的实例包括y-27632((+)-(r)-反式-4-(1-氨基乙基)-n-(4-吡啶基)环己烷甲酰胺二盐酸盐)等。用于粘附培养的rock抑制剂的浓度是能够抑制细胞死亡的浓度。例如,对于y-27632,该浓度通常为约0.1-200μm,优选地约2-50μm。rock抑制剂的浓度可以在添加期内变化。例如,在所述时间的后期,浓度可以减半。
可以适当地设置粘附培养中的分散的细胞的其他培养条件,如培养温度、co2浓度等。培养温度没有特别限制,并且,例如为约30-40℃,优选地约37℃。co2浓度例如为约1-10%,优选地约5%。
在从粘附培养开始起的2–3天内,接种的细胞粘附到培养容器的表面,并且开始延伸神经突。
尽管分散的细胞的粘附培养的时间没有特别限制,只要其足以使分散的细胞分化为成熟的海马神经元即可,但其通常不少于50天,优选地不少于80天,更优选地不少于100天。
在一个实施方案中,进行分散的细胞的粘附培养,直到出现成熟的海马神经元。成熟的海马神经元的出现可以通过海马神经元特异性的标记来验证。例如,成熟的海马神经元是zbtb20和foxg1阳性的,并且可以指定为具有map2阳性树突的细胞。因此,在一个实施方案中,进行分散的细胞的粘附培养,直到证实出现zbtb20和foxg1阳性的并且具有map2阳性的树突的细胞。
上文提及的成熟的海马神经元包括海马齿状回颗粒细胞(prox1阳性的,具有圆形形状的比较小的细胞)和海马ca3区锥体细胞(ka1阳性的,比较大的细胞)。
除了海马神经元,还可以诱导zbtb20和gfap阳性的星形胶质细胞。本发明还提供星形胶质细胞的制备方法。
单分散的细胞容易形成小团块,并且神经突在诱导的成熟海马神经元间延伸。
由此诱导的成熟的海马神经元是功能性的,并且由于电位刺激而引起钠和钾电流响应、诱导的动作电位和/或自发的兴奋性突触后电流(sepsc)。这些神经活动可以使用膜片钳技术(patchclamptechnique)证实。
诱导的成熟的海马神经元还可以直接用于功能分析等,或者可以通过使用适当的细胞解离溶液与培养容器解离和分离。
(11)细胞团聚体、分离的端脑或其部分组织或其前体组织的用途
在另一方面,可以从按前文提及获得的细胞团聚体分离端脑或其部分组织或其前体组织。本发明提供通过前文提及的本发明的方法获得的细胞团聚体、端脑或其部分组织及其前体组织。在另一个实施方案中,本发明提供通过前文提及的本发明的方法获得的海马神经元。
通过本发明获得的细胞团聚体、端脑或其部分组织、其前体组织和海马神经元可以用于移植治疗。例如,通过本发明获得的细胞团聚体、端脑或其部分组织(大脑皮质,基底神经节,脉络丛,海马等)、其前体组织或海马神经元可以用作治疗药物用于由端脑(大脑皮质,基底神经节,脉络丛,海马等)障碍导致的疾病,或者用于补偿端脑(大脑皮质,基底神经节,脉络丛,海马等)损伤病症中的相应的损伤部分。通过向患有由端脑障碍引起的疾病或具有受损的端脑的患者移植通过本发明获得的细胞团聚体、端脑或其部分组织(大脑皮质,基底神经节,脉络丛,海马等)、或其前体组织或海马神经元,可以治疗由端脑障碍引起的疾病或端脑损伤。作为由端脑障碍引起的疾病,可以提及帕金森病(parkinson’sdisease),亨廷顿舞蹈病(huntingtonchorea),阿尔茨海默病(alzheimer’sdisease),缺血性脑病(ischemicbraindiseases)(例如,大脑卒中(cerebralapoplexy)),癫痫(epilepsy),脑外伤(braintrauma),运动神经元病(motorneurondisease),神经变性疾病(neurodegenerativedisease)等。作为需要补充这些细胞的病症,可以提及神经外科手术后(例如,脑瘤摘除后)的那些。
在移植治疗中,由于组织相容性抗原的差异导致的移植物排斥通常是成问题的,然而,该问题可以通过使用由移植接受者的体细胞建立的多能干细胞(例如,诱导的多能干细胞)而得到解决。即,在优选的实施方案中,使用从接受者的体细胞建立的多能干细胞(例如,诱导的多能干细胞)作为本发明的方法中的多能干细胞,并且产生对所述接受者来说在免疫学上属于自身的端脑或其部分组织、或其前体组织或海马神经元并将其移植到所述接受者中。
此外,通过本发明得到的细胞团聚体、端脑或其部分组织或其前体组织、或海马神经元可以用于药物的筛选和评价。具体地,由于通过本发明得到的端脑或其部分组织或其前体组织具有与体内的端脑或其部分组织或前体组织极度相似的高级结构,其可以用于筛选用于由端脑障碍引起的疾病和损伤的端脑的治疗性药物、药物产品的副作用和毒性试验(例如,角膜刺激试验的替代试验)和开发用于端脑疾病的新治疗方法等。
下文通过参照下述实施例更详细地阐释本发明,所述实施例仅是示例性的,并不限制本发明的范围。
实施例
[实施例1]
由人多能干细胞选择性立体形成皮质前体组织
(方法)
通过胰蛋白酶处理,将人es细胞(khes-1;将荧光蛋白基因venus敲入到端脑特异性基因foxg1中)分散成单个细胞,并且按照sfebq方法(nakano等,cellstemcell,2012),形成团聚体,并且在37℃在存在5%co2的条件下进行悬浮团聚体培养,以用于分化诱导。将分散的9000个人es细胞接种在v底96孔板的每个孔中,所述板涂覆有低细胞吸附性的表面涂层,并且使用添加有20%ksr(knockoutserumreplacement)、0.1mm非必需氨基酸溶液(gibco/invitrogen),1mm丙酮酸钠溶液(sigma)和0.1mm2-巯基乙醇的不含生长因子的g-mem培养基(gibco/invitrogen)作为用于分化诱导的培养基。为了抑制分散引起的细胞死亡,在分化诱导的前3天加入20μmrock抑制剂y-27632,并且在接下来的3天将其浓度减半。在开始分化诱导后的第0天到第18天,加入wnt信号抑制剂iwr-1-end(3μm)和tgfβ信号抑制剂sb431542(5μm)并允许反应。在从分化诱导开始起的第18天,将这些团聚体转移到涂覆了低细胞粘附性表面涂层的9cm培养皿中,并且在37℃在存在5%co2、40%o2的条件下进行悬浮培养。从第18天到第35天,使用添加有1%n2补充剂(gibco/invitrogen)和1%脂质浓缩物(chemicallydefinedlipidconcentrate,gibco/invitrogen)的dmem/f12培养基(gibco/invitrogen)。从第35天起,使用进一步添加有10%fbs、5μg/ml肝素和1%生长因子减少的matrigel(bdbioscience)的培养基。在从分化诱导开始起的第1天和第34天分析团聚体,并且在第42天通过免疫组织染色进行分析。
(结果)
从分化诱导开始起18天后,在团聚体中观察到强foxg1::venus荧光。从分化诱导开始起26天后,在不少于90%的团聚体中以良好的重现性观察到强foxg1::venus荧光(图1a)。从分化诱导开始起的34天后,在75%的总细胞中观察到foxg1::venus的荧光。所有的团聚体都是foxg1::venus阳性的(图1b)。foxg1::venus阳性团聚体包含在内部具有脑室样腔的半球神经上皮样结构(假复层柱状上皮)。所述神经上皮结构在内腔侧具有对pax6和sox2为阳性的细胞高度密集的细胞层(图1d和e),而在其最内部发现处于有丝分裂的磷酸化组蛋白h3阳性的细胞(图1f)。这些结构与妊娠头三个月中的皮质脑室区相似。在脑室区样细胞层外表达有丝分裂后神经元标记tuj1和早期皮质板标记ctip2和tbr1。它们包含reelin阳性的cajal-retzius细胞,其是大脑皮质第i层和邻近表面的富含层粘连蛋白的层中的神经元。因此,清楚的是,在培养的团聚体中形成了皮质前体组织。以良好的重现性观察到所述在人妊娠头三个月中的皮质前体组织的自我组织。
[实施例2]
由人多能干细胞立体形成基底神经节前体组织
(方法)
至分化诱导的第35天,在与实施例1相似的培养条件下培养细胞。即,将人es细胞团聚体在v底96孔板中培养达分化诱导后18天,将悬浮的团聚体转移到非细胞粘附性培养皿(直径为6cm)中,并且从分化诱导的第18天至第35天在37℃在5%co2、40%o2的存在下进行悬浮培养。然而,仅在第15天至第21天期间向实施例1的培养基中以30nm或500nm的终浓度加入sonichedgehog(shh)信号激动剂sag,并允许反应。在第35天通过免疫组织染色分析团聚体。
(结果)
当30nmshh信号激动剂sag反应时,在foxg1::venus阳性的端脑神经上皮中形成表达gsh2的外侧神经节隆起(lge)(图2a,b中的箭头)。在这些条件下,在不少于70%的团聚体中以良好的重现性观察到gsh2阳性的lge神经上皮。胎儿lge产生纹状体神经元,其是gaba能性神经元。类似地,在来源于人es细胞的lge神经上皮下方观察到gad65阳性的gaba能性神经元(图2b)。
另一方面,当将500nm的shh信号激动剂sag反应时,在团聚体中的foxg1::venus阳性的端脑神经上皮形成表达nkx2.1的内侧神经节隆起(mge)(图2c,d)。在这些条件下,在不少于80%的团聚体中以良好的重现性观察到foxg1::venus阳性和nkx2.1阳性的mge神经上皮。在胎儿脑中,mge是苍白球和皮质中间神经元的前体组织。这表明,本发明的培养方法能够高效地诱导基底神经节前体组织lge和mge。
[实施例3]
大脑皮质和基底神经节的连续立体形成
(方法)
至分化诱导的第35天,在与实施例2相似的培养条件下培养细胞。即,将人es细胞团聚体在v底96孔板中培养达分化诱导后18天,将悬浮的团聚体转移到非细胞粘附性的培养皿(直径为9cm)中,并且从分化诱导的第18天至第35天在37℃在5%co2、40%o2的存在下进行悬浮培养。然而,仅在分化诱导的第15天-第21天期间,向培养基中以30nm的终浓度加入shh信号激动剂sag。在第35天通过免疫组织染色分析团聚体。
(结果)
如在实施例2中所示,当将30nm的shh信号激动剂sag反应时,端脑神经上皮是foxg1::venus阳性的,并且表达外侧神经节隆起(lge)标记gsh2,gad65(图3a,b)。lge神经上皮与gsh2阴性的、大脑皮质标记pax6阳性的皮质神经上皮连续形成(图3c)。这些结果表明,在一个团聚体中连续形成大脑皮质和基底神经节。在不少于50%的团聚体中以良好的重现性观察到在一个团聚体中大脑皮质和基底神经节的此种连续的自我形成。
[实施例4]
由人多能干细胞选择性立体形成脉络丛组织
(方法)
在实施例1的培养条件下在v底96孔板中培养达分化诱导后18天后,将悬浮的团聚体转移到非细胞粘附性的培养皿(直径为9cm)中,并且在37℃在5%co2、40%o2的存在下进行悬浮培养。从第18天到第42天,用于培养的培养基是添加有1%n2补充剂(gibco/invitrogen)、1%脂质浓缩物(chemicallydefinedlipidconcentrate,gibco/invitrogen)、10%fbs、5μg/ml肝素、3μmgsk-3β抑制剂chir99021和0.5nmbmp4的dmem/f12培养基(gibco/invitrogen),并且在第42天通过免疫组织染色分析团聚体。
(结果)
当在上文提及的条件下培养时,甚至在从分化诱导开始起的18天后,在团聚体中也没有观察到强的bf1(foxg1)::venus荧光。由于这些团聚体形成褶皱的单层上皮并且表达脉络丛标记ttr,lmx1a,otx2(图4a,b),因此,认为已经诱导了脉络丛组织。在不少于80%的团聚体中以良好的重现性观察到在这些条件下脉络丛组织的自我形成。
[实施例5]
由人多能干细胞选择性形成皮质缘(海马伞(fimbrial)前体组织)
(方法)
将细胞团聚体在v底96孔板中在实施例1的培养条件下培养至分化诱导的第18天,然后将悬浮的团聚体转移到非细胞粘附性培养皿(直径为9cm)中,并且在37℃在5%co2、40%o2的存在下进行悬浮培养。从第18天至第42天,用于培养的培养基是添加有1%n2补充剂(gibco/invitrogen)、1%脂质浓缩物(chemicallydefinedlipidconcentrate,gibco/invitrogen)、10%fbs、5μg/ml肝素、3μmgsk-3β抑制剂chir99021(wnt信号增强剂)的dmem/f12培养基(gibco/invitrogen),并且在第42天通过免疫组织染色分析团聚体。
(结果)
如前文提及的,当从第18天起在具有增强的wnt信号的条件下培养时,形成主要包含表达皮质缘标记lmx1a、otx2并且是foxg1::venus弱阳性的神经上皮的团聚体(图5a,b)。所述神经上皮不表达脉络丛标记ttr(图5a)。从所述标记表达模式来看,认为在这些条件下已经选择性地诱导了海马伞前体组织皮质缘。在不少于80%的团聚体中以良好的重现性观察到在这些条件下的皮质缘的选择性形成。
[实施例6]
脉络丛、海马前体组织和皮质前体组织的连续空间形成
(方法)
将人es细胞团聚体在v底96孔板中在实施例1的培养条件下培养达分化诱导后18天。然后,将悬浮的团聚体转移到非细胞粘附性的培养皿(直径为9cm)中,并且在37℃在5%co2、40%o2的存在下进行悬浮培养。从第18天至第35天,用于培养的培养基是添加有1%n2补充剂(gibco/invitrogen)、1%脂质浓缩物(chemicallydefinedlipidconcentrate,gibco/invitrogen)、10%fbs和5μg/ml肝素的dmem/f12培养基(gibco/invitrogen)。然而,仅在从第18天至第21天期间向培养基中添加3μmgsk-3β抑制剂chir99021和0.5nmbmp4,并且允许反应。尽管这些物质促进向脉络丛和皮质缘的分化,如实施例4和5所示,但是,在实施例6的培养中,它们的作用限于3天,并且从第21天起从培养基中将其去除。在第35天,通过免疫组织染色分析这些团聚体。
(结果)
如前文提及的,当仅短暂地在增强wnt信号和bmp信号的条件下进行培养然后将其去除时,团聚体表现出在培养的21-27天形成foxg1::venus阳性的神经上皮和foxg1::venus阴性的神经上皮(图6a),并且它们构成连续的神经上皮。在不少于80%的团聚体中以良好的重现性相邻地观察到包含foxg1::venus阳性和阴性的神经上皮二者的此种状态。foxg1::venus阴性的神经上皮具有从所述团聚体向外伸出的结构,并且其末端具有半球结构。在从分化诱导开始起的第35天,在这些团聚体中连续形成lmx1a阳性的和foxg1::venus阴性的脉络丛区,表达lmx1a和otx2的且foxg1::venus弱阳性的皮质缘区,lef1阳性的且foxg1::venus阳性的海马前体组织区,和lef1阴性的且foxg1::venus阳性的皮质前体组织(图6b,c)。在不少于80%的团聚体中以良好的重现性观察到在一个团聚体中脉络丛、海马前体组织和皮质前体组织的此种连续的自我形成。[实施例7-1]
海马组织的各区的连续立体形成
(方法)
在v底96孔板中在实施例1的培养条件下培养至分化诱导后18天后,将悬浮的团聚体转移到非细胞粘附性的培养皿(直径为9cm)中,并且在37℃在5%co2、40%o2的存在下进行悬浮培养。从第18天起用于培养的培养基是下述两种培养基中的任一种。
1)添加有1%n2补充剂(gibco/invitrogen)、1%脂质浓缩物(chemicallydefinedlipidconcentrate,gibco/invitrogen)、10%fbs和5μg/ml肝素的dmem/f12培养基(gibco/invitrogen)
2)添加有2%不含维生素a的b27补充剂(gibco/invitrogen)、2mml-谷氨酰胺和10%fbs的neurobasal培养基(gibco/invitrogen)
与实施例6类似,仅在从第18天至第21天的期间,向这些培养基中加入3μmgsk-3β抑制剂chir99021和0.5nmbmp4并且反应。在第61天和第75天,通过免疫组织染色分析这些团聚体。
(结果)
在使用上述提及的1)和2)中的任一种的培养基的培养中,当连续培养至第61天时,在团聚体中形成海马前体组织标记lef1阳性的且foxg1::venus阳性的神经上皮(图7a,b)。所述神经上皮包含许多海马前体组织标记nrp2阳性的神经细胞(图7d)。所述神经上皮还包含很多海马神经元和前体细胞标记zbtb20阳性的细胞(图7c)。在胎儿海马前体组织中,观察到表达强度梯度,其中在神经上皮中的脑室区和脑室下区中的zbtb20表达在齿状回的前体组织(邻近脉络丛和皮质缘的部分)中强,而在阿蒙角的前体组织(远离脉络丛和皮质缘的部分)中弱。类似地,在由人es细胞形成的lef1阳性的神经上皮中,观察到这样的表达强度梯度,其中zbtb20的表达在邻近脉络丛(lmx1a阳性,foxg1::venus阴性)和皮质缘(lmx1a阳性,foxg1::venus弱阳性)的区域的部分中较强,而随着其远离这些区域而变得较弱(图7a,b,c)。当在相同条件下继续培养至第75天时,证实在zbtb20弱阳性的阿蒙角区(图7e,ca)和皮质缘(图7e,缘)和脉络丛(图7e,cp)之间形成表达齿状回神经元特有的zbtb20和prox1二者的区域(图7e,dg)。这些表明,在海马组织中连续形成可能变成齿状回组织和阿蒙角组织的区域。
[实施例7-2]
通过连续立体形成海马组织中的各个区域和分散培养得到的成熟的海马神经元
(方法)
通过实施例7-1的方法诱导连续的海马组织,将在第60-90天期间得到的细胞团聚体用细胞解离溶液(如木瓜蛋白酶溶液(sumitomobakelite,mb-x9901)等)分散成单个细胞,并且将所述细胞接种到玻璃皿、载玻片等上,以进行平面培养。在进行培养之前,玻璃的表面用聚-d-赖氨酸(200μg/ml)在4℃包被过夜,并用层粘连蛋白20μg/ml/纤连蛋白8μg/ml在37℃包被过夜。
所用的培养基是添加了2%不含维生素a的b27补充剂(gibco/invitrogen)、2mml-谷氨酰胺和10%fbs的neurobasal培养基(gibco/invitrogen)。在这些平面条件下培养的细胞在分散后2-3天内粘附到玻璃表面,并且开始延伸神经突,在第140天和第197天之间通过免疫组织染色对其进行分析。
(结果)
分散成单个细胞的细胞容易形成小的团聚体,并且神经突在其神经元之间延伸(图8a)。在几乎所有的细胞中,海马标记zbtb20是阳性的(图8b),并且在第197天,foxg1::venus也是阳性的(图8b)。尽管发现与具有map2阳性的树突的神经元不同的弥散的细胞,但是由于所述细胞也是zbtb20(+)的,具有胶质细胞样形状,并且是gfap阳性的,因此认为它们是星形胶质细胞(图8c)。zbtb20阳性细胞包含海马齿状回标记prox1阳性的细胞和海马ca3区标记ka1阳性的细胞,其中prox1阳性的细胞是较小的圆形细胞,表明其是颗粒细胞,而ka1阳性的细胞具有较大的锥体细胞样形状(图8d-e)。认为这与体内在齿状回中的颗粒细胞和在ca区中的锥体细胞的形成是一致的。zbtb20阳性细胞的比例为约80%,并且以良好的重现性观察到该表达比率。
从这些结果,基于标记表达和细胞形态,表明可以诱导海马齿状回的颗粒细胞和海马ca3区的锥体细胞。
[实施例7-3]
通过分散培养立体诱导的海马组织得到的成熟海马神经元的功能分析
(方法)
通过以与实施例7-1相似的方法,对连续的海马组织进行分散培养。在该实验中,通过在玻璃或塑料皿、载玻片等上接种进行平面培养。对于培养,将玻璃或塑料表面用聚-d-赖氨酸(100μg/ml)在37℃包被3小时,并用层粘连蛋白20μg/ml/纤连蛋白8μg/ml在37℃包被过夜。
用于分散的第1-2天的培养基是添加了2%不含维生素a的b27补充剂(gibco/invitrogen)、2mml-谷氨酰胺、1%fbs、20ng/mlbdnf、20ng/mlnt-3和10μmy-27632的neurobasal培养基(gibco/invitrogen)。从培养的第3天起,使用添加了2%不含维生素a的b27补充剂(gibco/invitrogen)、2mml-谷氨酰胺、10%fbs、bdnf20ng/ml和nt-320ng/ml的neurobasal培养基(gibco/invitrogen),并且每三天更换一半量的培养基。在自分散起的第30-60天,将细胞在fluo4-am(lifetechnologies,f-14201)(5μm)中在37℃温育45分钟,用培养基洗涤,并且通过使用lcm的钙成像进行功能分析。此外,通过膜片钳技术电生理分析通过相同方法分散培养获得的细胞。测量通过全细胞膜片钳进行,并且在用内部缓冲液(120mmk-葡糖酸盐,10mmkcl,10mmegta和用koh调节至ph7.2的10mm含hepes的缓冲液)填充内部并用外部缓冲液(140mmnacl,2.5mmcacl2,2mmmgcl2,10mm葡萄糖,1mmnah2po4和用naoh调节至ph7.4的10mm含hepes的缓冲液)填充室的内部后,使用玻璃电极(电极阻抗值为3-6mω)。测量通过epc10(heka)进行。所有的实验都在室温进行。补偿膜容量成分,并且在系列阻抗值落入电极阻抗值的3倍的条件下进行所述实验。电位依赖性的钠、钾电流的电位维持在-60mv,并且当以-10mv从-80mv到+60mv刺激时进行测量。对于sepsc,当电压维持在-60mv时,测量时程电流,并且所用的药物是终浓度为10μm的dnqx(sigma,d0540)。关于动作电位,测量超极化刺激时的膜电位。
(结果)
在分散后30-31天的进展后的钙成像中,很多神经元表现出与钙流入相关的放电活动(firingactivity)(图9a,a’),可以证实各细胞的不同的时程活动模式(图9b)。在分散后第53天进行的膜片钳中,观察到由于电位刺激引起的钠、钾电流响应、诱导的动作电位和自发的兴奋性突触后电流(sepsc)(图9c-e)。观察到sepsc被ampa型谷氨酸受体拮抗剂dnqx抑制(图9f)。
这些实验表明,在实施例7得到的神经元中存在自发的神经活动,并且其细胞表现出响应刺激的活动,并且获得还具有突触网络的功能性神经。
[实施例8]
由人多能干细胞立体形成具有妊娠中期三个月类型的多层结构的大脑皮质
(方法)
直到分化诱导第35天,将细胞在实施例1的培养条件下培养。即,将人es细胞团聚体在v底96孔板中培养达分化诱导后18天,然后将悬浮的团聚体转移到非细胞粘附性的培养皿(直径为9cm)中,并且从分化诱导的第18天起在37℃在5%co2、40%o2的存在下进行悬浮培养。为了将团聚体长期维持在健康条件下,在第35天后,将团聚体每2周一次地分成一半,并且在实施例1所述的培养基中继续培养。在分化诱导第56天后,将细胞团聚体转移到高透氧性非细胞粘附性培养皿(直径为6cm,sarstedt)中,并继续培养。在分化诱导的第70天后,将生长因子减少的matrigel(bdbioscience)的浓度变为2%,并继续培养。在第70天和第91天,通过免疫组织染色分析这些团聚体。
(结果)
当在上文提及的条件下培养时,在自分化诱导开始起的第70天,团聚体表现出形态上清楚的分层结构(图10a-b’)。在所述分层结构的最外表层上,层粘连蛋白聚集,并且形成包含reelin阳性的cajal-retzius细胞的边缘区(图10c,c’)。在紧挨着边缘区下方观察到包含深层皮质板的tbr1阳性、ctip2阳性的神经元的皮质板(图10d,d’)。在该时间点,没有很多神经元表达表层皮质板标记satb2(图10e)。在内腔侧上形成具有高细胞密度并且包含pax6阳性和sox2阳性的神经元前体细胞的薄的脑室区(图10f,f’)和在其上方包含tbr2阳性细胞的脑室下区(图10g)。在皮质板和脑室下区之间发育出了包含分散的细胞并且与妊娠中期三个月的中间区非常相似的区域。在皮质板下形成了包含许多神经突的钙网膜蛋白阳性和map2阳性的细胞层(图10h,h’)。由于在该细胞层中观察到硫酸软骨素蛋白聚糖(cspg)的积聚(图10h”),表明形成了底板。在自分化诱导开始起的第91天,具有多层结构的大脑皮质组织变厚(图10i),并且甚至在该阶段就具有发育的sox2阳性和pax6阳性的脑室区和tbr2阳性的脑室下区(图10j,k,m)。皮质板相似地变厚(图10i),并且清楚地,不仅包含深层皮质板的tbr1阳性、ctip2阳性的神经元,而且还包含很多表层皮质板的satb2阳性、brn2阳性的神经元(图10l-o)。甚至在该阶段,在皮质板下方就观察到钙网膜蛋白阳性的底板(图10p)。因此,本发明的培养方法已经能够允许沿着图10q所示的表层-深层部分轴立体形成具有人妊娠中期三个月中的大脑皮质中显示的多层结构的组织。
[实施例9]
大脑皮质的自发轴的形成及其外源性控制
(方法)
直到分化诱导的第42天,将细胞在与实施例1相似的培养条件下培养。即,将人es细胞团聚体在v底96孔板中培养至分化诱导后18天,将悬浮的团聚体转移到非细胞粘附性的培养皿(直径为9cm)中,并且从分化诱导的第18天至第42天在37℃在5%co2、40%o2的存在下进行悬浮培养。所用的培养基与实施例1所用的相同。当研究外源性因子的影响时,向培养基中加入200ng/mlfgf8b,并且允许从第24天到第42天反应。在任何条件下,在第42天通过免疫组织染色分析团聚体。
(结果)
couptf1和lhx2是已知的在妊娠头三个月中在皮质脑室区中表达并且从背尾侧到吻侧形成梯度的背尾侧标记。另一方面,sp8是已知的表现出相反的梯度的吻侧标记。当没有外源性因子反应时,在由人多能干细胞诱导的皮质脑室区中,背尾侧标记couptf1也在一侧表达较强而在对侧较弱(图11a)。吻侧标记sp8的表达表现出与couptf1的表达相反的梯度(图11a),并且另一种背尾侧标记lhx2的表达表现出与couptf1的表达相同的梯度(图11b,c)。在体内在端脑组织中,大脑皮质的背尾侧邻近皮质缘。此外,在由人多能干细胞诱导的皮质脑室区中,其中强表达背尾侧标记couptf1和lhx2的区域邻近表达皮质缘标记zic1和otx2的区域形成(图11d,e)。这表明,在这些条件下,由人多能干细胞诱导的大脑皮质以自我组织的方式自发获得从背尾侧到吻侧的极性。
已知fgf8对于在体内获得针对大脑皮质吻侧的特异性是重要的。当在团聚体的培养物中不反应外源性因子时,由fgf信号引起的磷酸化的erk强烈积聚于吻侧,在吻侧中,背尾侧标记couptf1的表达弱(图11f)。另一方面,当反应外源性fgf8b时,couptf1的整体表达减弱,并且sp8的表达相反地在整个脑室区增加(图11g-i)。这些表明,可以通过给予外源性信号由此导致诱导来选择性控制沿大脑皮质的背-腹轴或前-后轴的额叶、枕叶等的区域性。
[实施例10]
hesc的维持和分化培养
(方法)
按照日本政府的hesc研究指南使用人es细胞(hesc)(khes-1)。将hesc用通过丝裂霉素c处理灭活的mef饲养细胞在37℃在2%co2下维持在补充了20%(体积/体积)knockoutserumreplacement(ksr;invitrogen)、2mm谷氨酰胺、0.1mm非必需氨基酸(invitrogen)、5ng/ml重组人bfgf(wako)、0.1mm2-巯基乙醇(2-me)、50u/ml青霉素和50μg/ml链霉素的dmem/f12(sigma)中。对于传代,使hesc解离,并且通过将其用包含0.25%胰蛋白酶、0.1mg/ml胶原酶iv、20%ksr和1mmcacl2的pbs在37℃处理7分钟从饲养细胞大块(enbloc)回收。通过轻轻地用移液器吹吸将解离的hesc块分成较小的小块(几十个细胞)。传代以1:3–1:4的分离比进行。
对于sfebq培养,将hesc用包含0.05mg/mldna酶i(roche)和10μmy-27632的trypleexpress(gibco/invitrogen)解离成单个细胞,并且将其接种到具有v底圆锥形孔的低细胞粘附表面包被的96孔板的每个孔中,使用包含20μmy-27632的皮质分化培养基,以进行聚集。所述皮质分化培养基是补充了20%ksr(knockoutserumreplacement)、0.1mm非必需氨基酸(gibco/invitrogen)、1mm丙酮酸盐(sigma)、0.1mm2-巯基乙醇、100u/ml青霉素和100μg/ml链霉素的g-mem(gibco/invitrogen)。将开始sfebq培养的日期定为第0天,从第0天至第18天,向培养物中加入iwr1e(wnt抑制剂)和sb431542(tgfβ抑制剂),分别达到3μm和5μm。
对由hesc诱导的皮质神经上皮在下述条件下进行培养。在第18天,将细胞团聚体转移到9-cm培养皿(非细胞粘附性表面涂层)中并且进一步在补充了1%n2补充剂(gibco/invitrogen)、1%脂质浓缩物(chemicallydefinedlipidconcentrate,gibco/invitrogen)、0.25mg/mlfungizone、100u/ml青霉素和100μg/ml链霉素的dmem/f12培养基(gibco/invitrogen)中在37℃在5%co2和40%o2的存在下培养。从第35天起,还向培养基中加入10%fbs、5μg/ml肝素和1%减少生长因子的matrigel(bdbiosciences)。为了防止细胞团聚体中央部分中的细胞死亡,在第35天后,每2周在解剖显微镜下将团聚体用精密镊子切成一半尺寸,并且在第56天后,使用lumox培养皿(sarstedt;透o2的)培养。自第70天起,增加matrigel的浓度(最终为2%),并且向培养基中加入b27补充剂(gibco/invitrogen)。
通过在培养的第24-42天期间加入人重组fgf8b(gibco,200ng/ml)而进行皮质神经上皮的前诱导(anteriorinduction)。在培养的第42天将细胞团聚体固定。
通过在培养的第15-21天期间加入hedgehog激动剂sag(30nm或500nm)而进行皮质神经上皮的腹侧化(ventralization)。在第35培养日将细胞团聚体固定。
(结果)
自我组织的皮质ne中的皮质内极性
对于改善的sfebq培养(图18a和a’),将9000个解离的hesc接种在低细胞粘附性v底96孔板的每个孔中(文献15),并且将它们在补充了rho-激酶抑制剂(y-27632)的g-mem-ksr培养基中培养(16)(图18a)。然后,将细胞团聚体转移到9-cm非细胞粘附性的培养皿中,并且在40%o2存在下培养。进行脂质浓缩物(第18天)、10%fbs、肝素和低浓度matrigel(1%)(第35天)的添加以用于脑室区的长期维持,而在前18天进行tgfβ抑制剂(sb431542)和wnt抑制剂(iwr1e)的添加以用于端脑区的有效诱导。
在这些改善的培养条件下,在第26天,所有hesc来源的团聚体都包含对foxg1::venus(端脑标记)(文献2)为阳性的神经上皮(图12a和图18b),并且总细胞(第34天)的75%以上在第34天表达foxg1::venus。相反,通过之前的方法,foxg1::venus阳性细胞的效率为总细胞的30-40%(图12b和图18c)。foxg1::venus阳性的神经上皮包含半球神经上皮样结构(假复层柱状上皮),内部具有脑室样腔(图12c;第42天)。这些神经上皮结构在内腔侧具有对pax6和sox2为阳性的高细胞密度的细胞层(图12d和e),而在其最内部发现处于有丝分裂的磷酸化的组蛋白h3阳性的细胞(图12f)。这些结构与妊娠头三个月中的皮质脑室区相似。在脑室区样细胞层外表达有丝分裂后神经元标记tuj1(cp;图12g)和早期皮质板标记ctip2与tbr1(文献1和2)(图12h和图18d)。神经元层还包含reelin阳性的的cajal-retzius细胞(图12i),和邻近表面的富含层粘连蛋白的层(图12j)。因此,在该hesc来源的皮质神经上皮中发生自我组织的分层。
有趣的是,自我组织的皮质神经上皮通常具有轴极性。couptf1在脑室区中的表达(图12k,红色),在胎儿脑中形成背尾侧-到-吻腹侧的表达梯度(图18e和f),在hesc来源的皮质神经上皮的一侧较强,而腹吻侧标记sp8以相反的表达梯度模式表达(图12k,白色)。与该现象一致的,lhx2表达(在体内形成背侧-到-腹侧的表达梯度)在与couptf1的同一侧也是强的(图12l和图18g)。在第35天容易观察到couptf1与sp8相反的梯度表达模式。在小鼠胚胎中,背尾侧皮质区的旁侧是皮质缘(图18h–j),其在以后产生海马的海马伞区域(fimbriaregion)。与该现象一致的,皮质标记otx2和zic1在具有强couptf1表达的一侧上在皮质神经上皮旁侧的区域中表达(图12m和图18k)。
这些发现表明,hesc来源的神经上皮自发获得皮质内背尾侧-腹吻侧极性。在小鼠胚胎中,fgf8促进皮质的吻侧特异性(rostralspecification)(文献17)。有趣的是,在couptf1表达的相对侧上的hesc来源的皮质神经上皮中观察到高水平的磷酸化的erk信号(在fgf信号传导的下游发挥作用)(图12n)。相反,用外源性fgf8处理hesc来源的皮质引起以couptf1的表达为代价的广泛的sp8表达(图12o和p与图18l),这表明fgf-mapk信号传导在该自我组织中的积极作用。
具有区域特异性弯曲的自我组织的皮质神经上皮的形态变化
在约第18–20天首先在hesc来源的神经上皮(n-钙粘蛋白阳性的和sox2阳性的)中检测到端脑标记foxg1的表达。神经上皮的顶侧(apkc阳性)位于团聚体的表面上(图13a,下图)。在第21天,神经上皮开始变成部分不连续的,并且分成几个大的神经上皮(图13a)。然后,这些分离的皮质神经上皮在曲率上变成顶部凹陷的(图13b–d和图19a,上图)。
皮质神经上皮的每个区室化的结构域具有不对称的弯曲结构。神经上皮的一端表征为具有卷曲的形状的端部(图13b–d,箭头),而另一侧表征为是平的。活性肌球蛋白(由磷酸化的mlc2表示)在皮质区的整个顶部表面上(包括平端)均匀地积聚(图13c)。在活体成像中,皮质区的卷曲侧接近另一端,并且最终与其接触(图13e和f)。在该过程中,皮质区中的神经上皮的主体在与卷曲侧相同的方向上移动(图13e–h)。到第27天,卷曲的形态发生最终产生在内部具有内腔的半球皮质结构(图13i和图19a,下图)。
通过加入rock抑制剂,减弱了具有卷曲的皮质结构域的形态变化(图13j–l),所述rock抑制剂抑制引起顶部收缩所需的rho-rock-肌球蛋白途径。神经上皮的卷曲侧表达背尾侧的标记(otx2和couptf1;图13m和n),这表明卷曲端对应于背尾侧。
当hedgehog激动剂(30nmsag,使用15–21天)使神经上皮微弱腹侧化(文献18,19)时,大部分的表达foxg1::venus的神经上皮表达lge的标记gsh2(文献20)(图13o,箭头,和图19b)。在该lge神经上皮下方产生gad65阳性的gaba能性神经元,如在体内观察到的(文献19)(图11p,红色),而其余的端脑神经上皮大部分对皮质标记pax6为阳性(图13q)。加入高浓度的sag以pax6和gsh2的表达为代价诱导mge标记nkx2.1(图19b和c)。重要地,用低sag处理的神经上皮表现出皮质(pax6阳性)-lge(gsh2阳性)结构域的连续形成,如在体内观察到的,这表明,改善的培养条件允许在一个团聚体中通过自我组织连续形成大脑皮质(pallial)-大脑皮质下(subpallial)结构。在该连续延伸的神经上皮中,皮质神经上皮的卷曲侧(图13o–q,箭头)与皮质-lge连接处相对,这与卷曲侧和不卷曲侧分别表示皮质神经上皮的背侧和腹侧的观点一致。
在胚胎中,发育中的皮质通过大脑皮质神经上皮的强烈弯曲而外翻,而胚胎大脑皮质是不可动的,原因在于其被固定到相邻的组织。胚胎神经上皮区从内侧大脑皮质(海马区)到皮质背侧部分的弯曲尤其强(图17a)。由于hesc来源的皮质神经上皮的背尾侧的位置没有固定,并且在本立体培养系统中移动,所以发生具有卷曲的形态变化。可以推测这影响了胚胎背侧皮质的强弯曲作用(图19d)。
这些发现证明,hesc来源的皮质神经上皮通过具有沿自我获得的背尾侧腹吻侧轴的不对称弯曲的形态变化而自我形成穹顶样神经上皮。在该拓扑变化后,神经上皮的顶侧表面变成位于皮质半球的内部。在活体成像中,神经干细胞通常在内腔表面分裂,同时它们进行重复的上下核移动(图13r和图19e;在这些阶段中,细胞分裂大部分是对称的)。
三个皮质神经元区的形态分离
改善的培养条件允许hesc来源的皮质神经上皮生长甚至超过第42培养日。在第70天,hesc来源的皮质神经上皮的厚度为200μm以上(图14a和a’)。通过该阶段,神经上皮形态上分层为脑室区、脑室下区、中间区、皮质板和边缘区(图14b–g和图20a与b)。边缘区的最表层积聚层粘连蛋白并且包含reelin阳性细胞(cr细胞)(图14c和c’)。皮质板在边缘区下方形成,并且包含对tbr1和ctip2为阳性的深层皮质神经元(图14d和d’)。在该阶段,表达表层-皮质板的标记satb2(文献21)的神经元群体仍然相对少(图14e)。在第70天,内腔脑室区为~100μm厚,并且包含pax6阳性sox2阳性的神经干细胞/前体(图14f和f’)或被称为放射状神经胶质的细胞(文献22)。在其上部中,形成包含对tbr2为阳性的细胞的脑室下区(图14g)。
通过该阶段,在皮质板与脑室下区之间发育出了与妊娠中期三个月的中间区相似的细胞稀少区。紧挨着皮质板下方形成了钙网膜蛋白阳性细胞层,所述细胞具有大量延伸到该中间区中的map2阳性的神经突(图14h与h’和图20c与d)。这些特征与人胎儿皮质中主要的底板中的神经元(例如,用于丘脑皮质连接的早期先驱神经元)的特征相似(文献23–25)。硫酸软骨素蛋白聚糖(cspgs)在胚胎底板及其下方的中间区中积聚(图20f,右下,括号)(文献26)。类似地,在hesc来源的皮质神经上皮中相应的区中观察到强cspg积聚(图14h”和图20e)。这些发现证明hesc来源的皮质神经上皮以与胚胎相同的顶部-基底次序不仅自我组织皮质板和边缘区,还自我组织底板和中间区。在该阶段,没有观察到在皮质或tag1阳性的离皮质轴突中gad65阳性的中间神经元的大量积聚(图20g)。
到第91天,皮质神经上皮达到300–350μm的厚度,但是仍然包含充分发育的脑室区(图14i–k与图20h和i)。皮质板也变得厚得多(-150μm;图14i),并且除了tbr1阳性和ctip2阳性的深层皮质板神经元之外还包含大量表层神经元(satb2阳性和brn2阳性)(图14l–n和图20j)。仍然在皮质板下方观察到底板神经元(钙网膜蛋白阳性)(图14o)。
在长期培养中观察到的形态层结构分离(总结在图14p)模拟妊娠中期三个月阶段初期人胎儿皮质的组织学(文献25,27)。此外,在hesc来源的皮质板内,表层神经元(satb2阳性的和brn2阳性的)优先位于比深层神经元(tbr1阳性的和ctip2阳性的)更表层处(图15a–h)。此外,当在第50天用edu然后在第70天用brdu进行1天的标记时,在第91天,edu-和brdu-标记的细胞分别优先位于深层和表层侧(图15i–l)。这些发现表明,在神经元定位中存在偏好的趋势,这让人想起在胎儿皮质形成过程中的内侧-外侧(inside-out)模式(文献5,6),其中迟生的皮质神经元位于外侧而早生的皮质神经元在内侧。与该观点一致,在第112天,在主要表达tbr1而不是satb2的hesc来源的皮质的内腔三分之二的部分中优先观察到成熟的皮质神经元标记camkiiα(图15m–o和图20k)。实际上,在细胞水平上,这些camkiiα神经元中大部分共表达tbr1而不是satb2(图20l和m;图15p总结)。
osvz中人特异性神经干细胞/前体的出现
最后,研究长期培养的hesc来源的皮质中的皮质神经干细胞/前体动力学。之前的体内研究已经揭示了内腔神经干细胞的非垂直分裂在晚期阶段增加,并且许多顶侧神经前体通过不对称分裂产生(文献28,29)。在本培养中,在第70天增殖内腔神经干细胞优先以“垂直”分裂平面分裂(60–90°;图16a–c),引起与内腔表面平行的子细胞的分离。相反,在第91天,增殖神经干细胞(磷酸-波形蛋白阳性的)表现出较高的非垂直分裂的频率(图16d–f)。
在第70和91天,svz包含大量tbr2阳性的、sox2阴性的、pax6阴性的中间前体(图14g和m)。有趣的是,在第91天,svz的外侧部分积聚另一群tbr2阴性sox2阳性、pax6阳性的磷酸-波形蛋白阳性的神经干细胞/前体(图16g-g”和图21a–c)。在第70天,这些细胞的群体的百分比较小,并且到第91天变成显著的(图16h)。在第91天,该tbr2阴性的且sox2阳性的细胞群体偏向定位在更顶侧,与tbr2阳性的和sox2阴性的中间前体的偏向内腔侧的定位相反(图16i,右侧)。有趣的是,这两种神经干细胞/前体差异性地响应notch信号抑制剂,所述notch信号抑制剂通过诱导早熟的神经元分化而强烈减少内腔神经干细胞/前体。notch信号抑制剂增加tbr2阳性的和sox2阴性的中间前体,而在处理后,很少保留tbr2阴性的和sox2阳性的细胞(图21d–f)。
最近的研究已经报道了在晚期阶段的人皮质形成osvz中积聚与tbr2阳性的中间前体截然不同的tbr2阴性的、sox2阳性的、pax6阳性的神经干细胞/前体群体(图21g)(文献11,12)。认为这些神经干细胞/前体(其被称为org(或osvz干细胞))(文献11,12)有助于人皮质特有的表层神经元的大量产生。org细胞具有延伸到顶部表面的突起,并且缺少内腔突起,这与内腔前体不同。类似地,在第91天的hesc来源的皮质神经上皮中的tbr2阴性的、sox2阳性的、pax6阳性的神经干细胞/前体也具有顶部突起,而没有内腔突起(图16j–k’和图21h,h’以及i)。这些细胞在位于svz中的体细胞(soma)中具有粒周蛋白阳性的基体(图21j),这与内腔神经干细胞不同,其中基体位于邻近内腔表面处。如体内org,hesc来源的org样细胞的分裂平面倾向于是水平的(图16l和m)。在tbr2阳性的前体中没有发现顶部突起(磷酸-波形蛋白阳性的;图21k-k”),如体内中间前体的情形。
综上所述,这些发现表明自我组织的皮质神经上皮重演了在人皮质形成晚期观察到的神经干细胞/前体动力学,包括org样前体的出现。
在本研究中,证明了hesc来源的皮质神经上皮可以执行其内部程序从而自我组织在人胎儿脑中观察到的轴模式和多区分离。本发明的培养系统允许hesc来源的皮质神经上皮在悬浮培养条件下长期健康生长,甚至超过13周。最后,皮质神经上皮变成约350μm厚,并包含在人妊娠中期三个月(从第11胚胎周开始)在胎儿皮质中观察到的多层结构(文献30)。这产生与之前的3d培养的局限性的明显对比,之前的3d培养可以支持皮质神经上皮直到与妊娠前三个月相对应的组织成熟度。本发明的培养方法还重演了人妊娠中期三个月神经皮质形成的另一个方面,即,在培养的第91天(13周)出现org样神经干细胞/前体。这些观察还表明,在本发明的方法中自我组织的组织的发育速度与在胎儿脑中的发育大致相当。
该培养的重要作用是内部编程的皮质形成在连续延伸的神经上皮中长期进行。这种皮质内极性的自我形成机制是将来研究的有吸引力的主题。另外,hesc来源的皮质神经上皮的卷曲形态变化表现出沿着自我形成的极性的不对称移动。
除了皮质神经上皮内的极性之外,本发明的培养系统还适用于整个端脑区的背-腹特异性研究。显著地,在部分腹侧化条件下(图13o–q),hesc来源的神经上皮通过自我组织重演在体内观察到的位置邻近的皮质和lge(纹状体原基),而甚至更强的hedgehog信号诱导mge形成。
本研究中所示的优化的培养系统允许皮质的复杂层状形成的重演:即,形成脑室区、脑室下区、中间区、底板、皮质板和边缘区。底板是灵长类动物中特别显著的结构(有时也称为第vii层),并且认为是由皮质内早生的神经元(例如,先驱神经元)形成的(文献24,25)。尽管底板仅在胎儿皮质中短暂存在,但是其衍生物中的一些存在于成人脑中作为成人白质中的间质神经元(文献33)。由于底板在出生后消失,因此其研究不容易,尤其是在人中,因此,我们的系统在研究该理解很少的神经元层中应该是重要的。另外,我们的培养系统可以适用于研究人胎儿皮质中的内侧-外侧层形成,包括无脑回(lissencephaly)的发病机制。
最后,我们的培养系统在研究org神经干细胞/前体在人皮质形成中的作用中非常有利。对于多脑回的人皮质,包括继续分裂多次以产生大量表层神经元的该类型的神经干细胞/前体可能是有利的。迄今为止,没有报道用于区分org的特异性的分子标记,并且org与内腔神经干细胞(二者均为sox2阳性的,pax6阳性的,和tbr2阴性的)之间的区分主要依赖于它们的细胞形态、行为和位置。因此,在缺少拓扑背景的解离培养的情形中,org研究的程度被相当大地限制。相反,本发明的培养系统在该方面提供极大的优点,原因在于其具有发育人皮质的3d背景。最近,报道了在由人多能干细胞产生的多层皮质组织中出现org的类似的观察(文献34)。该研究使用非选择性分化方法,其可能随机地获得脑区域的特异性(与我们重现性的皮质选择性分化培养不同)。
尽管以优选的实施方案为重点描述了本发明,但是本领域技术人员应该清楚所述优选的实施方案可以进行修改。本发明旨在,本发明可以通过除了本说明书中详细描述的那些方法之外的方法实施。因此,本发明包括后附的“权利要求书”的精神和范围所涵盖的所有修改。
在本文引用的任意公布中公开的内容,包括专利和专利申请,通过引用以它们在本文中公开的程度完全结合在本文中。
参考文献
1molyneauxbj,arlottap,menezesjr,macklisjd.(2007)neuronalsubtypespecificationinthecerebralcortex.(大脑皮质中的神经元亚型说明)natrevneurosci.8:427-437.
2hebertjm,fishellg.(2008)thegeneticsofearlytelencephalonpatterning:someassemblyrequired(早期端脑模式的遗传性:需要一些组装).natrevneurosci9:678-685.
3biellef,等(2005)multipleoriginsofcajal-retziuscellsatthebordersofthedevelopingpallium(在发育的大脑皮质边界的cajal-retzius细胞的多种来源).natneurosci.8:1002-1012.
4bystroni,blakemorec,rakicp.(2008)developmentofthehumancerebralcortex:bouldercommitteerevisited(人大脑皮质的发育:bouldercommittee重新审视).natrevneurosci.9:110-122.
5rakicp.(1974)neuronsinrhesusmonkeyvisualcortex:systematicrelationbetweentimeoforiginandeventualdisposition(恒河猴视皮质中的神经元:开始时间和最终处理之间的系统相关性).science.183:425-427.
6shenq.等.(2006)thetimingofcorticalneurogenesisisencodedwithinlineagesofindividualprogenitorcells(皮质神经发生的时间在个体祖细胞的谱系内编码).natneurosci9:743-751.
7eirakum.等.(2008)self-organizedformationofpolarizedcorticaltissuesfromescsanditsactivemanipulationbyextrinsicsignals(由escs自我组织形成极化皮质组织及其通过外部信号的活性操作).cellstemcell3:519-532.
8watanabek.等.(2005)directeddifferentiationoftelencephalicprecursorsfromembryonicstemcells(由胚胎干细胞定向分化端脑前体).natneurosci8:288-296.
9nasum,等.(2012)robustformationandmaintenanceofcontinuousstratifiedcorticalneuroepitheliumbylaminin-containingmatrixinmouseescellculture(在小鼠es细胞培养物中,通过包含层粘连蛋白的基质,稳健形成并维持连续的分层的皮质神经上皮).plosone7:e53024.
10marianij.等.(2012)modelinghumancorticaldevelopmentinvitrousinginducedpluripotentstemcells(使用诱导的多能干细胞在体外建模人皮质发育).procnatlacadsciusa.109:12770-12775.
11hansendv,luijh,parkerpr,kriegsteinar.(2010)neurogenicradialgliaintheoutersubventricularzoneofhumanneocortex(在人新皮质的外侧脑室下区中的神经性放射状神经胶质).nature464:554-561.
12fietzsa,等.(2010)osvzprogenitorsofhumanandferretneocortexareepithelial-likeandexpandbyintegrinsignaling(人和雪貂新皮质的osvz前体细胞是上皮样的,并且通过整联蛋白信号传导增殖).natneurosci.13:690-699.
13wangx,tsaijw,lamonicab,kriegsteinar.(2011)anewsubtypeofprogenitorcellinthemouseembryonicneocortex(小鼠胚胎新皮质中前体细胞的新亚型).natneurosci.14:555-561.
14shitamukaia,konnod,matsuzakif.(2011)obliqueradialglialdivisionsinthedevelopingmouseneocortexinduceself-renewingprogenitorsoutsidethegerminalzonethatresembleprimateoutersubventricularzoneprogenitors(在发育中的小鼠新皮质中的倾斜的放射状神经胶质分裂诱导生殖区(germinalzone)外侧自我更新的前体细胞,其与灵长类外侧脑室下区前体细胞相似).jneurosci.31:3683-3695.
15nakanot,等.(2012)self-formationofopticcupsandstorablestratifiedneuralretinafromhumanescs(从人escs自我形成视杯和可保存的分层的神经视网膜).cellstemcell10:771-785.
16watanabek,等.(2007)arockinhibitorpermitssurvivalofdissociatedhumanembryonicstemcells(rock抑制剂允许解离的人胚胎干细胞的存活).naturebiotechnol.25:681-686.
17stormee,等.(2006)dose-dependentfunctionsoffgf8inregulatingtelencephalicpatterningcenters(fgf8调节端脑模式中心的剂量依赖性功能).development133:1831-1844.
18fuccillom,rallum,mcmahonap,fishellg(2004)temporalrequirementforhedgehogsignalinginventraltelencephalicpatterning(腹侧端脑模式中对hedgehog信号传导的短暂需求).development131:5031-5040.
19danjot,等.(2011)subregionalspecificationofembryonicstemcell-derivedventraltelencephalictissuesbytimedandcombinatorytreatmentwithextrinsicsignals(通过用外部信号定时的和组合的处理引起胚胎干细胞来源的腹侧端脑组织的区下特异性).jneurosci.31:1919-1933.
20yunk,potters,rubensteinjl(2001)gsh2andpax6playcomplementaryrolesindorsoventralpatterningofthemammaliantelencephalon(gsh2和pax6在哺乳动物端脑的背腹模式中起互补性作用).development128:193-205.
21alcamoea,等.(2008)satb2regulatescallosalprojectionneuronidentityinthedevelopingcerebralcortex(在发育中的大脑皮质中,satb2调节胼胝体投射神经元的性质).neuron57:364-377.
22doetschf.(2003)theglialidentityofneuralstemcells(神经干细胞的神经胶质性质).natneurosci.6:1127-1134.
23kostovici,rakicp.(1990)developmentalhistoryofthetransientsubplatezoneinthevisualandsomatosensorycortexofthemacaquemonkeyandhumanbrain(在猕猴和人脑的视皮质和躯体感觉皮质中,短暂的底板区的发育史).jcompneurol.297:441-470.
24wangwz,等.(2010)subplateinthedevelopingcortexofmouseandhuman(在小鼠和人发育中的皮质中的底板).janat.217:368-380.
25judasm,sedmakg,kostovici.(2013)thesignificanceofthesubplateforevolutionanddevelopmentalplasticityofthehumanbrain(底板对于人脑进化和发育可塑性的重要性).fronthumneurosci.7:423.
26sheppardam,pearlmanal.(1997)abnormalreorganizationofpreplateneuronsandtheirassociatedextracellularmatrix:anearlymanifestationofalteredneocorticaldevelopmentinthereelermutantmouse(区神经元(preplateneurons)及其相关的胞外基质的异常改组:在蹒跚突变小鼠中,改变的新皮质发育的早期表现).jcompneurol.378:173-179.
27bayersa和altmanj.(2005)atlasofhumancentralnervoussystemdevelopment(人中枢神经系统发育图集),第3卷:thehumanbrainduringthesecondtrimester(在妊娠中期三个月期间的人脑)(crcpress,bocaraton)
28lamonicabe,luijh,hansendv,kriegsteinar.(2013)mitoticspindleorientationpredictsouterradialglialcellgenerationinhumanneocortex(有丝分裂纺锤体取向预测人新皮质中的外侧放射状神经胶质细胞产生).natcommun.4:1665.
29tavernae,huttnerwb.(2010)neuralprogenitornucleiinmotion(神经前体细胞核in运动).neuron67:906-914.
30bayattin,等.(2008)amolecularneuroanatomicalstudyofthedevelopinghumanneocortexfrom8to17postconceptionalweeksrevealingtheearlydifferentiationofthesubplateandsubventricularzone(孕后8至17周发育中的人新皮质的分子神经解剖学研究揭示底板和脑室下区的早期分化).cerebcortex18:1536-1548.
31letinick,zoncur,rakicp.(2002)originofgabaergicneuronsinthehumanneocortex(人新皮质中gaba能性神经元的起源).nature.417:645-649.
32rakics,zecevicn.(2003)emergingcomplexityoflayeriinhumancerebralcortex(人大脑皮质中第i层的出现复杂性).cerebcortex.13:1072-1083.
33judasm,sedmakg,pletikosm.(2010)earlyhistoryofsubplateandinterstitialneurons:fromtheodormeynert(1867)tothediscoveryofthesubplatezone(1974)(底板和间质神经元的早期历时:从theodormeynert(1867)到底板区的发现(1974)).janat.217(4):344-367.
34lancasterma,等.(2013)cerebralorganoidsmodelhumanbraindevelopmentandmicrocephaly(大脑细胞器建模人脑发育和小头病).nature.501:373-379.
35bayersaandaltmanj.(2004)atlasofhumancentralnervoussystemdevelopment(人中枢神经系统发育图集),第2卷:thehumanbrainduringthethirdtrimester(在妊娠后期三个月期间的人脑)(crcpress,bocaraton)
工业适用性
按照本发明,可以在体外由多能干细胞诱导具有如同体内端脑的高级次序结构的端脑或其部分组织(大脑皮质,基底神经节,海马,脉络丛等)或其前体组织。因此,本发明可用于脑神经领域的再生医学的实践。
本申请是基于在日本提交的专利申请no.2013-242394(申请日:2013年11月22日),其内容完全结合在本文中。
- 还没有人留言评论。精彩留言会获得点赞!