一种α‐L‐鼠李糖苷酶在制备5-氟-2’-脱氧脲苷衍生物中的应用的制作方法
本发明涉及一种α‐L‐鼠李糖苷酶在制备5-氟-2'-脱氧脲苷衍生物中的应用,特别涉及一种利用α-L-鼠李糖苷酶原始酶合成5-氟-2'-脱氧脲苷鼠李糖苷的方法,属于糖工程技术领域。
技术背景
5-氟-2'-脱氧脲苷(2’-Deoxy-5-fluorouridine)是一种氟代脱氧核苷类似物,被广泛用于治疗各种肿瘤,对肝癌、直肠癌、结肠癌、食道癌、胃癌和肺癌有较好的疗效,但该药物临床上表现出较低的选择性和各种毒副作用。为提高5‐氟‐2'‐脱氧脲苷的靶向性,增强疗效,降低毒副作用,近年来对其衍生物的研究成为新药研发的热点。现已证明核苷类药物的糖基化衍生物较之亲代化合物具有更低的毒副作用,且对抗肿瘤药物的鼠李糖基化修饰,利用肿瘤细胞表面存在的鼠李糖凝集素,可提高药物的肿瘤专一靶向性,降低毒副作用。
目前,5-氟-2'-脱氧脲苷的衍生物多通过化学法合成,生物酶法合成其衍生物研究较少。酶法对5-氟-2'-脱氧脲苷修饰,反应简单、条件温和、环境友好,但目前发现的能以5-氟-2'-脱氧脲苷为底物进行糖基化修饰的天然酶类非常有限,目前尚无酶法鼠李糖基化修饰5-氟-2'-脱氧脲苷的报道。
技术实现要素:
本发明针对现有技术的不足,提供一种α‐L‐鼠李糖苷酶在制备5-氟-2'-脱氧脲苷衍生物中的应用。
5-氟-2'-脱氧脲苷鼠李糖苷,包括3’‐O‐α-L-鼠李糖基-5-氟‐2'‐脱氧脲苷和5’‐O‐α-L-鼠李糖基-5-氟‐2'‐脱氧脲苷,所述的3’‐O‐α-L-鼠李糖基-5-氟‐2'‐脱氧脲苷化学结构式如下:
所述的5’‐O‐α-L-鼠李糖基-5-氟‐2'‐脱氧脲苷化学结构式如下:
一种α-L-鼠李糖苷酶在制备上述5-氟-2'-脱氧脲苷鼠李糖苷中的应用,所述的α-L-鼠李糖苷酶氨基酸序列如SEQ ID NO.1所示。
一种酶法制备5-氟-2'-脱氧脲苷鼠李糖苷的方法,包括如下步骤:
(1)采用磷酸缓冲液配制鼠李糖浓度为0.3M~0.5M,5-氟-2'-脱氧脲苷浓度为0.4M~0.6M,氨基酸序列如SEQ ID NO.1所示的α-L-鼠李糖苷酶添加量为5μg~10μg/mL的反应体系;
(2)将步骤(1)制得反应体系于45~60℃水浴中反应40~60h,煮沸终止反应,离心,取上清液;
(3)将步骤(2)制得的上清液,经分离、干燥后,制得5-氟-2'-脱氧脲苷鼠李糖苷。
所述步骤(1)中氨基酸序列如SEQ ID NO.1所示的α-L-鼠李糖苷酶选用GenBank登录号为JN704640.1。上述α-L-鼠李糖苷酶对5-氟-2'-脱氧脲苷有显著转糖基活性。
根据本发明优选的,所述步骤(1)中的磷酸缓冲液为浓度10~100mM,pH6~8的磷酸钠缓冲液;根据本发明进一步优选的,所述步骤(1)中的磷酸缓冲液为浓度50mM,pH6.5的磷酸钠缓冲溶液。
根据本发明优选的,所述步骤(2)中的离心为10000~12000转/分钟离心30分钟。
根据本发明优选的,所述步骤(2)中的反应条件为55℃水浴反应48h。
根据本发明优选的,所述步骤(2)中的煮沸终止反应条件为100℃煮沸5分钟。
根据本发明优选的,所述步骤(3)中的分离采用两步分离,初步分离采用规格15mm×100cm的Bio-gel P2色谱柱,以水为流动相;进一步分离采用Agilent 1200 HPLC系统Waters Spherisorb 5.0μm NH24.6mm×250mm色谱柱,流动相为乙腈-水。
根据本发明进一步优选的,上述初步分离的单次样品上样量为2~3mL,洗脱流速为0.2~0.3mL/分钟;最优的样品上样量为2mL,洗脱流速为0.2mL/分钟。
根据本发明进一步优选的,上述进一步分离的单次上样体积为10μL,流速为1.0mL/min,流动相为乙腈:水体积比70:30,紫外检测波长为294nm。
根据本发明优选的,所述步骤(3)中的干燥为冷冻干燥。
根据本发明进一步优选的,所述步骤(3)中还包括分离后的薄层层析检测,合迁移距离相同并在紫外灯下显色的产物。
上述薄层层析检测的步骤如下:
取1μL洗脱液,薄层层析板点样,在展层剂中展开,于紫外灯下观察显色产物;上述展层剂由氯仿和甲醇按体积比9:1混合配制。
上述5-氟-2'-脱氧脲苷鼠李糖苷在制备防治肿瘤药物中的应用。
有益效果
1、本发明首次发现氨基酸序列如SEQ ID NO.1所示的α-L-鼠李糖苷酶对5-氟-2'-脱氧脲苷具有显著转糖基活性,并成功合成了5-氟-2'-脱氧脲苷鼠李糖苷;
2、本发明以5-氟-2'-脱氧脲苷为原料,以廉价鼠李糖为糖基供体,采用α-L-鼠李糖苷酶原始酶合成5-氟-2'-脱氧脲苷鼠李糖苷,产物与其原料5-氟-2'-脱氧脲苷相比,含有鼠李糖基,增加了稳定性和靶向性,作为肿瘤靶向药物应用前景广阔。
附图说明
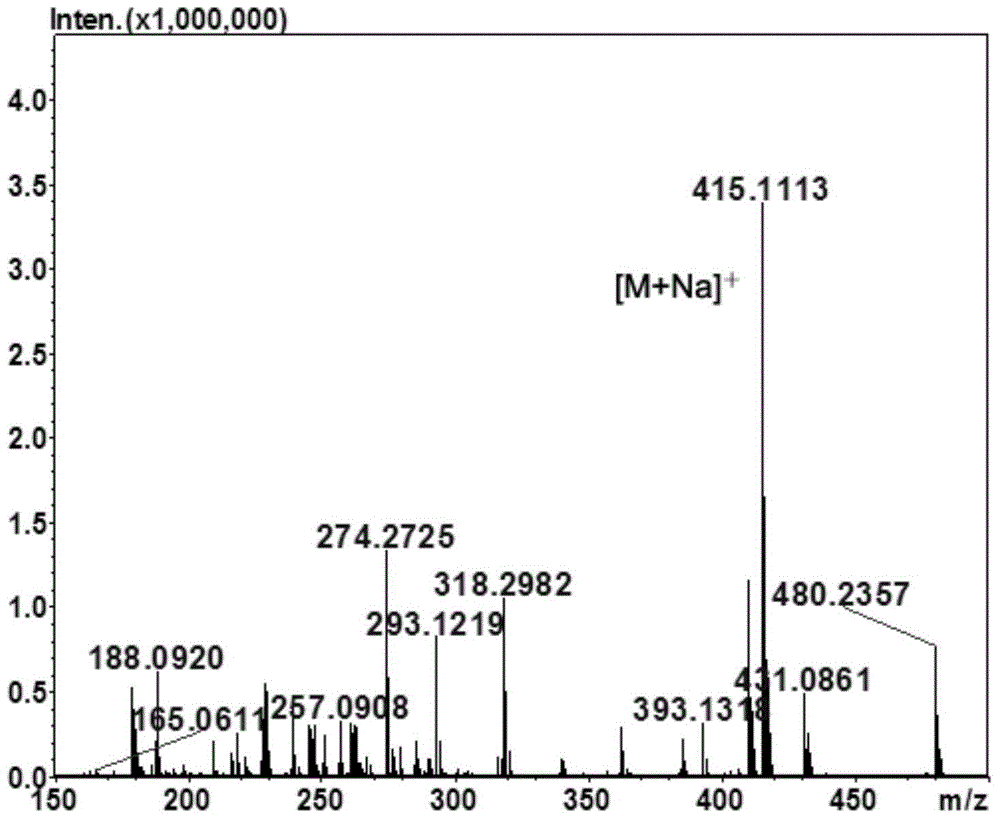
图1为5-氟-2'-脱氧脲苷衍生物1的质谱图;
图2为5-氟-2'-脱氧脲苷衍生物1的氢谱;
图3为5-氟-2'-脱氧脲苷衍生物1的碳谱
图4为5-氟-2'-脱氧脲苷衍生物1的氢氢相关核磁图谱;
图5为5-氟-2'-脱氧脲苷衍生物1的碳氢直接相关核磁图谱;
图6为5-氟-2'-脱氧脲苷衍生物1的碳氢远程相关核磁图谱。
图7为5-氟-2'-脱氧脲苷衍生物2的质谱图;
图8为5-氟-2'-脱氧脲苷衍生物2的氢谱;
图9为5-氟-2'-脱氧脲苷衍生物2的碳谱
图10为5-氟-2'-脱氧脲苷衍生物2的氢氢相关核磁图谱;
图11为5-氟-2'-脱氧脲苷衍生物2的碳氢直接相关核磁图谱;
图12为5-氟-2'-脱氧脲苷衍生物2的碳氢远程相关核磁图谱。
具体实施方式
下面结合实施例对本发明做进一步说明,但本发明所保护范围不限于此。
生物材料来源
pPIC9K质粒购自Invitrogen公司;
Pichia pastoris GS115购自Invitrogen公司。
实施例1
5-氟-2'-脱氧脲苷鼠李糖苷的制备方法,步骤如下:
1.α-L-鼠李糖苷酶的制备
人工合成GenBank登录号为JN704640的α-L-鼠李糖苷酶序列(编码蛋白GenBank登录号为AFA41506.1,核苷酸序列如SEQ ID NO.2),将其连接到pPIC9K质粒上,转化Pichia pastoris GS115。按照Invitrogen公司的毕赤酵母表达操作手册说明书制备α-L-鼠李糖苷酶,考马斯亮蓝法测定酶蛋白含量,经检测,氨基酸序列如SEQ ID NO.1所示。
2.α-L-鼠李糖苷酶催化合成5-氟-2'-脱氧脲苷鼠李糖苷
用pH6.5、50mM磷酸钠缓冲液配制反应体系10mL,鼠李糖终浓度为0.4M,酶的添加量为8μg/mL。在55℃反应48小时后,100℃煮沸5分钟,终止反应。
3.5-氟-2'-脱氧脲苷鼠李糖苷的纯化
将煮沸后的反应液12000转/分钟离心30分钟,吸取上清液,用规格15mm×100cm的Bio-gel P2色谱柱分离,以水为流动相,流速0.2mL/分钟,收集洗脱样品,薄层层析检测,合并在紫外灯下显色的产物,即为糖苷产物的混合物。然后再通过Agilent 1200 HPLC系统,流速为1.0mL/min,流动相为乙腈:水体积比70:30,紫外检测波长为294nm,合并保留时间相同的产物,冷冻干燥后制成粉末。共分离获得两种不同的糖苷产物,在Waters Spherisorb5.0μm NH24.6mm×250mm色谱柱有不同的保留时间,按出峰时间的先后分别标记为5-氟-2'-脱氧脲苷衍生物1和5-氟-2'-脱氧脲苷衍生物2。
4.5-氟-2'-脱氧脲苷鼠李糖苷衍生物的结构鉴定
分别取上述两种5‐氟‐2'‐脱氧脲苷鼠李糖苷用水稀释为质量百分比为1%的溶液,进行质谱分析。两种目标产物的特征分子离子峰(m/z)[M+Na]+均为415.111(如图1、7所示),判断产物的分子量为392,与预期产物分子量一致。
取5‐氟‐2'‐脱氧脲苷糖苷衍生物1、2各5mg粉末溶于氘代水,进行核磁解析,综合氢谱(如图2、8所示)、碳谱(如图3、9所示)、氢氢相关谱(COSY)(如图4、10所示)、碳氢直接相关谱(HSQC)(如图5、11所示)、碳氢远程相关谱(HMBC)(如图6、12所示),确定各位置碳氢的化学位移和偶合常数。鼠李糖基C‐1、H‐1偶合常数分别为170.5Hz和171.3Hz,推断鼠李糖基通过α键与5‐氟‐2'‐脱氧脲苷分子相连,同时在碳氢远程相关谱(HMBC)中观测到了鼠李糖基C‐1位分别和脱氧核糖基H‐3位,(如图6所示)和H‐5位(如图12所示)的交叉峰,鉴定新合成的产物分别为3’‐O‐α-L-鼠李糖基-5-氟‐2'‐脱氧脲苷(5-flurouracilα-L-rhamnopyranosyl-(1→3)-1-β-D-2’-deoxyribofuranosyl)和5’‐O‐α-L-鼠李糖基-5-氟‐2'‐脱氧脲苷(5-flurouracilα-L-rhamnopyranosyl-(1→5)-1-β-D-2’-deoxyribofuranosyl)。
3’‐O‐α-L-鼠李糖基-5-氟‐2'‐脱氧脲苷化学结构式如下:
5’‐O‐α-L-鼠李糖基-5-氟‐2'‐脱氧脲苷化学结构式如下:
上述质谱分析所用仪器为岛津LCMS‐IT‐TOF质谱仪(日本);核磁分析所用仪器为AVANCE600型超导超屏蔽傅立叶变换核磁共振波谱仪(瑞士Bruker公司)。
实施例2
一种酶法制备5-氟-2'-脱氧脲苷鼠李糖苷的方法,包括如下步骤:
(1)采用磷酸缓冲液配制鼠李糖浓度为0.3M,5-氟-2'-脱氧脲苷浓度为0.4M,氨基酸序列如SEQ ID NO.1所示的α-L-鼠李糖苷酶添加量为5μg/mL的反应体系;
所述步骤(1)中的磷酸缓冲液为浓度10mM,pH6的磷酸钠缓冲液;
(2)将步骤(1)制得反应体系于45℃水浴中反应40h,100℃煮沸5分钟终止反应,10000转/分钟离心30分钟,取上清液;
(3)将步骤(2)制得的上清液,经分离,薄层层析检测,合迁移距离相同并在紫外灯下显色的产物,冷冻干燥后,制得5-氟-2'-脱氧脲苷鼠李糖苷;
所述步骤(3)中的分离采用TLC回收,方法如下:
将煮沸后的反应液12000转/分钟离心30分钟,吸取上清液,在制备薄层层析板(PLC Silica gel 60 F254,Merck)点样展层;展层结束后,在层析板上每隔10cm取1cm宽的条形小板显色,判定目标糖类在层析板上的位置,然后刮取层析板未显色区域含目标糖苷的硅胶粉末,将其重新溶解于水中,离心取上清,冷冻干燥后所得粉末即为5-氟-2'-脱氧脲苷鼠李糖苷。
上述薄层层析检测的步骤如下:
取1μL洗脱液,薄层层析板点样,在展层剂中展开,于紫外灯下观察显色产物;上述展层剂由氯仿和甲醇按体积比9:1混合配制。
产物经结构鉴定,与实施例1的结果一致。
实施例3
一种酶法制备5-氟-2'-脱氧脲苷鼠李糖苷的方法,包括如下步骤:
(1)采用磷酸缓冲液配制鼠李糖浓度为0.5M,5-氟-2'-脱氧脲苷浓度为0.6M,氨基酸序列如SEQ ID NO.1所示的α-L-鼠李糖苷酶添加量为10μg/mL的反应体系;
所述步骤(1)中的磷酸缓冲液为浓度100mM,pH8的磷酸钠缓冲液;
(2)将步骤(1)制得反应体系于60℃水浴中反应60h,100℃煮沸5分钟终止反应,12000转/分钟离心30分钟,取上清液;
(3)将步骤(2)制得的上清液,经分离,薄层层析检测,合迁移距离相同并在紫外灯下显色的产物,冷冻干燥后,制得5-氟-2'-脱氧脲苷鼠李糖苷;
所述步骤(3)中的分离采用两步分离,初步分离采用规格15mm×100cm的Bio-gel P2色谱柱,以水为流动相,单次样品上样量为3mL,洗脱流速为0.3mL/分钟;进一步分离采用Agilent 1200 HPLC系统Waters Spherisorb 5.0μm NH2 4.6mm×250mm色谱柱,流动相为乙腈-水,单次上样体积为10μL,流速为1.0mL/min,流动相为乙腈:水体积比70:30,紫外检测波长为294nm。
上述薄层层析检测的步骤如下:
取1μL洗脱液,薄层层析板点样,在展层剂中展开,于紫外灯下观察显色产物;上述展层剂由氯仿和甲醇按体积比9:1混合配制。
产物经结构鉴定,与实施例1的结果一致。
5-氟-2'-脱氧脲苷在体内代谢速度快、选择性差、毒副作用较大。鼠李糖苷修饰的5-氟-2'-脱氧脲苷通过其携带的鼠李糖苷与肿瘤表面的鼠李糖凝集素相结合,将药物靶向传递到肿瘤细胞,从而提高了药物的肿瘤细胞识别专一性和抗肿瘤效果,降低药物对正常细胞的毒性,减少毒副作用。
- 还没有人留言评论。精彩留言会获得点赞!