一种改性脂肪酶及其制备方法与流程
本发明属于脂肪酶领域,具体涉及一种改性脂肪酶及其制备方法。
背景技术:
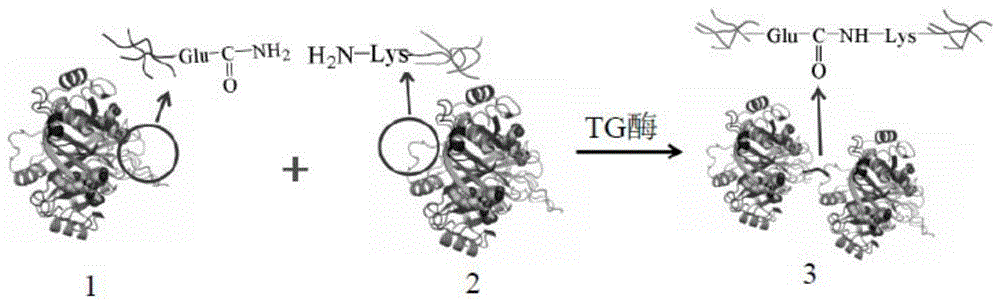
:脂肪酶是重要的工业酶制剂品种之一,可以催化解脂、酯交换、酯合成等反应,广泛应用于油脂加工、食品、医药、日化等工业。而一般工业生产的温度较高,脂肪酶的热稳定性差限制了其在工业生产中的应用。脂肪酶的热稳定性好,则更加有利于工业生产、运输和保存的过程,同时也意味着脂肪酶的使用寿命更长。因此有必要提供一种安全便捷的提高脂肪酶稳定性的方法。目前,提高脂肪酶的热稳定性的方法有很多种,比如分子改造、化学修饰等。分子改造主要采用理性设计定向进化等手段,但具体的突变位点往往难以确定。化学修饰包括对酶分子表面的基团进行修饰(氨基化,烷基化等)、固定化,化学交联等方法。通过分子间的交联可以改善酶分子的结构,增加酶的刚性,从而提高酶的热稳定性。化学交联常用的交联剂是戊二醛,但戊二醛存在一定的毒性,且对初始酶活力会有一定的损害。akbulutn等(akbulutn,mt,pijningt,etal.improvedactivityandthermostabilityofbacilluspumiluslipasebydirectedevolution[j].journalofbiotechnology,2013,164(1):123-129)通过对脂肪酶基因进行改组,使其在50℃下的半衰期延长到38.5min。khanahmadis等(khanahmadis,yusoff,amida,etal.optimizedpreparationandcharacterizationofclea-lipasefromcocoapodhusk[j].journalofbiotechnology,2015,185:153-161)利用戊二醛制备交联酶聚集体将脂肪酶的耐受温度提高10℃。中国专利cn201410288942.4提供了一种提高脂肪酶稳定性的方法,以高碘酸钠为氧化剂,氧化处理多糖制备氧化多糖,再以氧化多糖为修饰剂对米根霉脂肪酶进行化学修饰。修饰后的脂肪酶在50℃处理30min后,相对于未修饰脂肪酶,修饰后的脂肪酶稳定性提高78%。目前,上述用于提高脂肪酶稳定性的方法,无论是分子改造还是化学修饰,均无法应用于工业化脂肪酶稳定性的提高。技术实现要素:本发明所要解决的技术问题是针对现有技术的不足提供一种改性脂肪酶,该改性脂肪酶的热稳定性比采用现有技术改性后制得的脂肪酶的热稳定性有较大程度的改善,适用于工业化推广使用。本发明还提供一种改性脂肪酶的制备方法,该方法简单、安全无毒,且效果明显,所制备的改性脂肪酶的热稳定性比现有技术改性后制得的脂肪酶的热稳定性有较大程度的改善,可应用于工业化脂肪酶稳定性的提高。为此,本发明第一方面提供了一种改性脂肪酶,其由含有脂肪酶的底物在谷氨酰胺转氨酶的作用下进行交联反应制得。根据本发明,所述底物的溶液为脂肪酶溶液或脂肪酶溶液与保护蛋白溶液的混合物。在本发明的一些实施例中,所述脂肪酶包括脂肪酶粉、胞外产脂肪酶和细胞破壁后的发酵液中的一种或几种。在本发明的另一些实施例中,所述保护蛋白质包括明胶和/或牛血清蛋白。根据本发明,所述改性脂肪酶在50℃下的稳定时间≥60分钟。本发明第二方面提供了一种改性脂肪酶的制备方法,其以含有脂肪酶的底物在谷氨酰胺转氨酶的作用下进行交联反应,制得改性脂肪酶。根据本发明,所述底物的溶液为脂肪酶溶液或脂肪酶溶液与保护蛋白溶液的混合物。在本发明的一些实施例中,所述脂肪酶溶液是以磷酸缓冲液为溶剂与脂肪酶配制而成。在本发明的另一些实施例中,所述保护蛋白溶液是以磷酸缓冲液为溶剂与保护蛋白配制而成。根据本发明,所述底物的溶液中脂肪酶溶液与保护蛋白溶液的质量浓度比例为1:2-2:1。本发明中,基于底物总重量计的谷氨酰胺转氨酶的用量为40-200u/g,优选基于底物总重量计的谷氨酰胺转氨酶的用量为120-200u/g。在本发明的一些实施例中,所述脂肪酶溶液和保护蛋白溶液的浓度范围均为1-30mg/ml。在本发明的另一些实施例中,所述磷酸盐缓冲液的浓度为50-100mm,优选所述磷酸盐缓冲液的浓度为80-100mm。本发明中,所述磷酸盐缓冲液的ph值为6-8,优选所述磷酸盐缓冲液的ph值为7-8。在本发明的一些实施例中,所述脂肪酶包括脂肪酶粉、胞外产脂肪酶和细胞破壁后的发酵液中的一种或几种。在本发明的另一些实施例中,所述保护蛋白质包括明胶和/或牛血清蛋白。根据本发明,所述交联反应的温度为20-30℃,优选交联反应的温度为25-30℃;所述交联反应的时间为22-26h,优选所述交联反应的时间为24-26h。在本发明的一些实施例中,所述交联反应在摇床中进行;所述摇床的转速为100-200rpm,优选所述摇床的转速为180-200rpm。附图说明下面将结合附图来说明本发明。图1为tg酶催化脂肪酶或脂肪酶和保护蛋白发生分子间或分子内的交联反应示意图;图中附图标记的含义如下:1脂肪酶;2脂肪酶或保护蛋白;3改性脂肪酶。图2示出交联反应时间对改性脂肪酶酶活力的影响结果。图3示出交联反应温度对改性脂肪酶酶活力的影响结果。图4示出反应液ph值对改性脂肪酶酶活力的影响结果。图5为采用本发明方法制备改性脂肪酶过程中交联前后热稳定性比较图。具体实施方式为使本发明容易理解,下面将详细说明本发明。如前所述,用于提高脂肪酶稳定性的方法,无论是分子改造还是化学修饰,均无法应用于工业化脂肪酶稳定性的提高。本发明人研究发现用于提高脂肪酶稳定性的分子改造,操作复杂,耗时长,因而无法应用于工业化脂肪酶稳定性的提高;而用于提高脂肪酶稳定性的化学修饰,往往涉及有毒的修饰剂,操作工艺复杂,经济可行性低,因而也无法用于工业化脂肪酶稳定性的提高。本发明人进一步研究发现,使用谷氨酰胺转氨酶(tg酶)可催化脂肪酶发生分子间或分子内的交联,也可以催化脂肪酶与其他蛋白质分子共交联,从而形成网络大分子聚合物。具体说来tg酶可以催化蛋白质赖氨酸(lys)残基的ε-nh2和谷氨酸(glu)残基的γ-conh2形成异肽键[ε-(γ-谷酰胺)-赖氨酸],造成蛋白质分子间或分子内的交联,如图1和反应式(ⅰ)所示。这种交联对蛋白质的性质、胶凝能力、热稳定性等有显著影响,从而改善蛋白质的结构和功能性质,增加酶分子的刚性,使得交联后的脂肪酶的热稳定性显著提高。tg酶一般用于食品加工,本发明人首次将tg酶应用于具有活性的蛋白(脂肪酶)的改性。本发明正是基于上述发作出的。因此,本发明第一方面所涉及的改性脂肪酶可以理解为一种新型的提高了热稳定性的改性脂肪酶,其由含有脂肪酶的底物在谷氨酰胺转氨酶的作用下进行交联反应制得。在一些实施例中,例如,所述改性脂肪酶在50℃下的稳定时间≥60分钟。本发明中所述“底物的溶液”亦称“底物溶液”,其为脂肪酶溶液或脂肪酶溶液与保护蛋白溶液的混合物,其中所述底物为脂肪酶或脂肪酶与保护蛋白的混合物,因此,所述底物溶液也可以理解为由脂肪酶或脂肪酶与保护蛋白的混合物与溶剂,例如磷酸缓冲液配制而成的混合物溶液。在本发明的一些实施例中,所述脂肪酶包括脂肪酶粉、胞外产脂肪酶和细胞破壁后的发酵液中的一种或几种;优选所述脂肪酶为解脂耶氏酵母(yarrowialipolytica)脂肪酶。本发明对脂肪酶的来源没有特别的限制,例如,所述脂肪酶可以为市售产品,如novozym435,也可以由本发明人实验室于2005年9月30日保藏于中国微生物菌种保藏管理委员会普通微生物中心(地址:北京市海淀区中关村北一条13号中国科学院微生物所,邮编:100080),保藏编号为cgmccno.1470的亚罗解脂酵母(yarrowialipolytica)菌(参见中国专利cn200510112638.5)发酵制得;优选所述脂肪酶由保藏编号为cgmccno.1470的亚罗解脂酵母菌发酵制得。在本发明的另一些实施例中,所述保护蛋白质优选易于被tg酶催化交联的蛋白质,其包括明胶和/或牛血清蛋白。本发明对tg酶没有特别的限制,例如所述tg酶可以为市售产品,如可以购自东圣食品科技有限公司。在本发明的一些实施例中,所述底物的溶液中脂肪酶溶液与保护蛋白溶液的质量浓度比例为1:2-2:1;优选所述底物的溶液中脂肪酶溶液与保护蛋白溶液的质量浓度比例为1:1。在本发明的一些实施例中,基于底物总重量计的谷氨酰胺转氨酶的用量为40-200u/g。优选基于底物总重量计的谷氨酰胺转氨酶的用量为120-200u/g。进一步优选基于底物总重量计的谷氨酰胺转氨酶的用量为120u/g。根据本发明方法,所述脂肪酶溶液是以磷酸缓冲液为溶剂与脂肪酶配制而成。在本发明的一些实施例中,所述脂肪酶溶液的浓度范围为1-30mg/ml。根据本发明方法,所述保护蛋白溶液是以磷酸缓冲液为溶剂与保护蛋白配制而成。在本发明的一些实施例中,所述保护蛋白溶液的浓度范围为1-30mg/ml。在本发明的一些实施例中,所述磷酸盐缓冲液的浓度为50-100mm;优选所述磷酸盐缓冲液的浓度为80-100mm;进一步优选所述磷酸盐缓冲液的浓度为80mm。在本发明的一些实施例中,所述磷酸盐缓冲液的ph值为6-8;优选所述磷酸盐缓冲液的ph值为7-8;进一步优选所述磷酸盐缓冲液的ph值为7。本发明第二方面所涉及的改性脂肪酶的制备方法可以理解为一种提高脂肪酶稳定性的方法,具体包括以下步骤:(1)配制磷酸缓冲溶液。所述磷酸盐缓冲液的浓度为50-100mm;进一步优选所述磷酸盐缓冲液的浓度为80-100mm;更为优选地,所述磷酸盐缓冲液的浓度为80mm。在一定离子强度的缓冲液中可以保护脂肪酶的结构。若缓冲液的ph过高或过低,会使酶分子失活;而若离子强度太低则失去缓冲效果,离子强度过大会使酶分子失活。(2)配制脂肪酶溶液。以所述磷酸缓冲液为溶剂,加入脂肪酶,搅拌溶解均匀,制得脂肪酶溶液。所述脂肪酶包括脂肪酶粉、胞外产脂肪酶和细胞破壁后的发酵液中的一种或几种。(3)配制保护蛋白溶液。以所述磷酸缓冲液为溶剂,加入保护蛋白,加热溶解,制得保护蛋白溶液。加入保护蛋白一方面可以提供更多可供交联的基团,另一方面可以保护脂肪酶防止脂肪酶过度交联。所述保护蛋白质优选易于被tg酶催化交联的蛋白质,其包括明胶和/或牛血清蛋白。(4)制备底物的溶液。可以直接将所述脂肪酶溶液用作底物的溶液,或者将所述脂肪酶溶液与所述保护蛋白溶液混合得到所述底物的溶液。所述底物的溶液中所述脂肪酶溶液与保护蛋白溶液的质量浓度比例为1:2-2:1;优选所述底物的溶液中所述脂肪酶溶液与保护蛋白溶液的质量浓度比例为1:1。所述底物的溶液中所述脂肪酶溶液与保护蛋白溶液的质量浓度比例过低交联效果不明显,所述底物的溶液中所述脂肪酶溶液与保护蛋白溶液的质量浓度比例过高会使得交联反应过度,对脂肪酶结构改善作用不大。(5)制备反应液。向底物的溶液中加入tg酶,搅拌均匀后,制得反应液。基于底物总重量计的谷氨酰胺转氨酶的用量为40-200u/g。优选基于底物总重量计的谷氨酰胺转氨酶的用量为120-200u/g。进一步优选基于底物总重量计的谷氨酰胺转氨酶的用量为120u/g。tg酶加入量过少,催化效率低,加入过多则容易交联过度使酶失活。(6)进行交联反应。将反应液置于摇床中反应。所述摇床的转速为100-200rpm;优选摇床的转速为180-200rpm;进一步优选摇床的转速为180rpm。所述交联反应的温度为20-30℃;优选所述交联反应的温度为25-30℃;进一步优选所述交联反应的温度为25℃。温度过低,反应速度慢,温度过高脂肪酶容易失活。所述交联反应的时间为22-26h;优选所述交联反应的时间为24-26h;进一步优选所述交联反应的时间为24h。发明人研究发现,交联反应的时间过短,交联不充分,对脂肪酶的性能改善不明显;交联反应的时间过长,则容易交联过度,使酶分子失活。本发明所述用语“酶活”,亦称为“酶活力”,其定义为:在测定条件下,每分钟产生1μmol脂肪酸所需要的脂肪酶量,即为1个脂肪酶酶活单位,以u表示。本发明所述用语“改性脂肪酶或脂肪酶的稳定时间”是指改性脂肪酶或脂肪酶在一定温度条件下稳定的时间,例如在50℃下稳定的时间;这里所述稳定是指酶活力下降幅度低于5%。本发明中所述“解脂耶氏酵母”(yarrowialipolytica)一词,亦称为亚罗解脂酵母(yarrowialipolytica)。如前所述,谷氨酰胺转氨酶在食品领域已经有了广泛的应用,但是本发明人将其作为催化剂应用到具有活性的蛋白(脂肪酶)的交联反应中,从而避免了化学交联剂的使用,使得提高脂肪酶稳定性(即制备改性脂肪酶)的整个方法高效、安全、无毒。采用本发明方法制备改性脂肪酶(即提高脂肪酶的稳定性)既可以催化脂肪酶自身交联,而不引入其它的大分子或小分子物质,不会影响脂肪酶自身的性能;又可以催化脂肪酶与其它蛋白共交联,形成混合的网络大分子,提高酶的稳定性。该方法简单安全,更加有利于工业化生产。实施例为使本发明更加容易理解,下面将结合附图和实施例来来进一步详细说明本发明,这些实施例仅起说明性作用,并不局限于本发明的应用范围。本发明中所使用的原料或组分若无特殊说明均可以通过商业途径或常规方法制得。下述实施例中的解脂耶氏酵母脂肪酶均由本发明人实验室于2005年9月30日保藏于中国微生物菌种保藏管理委员会普通微生物中心(地址:北京市海淀区中关村北一条13号中国科学院微生物所,邮编:100080),保藏编号为cgmccno.1470的亚罗解脂酵母(yarrowialipolytica)菌发酵制得。本发明采用橄榄油乳化法来测定酶活力,即35℃条件下水解橄榄油-聚乙烯二醇(pva)乳化液10分钟的方法测定酶活力,具体方法如下:(1)制备橄榄油-聚乙烯二醇乳化液:以pva溶液与橄榄油的体积比为3:1的比例将质量浓度为3%的pva溶液与橄榄油混合,高速搅拌,制成均匀的乳化液;(2)配制乳化液反应体系:5ml橄榄油-聚乙烯二醇乳化液与4ml,0.1m,ph8的磷酸缓冲液混合,制成乳化液反应体系;(3)反应:35℃条件下,将乳化液反应体系预热5min后加入1ml稀释后的待测样品液(待测酶液),反应指定的时间后加入15ml无水乙醇终止反应,获得酶活力检测产物;上述反应可以在hzs-ha水浴振荡器(哈尔滨市东明医疗仪器厂)中进行。(4)结果检测:向酶活力检测产物中加入1-2滴酚酞指示剂,用0.05m的naoh进行滴定,获得待测样品滴定的naoh的体积。(5)酶活力计算:采用式(ⅱ)计算酶活力;酶活力其中:δv待测样品与空白样品滴定的naoh的体积差,单位ml;m每毫升naoh溶液所含的naoh微摩尔数;n样品的稀释倍数;t反应时间,单位min。实施例1:考察交联反应时间对改性脂肪酶酶活力的影响。(1)配制浓度为80mm的ph7.0的磷酸缓冲液;(2)以(1)中所配制的磷酸缓冲液为溶剂配制底物溶液:底物溶液1-1为脂肪酶溶液,其浓度为1mg/ml;底物溶液1-2为脂肪酶溶液与明胶(保护蛋白)溶液的混合物,并且在底物溶液ⅱ中脂肪酶浓度为1mg/ml,明胶(保护蛋白)的浓度为1mg/ml;(3)制备反应液:向底物溶液1-1中加入tg酶制成反应液1-1,tg酶添加量为120u每克底物。向底物溶液1-2中加入tg酶制成反应液1-2,tg酶添加量为120u每克底物。以底物溶液1-1作为对照反应液。(4)在25℃,转速为180rpm的条件下,分别将上述反应液1-1、1-2以及对照反应液反应12、24、36,48h。反应结束后,采用35℃条件下水解橄榄油-聚乙烯二醇(pva)乳化液10分钟的方法测定改性脂肪酶产物的酶活力,并与未改性脂肪酶的酶活力进行比较,结果如图2所示。从图2可以看出,加入明胶共交联的结果要优于脂肪酶单独交联;与对照组游离的脂肪酶相比,交联后的结果比不交联好;同时,还可看出最优反应时间为24h。实施例2:考察交联反应温度对改性脂肪酶酶活力的影响。(1)配制浓度为80mm的ph7.0的磷酸缓冲液;(2)以(1)中所配制的磷酸缓冲液为溶剂配制底物溶液:底物溶液2-1为脂肪酶溶液,其浓度为1mg/ml;底物溶液2-2为脂肪酶溶液与明胶(保护蛋白)溶液的混合物,并且在底物溶液2-2中脂肪酶浓度为1mg/ml,明胶(保护蛋白)的浓度为1mg/ml;(3)制备反应液:向底物溶液2-1中加入tg酶制成反应液2-1,tg酶添加量为120u每克底物。向底物溶液2-2中加入tg酶制成反应液2-2,tg酶添加量为120u每克底物。以底物溶液2-1作为对照反应液。(4)分别在20℃、25℃、30℃、35℃,转速为180rpm的条件下,将上述反应液2-1、2-2以及对照反应液反应24h。反应结束后,采用与实施例1相同的方法测定改性脂肪酶产物的酶活力,并与未改性脂肪酶的酶活力进行比较,结果如图3所示。从图3可以看出,若交联温度过高则酶容易失活,在20-25℃交联结果较好。实施例3:考察反应液ph值对改性脂肪酶酶活力的影响。(1)配制浓度为80mm的ph值分别为4、5、5.5、6、6.5、7、7.5、8的磷酸缓冲液;(2)分别以(1)中所述的磷酸缓冲液为溶剂配制底物溶液:底物溶液3-1到3-8为ph值分别为4、5、5.5、6、6.5、7、7.5、8的脂肪酶溶液,其浓度为1mg/ml;底物溶液3-21到3-28为ph值分别为4、5、5.5、6、6.5、7、7.5、8的脂肪酶溶液,其浓度为1mg/ml;底物溶液3-31到3-38为含有脂肪酶和明胶(保护蛋白)的ph值分别为4、5、5.5、6、6.5、7、7.5、8混合物溶液,并且在底物溶液3-31到3-38中脂肪酶浓度为1mg/ml,明胶(保护蛋白)浓度为1mg/ml。(3)制备反应液:向底物溶液3-1到3-8中加入tg酶制成反应液3-1到3-8,tg酶添加量为120u每克底物。向底物溶液3-31到3-38中加入tg酶制成反应液3-31到3-38,tg酶添加量为120u每克底物。以底物溶液3-21到3-28作为对照反应液3-21到3-28。(4)在25℃,转速为180rpm的条件下,分别将上述反应液3-1到3-8、3-31到3-38以及对照反应液3-21到3-28反应24h。反应结束后,采用与实施例1相同的方法测定改性脂肪酶产物的酶活力,并与未改性脂肪酶的酶活力进行比较,结果如图4所示。从图4可以看出,在ph7时的交联结果最好。实施例4:利用谷氨酰胺转氨酶催化脂肪酶交联,具体步骤如下:(1)配制浓度为80mm的ph7.0的磷酸缓冲液;(2)以(1)中所配制的缓冲液为溶剂,以脂肪酶为底物配制底物溶液,底物溶液的浓度为30mg/ml;(3)向底物溶液中加入tg酶制成反应液,tg酶添加量为120u每克底物。(4)在25℃,转速为180rpm的条件下,反应24h,制得改性脂肪酶。(5)检测酶的热稳定性在相同的反应条件下以非改性脂肪酶为对照组,与上述改性脂肪酶进行酶的热稳定性比较试验:将改性脂肪酶及对照组脂肪酶置于50℃的条件下,分别在0、2、3、5、10、15、20、30、45、60min时取样,并采用与实施例1相同的方法测其酶活力,比较非改性脂肪酶和改性脂肪酶在50℃下经历不同时间后的酶活力变化,结果如图5所示。从图5可以看出,非改性脂肪酶在50℃,1h后,酶活力保留率仅在30%左右;而采用tg酶交联之后获得的改性脂肪酶在50℃,1h后,酶活力几乎没有损失。说明采用本发明方法交联之后,所获得的改性酶的热稳定性得到显著的提高。实施例5:比较分别在戊二醛、京尼平和谷氨酰胺转氨酶(tg酶)存在条件下进行脂肪酶交联反应所获得的改性脂肪酶的酶活力。(1)配制浓度为80mm的ph7.0的磷酸缓冲液;(2)以(1)中所配制的磷酸缓冲液为溶剂配制底物溶液,其中脂肪酶浓度为0.5mg/ml,明胶浓度为0.5mg/ml;(3)制备反应液:在10ml底物溶液中加入0.5%(v/v)的戊二醛配制成反应液5-1;在10ml底物溶液中加入0.1的京尼平配制成反应液5-2;在10ml底物溶液中加入tg酶配制成反应液5-3,tg添加量为120u每克底物;(4)在25℃,转速为180rpm的条件下,将反应液5-1反应6h,反应液5-2和5-3反应24小时,制得改性脂肪酶。采用35℃条件下水解橄榄油-聚乙烯二醇(pva)乳化液10分钟的方法测定改性脂肪酶产物的酶活力,结果表1所示。表1利用交联剂和tg酶制得的改性脂肪酶的酶活力比较交联剂或催化剂戊二醛京尼平tg酶改性脂肪的酶活力保留率27.78%53.33%100%从表1可以看出以戊二醛和京尼平为交联剂进行脂肪酶交联,均会造成酶活力下降,尤其是以戊二醛为交联剂进行脂肪酶交联,对酶活力的造成的损失很大,而采用tg酶催化脂肪酶交联,酶活力基本没有损失。说明与化学交联剂相比,tg酶催化交联的过程更加温和,对脂肪酶活性结构的破坏较小。实施例6:利用tg酶催化脂肪酶与保护蛋白共交联制备改性脂肪酶。(1)配制浓度为80mm的ph7.0的磷酸缓冲液;(2)以(1)中所配制的磷酸缓冲液为溶剂,分别以脂肪酶、脂肪酶与保护蛋白(明胶或牛血清蛋白)的混合物为底物配制底物溶液:在底物溶液中,脂肪酶的浓度为0.5mg/ml,其它蛋白(明胶或牛血清蛋白)浓度为0.5mg/ml。(3)制备反应液:向底物溶液中加入tg酶制成反应液,tg酶添加量为120u每克底物。(4)在25℃,转速为180rpm的条件下,分别将上述的含有脂肪酶、明胶和tg酶的反应液6-1、含有脂肪酶、牛血清蛋白和tg酶的反应液6-2以及含有脂肪酶和tg酶的对照反应液6-3反应24h,制得改性脂肪酶。采用与实施例1相同的方法测定改性脂肪酶产物的酶活力,结果见见表2。表2添加不同保护蛋白交联结果比较蛋白种类脂肪酶脂肪酶+明胶脂肪酶+牛血清蛋白酶活保留率100%120%100%表2为本发明方法中添加不同的保护蛋白质(明胶、牛血清蛋白)与脂肪酶交联后的酶活力对比结果。令人意想不到的是,当添加的保护蛋白质为明胶或bsa时,酶活力不仅没有损失甚至还有一定程度的提高。应当注意的是,以上所述的实施例仅用于解释本发明,并不构成对本发明的任何限制。通过参照典型实施例对本发明进行了描述,但应当理解为其中所用的词语为描述性和解释性词汇,而不是限定性词汇。可以按规定在本发明权利要求的范围内对本发明作出修改,以及在不背离本发明的范围和精神内对本发明进行修订。尽管其中描述的本发明涉及特定的方法、材料和实施例,但是并不意味着本发明限于其中公开的特定例,相反,本发明可扩展至其他所有具有相同功能的方法和应用。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1