利用微波炉快速烘干植物叶片提取DNA的方法与流程
本发明涉及生物
技术领域:
中利用微波炉快速烘干植物叶片提取DNA的方法。
背景技术:
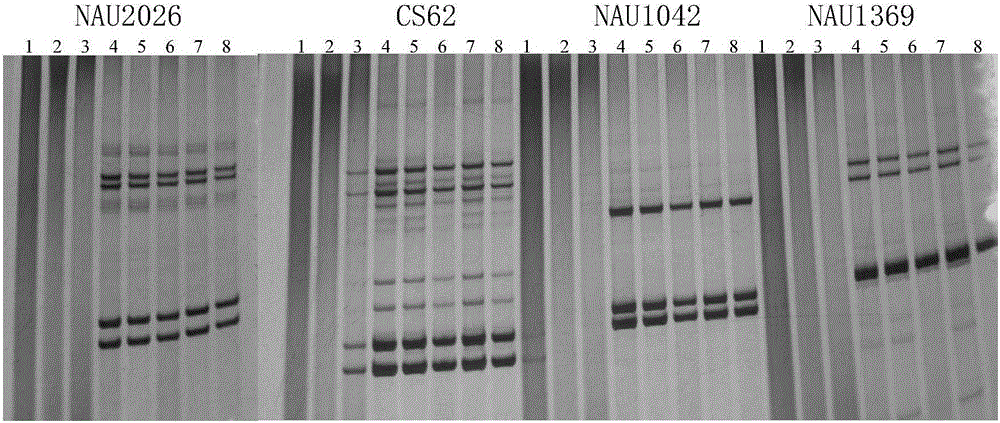
:植物DNA的提取是开展生物实验的基础,一般应用低温保鲜方法保存植物叶片,防止DNA的降解和氧化,如利用液氮保存或用冰袋保存,但携带均不方便。近年来采用硅胶干燥剂干燥植物叶片,用干燥后的叶片提取DNA,一般干燥时间需要48小时,中间还需要更换干燥剂,操作比较麻烦。目前急需一种可以快速烘干植物叶片提取DNA的方法。技术实现要素:本发明所要解决的技术问题是如何提取植物DNA。为解决上述技术问题,本发明首先提供了植物DNA提取方法,所述方法包括下述1)和2):1)用微波炉干燥离体植物器官和/或组织,得到干燥的植物器官和/或组织;2)提取所述干燥的植物器官和/或组织的DNA,得到DNA。上述方法中,所述微波为波长为0.12米的无线电波。上述方法中,所述植物组织和/或器官可为非幼嫩组织和/或器官。所述非幼嫩组织和/或器官具体可为非新生的组织和/或器官,如平展子叶或平展真叶。上述方法中,所述用微波干燥离体植物器官和/或组织具体可为将所述离体植物器官和/或组织在微波炉中进行处理,得到所述干燥的植物器官和/或组织。所述微波炉的工作频率可为2450兆赫。所述微波炉具体可为格兰仕集团产品,型号为G80F23N1P-M8。将所述离体植物器官和/或组织在所述微波炉中进行处理的条件具体可为a1)、a2)或a3):a1)高火条件下微波烘4分钟;a2)中火条件下烘6分钟;a3)低火条件下烘10分钟。上述方法中,所述2)可包括:21)破碎所述干燥的植物器官和/或组织,得到植物粉末;22)向所述植物粉末中加入细胞裂解液在65℃中反应60-70分钟,得到含有DNA的提取液,将该提取液称为提取液1,除去所述提取液1的杂质,得到DNA;所述细胞裂解液由水和溶质组成,所述溶质为Tris、EDTA钠盐、十六烷基三甲基溴化铵(CTAB)、聚乙烯吡咯烷酮(pvp)、NaCl、β-巯基乙醇和HCl,Tris、EDTA钠盐、十六烷基三甲基溴化铵(CTAB)、聚乙烯吡咯烷酮(pvp)、NaCl和β-巯基乙醇的浓度分别为0.1M、0.02M、2%(质量百分含量)、2%(质量百分含量)、1.5M、1%(体积百分含量),用HCl调节pH至8.0。所述离体植物器官和/或组织为可为直接从植物分离得到的植物组织和/或器官。上述方法中,所述干燥的植物器官和/或组织与所述细胞裂解液的配比为50mg:700-800μl,如50mg:700μl。上述方法中,所述除去所述提取液1的杂质可包括:向所述提取液1中加入溶液S得到含有DNA的提取液,将该提取液称为提取液2,除去所述提取液2的杂质,得到DNA;所述溶液S由氯仿和异戊醇组成,所述溶液S中氯仿和异戊醇的体积比为24:1。所述提取液1与所述溶液S的体积比可为1:1。上述方法中,所述除去所述提取液2的杂质可包括:将所述提取液2进行离心,使DNA进入上清液中,收集上清液,将该上清液称为上清液1,向所述上清液1中加入异丙醇得到含有DNA的提取液,将该提取液称为提取液3,除去所述提取液3的杂质,得到DNA。其中,异丙醇与所述上清液1的体积比可为2/3:1。上述方法中,所述除去所述提取液3的杂质可包括:将所述提取液3进行离心,使DNA进入沉淀中,收集沉淀,将该沉淀称为沉淀1,除去所述沉淀1的杂质,得到DNA。上述方法中,所述除去所述沉淀1的杂质可包括:用乙醇水溶液或乙醇洗涤所述沉淀1得到DNA。所述乙醇水溶液中乙醇的体积百分比可为70%。上述方法中,所述植物可为双子叶植物或单子叶植物。所述双子叶植物可为棉花。所述发射微波的装置具体可为微波炉。所述微波炉的工作频率可为2450兆赫。所述微波炉具体可为格兰仕公司产品,型号为G80F23N1P-M8。为解决上述技术问题,本发明还提供了所述方法在分子标记辅助育种中的应用,或所述方法在品种纯度检测或品种的真实性鉴定中的应用。上述应用中,所述植物可为双子叶植物或单子叶植物。所述双子叶植物可为棉花。上述应用中,所述植物组织和/或器官可为非幼嫩组织和/或器官。所述非幼嫩组织和/或器官具体可为非新生的组织和/或器官,如平展子叶或平展真叶。本发明中,所述平展真叶为从叶片长出平展及以后各时间段的叶片。本发明中,所述离心均可在4℃下进行。实验证明,本发明采用了微波炉烘干植物组织和器官,用于提取DNA,烘干时间短仅需4-10分钟,提取的DNA(浓度可达220.8-342.8ng/μl,OD260/OD280为2.00-2.03)应用于SSR分子标记效果与新鲜叶片提取的DNA一样,谱带清晰。并且微波炉烘干后当天提取的DNA和微波炉烘干放置一个星期提取的DNA质量均较好(浓度可达124.7-319.7ng/μl,OD260/OD280为2.02-2.06),均适用于SSR分子鉴定。本发明的植物DNA提取方法适用于在不具备分子实验的条件下先将植物组织和器官快速烘干然后再进行DNA的提取,并且快速烘干,不影响DNA的提取,异地取样简单,携带方便。本发明的植物DNA提取方法可应用于分子辅助育种,高代材料选择单株,能起到加快育种进程。这个方法可以从棉花的叶片烘干推广到其他植物的应用,应用范围广。附图说明图1为GK102不同时期的真叶在微波炉中火干燥后的提取的DNA的PCR结果。图2为石抗126平展子叶在低火、中火和高火烘干后提取的DNA在SSR引物CS62扩增后的图谱。图3为GK102的全展真叶在低火、中火和高火烘干后提取的DNA在SSR引物扩增后的图谱。图4为石抗126平展子叶在低火、中火和高火烘干后一个星期提取的DNA的SSR引物扩增图谱。图5为GK102全展真叶在低火、中火和高火烘干后一个星期提取的DNA扩增图谱。图6为GK102鲜叶提取的DNA的SSR引物扩增图谱。具体实施方式下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。下述实施例中的用到的棉花为GK102(2015年国家审定的棉花品种,山东鑫秋种业科技有限公司)和石抗126(国家棉花区试的对照品种,石家庄市农林科学研究院)。下述实施例中的微波炉为格兰仕公司产品,型号为G80F23N1P-M8,工作时发射的微波为波长为0.12米的无线电波,微波功率为800w。该微波炉的低火、中火和高火的工作方式分别为高火:100%功率输出,中火:66%功率输出,低火:17%功率输出。下述实施例中的细胞裂解液由水和溶质组成,溶质为Tris、EDTA钠盐、十六烷基三甲基溴化铵(CTAB)、聚乙烯吡咯烷酮(pvp)、NaCl、β-巯基乙醇和HCl,Tris、EDTA钠盐、十六烷基三甲基溴化铵(CTAB)、聚乙烯吡咯烷酮(pvp)、NaCl和β-巯基乙醇的浓度分别为0.1M、0.02M、2%(质量百分含量)、2%(质量百分含量)、1.5M、1%(体积百分含量),用HCl调节pH至8.0。实施例1、干燥棉花子叶和真叶DNA的提取1、干燥棉花子叶和真叶DNA的提取实验设重复,每次重复的实验方法如下:1.1棉花子叶和真叶的干燥采集石抗126的平展子叶,随机分为三组,分别为低火子叶组、中火子叶组和高火子叶组,将低火子叶组、中火子叶组和高火子叶组分别用微波炉的低火、中火和高火进行处理,处理方式分别为低火烘10分钟,中火烘6分钟,高火烘4分钟,得到低火干燥子叶、中火干燥子叶和高火干燥子叶(当天采集当天干燥)。采集GK102未展开的真叶嫩叶、全展开的真叶嫩叶和深绿色的成熟真叶(将其记为老叶),将这三种真叶均采用中火烘6分钟,得到中火干燥未展嫩叶、中火干燥全展嫩叶和中火干燥老叶。另采集全展开的真叶,随机分为三组,分别为低火全展真叶组、中火全展真叶组和高火全展真叶组,将低火全展真叶组、中火全展真叶组和高火全展真叶组分别用微波炉的低火、中火和高火进行处理,处理方式为低火烘10分钟,中火烘6分钟,高火烘4分钟,得到低火干燥全展真叶、中火干燥全展真叶和高火干燥全展真叶。1.2干燥棉花子叶和真叶当天进行DNA的提取将步骤1.1得到的各干燥叶片——石抗126低火干燥子叶、中火干燥子叶、高火干燥子叶和GK102中火干燥未展嫩叶、中火干燥全展嫩叶、中火干燥老叶、低火干燥全展真叶、中火干燥全展真叶、高火干燥全展真叶按照如下方法提取DNA(当天采集干燥当天提取),每种叶片设置至少三个重复:a1)将50mg左右干燥叶片置入2ml的离心管中,放入一粒直径5mm的钢珠,用MM301混合型研磨仪研磨,得到叶片粉末;a2)向步骤a1)的叶片粉末中加入700μl细胞裂解液摇匀,在65℃的水浴中反应60分钟,中间每10分钟缓慢颠倒离心管,得到含有DNA的提取液,将该提取液称为提取液1;a3)向步骤a2)的提取液1中加入与提取液1等体积的溶液S(溶液S由氯仿和异戊醇组成,其中氯仿和异戊醇的体积比为24:1),盖上盖子后,缓慢颠倒30-50下,得到含有DNA的提取液,将该提取液称为提取液2;将提取液2在4℃、12000r/min下进行离心,离心时间为10分钟,使DNA进入上清液中,收集上清液,将该上清液称为上清液1;a4)向步骤a3)的上清液1中加入与上清液1等体积的溶液S,盖上盖子后,缓慢颠倒30-50下,得到含有DNA的提取液,将该提取液称为提取液2′;将提取液2′在4℃、12000r/min下进行离心,离心时间为10分钟,使DNA进入上清液中,收集上清液,将该上清液称为上清液1′;a5)向步骤a4)的上清液1′中加入为上清液1′2/3体积的预冷的异丙醇得到含有DNA的提取液,将该提取液称为提取液3;a6)将步骤a5)的提取液3在4℃、8000r/min下进行离心,离心时间为1分钟,使DNA进入沉淀中,收集沉淀,将该沉淀称为沉淀1;用乙醇水溶液(乙醇水溶液中乙醇的体积百分比为70%)洗涤沉淀1两次,再用乙醇洗涤一次,真空抽干,得到DNA。将DNA用100μl的双蒸水溶解,得到DNA溶液。按照步骤a1)-a6)的方法,共得到低火干燥子叶DNA溶液、中火干燥子叶DNA溶液、高火干燥子叶DNA溶液、中火干燥未展真叶DNA溶液、中火干燥全展嫩叶DNA溶液、中火干燥老叶DNA溶液、低火干燥全展真叶DNA溶液、中火干燥全展真叶DNA溶液、高火干燥全展真叶DNA溶液。1.3保存一段时间后干燥棉花子叶和真叶DNA的提取将步骤1.1得到的各干燥叶片——低火干燥子叶、中火干燥子叶、高火干燥子叶、低火干燥全展真叶、中火干燥全展真叶和高火干燥全展真叶分别装入2ml的离心管中密封,室温放置一个星期后,分别按照步骤1.2中的提取DNA的方法进行DNA的提取,每种叶片设置至少三个重复,得到低火干燥子叶DNA溶液′、中火干燥子叶DNA溶液′、高火干燥子叶DNA溶液′、低火干燥全展真叶DNA溶液′、中火干燥全展真叶DNA溶液′和高火干燥全展真叶DNA溶液′。2、新鲜棉花叶片DNA的提取采用CTAB法提取新鲜棉花叶片DNA,具体步骤如下:b1)采集GK102棉花幼嫩叶片(即新鲜叶片)1-2片(200mg左右),直接装于2ml的离心管中,放入一粒直径5mm的钢珠,用MM301混合型研磨仪进行冷冻研磨,得到幼嫩叶片粉末;b2)向步骤b1)的幼嫩叶片粉末加入700μl细胞裂解液摇匀,在65℃的水浴中反应40分钟,中间每10分钟缓慢颠倒离心管,得到叶片提取液1;b3)向步骤b2)的叶片提取液1中加入与叶片提取液1等体积的溶液S,盖上盖子后,缓慢颠倒30-50下,在4℃、12000r/min下进行离心,离心时间为10分钟,收集上清液,将该上清液命名为叶片提取液2;b4)向步骤b3)的叶片提取液2中加入与叶片提取液2等体积的溶液S,盖上盖子后,缓慢颠倒30-50下,在4℃、12000r/min下进行离心,离心时间为10分钟,收集上清液,将该上清液命名为叶片提取液3;b5)向步骤b4)的叶片提取液3中加入是叶片提取液3大约2/3体积的预冷的异丙醇,缓慢颠倒离心管,直至有絮状沉淀集结,静止10分钟,用移液器枪头把絮状物挑到离心管中;用乙醇水溶液(乙醇水溶液中乙醇的体积百分比为70%)洗涤絮状物两次,再用乙醇洗涤一次,风干,得到新鲜叶片DNA。将新鲜叶片DNA用500μl的双蒸水溶解,得到新鲜叶片DNA溶液,保存于-20℃冰箱中备用。3、提取得到的DNA的鉴定3.1DNA质量检测(NANODROP2000)利用超微量分光光度计NANODROP2000分别检测步骤1中各DNA溶液与步骤2中新鲜叶片DNA溶液中DNA的浓度和纯度,结果平均值见表1和表2。表1、微波炉烘干叶片后当天提取的及鲜叶提取的DNA质量检测结果DNA溶液序号浓度(ng/μl)OD260/OD280低火干燥子叶DNA溶液1286.22.03中火干燥子叶DNA溶液2220.82.02高火干燥子叶DNA溶液3208.32.03低火干燥全展真叶DNA溶液4342.82.01中火干燥全展真叶DNA溶液5231.82.00高火干燥全展真叶DNA溶液6312.32.01新鲜叶片DNA溶液7324.31.91表2、微波炉烘干叶片后密封一个星期后提取的DNA质量检测结果处理序号浓度(ng/μl)OD260/OD280低火干燥子叶DNA溶液′1258.82.04中火干燥子叶DNA溶液′2220.02.06高火干燥子叶DNA溶液′3256.12.05低火干燥全展真叶DNA溶液′4236.42.04中火干燥全展真叶DNA溶液′5319.72.02高火干燥全展真叶DNA溶液′6124.72.02结果显示,新鲜叶片DNA溶液中DNA的平均浓度为324.3ng/μl,OD260/OD280平均为1.91。在微波炉烘干叶片后当天提取DNA时,低火干燥子叶DNA溶液、中火干燥子叶DNA溶液、高火干燥子叶DNA溶液、低火干燥全展真叶DNA溶液、中火干燥全展真叶DNA溶液、高火干燥全展真叶DNA溶液的平均浓度分别为286.2、220.8、208.3、342.8、231.8和312.3ng/μl,OD260/OD280平均分别为2.03、2.02、2.03、2.01、2.00和2.01。在微波炉烘干叶片密封室温放置一个星期后提取DNA,低火干燥子叶DNA溶液′、中火干燥子叶DNA溶液′、高火干燥子叶DNA溶液′、低火干燥全展真叶DNA溶液′、中火干燥全展真叶DNA溶液′、高火干燥全展真叶DNA溶液′的平均浓度分别为258.8、220.0、256.1、236.4、319.7和124.7,OD260/OD280平均值分别为2.04、2.06、2.05、2.04、2.02和2.02。子叶与全展真叶经微波干燥后提取的DNA浓度和质量不受干燥后放置时间的影响,子叶与全展真叶在干燥后可以密封放置,其DNA可满足随用随提。3.2DNA质量检测(SSR-PCR)利用表3中的引物对检测步骤1中各DNA溶液与步骤2中新鲜叶片DNA溶液中的DNA质量。表3、引物序列表序号引物对名称正向引物序列(5'to3')反向引物序列(5'to3')1CS62GATGGCTACCTCCCTTTGTA(序列1)CGTAAGGAAGCCTAGCAAAA(序列2)2NAU1042CATGCAAATCCATGCTAGAG(序列3)GGTTTCTTTGGTGGTGAAAC(序列4)3NAU1369TGGCAGAGATGAATGTAAGC(序列5)GGTAACGGATGGAAAATCAC(序列6)4NAU2026GAATCTCGAAAACCCCATCT(序列7)ATTTGGAAGCGAAGTACCAG(序列8)3.2.1SSR-PCR反应体系10μl:DNA模板1μl,10×Buffer(含MgCl2)1μl,10mMdNTPs0.3μl,2.5U/μlTaq酶0.2μl,10μM正向引物0.5μl,10μM反向引物0.5μl,6.5μlddH2O。反应程序:95℃预变性1分钟;94℃变性30秒,56℃退火45秒,72℃延伸1分钟,共30个循环;94℃变性1分钟,56℃退火45秒,72℃延伸2分钟,4℃保存。3.2.2电泳检测配胶:8%聚丙烯酰胺凝胶的组成:ddH2O21.2ml,5×TBE8ml,PAGE母液10.8ml,10%AP(10%过硫酸铵)720μL,TEMED(四甲基乙二胺)28.2μL,总量40ml。PAGE母液:丙烯酰胺:甲叉双丙烯酰胺=29:1,每30克加超纯水至100ml。电泳:将组装好的玻璃板装在电泳槽上,将配好的胶倒入玻璃板内,待胶完全凝固后加入1XTBE电泳液到电泳槽内,每个孔点样品1.8μL,180v电压1h。固定:用固定液固定10分钟。渗透:用渗透液渗透12分钟。蒸馏水快速洗两遍。显色:用显色液显色5分钟。蒸馏水洗两遍。终止:倒入终止液,终止反应。照相并记录结果。固定液:95%乙醇40ml+100%乙酸2ml+358mldH2O,共400ml。渗透液:0.6克AgNO3+300mlH2O。显色液:6克NaOH+5ml甲醛+2.5ml0.2%Na2S2O3(最后加)+400mldH2O(共400ml)。终止液:3克Na2CO3+400mldH2O。结果如图1-图6所示。图1为GK102不同时期的真叶用微波炉中火干燥后的DNA的PCR结果。其中,泳道1-3为中火干燥未展真叶DNA溶液,泳道4-6为中火干燥全展嫩叶DNA溶液,泳道7-8为中火干燥老叶DNA溶液。结果显示,未展平嫩叶经微波炉的中火干燥后得到的DNA质量均不好,均不能扩增出目的条带;而全展嫩叶与老叶经微波炉的中火干燥后得到的DNA质量均较好,利用NAU2026、CS62、NAU1042和NAU1369扩增得到的图谱与棉花品种指纹图谱库的结果一致。表明,未平展的真叶嫩叶不宜用微波炉干燥后提取DNA,而全展后真叶和老叶可以经微波炉干燥,且提取的DNA质量好。图2为石抗126子叶在低火、中火和高火烘干后提取的DNA在SSR引物CS62扩增后的图谱。其中,泳道1-3均为低火干燥子叶DNA溶液,泳道4-6均为中火干燥子叶DNA溶液,泳道7-9均为高火干燥子叶DNA溶液。图2的谱带一致,重复性好,且与棉花品种指纹图谱库的结果一致。表明,棉花子叶可以经微波炉干燥,且提取的DNA质量好。图3为GK102的全展真叶在低火、中火和高火烘干后提取的DNA在SSR引物扩增后的图谱。其中,泳道1-4均为低火干燥全展真叶DNA溶液,泳道5-8均为中火干燥全展真叶DNA溶液,泳道9-12均为高火干燥全展真叶DNA溶液,M为DNA分子量标准。结果显示,相同的引物的谱带一致,重复性好,且与棉花品种指纹图谱库的主带结果一致。表明,棉花全展真叶可以在微波炉中经低、中和高火干燥,且提取的DNA质量均很好。图4为石抗126子叶在低火、中火和高火烘干后一个星期提取的DNA的SSR引物扩增图谱。其中,泳道M均为DNA分子量标准,泳道1-3均为低火干燥子叶DNA溶液′,泳道4-6均为中火干燥子叶DNA溶液′,泳道7-9均为高火干燥子叶DNA溶液′。结果显示,相同的引物的谱带一致,重复性好,且与棉花品种指纹图谱库的结果一致。表明,棉花子叶在经微波干燥后提取的DNA的质量均很好,不受放置时间的影响,适合长途携带和邮寄,可以做到随用随提。图5为GK102全展真叶在低火、中火和高火烘干后一个星期提取的DNA扩增图谱。其中,泳道1-4均为低火干燥全展真叶DNA溶液′,泳道5-8均为中火干燥全展真叶DNA溶液′,泳道9-12均为高火干燥全展真叶DNA溶液′。结果显示,相同的引物的谱带一致,重复性好,且与棉花品种指纹图谱库的结果一致。表明,棉花全展真叶在经微波干燥后提取的DNA的质量均很好,不受放置时间的影响,适合长途携带和邮寄,可以做到随用随提。图6为GK102鲜叶提取的DNA的SSR引物扩增图谱。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1