一种藏药内生真菌来源的化合物及其制备方法和应用与流程
本发明属于医药技术领域。更具体地,涉及一种藏药内生真菌来源的化合物及其制备方法和应用。
背景技术:
藏药是我国医药宝库中的一大瑰宝,其大多数药材产于高原地区。青藏高原地域十分辽阔,气候复杂,垂直落差悬殊,整个地区包括寒带、寒温带、温带以及亚热带4个气候带。因此,其上植物种类繁多,藏药资源极其丰富。由于藏药大多生长在高寒地区,处在缺氧、昼夜温差大、日照强烈的特殊地理环境中,所以藏药具有抗旱、抗寒、繁殖方式特殊、光合作用所得有效积累高等特点,造就了藏药不同于一般植物的次生代谢成分,使其在临床上疗效明显高于低海拔地区的替代品。近年来,随着藏药产业化发展,使得藏药资源需求量急剧升高。我国基本一年消耗超过300吨的藏药资源,许多药材被滥挖滥采,导致一些珍贵藏药变成濒危物种。绿绒蒿为罂粟科绿绒蒿属的总称,全球共有49种,均生长在海拔3000米以上。而我国有38种,西藏出产27种,是最具特色的藏药品种之一[青海草业,2007,16( 4) : 50.]。绿绒蒿属植物是一年生或多年生的草本植物,是我国西藏地区重要的药用资源,如毛瓣绿绒蒿、多刺绿绒蒿等作为藏药被广泛使用,具有清热解毒、消炎等功效。[青海师范大学学报: 自然科学版, 2011(4):52.] 由于自然因素和人为因素的双重作用,如今藏药绿绒蒿已经面临绝种的危险。毛瓣绿绒蒿已在2000年被列入一级濒危藏药材。目前,山南藏药厂、藏医学院附属藏药厂已经用大花绿绒蒿替代毛瓣绿绒蒿入药。
植物内生菌是在植物内部组织中生长,与宿主植物共生互惠,但又不会引起宿主产生明显病害的一类微生物,包括细菌、真菌等。许多植物内生真菌都能分泌新型的生物活性化合物,这些代谢产物都是自然界中的潜在资源。部分植物内生真菌能够产生与宿主植物相同或相似的代谢产物,其可能是因为内生真菌与宿主植物长期的共生过程中,有一部分遗传基因在宿主中重新组合,从而获得与宿主分泌相同或相似代谢产物的能力。已从药用植物内生真菌代谢产物中分离出许多抗菌、抗肿瘤的活性物质[生物技术通报,2006,(3):33-37],但藏药内生菌次级代谢产物的研究还少见报道。
聚酮类生物碱化合物,其结构特点为取代十氢芴结构引入杂合酪氨酸环合结构,通常具有9-11个手性中心。该类化合物已报道的活性有抗菌、抗结核、抗肿瘤等,该骨架化合物于1999年首次被发现(Tetrahedron Lett.1999,6983-6986),迄今共有21个该骨架化合物发表,由于该类化合物结构特殊,活性显著,引起有机合成专家的关注,自2005年起,有多个课题组尝试了对该结构的全合成,主要工作集中于手性取代十氢芴的合成,直至2009年,首个该类结构化合物hirsutellone B得以完成全合成(Angew. Chem. Int. Ed.,2009,48,6870-6874),至今有两个课题组完成了该结构的全合成,合成步骤均在30步以上,最终得率在1%左右,因此通过化学合成的方法来合成该类结构的化合物仍然是不现实的。
在各种疾病中,癌症是致人死亡的主要疾病之一。抗癌药物的研发一直是药学研究的热点。抗肿瘤药物中有74%是天然产物或其衍生物,如紫杉醇及其衍生物就是目前临床上应用效果比较好的抗肿瘤药物。因此,从天然产物中寻找抗癌化合物或先导化合物具有重要的意义。藏药作为天然药物重要来源之一,来源于具有复杂而独特的自然条件和丰富多彩的动植物资源青藏高原,是我国具有完整理论体系的民族医药学的一部分。目前发现藏药在治疗心血管系统、肝胆疾病、呼吸系统的常见病、多发病和多种疑难杂症方面有着特殊的疗效,抗肿瘤药物的开发也具有巨大潜能。
技术实现要素:
本发明要解决的技术问题是克服上述现有技术中的各种问题缺陷和不足,提供一类源于西藏传统草药大花绿绒蒿内生真菌Neonectria sp.菌株DH24的新结构的化合物A16,以及该化合物的提取方法和在抗癌方面的应用。
本发明的目的是提供一种藏药内生真菌来源的化合物。
本发明另一目的是提供所述化合物的制备方法。
本发明的另一目的是提供所述化合物在抗癌方面的应用。
本发明上述目的通过以下技术方案实现:
一种藏药内生真菌来源的化合物,该化合物的分子量为487,其结构式如下式(I)所示:
该化合物从藏药传统草药大花绿绒蒿中分离的内生真菌菌株Neonectria sp. DH24的发酵培养物的乙酸乙酯粗提物中分离纯化得到的的新结构次级代谢产物,纯度为≥96%,属于聚酮类生物碱化合物。其结构运用核磁共振(1H-NMR, 13C-NMR, HSQC, HMBC,NOSEY)、高分辨质谱 (ESI-MS )等现代波谱技术进行测定。
其中,藏药内生真菌Neonectria sp. DH24分离自大花绿绒蒿的内生真菌,由西藏自治区高原生物研究所陈彬等人采集于西藏自治区山南地区错那县。该菌株已于2016年9月23日保藏于广东省微生物菌种保藏中心,保藏编号为GDMCC No:60081,保藏地址为广州市先烈中路100号大院59号楼5楼。
另外,上述藏药内生真菌来源的化合物的制备方法,包括如下步骤:
S1.种子培养液的获得
无菌条件下,将藏药内生真菌Neonectria sp. DH24菌株接入种子培养基,摇床培养,得到种子培养液。
S2.发酵
无菌条件下,将步骤S1所得的种子培养液接入发酵培养基中,静置培养得到发酵物;
S3.化合物提取分离
将步骤S2的发酵物用甲醇浸泡提取,所得甲醇提取液浓缩后,经正己烷萃取,氯仿萃取,乙酸乙酯萃取,浓缩得到各溶剂萃取物浸膏;其中,正己烷萃取物浸膏再经层析分离,得到式(I)的化合物A16。
其中,优选地,步骤S1所述种子培养基为PDB培养基,其比例配方如下:马铃薯 200-250g、葡萄糖18-23g、海盐20-30g、水1000mL。121℃、0.1MpPa灭菌25min后使用。
优选地,步骤S1所述摇床培养是18-22℃恒温摇床110-130rpm培养60-80小时。
更优选地,步骤S1所述摇床培养是20℃恒温摇床120rpm培养72小时。
优选地,步骤S2所述发酵培养基为大米培养基,其比例配方为:大米50-70g,海盐0.1-2g,水50-70mL。121℃、0.1MpPa灭菌25min后使用。
优选地,步骤S2所述静置培养的时间为45-60天。
优选地,步骤S2所述静置培养的温度为8-20摄氏度。
优选地,步骤S2所述静置培养的光照环境为:12h无光照,8℃;12小时有光照,20摄氏度;设置45个循环。
优选地,步骤S2所述静置培养的环境湿度为10-20%(优选为15%)。
优选地,步骤S3所述的甲醇的用量为与发酵物等体积。
优选地,用甲醇提取3次。
优选地,萃取用溶剂(正己烷、氯仿或乙酸乙酯)为甲醇用量的1/3。
优选地,所述层析分离是用柱层析硅胶进行柱层析分离。
优选地,所述柱层析硅胶的目数为200-300目。
优选地,柱层析分离进行侧吸分离时分别用10:0、9:1、8:2、7:3、6:4、5:5、4:6、3:7、2:8、1:9、0:10的石油醚:乙酸乙酯梯度淋洗,其中 8:2的石油醚-乙酸乙酯洗脱部分,经过葡聚糖凝胶Sephadex LH-20层析,用体积比为1:1的甲醇-二氯甲烷或石油醚-二氯甲烷为洗脱剂进一步洗脱,再经过Waters525-HPLC分离系统,C18半制备柱(10*460mm)用75%乙腈/水为溶剂纯化,保留时间为27min的组分为化合物A16。
本发明上述化合物具有显著的抑制癌细胞增殖的作用,可用于制备抗癌药物。因此,上述藏药内生真菌来源的化合物在制备抗肿瘤药物方面的应用,也在本发明的保护范围之内。
优选地,所述肿瘤为乳腺癌、肝癌、肺癌、肺腺癌或结肠癌。
更优选地,所述乳腺癌为乳腺癌细胞株MDA-MB-435。
更优选地,所述肝癌为肝癌细胞株HepG2。
更优选地,所述肺腺为肺癌细胞株A549。
更优选地,所述肺腺癌为肺腺癌细胞株Calu-3。
更优选地,所述结肠癌为结肠癌细胞株HCT-116。
本发明具有以下有益效果:
本发明提供了一种新型的藏药内生真菌来源的化合物,该化合物分离自西藏传统草药大花绿绒蒿内生真菌Neonectria sp.菌株DH24的次生代谢产物。研究显示,该类新化合物具有显著的抑制癌细胞增殖的作用,可用于制备抗癌药物,应用前景广阔。
而且,所述生产该化合物的菌株DH24具有可培养、易放大、易于实现工业化生产的特点,该化合物的制备方法简单,步骤简便,与现有技术中类似骨架化合物全合成方法相比,来源丰富,成本低廉;易于大规模生产应用。
附图说明
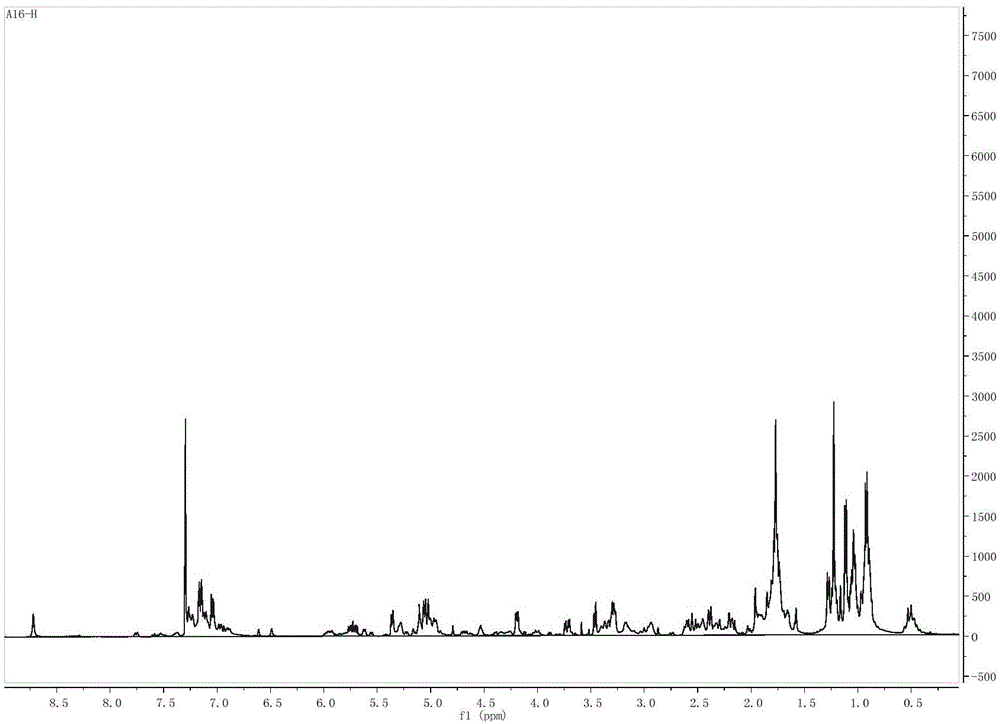
图1 为本发明A16化合物的核磁共振氢谱。
图2 为本发明A16化合物的核磁共振碳谱。
图3 为本发明A16化合物的H,H-cosy二维谱。
图4 为本发明A16化合物的HSQC二维谱。
图5 为本发明A16化合物的HMBC二维谱。
图6 为本发明A16化合物的ESI高分辨质谱。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
实施例1 大花绿绒蒿内生真菌DH24的分离鉴定
1、菌株的分离
藏药材大花绿绒蒿:由西藏自治区高原生物研究所陈彬等人采集于西藏自治区山南地区错那县。
通过对新鲜的藏药材大花绿绒蒿根部消毒,并削去外层根皮,切成小块状,无菌条件下接种到PDA培养基、Martin培养基或查氏培养基,室温培养(15-25摄氏度)以下培养5-20天,得到单菌落。
所得到的单菌落采用普通PDA培养基斜面4℃保藏。DH24菌落形态为土黄色短绒毛状菌丝,背面为黄褐色,有孢子生成。
2、菌株的鉴定
采用CTAB法提取上述分离到的藏药材内生真菌单菌落的纯培养的DNA,采用ITS间隔区的一对引物ITS1F和ITS4通过PCR扩增仪扩增ITS-rRNA基因片段,反应体系为50 uL,反应条件为:94℃预变性5 min,94℃变性40 s,52℃退火40 s,72℃延伸1 min,重复变性、退火和延伸三个步骤30个循环,最后72℃延伸补齐10 min。
通过葡聚糖凝胶电泳检测确定目标片段在600 bp左右,通过测序得出菌株的ITS-rRNA基因片段序列,在GenBank上通过BLAST在线比对搜索引擎对序列进行相似性分析,得到最大相似度为99%的菌株,确定该菌株为Neonectria sp. 属的真菌,命名为Neonectriasp.DH24,并于2016年9月23日保藏于广东省微生物菌种保藏中心,保藏编号为GDMCC No:60081,保藏地址为广州市先烈中路100号大院59号楼5楼。
实施例2 藏药内生真菌来源的新化合物A16的提取与表征
本发明的新化合物A16是在西藏传统草药大花绿绒蒿内生真菌菌株Neonectriasp. DH24的发酵培养物的乙酸乙酯粗提物中分离纯化得到的,纯度为≥96%。A16的分子量为487。其结构运用核磁共振(1H-NMR, 13C-NMR, HSQC, HMBC,NOSEY)、高分辨质谱 (ESI-MS )等现代波谱技术进行测定。
具体如下:
1、化合物的具体制备步骤如下:
S1 种子培养液的获得
S11 配制种子培养基:PDB培养基,组成按重量比为:马铃薯 200g,葡萄糖,20g,海盐30g,水1000mL,平均分装于4个500mL锥形瓶,121℃灭菌25min。
S12 种子的培养:将菌株Neonectria sp. DH24的菌株接入种子培养基,在20℃的温度下,置于恒温摇床以120rpm的转数,培养72小时得到种子培养液。
S2 发酵
发酵培养基:1000mL三角锥瓶内装60g大米,0.1g海盐,80mL水,经121℃(0.1MpPa)高温灭菌25min。
在超净工作台无菌操作下,将5mL步骤S1得到的种子培养液接入装有发酵培养基的锥形瓶中,共接种200瓶。于人工气候箱中,12h无光照,8℃,12小时有光照,20摄氏度,设置45个循环,设置培养箱湿度为15%。静置培养45天得到发酵物。
S3 化合物A16的提取分离:
将步骤S2培养好的发酵物以每瓶150ml甲醇提取三次,得到甲醇提取物;甲醇提取物经过浓缩得到浓缩物,浓缩物分别用正己烷进行萃取、氯仿萃取、乙酸乙酯萃取,每次萃取量为500mL,合并3次萃取溶剂,浓缩后得到各溶剂萃取物浸膏。其中,正己烷萃取物浸膏60g,该浸膏用200-300目的柱层析硅胶进行柱层析分离,具体为用10:0、9:1、8:2、7:3、6:4、5:5、4:6、3:7、2:8、1:9、0:10的石油醚:乙酸乙酯梯度淋洗,其中 8:2的石油醚-乙酸乙酯洗脱部分,经过葡聚糖凝胶Sephadex LH-20层析,用体积比为1:1石油醚-二氯甲烷为洗脱剂进一步洗脱,再经过Waters525-HPLC分离系统,C18半制备柱(10*460mm)用75%乙腈/水为溶剂纯化,保留时间为27min的组分为化合物A16(结构式(I)所示),得到产品8.0mg。
2、化合物的表征
(1)分离提取的化合物A16为淡黄色粉末状固体,对其进行核磁共振分析的谱图如图1~5所示,高分辨质谱如图6所示。
(2)化合物A16的结构分析的理化数据如下:
ESIMS m/z488.3[M+H]+,HRESIMS m/z 488.2795(calcd for C31H38O4N 488.2795)。1HNMR(400MHz,CDCl3)δ7.24(m,1H), 7.13(m,1H),7.11(m,1H), 7.01(dd,J = 8.4,2.2Hz, 1H), 5.69(m,1H), 5.32(d, J = 6.5 Hz, 1H), 5.05(m,1H), 5.00(m,1H), 4.16(dd, J = 6.9, 3.3Hz, 1H), 3.43(d, J = 6.9 Hz, 1H), 3.69(dd, J = 13.4, 5.0 Hz, 1H),3.26(m,1H), 2.53(m,1H), 2.35(d, J = 9.5 Hz, 1H), 2.16(dd, J = 9.3, 3.0 Hz, 1H), 1.89(m,1H), 1.79(m,1H),1.75(m,1H), 1.74(m,3H), 1.73(m,1H), 1.70(m,1H), 1.19(m,3H), 1.08(m,3H), 0.94(m,1H), 0.88(m,3H), 0.47(m,1H). 13CNMR(100MHz, CDCl3)δ206.0(C), 177.2(C), 172.9(C), 159.6(C), 141.7(CH), 136.6(C), 134.7(C), 131.5(CH), 129.0(CH), 128.3(CH), 124.0(CH), 122.0(CH), 115.5(CH2), 96.5(CH), 59.3(CH), 55.2(CH), 54.3(CH), 54.1(CH), 52.4(CH), 48.3(C), 47.9(CH2), 44.9(CH2), 34.6(CH2), 33.9(CH),28.3(CH), 27.4(CH),25.1(CH3), 23.5(CH3), 23.1(CH3), 20.2(CH3).
(3)从核磁共振及高分辨质谱的结构分析测试结果确定化合物A16的分子式为C31H37O4N,其结构式如下式(I)所示:
实施例3 藏药内生真菌来源的新化合物A16的抗癌活性测试
化合物的抗癌活性测试采用的是MTT法(T. Mosmann. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of immunological methods. Journal of Immunological Methods 1983, 65, 55-63.)。
1、材料
(1)四脞盐(MTT):用0.01mol/L 的磷酸盐缓冲液(PBS) 溶解MTT〔3,4,5-dimethythiazol-z-yl)2,5-diphenytetrazolium bromide,SIGMA〕终浓度5mg/ml,过滤除菌,分装后4 ℃避光保存。
(2)MTT裂解液的配制:80g的十二烷基磺酸钠溶解在200ml的N-N-二甲基甲酰胺中,水浴加热助溶,加入200ml蒸馏水,用80%乙酸与1N盐酸(1:1)混合调pH至4.7。
(3)细胞株选用:MDA-MB-435,HepG2,A549,HCT-116,A549 ,Calu-3肿瘤细胞株。于37 ℃下5%的CO2含量的空气中保藏。
2、操作步骤:
(1)单细胞悬液接种于96孔板(用培养基将细胞稀释至1×104/ml,每孔加入200µl稀释好的细胞),37 ℃,5%CO2,饱和湿度下培养24小时,(每组五个平行样);
(2)去除培养基,取新配制培养基按系列浓度制备A16药物溶液,每孔200µl,培养48小时;
(3)每孔加入2mg/ml的MTT 20µl,孵育4小时;
(4)尽量完全的吸出孔内培养液,加入DMSO液(150µl/孔),振荡10分钟,使结晶物充分溶解;
(5)酶标仪检测各孔OD值,(λ=570nm);
(6)以吸收液对药物浓度对数作图,求出IC50值。
3、抗肿瘤活性结果
结果如表1所示,化合物A16对乳腺癌细胞(MDA-MB-435)、肝癌细胞(HepG2)、结肠癌细胞(HCT-116)、肺腺癌细胞(Calu-3)、肺癌A549等多种癌细胞均表现出很好的抗癌活性。
表1
- 还没有人留言评论。精彩留言会获得点赞!