沟叶结缕草中一个新的耐盐基因ZmGnTL及其表达载体和应用的制作方法
本发明属于分子生物学领域,涉及盐生植物沟叶结缕草中一个新的耐盐基因ZmGnTL及其植物表达载体和应用。
背景技术:
土壤盐渍化是影响植物生长发育的重要胁迫因子,盐胁迫显著抑制植物生长发育,抗盐种质的培育利用显得非常关键;为了加快植物抗盐育种进程,快速高效的基因工程技术已经受到热捧和关注,挖掘优异的耐盐基因已成为耐盐育种的重要前提。
糖基转移酶(Glycosyltransferases,GT)作为蛋白糖基化(低聚糖以糖苷的形式与蛋白上特定的氨基酸残基共价结合)反应中的必要酶,成为糖生物学研究的重要组成部分,根据氨基酸和糖的连接方式不同可以分为:C位甘露糖化,N位糖基化,O位糖基化和GPI(glycophosphatidlyinositol)锚定连接四种类型。根据其催化的底物性质和序列相关性,植物中包括了91个GT家族(GT1—GT94,GT36,GT46和GT86除外),每个家族又包含多个成员;已有报道表明,两个尿苷二磷酸-葡萄糖醛酸转移酶基因(UGT85A5和UGT87A2)的过量表达显著提高了拟南芥和烟草耐盐性,而其它糖基转移酶的耐盐功能尚无报道。
本课题组前期通过表达文库筛选从盐生植物沟叶结缕草中获得了一个耐盐候选基因ZmGnTL(β-1,6-N-acetylglucosaminyltransferase like enzyme,N-乙酰氨基葡萄糖转移酶),其在水稻中的同源基因(LOC4333577)的功能未知,其在拟南芥中的同源基因AtGnTL(AT3G52060)编码的蛋白参与了胞间连丝互作,而AtGnTL的耐盐功能尚不明确;由此,我们获得的ZmGnTL是一个新的耐盐候选糖基转移酶家族基因;本发明的动因就是:将沟叶结缕草ZmGnTL构建到植物表达载体中,通过农杆菌介导的方法进行遗传转化,获得具有耐盐特性的新种质;本专利对于优良作物新品种的培育及在生产中的广泛应用,具有重要意义。
技术实现要素:
针对背景技术提出的培育耐盐新种质的问题,本发明的目的在于提供一个新的盐生植物沟叶结缕草耐盐基因ZmGnTL。
本发明的另一目的在于该耐盐基因ZmGnTL的植物表达载体。
本发明所构建的植物表达载体可直接用于农杆菌介导的植物遗传转化,创制耐盐新种质,可用于植物品种改良。
本发明的目的可以通过以下技术方案实现:
沟叶结缕草耐盐基因ZmGnTL,该基因的序列为SEQ ID NO. 1;
含有本发明所述的沟叶结缕草耐盐基因ZmGnTL的植物表达载体,由所述的沟叶结缕草耐盐基因ZmGnTL与植物表达载体构成;
所述的含有沟叶结缕草耐盐基因ZmGnTL的植物表达载体,优选为BamHⅠ和NotⅠ双酶切ZmGnTL后插入到gateway入门载体pENTR1A后与pEarleyGate103表达载体质粒进行重组反应得到。
本发明所述的含有沟叶结缕草耐盐基因ZmGnTL的植物表达载体的构建方法,包括如下步骤。
(1)ZmGnTL基因全长的克隆:设计引物ZmGnTL-F: SEQ ID NO.2和ZmGnTL-R: SEQ ID NO.3,以沟叶结缕草cDNA为模板,进行PCR反应,PCR产物连接到pMD19-T Simple载体,转化TOP10感受态细胞,提取阳性质粒并测序获得基因全长序列为SEQ ID NO. 1。
(2)pENTR1A-ZmGnTL质粒构建:设计引物ZmGnTL-BamHⅠ-F: SEQ ID NO.4和ZmGnTL-NotⅠ-R: SEQ ID NO.5,以步骤(1)中的阳性测序质粒为模板,用高保真酶进行PCR反应,获得在上游和下游分别引入BamHⅠ和NotⅠ酶切位点的ZmGnTL基因,PCR产物连接到pMD19-T Simple载体,转化TOP10感受态细胞,提取阳性质粒pMD19-T Simple-ZmGnTL;BamHⅠ和NotⅠ分别对阳性质粒pMD19-T Simple-ZmGnTL和pENTR1A进行双酶切,取酶切后的ZmGnTL片段与BamHⅠ和NotⅠ双酶切的pENTR1A连接,连接产物转化TOP10感受态细胞;37 ℃过夜培养,挑取阳性单克隆扩大培养,提取质粒pENTR1A-ZmGnTL。
(3)提取的阳性质粒pENTR1A-ZmGnTL经PvuⅠ单酶切线性化后与pEarleyGate103载体质粒进行LR重组反应,转化,提取阳性质粒,电泳检测并测序验证为SEQ ID NO. 1,植物表达载体pEarleyGate103-ZmGnTL构建成功。
本发明所述的沟叶结缕草耐盐基因ZmGnTL在创建耐盐新种质中的应用。
本发明所述的植物表达载体在创建耐盐新种质中的应用。
本发明的有益效果:
1.本发明提供的沟叶结缕草ZmGnTL是一个新的耐盐基因,该基因可提高植物耐盐性;
2.本发明构建的沟叶结缕草ZmGnTL植物表达载体为首次报道,可直接用于农杆菌介导的遗传转化,创造耐盐新种质,提高植物的耐盐性,可进行植物品种改良。
附图说明
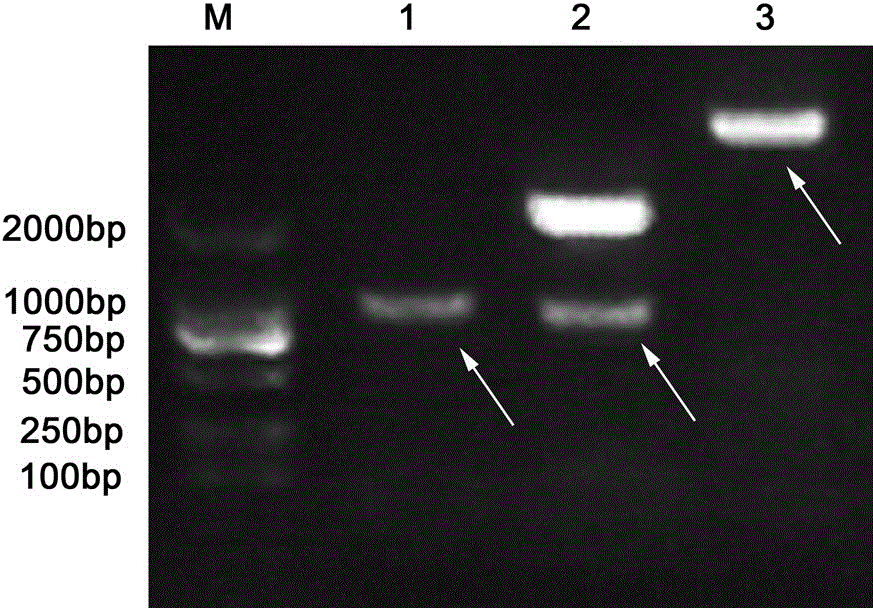
图1 ZmGnTL琼脂糖凝胶电泳分析。
M:DNA Marker
1:ZmGnTL;
2:pMD19-T Simple-ZmGnTL 质粒BamHⅠ和NotⅠ双酶切
3:pEarleyGate103-ZmGnTL 表达载体电泳检测图
图2 植物表达载体pEarleyGate103-ZmGnTL的构建流程图
图3 野生型(WT)与转基因拟南芥(ZmGnTL)PCR鉴定
图4 野生型与转基因拟南芥幼苗生长期耐盐性评价
图5 野生型与转基因拟南芥成苗耐盐性评价
具体实施方式。
实施例1 沟叶结缕草ZmGnTL的克隆。
选用沟叶结缕草(Zoysia matrella)作为材料,选取健康的草皮块,置于装满石英砂的杯中,于1/2 Hongland营养液水培20天后,转入到含300mM NaCl的1/2 Hongland营养液中处理7d,取0.1g幼嫩叶片,参照Trizol RNA提取试剂盒(TaKaRa)说明书方法,提取叶片总RNA,按照M-MLV反转录试剂盒(TaKaRa)取1 µg总RNA反转录成cDNA,用RNase消化cDNA产物,设计引物扩增ZmGnTL;
上游引物ZmGnTL-F: 5′-ATGACGTCACCGGCGCCG-3′(SEQ ID NO.2);
下游引物ZmGnTL-R: 5′-GTCACGTAGGATGACCGA-3′(SEQ ID NO.3)。
以提取的叶片cDNA为模板,进行PCR反应,20 µL反应体系:2×LA RCR Mix 10 µL,ZmGnTL-F、ZmGnTL-R引物各1.0 µL(10 µmol·L-1),cDNA模板 1 µL,ddH2O 7 µL;反应程序:95 ℃预变性3 min,然后94 ℃解链30 sec,60 ℃退火30 sec,72 ℃延伸1 min,反应30个循环,72 ℃延伸10 min;PCR产物用凝胶回收试剂盒(AXYGEN)回收纯化,用T4DNA连接酶(TaKaRa)连接到pMD19-T Simple载体(TaKaRa),转化TOP10感受态细胞,提取质粒并测序为SEQ ID NO.1。
实施例2. 植物表达载体pEarleyGate103-ZmGnTL的构建。
设计引物进行PCR反应,在目的基因ZmGnTL的上游和下游分别引入酶切位点BamHⅠ和NotⅠ,PCR产物连接到pMD19-T Simple载体,转化TOP10感受态细胞,提取阳性质粒,BamHⅠ和NotⅠ双酶切的ZmGnTL片段与BamHⅠ和NotⅠ双酶切的pENTR1A连接,转化大肠杆菌,提取的阳性质粒经PvuⅠ单酶切线性化后与pEarleyGate103载体质粒进行LR重组反应(Invitrogen),转化,提取阳性质粒,电泳检测并测序验证为SEQ ID NO.1;
上游引物ZmGnTL-BamH-F:5′- GGATCCGGATGACGTCACCGGCGCCG -3′(SEQ ID NO.4);
下游引物ZmGnTL-NotI-R:5′- GCGGCCGCGAGTCACGTAGGATGACCGA -3′(SEQ ID NO.5)。
①以实施例1中提取的阳性测序质粒作为模板,用高保真酶(PrimeSTARTM HS DNA Polymerase,TaKaRa)进行PCR反应,25 µL反应体系:10×HS RCR Buffer 2.5 µL,ZmGnTL-BamHⅠ-F、ZmGnTL-NotⅠ-R引物各1.0 µL (10 µmol·L-1),dNTP mix 2.0 µL (2.5 mmol·L-1),PrimeSTARTM HS DNA Polymerase 0.2 µL,cDNA模板 1 µL,ddH2O 17.3 µL;反应程序:95 ℃预变性3 min,然后94 ℃解链30 sec,62 ℃退火30 sec,72 ℃延伸1 min,反应30个循环,72 ℃延伸10 min;PCR产物用凝胶回收试剂盒(AXYGEN, USA)回收,连接到pMD19-T Simple载体,转化TOP10感受态细胞,提取阳性质粒pMD19-T Simple-ZmGnTL并测序验证。
②取gateway入门载体pENTR1A (Invitrogen) 和pMD19-T Simple-ZmGnTL用BamHⅠ和NotⅠ双酶切,双酶切体系(40 µL):10×K Buffer 2 µL,0.1% BSA 4 µL,质粒pENTR1A或pMD19-T Simple-ZmGnTL15 µL,BamHⅠ 2 µL,Not I 2 µL,ddH2O 15 µL;37 ℃反应2 h;双酶切产物进行琼脂糖凝胶电泳分析,用凝胶回收试剂盒(AXYGEN)回收质粒pENTR1A大片段和pMD19-T Simple-ZmGnTL小片段。用TaKaRa连接体系连接两个回收的产物,反应体系(5 µL):SolutionⅠ2.5 µL,pENTR1A大片段0.5 µL,pMD19-T Simple-ZmGnTL小片段2 µL;16 ℃连接2h,连接产物转化TOP10感受态细胞;37 ℃过夜培养,挑取阳性单克隆扩大培养,提取质粒pENTR1A-ZmGnTL。
③取质粒pENTR1A-ZmGnTL用PvuⅠ单酶切,酶切体系(40 µL):10×K Buffer 4 µL,质粒pENTR1A-ZmGnTL 15 µL,PvuⅠ2 µL,ddH2O 19 µL;37 ℃反应2 h,用凝胶回收试剂盒(AXYGEN)回收质粒pENTR1A-PvuⅠ片段。将回收的片段与pEarleyGate103载体质粒进行LR重组反应,反应体系(5µL):pENTR1A-ZmGnTL大片段3 µL,pEarleyGate103质粒1 µL,LR ClonaseTMⅡ enzyme mix 1 µL;25 ℃反应1 h,加入1 µL Proteinase K,37 ℃反应10 min;重组产物转化TOP10感受态细胞,37 ℃过夜培养,挑取阳性单克隆扩大培养,提取质粒pEarleyGate103-ZmGnTL,电泳和测序验证为SEQ ID NO.1。植物表达载体pEarleyGate103-ZmGnTL的构建成功。
实施例3 植物表达载体pEarleyGate103-ZmGnTL遗传转化拟南芥及其耐盐性鉴定。
①农杆菌菌株EHA105感受态制备及冻融法转化:从YEB(50 µg/mL 利福平)平板上挑取EHA105单菌落,接种于50 mL 含50 µg/mL 利福平的YEB液体培养基中,220 rpm,28℃培养至OD值0.6,而后冰浴菌液30 min,离心收集菌体,悬浮于2 mL预冷的100mM CaCl2(20%甘油)溶液中,200 µL/管分装,待用;取5 µL pEarleyGate103-ZmGnTL载体质粒,加入100 µL 感受态细胞,冰浴30 min,液氮冷冻5 min,37℃ 5 min,加入800 µL YEB 液体培养基,28℃ 200 rpm预培养3 h,菌液涂板于YEB(50 µg/mL 利福平 + 50 µg/mL卡那霉素)固体培养基上,28℃ 暗培养2天,挑取单克隆检测,选取阳性克隆摇菌,用于拟南芥花序转化。
②拟南芥花序浸染及种子采收:将阳性单克隆接到50 mL 的YEB(50 µg/mL 利福平 + 50 µg/mL卡那霉素)液体培养基中,培养36小时,5000 rpm离心20分钟,然后用转化液(5%蔗糖+500uL/L的Silwet L-77)剧烈悬浮沉淀至完全悬起;将拟南芥地上部分直接浸泡于上述悬浮液中1分钟,然后用保鲜膜完全包裹植株以保湿,放回培养室培养24小时,打开保鲜膜,待种子成熟时采收。
③种子消毒后播种:将种子放入5mL的离心管中,加入50%巴斯消毒液,添加0.1%的Triton X-100摇晃15分钟,然后在超净台中用无菌水洗5次,而后直接把种子倒在灭菌过的滤纸上,吹干种子(放置1小时),轻轻敲击滤纸将干种子均匀撒播到筛选培养基(1/2MS + 20mg/L 草胺磷 + 25mg/L氨苄青霉素)筛选培养10天,然后将抗性苗移栽到土中,用透明的盖子覆盖幼苗1周以保湿;待抗性苗7~8片叶,提取拟南芥叶片DNA,PCR(引物ZmGnTL-F和ZmGnTL-R)鉴定(图3)。
④耐盐评价:经PCR鉴定的T1代转基因苗继续生长,采收T2代种子。对野生型和T2代抗性转基因拟南芥进行盐处理,一方面将种子置于培养基盐处理(0mM和120mM NaCl+MS培养基)培养14天(图4),一方面将生长14天拟南芥成苗种植于土壤中采用150mM和200mM 的NaCl盐溶液进行浇灌后生长14天(图5),发现3个转ZmGnTL基因拟南芥的生长明显优于野生型拟南芥(图4和5),耐盐性显著提高。
综上所述,本发明构建了含有耐盐基因的植物表达载体pEarleyGate103-ZmGnTL,其中ZmGnTL首次报道。所构建的载体可导入植物中,提高植物的耐盐特性。
<110> 江苏省中国科学院植物研究所
<120> 沟叶结缕草中一个新的耐盐基因ZmGnTL及其表达载体和应用
<160> 5
<210> 1
<211> 1086
<212> DNA
<213> 沟叶结缕草(Zoysia matrella)
<220>
<223> 沟叶结缕草耐盐基因ZmGnTL核苷酸序列
<400> 1
atgac gtcac cggcg ccggc gtaca cctcg ccgtt cgtgc tctcc gtgct cctgc tcatc 60
tccat cccgg ccgtc ttcct cctcg cgccg cgcct gctcc cgccc aagac gctcc cggcc 120
atacc ggacg ccgac gagtc cgaag acctc gccct cttcc gccgc gccat cctct catcg 180
tcctc ggcga cgccg acgcc tacca ccacc tccta cttct tccgc cgccg cccag cgccc 240
aaggt cgcct tcctc ttcct cacca actcc gacct cgtct tctcc ccgct ctggg agaag 300
ttctt ccgcg gccac agcca cctct tcaat atcta cgtcc acgct gaccc ctact ctgtc 360
ctcga gctgc cgccc acgcc cacat tccgt ggtcg ctttg tcccc tccaa ggcca cacag 420
cgcgc ctccc caacc ctcat ctccg ccgca cgccg cctac tcgcc accgc gctca tcgac 480
gactc ctcca accag ttctt tgcgc tcctg tcaca gtcct gcatc ccgct ccacc cgttc 540
cccac tctgt acaat gcacc cctat cagac aatgc cggcc ctcat ggcca ccacc gcagc 600
ttcat tgaga taaag gacaa cattg acaac gatcc cacgg tactg catga caggt actat 660
gcccg aggtg acgat gtgat gcttc cggag gtccc atatg atagg ttccg tgccg gatca 720
cagtt ctttg tgctc accag aagac atgcc atcat ggttg tgagg gatgt gcggc tgtgg 780
aagaa gttca agcag ccctg cctct tcacg cacag ggatt catgc taccc ggagg agcat 840
tactt tccca cattg ctgga tatgc aagat cctga gggtt gcact aagta tactc tgacg 900
aaggt aaact ggaca gattc agttg caggc caccc acata cgtat gggcc tggag aggtg 960
tcagc aaacc tcatc aggga gctga ggaaa tcaaa tggga catac tcata tatgt ttgcc 1020
cgcaa gtttg caccc gagtg tcttg agcca ctgat ggaga ttgcg gactc ggtca tccta 1080
cgtga c 1086
<210> 2
<211> 18
<212> DNA
<213> 人工序列
<220>
<221> PCR反应扩增ZmGnTL基因用上游引物ZmGnTL-F
<400> 2
atgacgtcac cggcgccg 18
<210> 3
<211> 18
<212> DNA
<213> 人工序列
<220>
<221> PCR反应扩增ZmGnTL基因用下游引物ZmGnTL-R
<400> 3
gtcacgtagg atgaccga 18
<210> 4
<211> 26
<212> DNA
<213> 人工序列
<220>
<221> PCR反应扩增ZmGnTL基因引入BamH I酶切位点用上游引物ZmGnTL-BamH I-F
<400> 4
ggatccggat gacgtcaccg gcgccg 26
<210> 5
<211> 28
<212> DNA
<213> 人工序列
<220>
<221> PCR反应扩增ZmGnTL基因引入Not I酶切位点用下游引物ZmGnTL- Not I-R
<400> 5
gcggccgcga gtcacgtagg atgaccga 28
- 还没有人留言评论。精彩留言会获得点赞!