重组溶瘤流感病毒制备方法和应用与流程
本发明涉及生物
技术领域:
中,重组溶瘤流感病毒制备方法和应用。
背景技术:
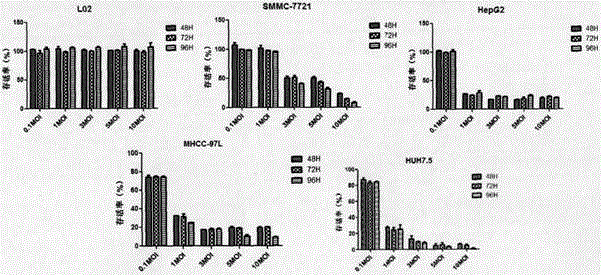
:肿瘤是严重危害人类健康的“杀手”,现有的临床治疗手段包括手术、放疗、化疗、靶向药物等手段,虽然有一定程度的临床疗效,但存在副反应大、效果有限、对人体正常细胞也造成很大杀伤力等问题。因此肿瘤治疗面临的巨大挑战是,如何高效、特异性杀伤肿瘤细胞,而对正常细胞组织无杀伤能力。随着分子生物学的发展及人们在基因水平对肿瘤的全新认识,新的肿瘤治疗方法应运而生。二十世纪九十年代,基因治疗开始运用到多种疾病的治疗中,并在一些遗传病中取得了一定疗效。这些进展极大促进了其在治疗肿瘤领域的发展,并为肿瘤治疗开拓了新思路。第一代肿瘤基因治疗载体,是利用病毒载体将抑癌基因导入人体的肿瘤细胞中,使抑癌基因发挥抑制、杀伤肿瘤细胞的作用。但肿瘤机制复杂,基因突变多样,一个或者两个抑癌基因的导入不足以抑制肿瘤细胞的生长,并且一些病毒载体不能在肿瘤细胞中转染,治疗效果并不明显。因此设计一种新的病毒载体,其可以特异性在肿瘤细胞中复制,选择性地在肿瘤细胞中生长,造成对肿瘤细胞的特异性杀伤。同时,由于病毒的复制,并从裂解的靶向细胞中释放出来,对周围细胞造成继续杀伤并裂解肿瘤细胞。这类病毒载体可以克服第一代肿瘤基因治疗载体的缺陷。这种病毒载体被称为溶瘤病毒。肿瘤细胞有自己的独立的不同于正常细胞的遗传特征,例如基因突变,基因表达异常等生理特征。然而肿瘤细胞在获得特殊的生长特权的同时,也更易成为病毒的宿主。例如:很多肿瘤细胞拥有对Ras激活凋亡的耐受,但反转录病毒因双链RNA激活的蛋白激酶R(PKR)被抑制而在此种细胞内生长旺盛。研究表明,Ras的活化和PKR的抑制有关。同时恶性肿瘤细胞表面的病毒受体表达量高,导致其更易成为病毒的宿主。一般来说,溶瘤病毒有效杀伤肿瘤细胞主要有以下几种机制:第一、病毒直接在肿瘤细胞中复制、包装及释放,病毒粒子的聚集以及肿瘤细胞转录翻译途径占用均导致癌细胞死亡。第二、病毒蛋白具有细胞毒作用或影响细胞功能,例如,细胞表达的抗原诱导机体产生细胞毒T淋巴细胞免疫反应。第三、病毒感染细胞后,增加了细胞对免疫反应的敏感性,即增加了细胞因子对细胞引起的免疫效果,从而造成对肿瘤细胞的杀伤。近年随着反向遗传学技术的迅猛发展,流感病毒作为载体表达外源基因成为可能。改造流感病毒作为载体表达外源基因有很多优势:(1)流感病毒具有易于改造的特性,利用肿瘤细胞与正常细胞不同的遗传特征,可靶向性作用于肿瘤目的细胞,为肿瘤的治疗提供新的研究策略;(2)能够诱导机体产生较强烈的体液、细胞和黏膜免疫应答,以及较全面的交叉免疫保护反应;(3)反向遗传学技术趋于成熟,对流感病毒进行定向改造和利用成为抗肿瘤研究的新途径。人H1N1流感病毒毒株A/PR/8/34(简称PR8)是一株鸡胚适应病毒株,能在鸡胚中有效地复制。PR8为单股负链、分节段的RNA,共有8个独立的RNA片段组成,编码10种蛋白质。片段1-3编码RNA依赖的RNA聚合酶,片段1编码聚合酶亚基PB2,片段2编码聚合酶亚基PB1,片段3编码聚合酶亚基PA;片段4编码血凝素HA,是一种与病毒附着感染有关的表面糖蛋白;片段5编码核蛋白NP,是病毒RNA的主要结构部分;片段6编码神经氨酸酶NA,是一种包膜糖蛋白;片段7编码两种基质蛋白M1和M2,是非糖基化的结构蛋白;片段8编码两种非结构蛋白NS1和NS2。技术实现要素:本发明所要解决的技术问题是如何治疗肿瘤,尤其是对肝癌的治疗。为解决上述技术问题,本发明首先提供了重组流感病毒(名称为rFLU-HTRP,重组溶瘤流感病毒),所述重组流感病毒为1)或2):1)含有名称分别为HTRP1与HTRP2的蛋白质的病毒;2)表达所述HTRP1与所述HTRP2的病毒;所述HTRP1为下述A1)或A2)或A3)的蛋白质:A1)氨基酸序列是序列1的蛋白质;A2)在序列1所示的氨基酸序列中经过取代和/或缺失和/或添加一个或几个氨基酸残基得到的具有相同功能的由A1)衍生的蛋白质;A3)在A1)或A2)的N端或/和C端连接标签得到的融合蛋白质;所述HTRP2为下述B1)或B2)或B3)的蛋白质:B1)氨基酸序列是序列3的蛋白质;B2)在序列3所示的氨基酸序列中经过取代和/或缺失和/或添加一个或几个氨基酸残基得到的具有相同功能的由B1)衍生的蛋白质;B3)在B1)或B2)的N端或/和C端连接标签得到的融合蛋白质。上述重组流感病毒的基因组为单股负链、分节段的RNA,所述重组流感病毒的负链RNA转录出与所述负链RNA互补的成套正链RNA,所述成套正链RNA包括PB1-RNA、PB2-RNA、PA-RNA、NP-RNA、M-RNA、NA-RNA、HTRP1-RNA和HTRP2-RNA;所述PB1-RNA为编码流感病毒毒株中PB1的RNA;所述PB2-RNA为编码所述流感病毒毒株中PB2的RNA;所述PA-RNA为编码所述流感病毒毒株中PA的RNA;所述NP-RNA为编码所述流感病毒毒株中NP的RNA;所述M-RNA为编码所述流感病毒毒株中M1和M2的RNA;所述NA-RNA为编码所述流感病毒毒株中NA的RNA;所述HTRP1-RNA为编码所述HTRP1的RNA;所述HTRP2-RNA为编码所述HTRP2的RNA。上述重组流感病毒中,所述成套正链RNA也可仅由所述PB1-RNA、所述PB2-RNA、所述PA-RNA、所述NP-RNA、所述M-RNA、所述NA-RNA、所述HTRP1-RNA和所述HTRP2-RNA组成。上述重组流感病毒中,所述HTRP1-RNA的序列为将序列表中序列2的第41-289位中所有T均替换为U,其它核苷酸均不变得到的序列;所述HTRP2-RNA的序列为将序列表中序列4的第47-3817位中所有T均替换为U,其它核苷酸均不变得到的序列。所述流感病毒毒株可为甲型流感病毒任一亚型(H1-H16、N1-N9)或乙型流感病毒任一谱系(B/Victoria、B/Yamagata),具体可为A/PR/8/34。为解决上述技术问题,本发明还提供了所述重组流感病毒的构建方法,所述方法包括将含有编码所述PB1-RNA的DNA分子的重组载体、含有编码所述PB2-RNA的DNA分子的重组载体、含有编码所述PA-RNA的DNA分子的重组载体、含有编码所述NP-RNA的DNA分子的重组载体、含有编码所述M-RNA的DNA分子的重组载体、含有编码所述NA-RNA的DNA分子的重组载体、含有编码所述HTRP1-RNA的DNA分子的重组载体和含有编码所述HTRP2-RNA的DNA分子的重组载体导入包装细胞中,得到重组流感病毒。为解决上述技术问题,本发明还提供了下述任一产品:P1、所述的重组流感病毒的基因组;P2、用于治疗肿瘤的成套载体,由P2a与P2b组成:P2a、含有所述HTRP1的编码基因的载体;P2b、含有所述HTRP2的编码基因的载体;P3、用于治疗肿瘤的成套表达盒,由P3a与P3b组成:P3a、含有所述HTRP1的编码基因的表达盒;P3b、含有所述HTRP2的编码基因的表达盒;P4、用于治疗肿瘤的成套基因,由P4a与P4b组成:P4a、所述HTRP1的编码基因;P4b、所述HTRP2的编码基因;P5、用于治疗肿瘤的成套蛋白质,由P5a与P5b组成:P5a、所述HTRP1;P5b、所述HTRP2;P6、所述P2a或所述P2b;P7、所述P3a或所述P3b;P8、所述P4a或所述P4b;P9、所述P5a或所述P5b。为解决上述技术问题,本发明还提供了与所述重组流感病毒相关的生物材料,所述生物材料为下述E1)至E6)中的任一种:E1)编码所述重组流感病毒的所述成套正链RNA的成套DNA分子;E2)成套载体,由下述E2a)、E2b)、E2c)、E2d)、E2e)、E2f)、E2g)和E2h)组成:E2a)含有编码所述PB1-RNA的DNA分子的重组载体;E2b)含有编码所述PB2-RNA的DNA分子的重组载体;E2c)含有编码所述PA-RNA的DNA分子的重组载体;E2d)含有编码所述NP-RNA的DNA分子的重组载体;E2e)含有编码所述M-RNA的DNA分子的重组载体;E2f)含有编码所述NA-RNA的DNA分子的重组载体;E2g)含有编码所述HTRP1-RNA的DNA分子的重组载体;E2h)含有编码所述HTRP2-RNA的DNA分子的重组载体;E3)含有所述重组流感病毒的微生物;E4)含有所述重组流感病毒的动物细胞系;E5)含有所述重组流感病毒的动物组织;E6)含有所述重组流感病毒的动物器官;所述成套DNA分子由编码所述PB1-RNA的DNA分子、编码所述PB2-RNA的DNA分子、编码所述PA-RNA的DNA分子、编码所述NP-RNA的DNA分子、编码所述M-RNA的DNA分子、编码所述NA-RNA的DNA分子、编码所述HTRP1-RNA的DNA分子和编码所述HTRP2-RNA的DNA分子组成。上述生物材料中,所述编码所述HTRP1-RNA的DNA分子可为核苷酸序列是序列表中序列2的第41-289位所示的DNA分子;所述编码所述HTRP2-RNA的DNA分子可为核苷酸序列是序列表中序列4的第47-3817位所示的DNA分子。上述生物材料中,所述动物细胞系、所述动物组织和所述动物器官均不包括繁殖材料。上述生物材料中,E3)所述微生物、E4)所述动物细胞系、E5)所述动物组织和E6)所述动物器官均可为流感病毒的寄主。在本发明的一个实施例中,E2a)所述重组载体为pHW-PB1;E2b)所述重组载体为pHW-PB2;E2c)所述重组载体为pHW-PA;E2d)所述重组载体为pHW-NP;E2e)所述重组载体为pHW-M;E2f)所述重组载体为pHW-NA;E2g)所述重组载体为pHW-HTRP1。E2h)所述重组载体为pHW-HTRP2。pHW-HTRP1可表达序列1所示的HTRP1,pHW-HTRP2可表达序列3所示的HTRP2。为解决上述技术问题,本发明还提供了治疗肿瘤药物,所述药物的活性成分为所述重组流感病毒。上述药物的活性成分还可为将所述重组流感病毒和其它治疗肿瘤药物进行组合得到的组合物作为活性成分。为解决上述技术问题,本发明还提供了下述任一应用:I、所述重组流感病毒在制备治疗肿瘤药物中的应用;II、所述产品在制备治疗肿瘤药物中的应用;III、所述生物材料在制备治疗肿瘤药物中的应用;IV、所述治疗肿瘤药物在在制备治疗肿瘤药物中的应用;V、所述重组流感病毒在治疗肿瘤中的应用;VI、所述产品在治疗肿瘤中的应用;VII、所述生物材料在治疗肿瘤中的应用;VIII、所述治疗肿瘤药物在治疗肿瘤中的应用。本发明中所述肿瘤可为实体肿瘤。所述肿瘤具体可为肝癌、肺癌、结肠癌、大肠癌、乳腺癌、卵巢癌、宫颈癌、胃癌、肾癌、胰腺癌、前列腺癌、淋巴瘤、神经胶质瘤或黑色素瘤。所述肝癌具体可为肝细胞癌。实验证明,本发明的重组流感病毒(rFLU-HTRP)对肿瘤细胞具有特异的杀伤作用:rFLU-HTRP感染细胞后rFLU-HTRP对肿瘤细胞产生明显的杀伤作用,但对正常肝细胞无明显杀伤作用。本发明的重组流感病毒可以抑制动物体内肿瘤的生长并可以抑制肿瘤的发展:本发明的重组流感病毒治疗荷瘤动物后存活率得到提高,肿瘤的生长得到有效抑制,rFLU-HTRP瘤内注射组与静脉注射组肿瘤体积分别为PBS组的0.07和0.13倍,治疗后肿瘤的肿瘤特征得到抑制,肿瘤异型性不明显,核分裂现象不明显。本发明的重组流感病毒具有杀伤肿瘤特异性强、有效性高、良好安全性的优点:重组流感病毒选择性杀伤肿瘤细胞,而对宿主正常细胞没有明显影响。本发明的重组流感病毒可用于对肿瘤的治疗。附图说明图1为rFLU-HTRP电镜下形态及病毒颗粒直径大小分布。其中,A图为电镜下rFLU-HTRP病毒颗粒形态,B图为病毒颗粒直径大小分布。图2为MTS法检测重组流感病毒rFLU-HTRP对肝癌细胞的影响。图3为以结晶紫染色的方法检测重组流感病毒rFLU-HTRP感染后48小时对肝癌细胞系(SMMC-7721、HepG2、MHCC-97L、HUH7.5)和正常肝细胞(L02)病变的影响。图4为重组流感病毒rFLU-HTRP在体内荷人肝癌细胞HepG2瘤裸鼠中抗肿瘤作用研究。图5为成瘤裸鼠各组织病理观察。图6为裸鼠重组流感病毒rFLU-HTRP在不同组织中的复制情况。具体实施方式下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂、仪器等,如无特殊说明,均可从商业途径得到。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。下述实施例中的pHW2000(HoffmannE,MraussS,PerezD,etal.Eight-Plasmidsystemforrapidgenerationofinfluenzavirusvaccines.Vaccine,2002,20:3165~70,)公众可从申请人处获得该生物材料,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。下述实施例中的非洲绿猴SV40转化的肾细胞(COS-1)为ATCC(AmericanTypeCultureCollection)细胞库产品,狗肾细胞(MDCK)为ATCC(AmericanTypeCultureCollection)细胞库产品,SPF鸡胚为北京实验动物研究中心产品。下述实施例中的重组载体pHW-PB1、pHW-PB2、pHW-PA、pHW-NP、pHW-M和pHW-NA(HoffmannE,MraussS,PerezD,etal.Eight-Plasmidsystemforrapidgenerationofinfluenzavirusvaccines.Vaccine,2002,20:3165-70)公众可从申请人处获得,这些生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。重组载体pHW-PB1、pHW-PB2、pHW-PA、pHW-NP、pHW-M和pHW-NA分别含有分别与流感病毒株A/PR/8/34(HoffmannE,MraussS,PerezD,etal.Eight-Plasmidsystemforrapidgenerationofinfluenzavirusvaccines.Vaccine,2002,20:3165-70)的内部病毒基因骨架PB1、PB2、PA、NP、M和NA反向互补的DNA片段,pHW-PB1、pHW-PB2、pHW-PA、pHW-NP和pHW-NA分别编码流感病毒株A/PR/8/34的PB1、PB2、PA、NP和NA,pHW-M编码流感病毒株A/PR/8/34的M1和M2。下述实施例中的HepG2、SMMC-7721、MHCC-97L、HuH-7.5和L02均为中国人民解放军第三○二医院产品。实施例1、重组流感病毒的拯救本发明提供了一种重组流感病毒(重组溶瘤流感病毒),该重组流感病毒表达名称分别为HTRP1与HTRP2的蛋白质;HTRP1为氨基酸序列是序列1的蛋白质,HTRP2为氨基酸序列是序列3的蛋白质,HTRP1由序列表中序列2的第41-289位核苷酸所示的HTRP1基因编码,HTRP2由序列表中序列4的第47-3817位核苷酸所示的HTRP2基因编码。1、重组载体的构建将序列2所示的DNA分子用AarI酶切,得到含有HTRP1基因的DNA片段,将pHW2000用AarI酶切,得到pHW2000骨架载体1,将含有HTRP1基因的DNA片段与pHW2000骨架载体1进行连接,得到重组载体,将该重组载体命名为pHW-HTRP1,pHW-HTRP1表达序列1所示的HTRP1。将序列4所示的DNA分子用BsmBI酶切,得到含有HTRP2基因的DNA片段,将pHW2000用BsmBI酶切,得到pHW2000骨架载体2,将含有HTRP2基因的DNA片段与pHW2000骨架载体2进行连接,得到重组载体,将该重组载体命名为pHW-HTRP2,pHW-HTRP2表达序列3所示的HTRP2。2、重组流感病毒的拯救将步骤1的pHW-HTRP1和pHW-HTRP2与重组载体pHW-PB1、pHW-PB2、pHW-PA、pHW-NP、pHW-M和pHW-HA共8种载体各0.2μg等量混合后加入10μL转染试剂(Effectene,Qiagen公司产品)中室温作用10min,共转染到非洲绿猴SV40转化的肾细胞(COS-1)和狗肾细胞(MDCK)中,于37℃、5%CO2下培养48-60小时,得细胞悬液,将细胞悬液接种9-11日龄SPF鸡胚,37℃培养72h,收获鸡胚尿囊液并按照OIE标准对其进行血凝(HA)试验,HA血凝效价的检测结果是1:256-512。成功获得的重组流感病毒命名为rFLU-HTRP,进一步经扩大培养、浓缩、纯化得到rFLU-HTRP,-70℃冻存。按照上述方法,将pHW-HTRP1替换为pHW2000,其他步骤均不变,进行重组流感病毒的拯救,结果并未得到重组流感病毒。按照上述方法,将pHW-HTRP2替换为pHW2000,其他步骤均不变,进行重组流感病毒的拯救,结果并未得到重组流感病毒。按照上述方法,将pHW-HTRP1替换为pHW2000并将pHW-HTRP2替换为pHW2000,其他步骤均不变,进行重组流感病毒的拯救,结果并未得到重组流感病毒。3、重组流感病毒的鉴定步骤2获得的重组流感病毒株rFLU-HTRP负染后经透射电镜观察病毒形态,结果表明rFLU-HTRP符合流感病毒典型形态特征,有包膜,表面有刺突结构,病毒颗粒大小在80-120nm之间,结果如图1所示。将步骤2的rFLU-HTRP接种9-11日龄SPF鸡胚传代,取第二代鸡胚尿囊液提取病毒RNA,经过RT-PCR,扩增出正确的PB2、PB1、PA、NP、NA和M基因片段以及HTRP1基因和HTRP2基因。将步骤2的rFLU-HTRP经鸡胚扩大培养,超滤浓缩、蔗糖梯度离心纯化后,跑SDS-PAGE电泳,凝胶染色、脱色后,可检测到相应大小的NP、HA1、HA2、NEP蛋白,表明抗原的主要成分没有丢失。实施例2、重组流感病毒rFLU-HTRP在肝癌细胞中的特异性作用将实施例1步骤2的rFLU-HTRP用PBS重悬,得到rFLU-HTRP悬浮液。利用MTS试剂盒(Promega)检测不同感染复数时重组流感病毒rFLU-HTRP对肝癌细胞的细胞毒特异性,所用肝癌细胞为SMMC-7721、HepG2、MHCC-97L和HuH-7.5,利用人正常肝细胞L02作为对照。实验重复三次,每次重复实验的具体步骤如下:将细胞接种在含有培养基的96孔板中,每孔培养基的量相同,每孔一种细胞,每种细胞两个复孔,每孔104个细胞,于37℃、5%CO2下培养24小时后,按照活细胞TCID50的感染复数MOI为10,分别对每种细胞接种rFLU-HTRP悬浮液(每种细胞分别接种等体积的PBS作为对照),于37℃、5%CO2下进行培养。按照上述方法,将活细胞TCID50的感染复数MOI为10分别替换为0.1、1、3和5,对每种细胞接种rFLU-HTRP悬浮液,培养各细胞。1、MTS法检测重组流感病毒rFLU-HTRP对肝癌细胞的影响分别在上述各细胞接种rFLU-HTRP悬浮液后的48小时、72小时、96小时利用MTS试剂检测rFLU-HTRP对肝癌细胞的细胞毒特异性,样品细胞中加入MTS试剂37℃保温1小时后,进行490nm吸光值检测,计算各孔细胞的细胞存活率Cellviabillty,%),结果如图2所示。当活细胞TCID50的感染复数MOI为3、5、10时,感染后各时间点均对肝癌细胞SMMC-7721、HepG2、MHCC-97L和HuH-7.5产生明显杀伤作用,当活细胞TCID50的感染复数MOI为0.1和1时,感染后各时间点均对肝癌细胞HepG2、MHCC-97L和HuH-7.5产生明显杀伤作用,而各时间点不同感染复数均对正常肝细胞L02无明显杀伤作用。RT-PCR检测目的基因的表达:在上述490nm吸光值检测后,分别提取各细胞总RNA,反转录为cDNA后分别利用HTRP1的引物upstreamprimer5’-TATTCGTCTCAGGGAGCAAAAGCAGGGTG-3’和downstream5’-ATATCGTCTCGTATTAGTAGAAACAAGGGT-3’以及HTRP2的引物upstreamprimer5’-TATTCGTCTCAGGGAGCAAAAGCAGGGG-3’和downstream5’-ATATCGTCTCGTATTAGTAGAAACAAGGGTGTTT-3’进行PCR反应,对PCR产物进行琼脂糖凝胶电泳分析,以未感染病毒的细胞作为对照。结果显示,在rFLU-HTRP不同感染复数(3、5和10)及不同感染时间(48小时、72小时和96小时)时的肝癌细胞SMMC-7721、HepG2、MHCC-97L和HuH-7.5中均检测到了HTRP1与HTRP2的目的基因片段,说明重组流感病毒rFLU-HTRP在SMMC-7721、HepG2、MHCC-97L和HuH-7.5中HTRP1与HTRP2基因均有表达,而rFLU-HTRP感染的L02细胞中未检测到目的基因片段。2、细胞病变检测:以结晶紫染色的方法检测重组流感病毒rFLU-HTRP感染上述肝癌细胞后48小时对肝癌细胞系(SMMC-7721、HepG2、MHCC-97L、HUH7.5)和正常肝细胞(L02)病变的影响。如图3所示,在感染剂量为0.1MOI时,肝癌细胞系HUH7.5细胞病变均超过90%,表明rFLU-HTRP对HUH7.5有较强的细胞杀伤作用;在感染剂量大于0.1MOI时,四种肝癌细胞系病变均超过90%,表明rFLU-HTRP对肝癌细胞有明显的杀伤作用;而各感染剂量病毒均对正常肝细胞L02无明显杀伤作用。且此结果与MTS结果相一致。结果表明,rFLU-HTRP对肝癌细胞有选择性杀伤作用,而对正常细胞无明显影响。实施例3、重组流感病毒rFLU-HTRP在荷肝癌移植裸鼠中的抗肿瘤作用实验重复三次,每次重复试验的步骤如下:重组流感病毒rFLU-HTRP在体内荷肝癌细胞HepG2瘤裸鼠中抗肿瘤作用的研究:4周龄的SPF级BABL/C裸鼠(北京维通利华实验动物技术有限公司),体重18-20g,右侧肋部皮下接种5×107/mlHepG2细胞悬浮液(将HepG2细胞悬浮于PBS中得到的液体)100μl,将接种当天记为第0天。2周后(第14天)于注射部位肿瘤体积长至100-150mm3时,进行随机分组,每组5只裸鼠,分别为rFLU-HTRP瘤内注射组(I.T组)、rFLU-HTRP静脉注射组(I.V组)、PBS对照组。肿瘤体积通过肿瘤直径的检测来计算,按照公式:肿瘤体积=(最长直径×最短直径2)/2。向瘤内注射组组每只裸鼠肿瘤中注射rFLU-HTRP悬液(rFLU-HTRP悬液为向PBS中加入rFLU-HTRP得到的rFLU-HTRP浓度为2×109PFU/50μl的液体)进行治疗,每只裸鼠rFLU-HTRP注射量为2×109PFU,连续注射5天;向静脉注射组组每只裸鼠静脉中注射rFLU-HTRP悬液进行治疗,每只裸鼠rFLU-HTRP注射量为2×109PFU,连续注射5天;向PBS对照组每只裸鼠静脉中注射50μlPBS,连续注射5天,作为对照。肿瘤体积变化:从第14天始,测量肿瘤体积,治疗后8周内观察小鼠肿瘤体积变化,结果见图4和表1。表1、不同组别肿瘤体积随时间的变化(mm3)时间I.T组I.V组PBS组第14天183.2±19.3149.9±47.2217.9±44.7第26天423.0±127.0447.3±177.71088.7±270.5第38天280.4±144.2331.5±157.52167.1±643.3第50天202.4±174.5335.0±50.02613.1±948.2第62天228.3±101.3405.0±107.13128.4±777.5结果显示,在第62天,I.T组和I.V组的肿瘤体积分别为PBS组的0.07和0.13倍;表明,rFLU-HTRP具有良好的体内抑制肿瘤生长作用,并且瘤内注射的抑制作用高于静脉注射;rFLU-HTRP可以通过抑制肿瘤的生长荷瘤裸鼠生存率。成瘤裸鼠各组织病理观察:在第62天,处死裸鼠,取出各组裸鼠肿瘤、肝脏、肺、肾、心、脑进行病理损伤情况观察。如图5所示,PBS组肿瘤异型性显著,有多核分裂现象;静脉注射组与瘤内注射组肿瘤异型性不明显,核分裂现象不明显,表明PBS组肿瘤恶性程度较两rFLU-HTRP治疗组更高,说明静脉注射及瘤内注射rFLU-HTRP均有明显的抑制肿瘤的作用。同时,PBS对照组肝脏病理出现肝细胞溶解及坏死现象,肺泡壁明显增厚、充血及大量的炎性渗出;静脉注射组肺泡壁轻微增厚、少量充血。各组裸鼠肾、心、脑经肉眼观察均未见病理变化。rFLU-HTRP在各组裸鼠组织中的复制情况:将各组裸鼠肿瘤、肝脏、肺、脾、肾、心、脑组织研磨后,提取RNA,荧光实时定量PCR检测rFLU-HTRP在不同组别不同组织中的复制情况,所用引物为:upstreamprimer5’-AAGACCAATCCTGTCACCTCTGA-3’/downstreamprimer5’-CAAAGCGTCTACGCTGCAGTCC-3’。内参为mouse-GAPDH,内参的引物为upstreamprimer5’-GGGAAATTCAACGGCACAGT-3’/downstreamprimer5’-AGATGGTGATGGGCTTCCC-3’。PBS对照组动物各组织均未检测到该病毒株的复制。静脉注射组及瘤内注射组(图6)均在肿瘤组织中检测到病毒的高表达,其次,在肺、肝脏中两rFLU-HTRP治疗组病毒均有复制。由此表明,rFLU-HTRP可选择性的在肿瘤组织中复制,因此导致了明显的体内抑瘤效果。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1