一种含附属器的组织工程皮肤及其制备方法与流程
本发明属于生物技术领域,具体涉及到一种含附属器的组织工程皮肤及其制备方法。
背景技术:
皮肤作为人体最大的组织器官,是人体的第一道防护屏障,它可以防止体内水份、电解质的丢失,同时也保护机体不受外界有害物质的侵害,皮肤容易受到外伤、烧伤、炎症、溃疡、肿瘤术后及先天疾病等因素的损害。组织工程皮肤的出现为创面修复领域研究提供了一种新的治疗途径。目前国内外市场已有很多种皮肤替代物,一种只具有真皮层的单层组织工程皮肤,这种皮肤替代物隔离外界细菌能力差,容易引起感染;另一种为双层组织工程皮肤,既含有表皮层又含有真皮层的组织工程化皮肤,这种皮肤替代物虽然效果较好,但是细胞生长及保存条件苛刻,使其成本高昂,保质期短,而且所用支架胶原凝胶的收缩率较大,使用同种异体细胞和牛胶原,存在着不可预知的免疫排斥反应和潜在病毒感染的风险而且脆性大,操作困难。就对于目前的技术方法并不能在组织工程皮肤中构建出皮肤的附属器结构,如毛囊、汗腺、皮脂腺等。这些结构在皮肤创伤修复和重建过程中又起着至关重要的作用。因此,本发明对于含有毛囊附属器的组织工程皮肤的构建对于后续研发含有附属器的组织工程皮肤奠定了基础。
公告号为cn101773688b的中国专利公开了一种含附属器的组织工程皮肤的制备方法,是在凝胶溶液中接种羊膜间充质干细胞、向毛乳头方向诱导的羊膜间充质干细胞、羊膜上皮细胞、向汗腺上皮方向诱导的羊膜上皮细胞,经真皮层培养后,再经形成毛囊、汗腺结构的诱导培养,于其表面再接种羊膜上皮细胞和经向角质形成细胞诱导的羊膜上皮细胞,培养后得到具有毛囊、汗腺结构的组织工程皮肤,该发明使用的培养基80%体积分数来源于动物细胞外基质,成分复杂,容易传播疾病,容易发生排斥反应。
公告号为cn105056307a的中国专利公开了一种人造皮肤及其制备方法,该人造皮肤包括表皮细胞、真皮细胞和生物支架材料;其是将所述真皮细胞复合于所述生物支架材料内部,在表面接种所述表皮细胞,培养制备获得的。该人造皮肤具有真皮层和表皮层,带有活性细胞,且表皮层中含有角质层,接近于正常皮肤,但是该发明所述的生物支架材料是胶原蛋白、细胞外基质复合物、透明质酸、多糖、硫酸软骨素、聚乳酸、聚羟基乙酸、聚乳酸和聚羟基乙酸的共聚物中的一种或两者以上混合物。
技术实现要素:
为了解决现有技术的不足,本发明提供了一种含附属器的组织工程皮肤及其制备方法,使用尿液细胞为种子细胞,获取方便,培养周期短,含有的毛囊结构有利于创面的愈合,并且本发明为后续开发含有附属器组织工程皮肤奠定了基础。
本发明技术方案如下所示:
一种含附属器的组织工程皮肤的制备方法,步骤为:
步骤一:尿液细胞的收集
1)收集杯中加入2ml青霉素/链霉素双抗后,收集90-150ml尿液;
2)将尿液倒入3-5个50ml离心管中,离心400r/min,10min,吸去上清液至每管剩余液体1-5ml,合并到一个离心管内,加入10-30ml含有体积分数为5%青霉素/链霉素的pbs中,混匀后,离心400r/min,10min,吸去上清液至剩余液体0.5-1ml;
3)将六孔板1孔用0.1%明胶包被20min-30min后,吸去孔内液体,将步骤2)得到的剩余液体倒入包被好的孔中,加入2mlregm培养基再加入3μlprimocin后,放入37℃培养箱内培养,待尿液中细胞贴壁后,进行换液处理;
4)当尿液细胞融合度达到80%,则可进行传代培养;
步骤二:多能干细胞的诱导与培养
①细胞转染:将表达转录调控因子oct4、sox2、nanog、klf4和lin28导入尿液细胞,然后分至预先用matrigel包被的6孔板中,用培养液b补至每孔2ml培养,细胞培养密度为1×106/ml;
②细胞增殖:细胞转染第2天,将培养基b更换为mtesr1培养基,并且连续7天每天更换mtesr1培养基,得到克隆细胞;
③细胞优化:镜下观察并挑选形态与人胚胎干细胞相近的克隆细胞,作为多能干细胞,并接种于用matrigel包被的12孔板中,细胞接种密度为1×106/ml,每孔加1mlmtesr1培养基进行传代培养;
步骤三:间充质干细胞的诱导与培养
(1)当诱导多能干细胞长至80%时,将mtesr1培养基去除,加1mldmem/f12培养液清洗一遍后,加含0.5mmedta的dpbs消化5min,400r/min,离心5min,收集细胞沉淀,加入mtesr1培养基以1:3的比例进行传代,传至已被matrigel包被好的六孔板中;
(2)待多能干细胞长至六孔板的70%-80%时,pbs冲洗一遍后,更换培养基d,培养2天后,得到间充质干细胞,加含0.5mmedta的dpbs进行消化,400r/min,离心5min,加入培养基e重悬细胞,制成1×106/ml单细胞悬液;
(3)将单细胞悬液接种至0.1%明胶预先包被的10ml细胞培养皿中,当细胞融合度达到90%后,加含0.5mmedta的dpbs消化细胞,然后加入培养基e按照1:3的比例进行细胞传代培养;
步骤四:(一)组织工程表皮细胞的培养
<1>将间充质干细胞培养基中的培养基e去除,加1mldmem/f12培养液清洗一遍后,加含0.5mmedta的dpbs消化5min,400r/min,离心5min,收集细胞沉淀,加入培养基e以1:3的比例进行传代,传至已被matrigel包被好的六孔板中;
<2>待间充质干细胞长至六孔板的70%-80%时,pbs冲洗一遍后,更换培养基f,每两天更换一次培养基,培养4天后,得到表皮细胞,加含0.5mmedta的dpbs进行消化,400r/min,离心5min,加入培养基g重悬细胞,制成1×106/ml单细胞悬液;
<3>将单细胞悬液接种至10cm细胞培养皿中,细胞融合度达到90%后,加含0.5mmedta的dpbs消化,使用培养基g重悬细胞,制成1×106/ml单细胞悬液,备用;
(二)组织工程成纤维细胞的培养
[1]同步骤四(一)中的<1>;
[2]待间充质干细胞长至六孔板的70%-80%时,pbs冲洗一遍后,更换培养基h,每两天更换一次培养基,培养5天后,得到成纤维细胞,加含0.5mmedta的dpbs进行消化,400r/min,离心5min,加入培养基i重悬细胞,制成5×105/ml单细胞悬液;
[3]将单细胞悬液接种至10cm细胞培养皿中,细胞生长3天融合度达到90%后,加含0.5mmedta的dpbs消化,使用培养基i重悬细胞,制成5×105单细胞悬液,备用;
(三)组织工程毛囊细胞的诱导培养
{1}同步骤四(一)中的<1>;
{2}待间充质干细胞长至六孔板的70%-80%时,pbs冲洗一遍后,更换培养基j,每两天更换一次培养基,培养5天后,得到毛囊细胞,加含0.5mmedta的dpbs进行消化,400r/min,离心5min,加入培养基k重悬细胞,制成5×105/ml单细胞悬液;
{3}将单细胞悬液接种至10cm细胞培养皿中,细胞生长3天融合度达到90%后,加含0.5mmedta的dpbs消化,使用培养基k重悬细胞,制成5×105单细胞悬液,备用;
步骤五:含有附属器的组织工程双层皮肤的构建
<i>将羊膜打孔成与6板孔直径相同的羊膜圆片;
<ii>将成纤维细胞与毛囊细胞按0.9-1.1:1的比例混合,接种到羊膜基质层,加入培养液i进行培养,待细胞的融合度达到75-85%,在羊膜的上皮面接种表皮细胞,加入培养基g进行培养;
<iii>培养2天后表皮细胞紧贴于羊膜上皮面,将培养基g弃去,加入2ml培养液l继续培养,每天换液,培养2天,即得。
进一步的,所述的dmem/f12培养液体积比为9:1,并且以dmem/f12体积比为9:1混合为基础培养基,使用基础培养基配制以下培养基,其中添加物浓度为终浓度:
培养基b:商用型regm培养基与mef培养基以1:1的体积比混合;
培养基d:基础培养基500ml、l-谷酰胺2mmol/l、碱性成纤维细胞生长因子75ug/l、地塞米松10-8mol/l;
培养基e:基础培养基500ml、人表皮生长因子20ng/ml、肝细胞生长因子3ng/ml、碱性成纤维细胞生长因子2ng/ml、血小板衍生因子5ng/ml、胰岛素样生长因子5ng/ml、转化生长因子-β5ng/ml;
培养基f:基础培养基500ml、角质化细胞生长因子20ug/l、转化生长因子-β45ug/l、血小板衍生因子-ab8ug/l、血管内皮生长因子15ug/l、白细胞介素-25ug/l、氢化可的松0.4ug/ml;
培养基g:基础培养基500ml、氢化可的松0.5ng/ml、霍乱毒素1×10-10mol/l、胰岛素0.05ng/ml、三碘甲状腺原氨酸1×10-7mol/l、腺嘌呤1.8×10-4mol/l、青霉素100iu/ml、人表皮生长因子15ng/ml、转铁蛋白10ug/ml、谷氨酸5ug/ml、rock抑制剂5μm、羧甲基壳聚糖0.1mg/ml;
培养基h:基础培养基500ml、碱性成纤维细胞生长因子10ug/l、维生素c1mmol/l、非必需氨基酸0.02mmol/ml;
培养基i:基础培养基500ml、胰岛素5ng/ml、氢化可的松300ug/ml、腺嘌呤15ug/ml、维生素c120ug/ml、人表皮生长因子5ng/ml、碱性成纤维细胞生长因子8ng/ml、bpe20ug/ml、转铁蛋白10ug/ml、羧甲基壳聚糖0.5mg/ml;
培养基j:基础培养基500ml、成纤维细胞生长因子5ug/ml、肝细胞生长因子5ug/ml、wnt3a30-200ng/ml、角质细胞生长因子12.5μg/ml、胰岛素样生长因子50ng/ml、血管内皮生长因子10ng/ml、表皮细胞生长因子20μg/l、神经生长因子15ng/ml、青霉素100iu/ml、链霉素100iu/ml、l-谷氨酰胺3mmol/l、胸腺素β40.015%;
培养基k:基础培养基500ml、l-谷氨酰胺2.5mmol/l、胰岛素-转铁蛋白-硒添加剂1ng/ml、肝细胞生长因子5ug/ml、胰岛素3ng/ml;
培养基l:基础培养基500ml、胰岛素0.05μmol/l、非必需氨基酸0.05mmol/ml、人表皮生长因子10ng/ml、青霉素100iu/ml、牛垂体提取物20ug/ml、氯化钙300μg/ml。
进一步的,步骤五中所述的羊膜使用前浸泡在含有0.5-2%质量分数壳聚糖的deme培养基中12小时。
进一步的,步骤五中所述的羊膜为脱细胞羊膜。
进一步的,步骤五中所述的成纤维细胞与毛囊细胞接种总密度为0.2×107-2×107/ml。
进一步的,步骤五中所述的表皮细胞接种密度为1×106-2×106/ml。
另外,本发明还提供了由本发明的含附属器的组织工程皮肤的制备方法制得的含附属器的组织工程皮肤。
本发明使用的培养基为:所述的培养基a为尿液细胞培养基;所述的培养基b为多能干细胞诱导培养基;所述的培养基c为多能干细胞细胞培养基;所述的培养基d为间充质干细胞诱导培养基;所述的培养基e为间充质干细胞培养基;所述的培养基f为表皮细胞诱导培养基;所述的培养基g为表皮细胞培养基;所述的培养基h为成纤维细胞诱导培养基;所述的培养液i为成纤维细胞培养基;所述的培养基j为毛囊细胞诱导培养基;所述的培养基k为毛囊细胞培养基;所述的培养液l为组织工程双层皮肤培养基。
本发明使用的生物支架材料为羊膜,对皮肤具有良好的亲和性,羊膜是胎盘的最内层,具有一定的弹性,含有大量不同的胶元,羊膜常作为移植的生物材料,为了减少羊膜中细胞对异体的排斥,本发明使用了脱细胞羊膜,并且通过试验发现羊膜使用前浸泡在含有0.5-2%质量分数壳聚糖的deme培养基中12小时,可以较好的提高组织工程皮肤内部的细胞密度,并且提高其愈合能力。
本发明使用的细胞培养基配方合理,满足了细胞生长所需要的营养,并且可以有效的提高细胞的生长速度,缩短培养时间。
与现有技术相比,本发明具有以下优点:
(1)本发明所用的诱导多能干细胞是经尿液中提取的尿液细胞诱导分化获得的,干细胞的获取方便,效率高且对人体无伤害。
(2)本发明中所用培养中加有羧甲基壳聚糖能促进细胞生长,缩短了细胞的培养周期。
(3)本发明中所制备的组织工程皮肤含有毛囊结构能够调节创面新陈代谢、温度,加快创面的功能恢复。
(4)本发明中所用的生物支架为脱细胞羊膜,方便获取且免疫原性低。
附图说明
图1是表皮细胞标志分子ck19免疫荧光鉴定显微镜图;
图2是表皮细胞标志分子ck19流式细胞学鉴定显微镜图;
图3是成纤维细胞标志分子vimentin免疫荧光鉴定显微镜图;
图4是成纤维细胞标志分子vimentin的rt-pcr电泳图;
图5是毛囊细胞标志分子ck15免疫荧光鉴定显微镜图;
图6是毛囊细胞标志分子ck15的rt-pcr的电泳图;
图7是组织工程皮肤细胞分布图。
具体实施方式
本发明通过以下实施例进行进一步的说明,使本领域技术人员更加理解本发明技术方案,本发明使用的成分均属于常规产品,其中,所用的非配制培养基均购于北京裕恒丰科技有限公司,品牌sciencell,wnt3a购自华雅再生医学生物工程技术有限公司。
实施例1培养基成分与种类
以dmem/f12体积比为9:1混合为基础培养基,使用基础培养基配制以下培
养基,其中添加物浓度为终浓度:
培养基b:商用型regm培养基与mef培养基以1:1的体积比混合;
培养基d:基础培养基500ml、l-谷酰胺2mmol/l、碱性成纤维细胞生长因子75ug/l、地塞米松10-8mol/l;
培养基e:基础培养基500ml、人表皮生长因子20ng/ml、肝细胞生长因子3ng/ml、碱性成纤维细胞生长因子2ng/ml、血小板衍生因子5ng/ml、胰岛素样生长因子5ng/ml、转化生长因子-β5ng/ml;
培养基f:基础培养基500ml、角质化细胞生长因子20ug/l、转化生长因子-β45ug/l、血小板衍生因子-ab8ug/l、血管内皮生长因子15ug/l、白细胞介素-25ug/l、氢化可的松0.4ug/ml;
培养基g:基础培养基500ml、氢化可的松0.5ng/ml、霍乱毒素1×10-10mol/l、胰岛素0.05ng/ml、三碘甲状腺原氨酸1×10-7mol/l、腺嘌呤1.8×10-4mol/l、青霉素100iu/ml、人表皮生长因子15ng/ml、转铁蛋白10ug/ml、谷氨酸5ug/ml、rock抑制剂5μm、羧甲基壳聚糖0.1mg/ml;
培养基h:基础培养基500ml、碱性成纤维细胞生长因子10ug/l、维生素c1mmol/l、非必需氨基酸0.02mmol/ml;
培养基i:基础培养基500ml、胰岛素5ng/ml、氢化可的松300ug/ml、腺嘌呤15ug/ml、维生素c120ug/ml、人表皮生长因子5ng/ml、碱性成纤维细胞生长因子8ng/ml、bpe20ug/ml、转铁蛋白10ug/ml、羧甲基壳聚糖0.5mg/ml;
培养基j:基础培养基500ml、成纤维细胞生长因子5ug/ml、肝细胞生长因子5ug/ml、wnt3a30-200ng/ml、角质细胞生长因子12.5μg/ml、胰岛素样生长因子50ng/ml、血管内皮生长因子10ng/ml、表皮细胞生长因子20μg/l、神经生长因子15ng/ml、青霉素100iu/ml、链霉素100iu/ml、l-谷氨酰胺3mmol/l、胸腺素β40.015%;
培养基k:基础培养基500ml、l-谷氨酰胺2.5mmol/l、胰岛素-转铁蛋白-硒添加剂1ng/ml、肝细胞生长因子5ug/ml、胰岛素3ng/ml;
培养基l:基础培养基500ml、胰岛素0.05μmol/l、非必需氨基酸0.05mmol/ml、人表皮生长因子10ng/ml、青霉素100iu/ml、牛垂体提取物20ug/ml、氯化钙300μg/ml。
实施例2一种含附属器的组织工程皮肤
所述的组织工程皮肤的制备方法为:所涉及到的培养基成分如实施例1,步骤为:
步骤一:尿液细胞的收集
1)收集杯中加入2ml青霉素/链霉素双抗后,收集120ml尿液;
2)将尿液倒入4个50ml离心管中,离心400r/min,10min,吸去上清液至每管剩余液体3ml,合并到一个离心管内,加入20ml含有体积分数为5%青霉素/链霉素的pbs中,混匀后,离心400r/min,10min,吸去上清液至剩余液体0.75ml;
3)将六孔板1孔用0.1%明胶包被25min后,吸去孔内液体,将步骤2)得到的剩余液体倒入包被好的孔中,加入2mlregm培养基再加入3μlprimocin后,放入37℃培养箱内培养,待尿液中细胞贴壁后,进行换液处理;
4)当尿液细胞融合度达到80%,则可进行传代培养;
步骤二:多能干细胞的诱导与培养
①细胞转染:将表达转录调控因子oct4、sox2、nanog、klf4和lin28导入尿液细胞,然后分至预先用matrigel包被的6孔板中,用培养液b补至每孔2ml培养,细胞培养密度为1×106/ml;
②细胞增殖:细胞转染第2天,将培养基b更换为mtesr1培养基,并且连续7天每天更换mtesr1培养基,得到克隆细胞;
③细胞优化:镜下观察并挑选形态与人胚胎干细胞相近的克隆细胞,作为多能干细胞,并接种于用matrigel包被的12孔板中,细胞接种密度为1×106/ml,每孔加1mlmtesr1培养基进行传代培养;
步骤三:间充质干细胞的诱导与培养
(1)当诱导多能干细胞长至80%时,将mtesr1培养基去除,加1mldmem/f12培养液清洗一遍后,加含0.5mmedta的dpbs消化5min,400r/min,离心5min,收集细胞沉淀,加入mtesr1培养基以1:3的比例进行传代,传至已被matrigel包被好的六孔板中;
(2)待多能干细胞长至六孔板的75%时,pbs冲洗一遍后,更换培养基d,培养2天后,得到间充质干细胞,加含0.5mmedta的dpbs进行消化,400r/min,离心5min,加入培养基e重悬细胞,制成1×106/ml单细胞悬液;
(3)将单细胞悬液接种至0.1%明胶预先包被的10ml细胞培养皿中,当细胞融合度达到90%后,加含0.5mmedta的dpbs消化细胞,然后加入培养基e按照1:3的比例进行细胞传代培养;
步骤四:(一)组织工程表皮细胞的培养
<1>将间充质干细胞培养基中的培养基e去除,加1mldmem/f12培养液清洗一遍后,加含0.5mmedta的dpbs消化5min,400r/min,离心5min,收集细胞沉淀,加入培养基e以1:3的比例进行传代,传至已被matrigel包被好的六孔板中;
<2>待间充质干细胞长至六孔板的75%时,pbs冲洗一遍后,更换培养基f,每两天更换一次培养基,培养4天后,得到表皮细胞,加含0.5mmedta的dpbs进行消化,400r/min,离心5min,加入培养基g重悬细胞,制成1×106/ml单细胞悬液;
<3>将单细胞悬液接种至10cm细胞培养皿中,细胞融合度达到90%后,加含0.5mmedta的dpbs消化,使用培养基g重悬细胞,制成1×106/ml单细胞悬液,备用;
(二)组织工程成纤维细胞的培养
[1]同步骤四(一)中的<1>;
[2]待间充质干细胞长至六孔板的75%时,pbs冲洗一遍后,更换培养基h,每两天更换一次培养基,培养5天后,得到成纤维细胞,加含0.5mmedta的dpbs进行消化,400r/min,离心5min,加入培养基i重悬细胞,制成5×105/ml单细胞悬液;
[3]将单细胞悬液接种至10cm细胞培养皿中,细胞生长3天融合度达到90%后,加含0.5mmedta的dpbs消化,使用培养基i重悬细胞,制成5×105单细胞悬液,备用;
(三)组织工程毛囊细胞的诱导培养
{1}同步骤四(一)中的<1>;
{2}待间充质干细胞长至六孔板的75%时,pbs冲洗一遍后,更换培养基j,每两天更换一次培养基,培养5天后,得到毛囊细胞,加含0.5mmedta的dpbs进行消化,400r/min,离心5min,加入培养基k重悬细胞,制成5×105/ml单细胞悬液;
{3}将单细胞悬液接种至10cm细胞培养皿中,细胞生长3天融合度达到90%后,加含0.5mmedta的dpbs消化,使用培养基k重悬细胞,制成5×105单细胞悬液,备用;
步骤五:含有附属器的组织工程双层皮肤的构建
<i>将羊膜打孔成与6板孔直径相同的羊膜圆片;
<ii>将成纤维细胞与毛囊细胞按1.0:1的比例混合,成纤维细胞与毛囊细胞接种总密度为1×107/ml,接种到羊膜基质层,加入培养液i进行培养,待细胞的融合度达到80%,在羊膜的上皮面接种表皮细胞,接种密度为1.5×106/ml,加入培养基g进行培养;
<iii>培养2天后表皮细胞紧贴于羊膜上皮面,将培养基g弃去,加入2ml培养液l继续培养,每天换液,培养2天,即得。
所述的dmem/f12培养液体积比为9:1,
所述的羊膜为脱细胞羊膜,使用前浸泡在含有1%质量分数壳聚糖的deme培养基中12小时。
实施例3一种含附属器的组织工程皮肤
与实施例2的区别是,使用的羊膜为脱细胞羊膜,使用前浸泡在含有0.5%质量分数壳聚糖的deme培养基中12小时;
步骤五,含有附属器的组织工程双层皮肤的构建,具体如下:
<i>将羊膜打孔成6板孔直径相同的羊膜圆片;
<ii>将成纤维细胞与毛囊细胞按1.1:1的比例混合,接种到羊膜基质层,接种总密度为2×107/ml,加入培养液i进行培养,待细胞的融合度达到75%,在羊膜的上皮面接种表皮细胞,加入培养基g进行培养,接种密度为2×106/ml;
<iii>培养2天后表皮细胞紧贴于羊膜上皮面,将培养基弃去,加入2ml培养液l继续培养,每天换液,培养2天,即得;其他同实施例2。
实施例4一种含附属器的组织工程皮肤
与实施例2的区别是,使用的羊膜为脱细胞羊膜,使用前浸泡在含有2%质量分数壳聚糖的deme培养基中12小时;
步骤五,含有附属器的组织工程双层皮肤的构建,具体如下:
<i>将羊膜打孔成与培养板孔直径相同的羊膜圆片;
<ii>将成纤维细胞与毛囊细胞按0.9:1的比例混合,接种到羊膜基质层,接种总密度为0.2×107/ml,加入培养液i进行培养,待细胞的融合度达到85%,在羊膜的上皮面接种表皮细胞,加入培养基g进行培养,接种密度为1×106/ml;
<iii>培养2天后表皮细胞紧贴于羊膜上皮面,将培养基弃去,加入2ml培养液l继续培养,每天换液,培养2天,即得;
其他同实施例2。
对比例1培养基成分与种类
与实施例1的区别是,培养基i不添加羧甲基壳聚糖,其他同实施例1。
对比例2一种含附属器的组织工程皮肤
与实施例2的区别是,所涉及到的培养基成分如对比例1,所述的组织工程皮肤制备方法与实施例2类似。
对比例3一种含附属器的组织工程皮肤
与实施例2的区别是,使用的羊膜为脱细胞羊膜,使用前没有浸泡含有1%质量分数壳聚糖的deme培养基中12小时,其他同实施例2。
试验例1、细胞的鉴定
通过对实施例2-4进行细胞鉴定,发现本发明实施例2-4制得的组织工程皮肤细胞种类与分布类似,其中以实施例2为例进行具体细胞的鉴定。
(1)表皮细胞的鉴定
表皮细胞的表型鉴定免疫荧光鉴定
①0.25%胰酶消化表皮细胞,以1×105的接种量接种于12孔板中,待其贴壁,4%的多聚甲醛固定2h,pbs洗三遍;
②加200μl的一抗稀释液(pbs+10%血清+0.3%tritonx-100)常温封闭1-2h;
③弃去一抗稀释液,加入200μl鼠源ck19一抗抗体(稀释度为1:100),4℃孵育过夜,pbs冲洗3次,每次5min;
④加200μlfitc标记羊抗鼠二抗(1:400),常温避光反应1h,pbs冲洗;上机检测前用pi染核;
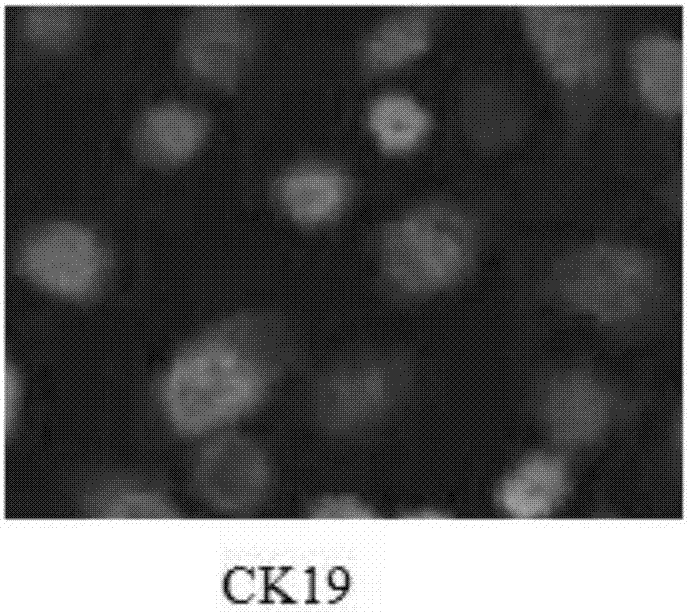
⑤结果判定:荧光倒置显微镜下观察结果见绿色荧光为阳性,ck19表达于细胞浆,与同表达于细胞核的pi显示的红色荧光叠加后为橙色荧光。结果见附图1。
本发明细胞显示绿色荧光为表皮细胞标志分子ck19在细胞质中的表达,ck19是细胞早期分化过程表达的角蛋白,从图1中可以看出,本发明细胞质显示为绿色荧光,为阳性,检测细胞为表皮细胞,
流式细胞学鉴定
①0.25%胰酶消化表皮细胞并收集细胞,细胞数为2×105个;
②细胞胞重悬于1mldpbs中洗涤2次,200r/min,离心5min,得到的细胞沉淀加入1ml70%预冷的酒精重悬固定2h;
②离心弃去固定液,加入200μl鼠源ck19、一抗抗体(稀释度为1:100)常温下孵育30min;
④1mlpb洗涤后,分别与fitc标记二抗(稀释度为1:200)常温避光孵育1h;
⑤pbs洗两次后,弃去pbs,根据细胞量加入适量的pbs重悬细胞,利用流式细胞仪检测。结果见附图2。
从图2中可以看出,所检测的细胞ck19阳性表达率为95%以上,因此同样得出检测细胞为表皮细胞。
(2)成纤维细胞的鉴定
免疫荧光鉴定
①0.25%胰酶消化成纤维细胞,以1×105的接种量接种于12孔板中,待其贴壁,4%的多聚甲醛固定2h,pbs洗三遍;
②加200μl的一抗稀释液(pbs+10%血清+0.3%tritonx-100)常温封闭1-2h;
③弃去一抗稀释液,加入200μl鼠源vimentin一抗抗体(稀释浓度为1:100),4℃孵育过夜,pbs冲洗三次3次,每次5min;
④加200μlfitc标记羊抗鼠二抗(1:400),常温避光反应1h,pbs冲洗;上机检测前用pi染核;
⑤结果判定:荧光下观察见绿色荧光为阳性。结果见附图3。
图3显示本发明细胞显示绿色荧光,为成纤维细胞标志分子vimentin,说明了本发明呈阳性,所检测细胞为成纤维细胞。
rt-pcr检测成纤维细胞分子标志物vimentinmrna水平的表达
vimentin引物序列为(f5'-gaacgccagatgcgtgaaatg-3',r5'-ccagagggagtgaatccagatta-3',280bp),β-actin引物序列(f5'-ttgcgttacaccctttctt-3',r5'-caccttcaccgttccagt-3',497bp)(1)细胞总rna提取
①0.25%胰酶消化成纤维细胞收集细胞,移入1.5ml离心管中,离心弃上清液;
②加入1mltrizol裂解细胞,充分振荡混匀室温静置5min,然后加入200μl的氯仿,上下振荡混匀,室温静置15min;
③4℃条件下,12000r/min离心15min;取上层水相,加入500μl异丙醇,振荡混匀,室温静置10min;
④4℃条件下,12000r/min离心10min;弃上清,1ml75%的乙醇洗涤沉淀,悬浮后4℃条件下,12000r/min离心5min;弃上清,将沉淀室温干燥2~5min,溶于depc水中。
(rna的质量鉴定:利用紫外分光光度计测定提取的细胞rna纯度及含量,a260与a280比值在1.8~2.0之间,基本无蛋白质污染。)
(2)总rna逆转录反应合成cdna
①反应体系
300ng样品rna,50pmol通用引物,无rna酶水至7μl,2μl5×mlvpcr缓冲液,5μmol脱氧核糖核苷三磷酸混合物,10urna酶抑制剂,50u逆转录酶,total10μl。
②反应条件
引物与模板结合:70℃10min,
转录工作:42℃1h,
解链:70℃15min,
降温:4℃5min。
rt-pcr反应体系及条件
①反应体系
灭菌蒸馏水7.7μl、taq酶10μl、上游引物1pmol、下游引物1pmol、cdna1.5μl、total20μl。
②反应条件
③反应结束后,取pcr产物5μl,经3%琼脂糖凝胶电泳后,紫外灯下观察,集rt-pcr凝胶图像并进行分析。结果见附图4。
从图4中可以看出,β-actin作为内参,得出vimentin得以表达,并且属于高表达,说明了检测的细胞中vimentin属于高表达蛋白,证明检测细胞属于成纤维细胞。
(3)毛囊细胞的鉴定
免疫荧光鉴定
所用抗体为兔源ck15抗体,实验步骤同成纤维细胞免疫荧光鉴定步骤,结果见附图5。
ck15集中表达于毛囊隆突区,是毛囊细胞的标志分子,图5显示绿色荧光为ck15,说明本发明检测的细胞为阳性,证明检测的细胞为毛囊细胞。
pcr鉴定
ck15引物序列(f5'-ctacagccctacatacac-3',r5'-ggtctgtgctgcagctca-3',560bp);其他实验步骤同成纤维细胞检测步骤。结果见附图6,从图6中可以看出,pcr产物电泳成像得到单一的ck15条带,说明了检测的细胞为毛囊细胞。
(4)组织工程皮肤形态分析
将实施例2得到的双层组织工程皮肤进行检测,将其放入he染色剂中,通过he染色后并在镜下呈现细胞的图像,结果见附图7。
从图7中可以看出,不同类型的细胞形态结构存在很大的差异,其中表皮细胞位于皮肤最外层,图7中可以看出胞质中含有大量的透明角质颗粒,属于表皮细胞分泌物质角蛋白,成纤维细胞呈现细长形态,位于表皮细胞内部,毛囊细胞分布在皮肤的最内层,本发明制备的组织工程皮肤与人体皮肤结构近似,含有的毛囊结构可以有效地增加皮肤的透气性,更加有利于皮肤创口愈合。
试验例2、组织工程皮肤性质评价
实施例2-4与对比例2-3:显微镜观察组织工程皮肤发现,放大同样倍数时,观察细胞种类与生长密度,以实施例2为参照进行比较,具体见表1所示。
表1细胞种类与生长密度
显微镜观察组织工程皮肤发现实施例2-4与对比例2-3中的细胞种类位置更加有序,实施例2-4细胞种类与生长密度相似,细胞密度高,而对比例2-3细胞中表皮细胞数、成纤维细胞与毛囊细胞生长无序,密度低。
试验例2、愈合效果分析
试验材料:雄性balb/c-nu小鼠,于小鼠背部正中线上,用手术剪去除一直径为6mm的圆形皮肤全层,移植实施例2-4与对比例2-3制备的组织工程皮肤。
实施例2-4组织工程皮肤与创面贴敷效果较好,1周后创面面积愈合70%左右,新生皮肤与正常皮肤触感相同。
对比例2-3组织工程皮肤与创面贴敷效果较好,1周后创面面积愈合60%左右,新生皮肤对比正常皮肤触感稍感紧绷。对比发现本发明实施例1-3相对对比例2-3具有愈合效果更好,愈合速度快。
- 还没有人留言评论。精彩留言会获得点赞!