一种生产胞二磷胆碱的重组微生物及生产胞二磷胆碱的方法与流程
本发明属于生物技术领域,具体地,涉及一种生产胞二磷胆碱的重组微生物,利用重组微生物生产胞二磷胆碱以及利用该重组微生物通过生物方法生产胞二磷胆碱。
背景技术:
胞二磷胆碱(citicoline,cdp-choline,缩写cdpc)属于核苷的衍生物,由5’胞苷酸和磷酸胆碱合成而成。分子式c14h26n4o11p2,相对分子质量488.323962,沸点851.4°c。它是从胆碱生成磷脂酰胆碱的中间体,存在于所有细胞中,是磷脂合成的主要辅酶,通过促进卵磷脂的合成而改善脑的功能。用于治疗急性颅脑外伤和脑手术后意识障碍等。
胞二磷胆碱的生产主要有化学法和生物法两种。化学合成法以胞苷酸和磷酸胆碱为底物,甲苯磺酰氯为缩合剂,在n-二甲基甲酰胺作用下生成胞磷胆碱钠,但该方法反应转化率低,副产物多,成本高且污染大。
生物法生产胞二磷胆碱有比较长的历史。主要是单酶/多酶催化法或单菌/多菌转化法。1975年shojishirota等研究酵母合成胞二磷胆碱及其影响因素(shojishirota1975,agrbiolchen,35(3):1469-1474.)。1982年isaotakata等人用复合k2卡拉胶固定fumarase酶生物合成cdpc(takataj1982,fermemtechnol,60(5):431-437.)1992-2002年邱蔚然等利用固定化酵母细胞生产胞二磷胆碱(邱蔚然1992,中国生化药物杂志,62(4):37-39.;余冬生2002,无锡轻工大学学报,21(3):277-280.)。近年来,用酵母菌或产氨短杆菌等以乳清酸和磷酸胆碱为底物,在添加葡萄糖产atp的情况下,发酵生产胞二磷胆碱,依然存在成本高,转化率低等问题(应汉杰2015,一株表达胆碱激酶及磷酰胆碱胞苷转移酶的基因工程菌及其构建方法与应用,201510184705.8),不利于大规模工业化生产应用。
因此,需要开发一种能无污染、低成本的胞二磷胆碱合成方法,可以有效地实现胞二磷胆碱的大规模工业化生产,从而降低胞二磷胆碱的生产成本和减少污染。
目前胞二磷胆碱的年需求量仅国内就达1000吨,目前仅能提供50吨左右,本发明满足了上述需求并且还具有相关的优势。
技术实现要素:
发明目的:设计和生产具有较高产量胞二磷胆碱生产合成和积累能力的重组微生物,并利用该重组微生物实现以氯化胆碱为底物的胞二磷胆碱的高产量生物法生产。
技术方案:
1.去除利用和降解胞二磷胆碱的酶的编码基因
首先为了使微生物能够积累胞二磷胆碱(cdpc),对细胞中利用胞二磷胆碱的酶的编码基因进行了敲除或阻断,这些酶包括:胞苷-5'-二磷酸-二酰基甘油焦磷酸酶(cdh),胞苷-5'-二磷酸醇水解酶(usha),它们能够催化胞二磷胆碱生成胞苷酸和磷酸胆碱。
2.从磷酸胆碱的胞苷酰化来合成胞二磷胆碱
在自然界中生物中,存在能够将胞苷三磷酸(ctp)去磷酸化并与磷酸胆碱(pc)生成胞二磷胆碱和焦磷酸的胞苷酰转移酶(ec2.7.7统称ctase)。如,酿酒酵母来源的pct1(tsukagoshiy1991,jbacteriol.173(6):2134-6.),cds1(carter1966,jlipidres7(5);678-83.),ect1(visedogonzalez1989,biochemj260(1);299-301.);大肠杆菌来源的cdsa(carter1966,jlipidres7(5);678-83.),ispd(rohdich1999,procnatlacadsciusa1999;96(21);11758-63.),moca(neumann2009,jbiolchem284(33);21891-8.),kdsb(ghalambor1966,jbiolchem1966;241(13);3216-21.),cca(shi1998,emboj17(11);3197-206.);链球菌(streptococcusmitisb6)来源的licc(denapaited2010plosone.5(2):e9426.);家鼠(musmusculus)来源的pcyt1a(geneid:13026),pcyt1b(geneid:236899);komagataellaphaffiigs115来源的pas_chr2-2_0401(geneid:8199108);假丝酵母菌(candidadubliniensiscd36)来源的cd36_40620;果蝇来源的cct1(geneid:117353),cct2(geneid:38180)等等。
这些对ctp具有特异性的ctase或/和它们同源的酶的编码基因可以用dna合成的方法获得,也可以直接相应的生物中提取的mrna为模板,通过pcr的方法获得。因此,将上述获得的任何一个基因在重组细胞中进行表达,成功表达的ctase就可以在重组细胞中以ctp和pc为底物来产生cdpc,并且显著增加cdpc的产量。
为了进一步获得特异性更高的某一ctase,可以通过蛋白质工程的技术,也可以获得具有对ctp高特异性的ctase突变体,用来在重组细胞中产生大量的cdpc(如,通过蛋白质工程来提高芽孢杆菌中支链淀粉酶的热稳定性(chang2016,mplosone.11(10):e0165006.))。
3.增强细胞中胆碱及磷酸胆碱的供给
为了获得更多的磷酸胆碱,就需要提供更快的氯化胆碱的供给,为防止氯化胆碱进入细胞成为限速步骤,我们对胆碱转运蛋白bett进行了表达,以获得更多的转运蛋白。
大多野生型的生物都能生产多种磷酸化酶,如酸性磷酸化酶、碱性磷酸化酶,例如大肠杆菌产生酸性磷酸化酶(apha)、碱性磷酸化酶(phoa)(参考http://ecocyc.org/)。而细胞内的磷酸胆碱会被这些磷酸酶水解成胆碱和磷酸。胆碱又会进一步被脱氢生成甘氨酸甜菜碱。能够降解胆碱的脱氢酶,包括大肠杆菌的胆碱脱氢酶beta、betb(gadda2003,applenvironmicrobiol69(4);2126-32.),乙醇酸氧化酶glcd、glce、glcf(lord1972,biochimbiophysacta1972;267(2);227-37.)。
作为cdpc的前体物,磷酸胆碱的持续性供给很重要。为此,1)是在重组细胞中表达或超量表达胆碱转运蛋白,以加速胆碱进入细胞。2)必须使细胞缺少磷酸化酶,以实现磷酸胆碱的持续稳定供应。3)是在重组细胞中表达或超量表达胆碱激酶(ckase),从而加速胆碱磷酸化生成磷酸胆碱。相关的胆碱激酶可能并不存在于所有的、非基因改造过的细胞中。目前已知的能够催化胆碱磷酸化的胆碱激酶,包括酿酒酵母来源的cki1(ec2.7.1.32https://www.biocyc.org/geneorgid=yeast&id=ylr133w-monomer)(wittenberg1953,biol.chem,431-44),eki1(乙醇胺激酶,ethanolaminekinasehttps://biocyc.org/geneorgid=yeast&id=ydr
147w)(sung1967,biochem.j.105,497);家鼠(musmusculus)来源的chka(geneid:12660),chkb(geneid:12651);智人来源的chka(geneid:1119),chkb(geneid:1120);拟南芥(arabidopsisthaliana)来源的ck1(geneid:843500);秀丽隐杆线虫(caenorhabditiselegans)来源的cka-1(geneid:177807),cka-2(geneid:180703),ckb-1(geneid:181904),ckb-2(geneid:175565),ckb-4(geneid:184864)等等。3)由于本发明是在发酵期间添加底物氯化胆碱,为防止底物的降解,必须将能够降解胆碱的酶敲除或阻断。
4.增加cdpc的前体物ctp的浓度
细胞中的ctp是嘧啶合成途径的中间产物,它是由尿苷三磷酸utp在胞苷三磷酸合成酶pyrg的作用下生成。但pyrg受到其产物cdp的反馈抑制,对该酶第160位天冬氨酸到谷氨酸(d160e),或第162位谷氨酸到丙氨酸(e162a)或第168位谷氨酸到赖氨酸的突变(e168k)可有效解除cdp对其反馈抑制作用(iyengara2003,biochemj.369(pt3):497-507)。而ctp会在5-羟基-ctp焦磷酸酶nudg的作用下生成胞苷酸cmp。敲除或阻断nudg的编码基因,可有效的阻止ctp的分流,积累更高浓度的ctp,从而提高cdpc的产量。
5.阻断尿苷二磷酸ump的分流
在大肠杆菌嘧啶合成途径中,ump作为胞二磷胆碱合成的中间产物,除经ctp合成胞二磷胆碱外,还可以在5’-核苷酸酶催化下生成尿苷。阻断或敲除在5’-核苷酸酶的编码基因umpg,umph,就可解除ump的分流,从而使ump专门用于cdpc的合成。
6.解除嘧啶核苷合成的反馈抑制和反馈阻遏,增加嘧啶核苷合成的代谢流和cdpc的产量
嘧啶核苷酸合成途径催化第一步由氨基甲酰磷酸合成酶carab催化合成氨基甲酰磷酸。该酶分别受到代谢终产物嘌呤、嘧啶以及精氨酸的反馈阻遏(devroeden2006,jbacteriol.188(9):3236-45.),相应阻遏蛋白分别为purr,pepa,argr(kim2015,microbcellfact14:98),本发明通过对阻遏蛋白编码的基因purr,pepa,argr的敲除,进而解除了carab的转录的抑制,加快了氨基甲酰磷酸合成。同时该酶也会受到ump的反馈抑制,根据文献报道(delannays1999,jmolbiol.286(4):1217-28),将该酶的一个亚单位(carb)的第948位氨基酸-丝氨酸突变成苯丙氨酸(s948f)就可有效解除ump的抑制作用,本发明通过在染色体上对carb基因进行突变,获得携带编码carb(s948f)突变基因的重组菌株。
嘧啶核苷酸合成途径催化第二步是由天冬氨酸氨甲酰基转移酶催化合成氨基甲酰天冬氨酸。该酶由一个起调控作用的亚基(pyri)和一个起催化亚基(pyrb)组成,在ctp浓度高的时候,ctp会结合pyri从而降低酶的活性。如果将编码天冬氨酸氨甲酰基转移酶调控亚基破坏掉,如将其编码基因的敲除,就解除终产物ctp对其的反馈抑制作用(coudrayl2009,bioorgmedchem.17(22):7680-9)。
嘧啶核苷酸合成途径中pyre编码乳清酸核糖磷酸转移酶,催化乳清酸合成乳清酸单磷酸,大肠杆菌w3110宿主菌中pyre基因上游rph基因终止密码子附近存在移码突变(kajfrankjensen1993,journalofbacteriology,3401-3407.),导致部分rph基因转录无法终止,进而影响下游pyre基因的表达,导致宿主菌中乳清酸的积累。对基因组中的pyre进行修正,可有效消除副产物乳清酸的积累。
另外在嘧啶核苷酸合成中,核糖是通过核糖磷酸焦磷酸为前体物合成到核苷上的,核糖磷酸焦磷酸激酶(prs)催化5-磷酸核糖与atp反应合成核糖磷酸焦磷酸prpp。但是大肠杆菌来源的核糖磷酸焦磷酸激酶受到adp的反馈抑制,对prs上的第128位的天冬氨酸到丙氨酸(d128a)的突变可有效解除adp对其反馈抑制作用(shimaoka2007jbioscibioeng103(3):255-61.)。
pyrh基因编码的ump激酶,催化ump磷酸化合成尿苷二磷酸udp,但该酶受到其产物udp的反馈抑制,有文献报道,该酶第93位的天冬氨酸到丙氨酸的突变(d93a)能够有效解除相应的反馈抑制作用(meyerp2008,jbiolchem.283(51):36011-8.)。
有益效果:本发明具有以下优点:与现有技术相比,本发明所述的生产胞二磷胆碱的重组微生物以及应用该重组微生物利用生物法生产实现胞二磷胆碱的高产量生产方法,开发了一种能无污染、低成本的胞二磷胆碱合成方法,其具有以下有益效果:微生物发酵过程中,细胞中会积累一定量的胞苷三磷酸,通过利用遗传操作的生物材料的方法建立重组微生物,通过代谢工程的手段,改造微生物,并利用微生物发酵的方法,使胞内富集胞二磷胆碱的前体物胞苷三磷酸,最终实现胞二磷胆碱的合成并积累在其生长的基质中,就可以有效地实现胞二磷胆碱大规模工业化生产,从而降低胞二磷胆碱的生产成本和减少污染,绿色环保,具有较高的推广应用价值。
附图说明:
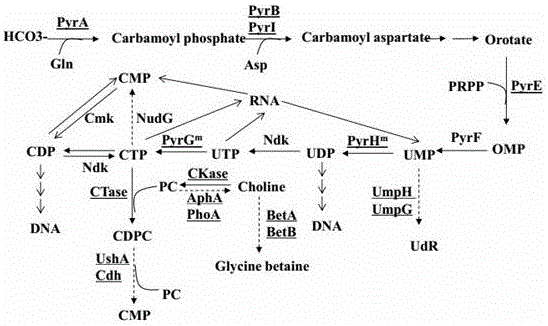
图1为大肠杆菌中胞二磷胆碱的代谢路径示意图;
图2为胞二磷胆碱检测的hplc图谱。
其中:carbamoylphosphate:氨甲酰磷酸;carbamoylaspartate:氨甲酰天冬氨酸;orotate:乳清酸盐;omp:乳清酸-5'-单磷酸;ump:尿苷-5'-单磷酸;udp:尿苷-5'-二磷酸;utp:尿苷-5'-三磷酸;udr:尿苷;cdr:胞苷;ctp:胞苷-5'-三磷酸;cdp:胞苷-5'-二磷酸;cmp:胞苷-5'-单磷酸;cdpc:胞二磷胆碱;pc:磷酸胆碱;choline:胆碱;glycinebetaine:甘氨酸甜菜碱;pyra:氨基甲酰磷酸合成酶;pyrb/i:天冬氨酸氨甲酰基转移酶;pyre:乳清酸磷酸核糖转移酶;pyrf:尿苷-5’磷酸脱羧酶;pyrh:尿苷-5'-单磷酸激酶;pyrg:胞苷三磷酸合成酶;cmk:胞苷-5'-单磷酸激酶;ctase:胞苷酰转移酶;ckase:胆碱激酶;ndk:核苷二磷酸激酶;nudg:5-羟基-胞苷三磷酸二磷酸酶;ump:尿苷-5’-单磷酸;umpg:广义特异性核苷酸酶/多聚磷酸酶;umph:尿苷5’磷酸酶;beta:胆碱脱氢酶;betb:甜菜碱醛脱氢酶;apha:酸性磷酸酶;phoa:碱性磷酸酶;usha:胞苷二磷酸醇水解酶;cdh:胞苷二磷酸-二酰基甘油焦磷酸酶。
具体实施方式
下面将通过几个具体实施例,进一步阐明本发明,这些实施例只是为了说明问题,并不是一种限制。
实施例1在大肠杆菌中基因敲除的方法
本发明采用datsenko的方法在大肠杆菌中进行基因敲除(datsenkoka2000,procnatlacadsciusa,97(12):6640~6645),相应的基因敲除引物见babat2006,molsystbiol2(1),0008。
实施例2摇瓶发酵验证重组菌株的方法
验证重组菌株在摇瓶发酵中生产胞二磷胆碱的发酵培养基,具体为每升培养基中yc溶液100ml,葡萄糖20g,5倍的盐溶液200ml,tm2溶液1ml,柠檬酸铁10mg,无水硫酸镁120mg,氯化钙111mg,硫胺素1ug,以去离子水定容,其中5倍的盐溶液为磷酸氢二钠每升30g,磷酸二氢钾每升15g,氯化钠每升2.5g,氯化铵5.0g,以离子水定容;tm2溶液为四水氯化锌每升2.0g,六水氯化钙每升2.0g,两水钼酸钠每升2.0g,五水硫酸铜每升1.9g,硼酸每升0.5g,盐酸每升100ml。发酵培养基m9中yc溶液为去离子水100ml;发酵培养基ms3.2中yc溶液为蛋白胨4g,酵母粉4g,氯化钠10g,去离子水100ml。上面溶液灭菌为121°c,20-30分钟。
摇瓶发酵过程如下:首先接种重组菌株至含有抗生素的一定量的lb培养基(著[美]j.莎姆布鲁克黄培堂译,子克隆指南2002,1595)中,置34℃摇床中,250rpm培养过夜;取过夜种子100μl转移到至2ml含有抗生素的lb,于34℃摇床中,250rpm培养4-6h至od600值为1.5左右;随后将2ml二级种子全部转入装有18ml发酵培养基的摇瓶中,置34℃摇床中,250rpm培养od600值为1左右时,添加iptg至终浓度0.1mm后,添加氯化胆碱至终浓度为4mm,继续培养20小时左右后,取发酵液离心检测,具体检测方法见实施例4。
实施例35l发酵罐利用重组菌株发酵生产胞二磷胆碱的方法
验证重组菌株在发酵罐中发酵生产胞二磷胆碱的发酵培养基为mf1.32,具体为每升培养基中含硫酸铵2g,氯化钠8g,磷酸二氢钾2g,六水氯化镁1.65g,葡萄糖10g,氯化钙105mg,氯化锌10mg,tm2微量元素溶液1ml,柠檬酸铁94mg,蛋白胨6g,酵母粉6g,以去离子水定容。其中tm2微量元素溶液为氯化锌1.31g,氯化钙1.01g,四水合钼酸铵1.46g,硫酸铜1.9g,硼酸0.5g,盐酸10ml,以去离子水定容。补料培养基每升含葡萄糖600g,蛋白胨40g,酵母粉40g。
发酵如下:首先准备种子,从lb平板上挑取单克隆到含有抗生素的lb试管34℃过夜培养,按接种量1%接入装100mllb的500ml摇瓶,34℃培养4小时,od至1.5~2;以接种量5%接种至装有1.5l发酵培养基mf1.32的5l发酵罐,37℃培养,用氨水调节ph为6.9,溶氧转速偶联,维持溶氧在30%,发酵3小时,开始补料8g/l/h,发酵5小时,od600至16~25时,降低温度至32℃,加入iptg,使终浓度为0.5mmol/l进行诱导,发酵10小时,固定转速1000rpm,当溶氧高于40%时,开始偶联补料,使溶氧维持在30%-45%。发酵27小时后开始取样检测,检测方法见实施例4。
实施例4hplc测定发酵液中的胞二磷胆碱和相关副产物
精密吸取200ul发酵液于800ul去离子水中,加入1ml无水乙醇,旋涡震荡5min,离心取上清液过0.22um的滤膜,用高效液相色谱(hplc)检测,hplc的参数如下:采用agilentsbc184.6*150mm5um,流动相为甲醇和10mmpbs(ph4.0),流动相比例0.01-4.00分钟甲醇比例为2%,4.00-5.00分钟甲醇比例由2%上升到10%,5.00-5.01分钟甲醇比例由10%降至2%,5.10-10.0分钟甲醇比例为2%,利用紫外检测器检,测波长272nm;流动相的流速为0.8ml/min,发酵液的上样量5μl,柱温30℃。cdpc出峰时间为2.745分钟,图谱如图2所示。
实施例5构建不能降解和利用cdpc的重组大肠杆菌
如图1所示,在大肠杆菌中,cdpc会被胞苷二磷酸醇水解酶usha、cdp-二酰基甘油焦磷酸酶cdh催化生成cmp和磷酸胆碱。本发明以大肠杆菌wj2(atcc27325△lacientdt5)为出发菌株,在wj2中敲除usha、cdh的编码基因,获得了重组菌,这些菌株利用和降解cdpc的能力逐渐减弱,其中重组菌hq24(wj2△ushaδumpgδumphδpyriδcdh)在摇瓶发酵中完全不能利用和降解cdpc。例如,在发酵培养基中添加2.0g/l的胞二磷酸胆碱,24h后检测wj2、wj3(wj2△usha)的cdpc残留为0.15g/l、1.02g/l。[sq150916结果:0.3/1.92]说明usha的敲除可显著消除cdpc的降解。在发酵培养基中添加1g/l的胞二磷酸胆碱,24h后检测hq19(wj2△ushaδumpgδumphδpyri)、hq24(hq19δcdh)、hq25(hq19δmazg)、hq26(hq19δnudf)的cdpc残留为0.5g/l、1.0g/l、0.45g/l、0.46g/l。说明cdh的敲除可完全消除cdpc的降解。hq24/py022(phs01-pct1-cki1-pyre-prs128)在发酵罐中发酵26h可达17g/l。
hq24/py022其分类命名为大肠埃希氏菌(escherichiacoli.),该菌株已于2017年06月26日保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编:100101,保藏编号为cgmccno.14277。
实施例6构建不能降解胆碱的重组大肠杆菌
本发明中大肠杆菌代谢生产胞二磷胆碱是以外源添加的氯化胆碱为底物,同时利用细胞自身嘧啶合成途径中产生的ctp,来合成胞二磷胆碱。这就涉及到底物以及中间产物在细胞内的代谢。底物胆碱会在胆碱脱氢酶的作用下参与细胞膜的电子传递并生成甜菜碱醛并进一步在甜菜碱醛脱氢酶作用下生成甘氨酸甜菜碱。
为阻止底物及中间产物的降解,本发明将胆碱脱氢酶的编码基因beta/b进行了敲除。
分别以hq33(hq24δpurrδfhua::trc-pyre,carb948)、hq34(hq33δbetab)为宿主,表达质粒py012,在发酵罐上发酵后,检测43h的cdpc产量hq33/py012为18.40g/l,hq34/py012为20.87g/l。说明胆碱脱氢酶的敲除可以阻断底物氯化胆碱的降解,使氯化胆碱完全用于磷酸化生成磷酸胆碱,进而提高cdpc的产量。
实施例7构建不能降解磷酸胆碱的重组大肠杆菌
本发明中生产胞二磷胆碱是以外源添加的氯化胆碱为底物,经胆碱激酶催化生成中间产物磷酸胆碱。而大肠杆菌中磷酸胆碱会被细胞中存在的酸性磷酸酶或碱性磷酸酶降解回到胆碱。
为阻止中间产物磷酸胆碱的降解,本发明将酸性磷酸酶的编码基因apha以及碱性磷酸酶的编码基因phoa进行了敲除。
分别以hq33(hq24δpurrδfhua::trc-pyre,carb948)、hq35(hq33δapha)、hq36(hq33δphoa)为宿主,表达质粒py012,在发酵培养基中进行摇瓶发酵后,检测hq33/py012的cdpc产量分别为1.82g/l、1.86g/l、1.87g/l。说明磷酸酶的敲除可以减少或阻断中间产物磷酸胆碱的降解,使磷酸胆碱更多的流向产物的合成,进而提高cdpc的产量。
实施例8过表达胞苷酰转移酶和/或胆碱激酶增加cdpc的产量
胞二磷胆碱及其底物胆碱中间产物磷酸胆碱的降解基因敲除后,cdpc的产量很低,说明胞内催化胆碱生成cdpc的关键酶的表达量不足。为了提高细胞中cdpc的产量,本发明将cdpc合成过程中的ctase以及ckase进行了适量表达。将表达不同携带编码ctase和/或ckase基因的质粒转化大肠杆菌表达宿主,cdpc的产量会有不同程度的提高。例如,在hq33中分别表达质粒phs01(pcl1920plac::ptrc,见ls9专利us20130029395a1),py008(phs01-pct1-cki1),py012(phs01-pct1-cki1-licc),摇瓶发酵培养,24小时后cdpc的产量分别为0g/l、1.44g/l、1.55g/l。
实施例9过表达胆碱转运蛋白来增加cdpc的产量
bett是氢离子驱动的胆碱转运蛋白,属于甜菜碱胆碱转运bcct家族。该蛋白在好氧条件下表达且受渗透压的诱导。高渗透压会加强bett的转录,同样胆碱的加入会进一步加强转录。为了获得更多的cdpc,就需要提供更快的氯化胆碱的供给,为防止氯化胆碱进入细胞成为限速步骤,我们对bett进行了过表达,以获得在渗透压不加大的情况下有更多的转运蛋白。以hq33为宿主,分别表达py012、py012-bett,在发酵培养基中摇瓶发酵,24h后检测cdpc的产量后者是前者的2.36倍。说明bett的过表达可以显著的提高cdpc的产量。
实施例10敲除ump降解酶编码基因来增加cdpc的产量
尿苷单磷酸ump是嘧啶合成途径的中间产物,它可以通过回补途径尿苷5’-单磷酸酶生成尿苷二磷酸udp,也可以由5’-核苷酸酶降解为尿苷。为了获得更多的产物cdpc,本发明中对5’-核苷酸酶的编码基因umpg和umph进行了敲除。以wj3和hq18(wj3δumpgδumph)为宿主,转化质粒py022(py008-pyre-prs128),在发酵培养基中摇瓶发酵,24h后检测cdpc的产量分别为1.9g/l和1.92g/l。菌株hq18/py022在发酵罐中发酵26h可达8.93g/l。
实施例11过表达pyre增加cdpc的产量
通过在质粒上和基因组上对pyre基因进行超量表达来解除上游rph基因移码突变导致的表达缺陷,增加cdpc的产量。例如以hq04(w3110(δdeoaδungδpurrδushaδbetabi,bettptrc))为宿主,分别表达py008、py009(py008-pyre),在发酵培养基中摇瓶发酵,cdpc的产量从0.67g/l提高到0.80g/l。说明过表达pyre,可以进一步提高胞二磷胆碱的产量。
实施例12过表达prs128提高cdpc的产量
在大肠杆菌嘧啶合成途径中,核糖磷酸焦磷酸(prpp)会在乳清酸核糖磷酸转移酶(pyre)的作用下将磷酸基转移至乳清酸生成乳清酸单磷酸(omp)。而prpp的不足会成为嘧啶合成途径中的限速步骤,导致胞二磷胆碱产量较低且造成副产物乳清酸的积累。核糖磷酸焦磷酸激酶(prs)催化5-磷酸核糖与atp反应合成prpp。但prs受到adp的反馈抑制,将prs的第128位的天冬氨酸突变为丙氨酸获得的prs128,就可以解除adp的反馈抑制作用。例如以wj3为宿主,分别表达py017(py009-prs)、py022(py009-prs128)后,在发酵培养基中摇瓶发酵,cdpc产量从1.80g/l提高到1.96g/l。
实施例13敲除编码pyri的基因可以提高cdpc产量
嘧啶核苷酸合成途径催化第二步是由天冬氨酸氨甲酰基转移酶催化合成氨基甲酰天冬氨酸。该酶由一个起调控作用的亚基(pyri)和一个起催化亚基(pyrb)组成,在ctp浓度高的时候,ctp会结合pyri从而降低酶的活性。本发明将pyri编码基因进行敲除,解除了终产物ctp对其的反馈抑制作用。例如在hq18、hq19(hq18dpyri)为宿主中表达py022,在发酵培养基中摇瓶发酵,cdpc的产量从1.74g/l提高到1.92g/l。说明pyri基因的敲除可以解除ctp对天冬氨酸氨甲酰基转移酶的反馈抑制,进而加速嘧啶合成途径的合成,提高cdpc的产量。
实施例14敲除编码阻遏蛋白purr、argr的基因可以提高cdpc产量
嘧啶核苷合成途径第一步由氨基甲酰磷酸合成酶催化合成氨基甲酰磷酸。该酶的编码基因carab受到代谢终产物嘌呤、嘧啶以及精氨酸的反馈阻遏作用。而嘌呤核苷酸受由purr基因编码的阻遏蛋白的抑制,精氨酸受到argr基因编码的阻遏蛋白的抑制。本发明通过对purr、argr的敲除,进而解除了carab的转录的抑制,加快了氨基甲酰磷酸的合成。例如在hq19、hq22(hq19dpurr);hq20(hq18dpurr)、hq21(hq20dargr)中分别表达py022,在发酵培养基ms3.2中摇瓶发酵,cdpc的产量分别为1.25g/l、1.54g/l;1.15g/l、1.34g/l。说明purr或argr基因的敲除可以解除对carab的反馈阻遏,进而促进嘧啶途径的合成,提高cdpc的产量。
以上所述仅是发明的几个实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离发明原理的前提下,还可以做出若干改进,这些改进也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!