N-(2-(取代-萘-1-基)乙基)取代酰胺类化合物、其制备及其用途的制作方法
本发明属于医药化工领域,涉及n-(2-(取代-萘-1-基)乙基)取代酰胺类化合物及其制备方法、药物组合物和预防/治疗褪黑素能系统疾病、紧张、焦虑症、季节性情感障碍、心血管疾病、消化系统疾病、精神分裂症、恐惧症、抑郁症、严重抑郁症、睡眠障碍、睡眠失调、飞行时差引起的失眠或疲劳、体重失调等疾病或病症的用途。
背景技术:
褪黑素受体(melatoninreceptor,mt)激动剂是一类新型的具有抗抑郁、抗焦虑、调节昼夜周期及体重等作用的化合物。与目前常用的选择性5-羟色胺(5-ht)重摄取抑制剂(ssris)及5-羟色胺-去甲肾上腺素重摄取抑制剂(snris)类抗抑郁药相比,褪黑素受体激动剂类化合物在应用中有多种优势,主要是更少的不良反应,包括体重增加、对性功能的不良影响、撤药反应等。由于其全新的作用机制及良好的临床表现,该类药物目前备受关注。目前该类药物已有四个上市,分别是melatonin、agomelatine、ramelteon、tasimelteon;另外还有一个处于临床ii期研究的tik301。
agomelatine是唯一已被批准应用于临床的褪黑素受体激动剂类抗抑郁药,由法国servier公司开发。与其他褪黑素受体激动剂相比,agomelatine尤为特别。它不但是褪黑素受体mt1和mt2的激动剂(抑制常数ki分别为6.15×10-11mol/l和2.68×10-10mol/l),同时还是5-ht2c受体拮抗剂(ic50=2.7×10-7mol/l)。多项临床研究证明其具有明显的抗抑郁作用,起效较快,对抑郁以及伴随的焦虑症均有较好疗效;与帕罗西汀等ssris相比,其起效时间更快,对重度抑郁症(mdd)疗效可能更优,能增加mdd患者睡眠的连续性和质量;同时,其对性功能的负面影响要明显小于其他抗抑郁药。
该药2009年在欧洲上市,2011年4月在我国批准进口。目前其临床适应症为成人抑郁症,针对焦虑症以及睡眠失调的临床研究也正在进行当中。
作为一个全新机制的多靶点抗抑郁药,agomelatine在上市之前的市场预期是定位为“重磅炸弹”级新药的,但是实际上市之后反响并不如预期。主要原因包括其体内代谢性质不尽人意,以及其对肝酶有不良影响。
agomelatine的口服吸收迅速且完全(超过80%),但由于肝脏的首过效应,吸收后经cyp1a2(约占90%)和cyp2c9(约占10%)的代谢,通过脱甲基和羟基化反应,最终产生对5-ht2c受体无亲和力、对mt受体有低亲和力(大约下降3-4个数量级)的二羟基代谢物,从而失效。
agomelatine的绝对生物利用度在5%以下,某些文献甚至表示该值实测仅为1%(例如australianpublicassessmentreportforagomelatine,submissionno:pm-2009-00483-3-1)。
由于该药物口服生物利用度太差,在临床应用当中势必要以增加用量为代价。口服生物利用度太差还会导致显著的个体差异。agomelatine对肝酶有不良影响,超过1%的用药者会出现alt/ast升高(超过正常上限三倍)。这一不良反应是特异体质性的(idiosyncratic),也具有剂量相关性。因此,通过提高这类化合物的口服生物利用度来降低口服剂量、降低肝脏损伤显得尤为重要。
本发明基于以上背景技术,完成了以下
技术实现要素:
。
发明内容
本发明人经过深入的研究和创造性的劳动,得到式i所示的化合物。本发明人惊奇地发现,式i的化合物或其药学上可接受的盐、溶剂合物或者它们的混合物具有以下良好的成药性质:与agomelatine相比,在受体结合实验(mt1、mt2以及5-ht2c)中表现出相当或者更高的受体亲和力;在体外及体内药代动力学实验中表现出更强的代谢稳定性;在整体动物实验中表现出更强的药效学活性,同时在急性毒性实验中表现出更好的安全性。
研究结果表明,式i的化合物或其药学上可接受的盐、溶剂合物,或者它们的混合物可以用于预防/治疗褪黑素能系统疾病、紧张、焦虑症、季节性情感障碍、心血管疾病、消化系统疾病、精神分裂症、恐惧症、抑郁症、严重抑郁症;睡眠障碍、睡眠失调、飞行时差引起的失眠或疲劳;体重失调等疾病或病症。
本发明的第一方面涉及以下内容:
1.式i的化合物或其药学上可接受的盐、溶剂合物,或者它们的混合物,
其中:
x为h或者卤素;
r1为ch3或者cd3;
r2为ch3或者c2h5;
条件是当x为h时,r2不为ch3。
2.实施方案1的化合物,其中:
所述x为氟或氯。
3.实施方案1的化合物,其中:
所述r1为cd3。
4.实施方案1的化合物,其中:
所述x为氟或氯,并且所述r1为cd3。
5.实施方案1的化合物,其选自:
n-(2-(6-氯-7-氘代甲氧基-萘-1-基)乙基)乙酰胺;
n-(2-(6-氯-7-甲氧基-萘-1-基)乙基)乙酰胺;
n-(2-(6-氟-7-氘代甲氧基-萘-1-基)乙基)乙酰胺;
n-(2-(6-氟-7-甲氧基-萘-1-基)乙基)乙酰胺;
n-(2-(6-氯-7-氘代甲氧基-萘-1-基)乙基)丙酰胺;
n-(2-(6-氯-7-甲氧基-萘-1-基)乙基)丙酰胺;
n-(2-(6-氟-7-甲氧基-萘-1-基)乙基)丙酰胺;
n-(2-(6-氯-7-氘代甲氧基-萘-1-基)乙基)乙酰胺氯化氢盐水合物;
n-(2-(6-氯-7-氘代甲氧基-萘-1-基)乙基)乙酰胺氯化氢盐;
n-(2-(6-氯-7-甲氧基-萘-1-基)乙基)乙酰胺氯化氢盐水合物;
n-(2-(6-氯-7-甲氧基-萘-1-基)乙基)乙酰胺氯化氢盐;
n-(2-(6-氯-7-甲氧基-萘-1-基)乙基)乙酰胺溴化氢盐水合物;
n-(2-(6-氯-7-甲氧基-萘-1-基)乙基)乙酰胺硫酸盐;
n-(2-(6-氯-7-甲氧基-萘-1-基)乙基)乙酰胺甲磺酸盐;和
n-(2-(6-氟-7-甲氧基-萘-1-基)乙基)乙酰胺氯化氢盐水合物。
6.一种药物组合物,其包含:
治疗和/或预防有效量的根据实施方案1-5中任一项所述的式i的化合物或其药学上可接受的盐、溶剂合物或者它们的混合物,以及
药学上可接受的辅料。
7.药物组合,其包含:
a)一种或多种第一活性成分,其选自根据实施方案1至5中的任一项的式i的化合物或其药学上可接受的盐、溶剂合物或者它们的混合物,和
b)一种或多种选自褪黑素受体激动剂和5-ht2c受体拮抗剂的其它活性成分。
8.根据实施方案1-5中任一项所述的式i的化合物或其药学上可接受的盐、溶剂合物或者它们的混合物在制备褪黑素受体激动剂中的用途。
9.根据实施方案1-5中任一项所述的式i的化合物或其药学上可接受的盐、溶剂合物或者它们的混合物在制备5-ht2c受体拮抗剂中的用途。
10.根据实施方案1-5中任一项所述的式i的化合物或其药学上可接受的盐、溶剂合物或者它们的混合物在制备预防或治疗选自下述的疾病或病症的药物中的用途:褪黑素能系统疾病、紧张、焦虑症、季节性情感障碍、心血管疾病、消化系统疾病、精神分裂症、恐惧症、抑郁症、严重抑郁症;睡眠障碍、睡眠失调、飞行时差引起的失眠或疲劳;体重失调。
11.一种合成实施方案1的式i化合物的方法,其包括:
使甲氧基苯或者卤素邻位取代的甲氧基苯与丁二酸酐在催化剂作用下发生friedel-crafts反应得到芳香酮即中间体1;
中间体1中的酮羰基用三乙基硅烷还原成亚甲基得到中间体2;
中间体2在酸性催化剂作用下环化得到四氢化萘即中间体3;
中间体3与氰基乙酸发生氰化反应得到二氢萘基乙腈即中间体4;
中间体4脱氢得到萘基乙腈即中间体5;和
中间体5在催化剂六水合氯化镍的存在下与硼氢化钠和乙酸酐或丙酸酐反应得到乙酰胺或丙酰胺化合物。
12.实施方案11的方法,其还包括:
将所述乙酰胺或丙酰胺化合物溶解在甲苯中与无水三氯化铝作用得到萘酚;和
使所述萘酚与氘代碘甲烷反应得到氘代的乙酰胺或丙酰胺化合物。
13.实施方案11或12的方法,其还包括:
使乙酰胺或丙酰胺化合物或者氘代的乙酰胺或丙酰胺化合物与酸反应形成盐。
14.根据实施方案1-5中任一项所述的式i的化合物或其药学上可接受的盐、溶剂合物或者它们的混合物,其用于预防或治疗疾病或病症。
15.根据实施方案1-5中任一项所述的式i的化合物或其药学上可接受的盐、溶剂合物或者它们的混合物,其用于预防或治疗选自以下的疾病或病症:褪黑素能系统疾病、紧张、焦虑症、季节性情感障碍、心血管疾病、消化系统疾病、精神分裂症、恐惧症、抑郁症、严重抑郁症;睡眠障碍、睡眠失调、飞行时差引起的失眠或疲劳;体重失调。
本发明的第二方面涉及上述本发明任一项实施方案所述的化合物或其药学上可接受的盐、溶剂合物或者它们的混合物在用于预防或治疗疾病或病症的用途。
本发明的第三方面涉及上述本发明任一项实施方案所述的化合物或其药学上可接受的盐、溶剂合物或者它们的混合物在用于在有此需要的受试者中预防或治疗选自下述的疾病或病症中的用途:褪黑素能系统疾病、紧张、焦虑症、季节性情感障碍、心血管疾病、消化系统疾病、精神分裂症、恐惧症、抑郁症、严重抑郁症;睡眠障碍、睡眠失调、飞行时差引起的失眠或疲劳;体重失调。
本发明的第四方面涉及上述本发明任一项实施方案所述的化合物或其药学上可接受的盐、溶剂合物或者它们的混合物的制备方法的制备方法。
附图说明
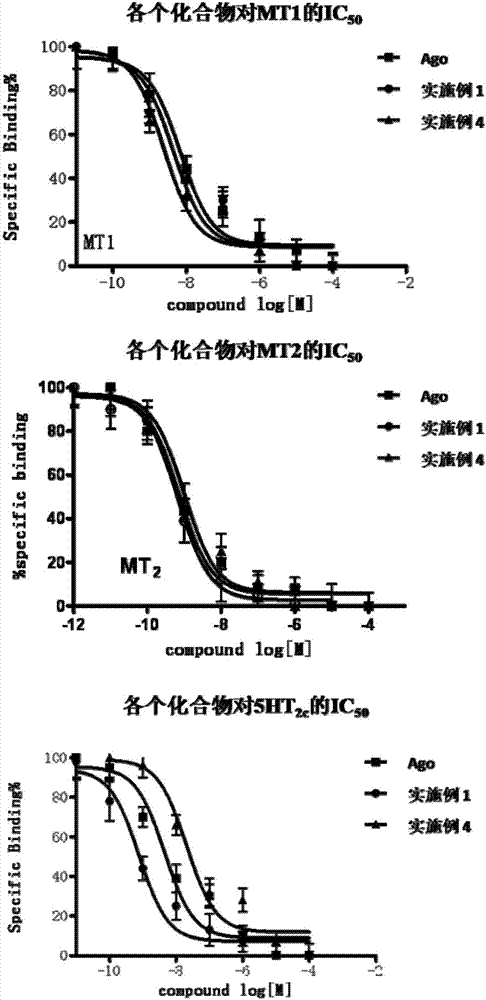
图1示出了实施例1和实施例4的化合物以及对照ago的mt1、mt2和5ht2c受体结合实验结果。
图2示出了实施例1、2、3、4、5、6、7化合物和对照ago和d3-ago的体外代谢稳定性实验结果。
具体实施方式
定义
术语“代谢稳定性”在本申请中是指化合物以原型药物的形式进入及稳定地存在于体内、不被代谢为其他结构形式的能力。
术语“药学上可接受的”在本申请中是指:化合物或组合物在化学上和/或在毒理学上与构成制剂的其它成分和/或与用其预防或治疗疾病或病症的人类或哺乳动物相容。
术语“受试者”或“患者”在本申请中包括人类和哺乳动物。
术语“辅料”在本申请中是指用以将化合物给药的赋形剂或者媒介物,其包括但不限于稀释剂、崩解剂、沉淀抑制剂、表面活性剂、助流剂、粘合剂、润滑剂、包衣材料等。辅料在e.w.martin的“remington'spharmaceuticalsciences”中被一般性描述。辅料的实例包括但不限于单硬脂酸铝、硬脂酸铝、羧甲基纤维素、羧甲基纤维素钠、交聚维酮、异硬脂酸甘油酯、单硬脂酸甘油酯、羟基乙基纤维素、羟基甲基纤维素、羟基硬脂酸羟基二十八酯、羟基丙基纤维素、羟基丙基甲基纤维素、乳糖、乳糖一水合物、硬脂酸镁、甘露醇、微晶纤维素等。
在本申请的上下文中,除非作出相反的具体说明,术语“治疗”也可包括预防。
术语“溶剂合物”在本申请中指的是通过组合式i化合物或其药学上可接受的盐和溶剂而形成的复合物。应理解的是,在治疗本申请所述的疾病或病症中使用的式i化合物的任何溶剂合物尽管可能提供不同的性质(包括药代动力学性质),但是一旦吸收至受试者中,会得到式i化合物,使得式i化合物的使用分别涵盖式i化合物的任何溶剂合物的使用。
术语“水合物”指的是上述术语“溶剂合物”中溶剂为水的情形。
应进一步理解,式i化合物或其药学上可接受的盐可以溶剂合物形式分离,并且因此任何所述溶剂合物皆包括于本发明的范围内。例如,式i化合物或其药学上可接受的盐可以未溶剂化形式以及与药学上可接受的溶剂(诸如,水、乙醇等)形成的溶剂化形式存在。
术语“药学上可接受的盐”是指本发明化合物的相对无毒、无机酸或有机酸加成盐。例如,参见s.m.berge等人“pharmaceuticalsalts”,j.pharm.sci.1977,66,1-19。其中,无机酸例如盐酸、氢溴酸、氢碘酸、硫酸、磷酸或硝酸等;有机酸例如甲酸、乙酸、乙酰乙酸、丙酮酸、三氟乙酸、丙酸、丁酸、己酸、庚酸、十一酸、月桂酸、苯甲酸、水杨酸、2-(4-羟基苯甲酰基)-苯甲酸、樟脑酸、肉桂酸、环戊烷丙酸、二葡萄糖酸、3-羟基-2-萘甲酸、烟酸、巴莫酸、果胶酯酸、3-苯基丙酸、苦味酸、特戊酸、2-羟基乙磺酸、衣康酸、胺基磺酸、三氟甲磺酸、十二烷基硫酸、乙磺酸、苯磺酸、对-甲苯磺酸、甲磺酸、2-萘磺酸、萘二磺酸、樟脑磺酸、柠檬酸、酒石酸、硬脂酸、乳酸、草酸、丙二酸、琥珀酸、苹果酸、己二酸、海藻酸、马来酸、富马酸、d-葡萄糖酸、扁桃酸、抗坏血酸、葡庚糖酸、甘油磷酸、天冬胺酸、磺基水杨酸等。例如,可使用hcl(或盐酸)、hbr(或氢溴酸溶液)、甲磺酸、硫酸、酒石酸或富马酸与式i所示的化合物形成药学上可接受的盐。
应理解,本申请所用的术语“本发明化合物”根据语境可包括:式i所示的酰胺类化合物、其药学上可接受的盐、其溶剂化物、其药学上可接受的盐的溶剂化物、以及它们的混合物。
本发明的一个方面提供式i所示的化合物或其药学上可接受的盐、溶剂合物或者它们的混合物,
其中:
x为h或者卤素;
r1为ch3或者cd3;
r2为ch3或者c2h5;
条件是当x为h时,r2不为ch3。
式i结构范围中排除化合物:agomelatine(x为h,r1、r2都为ch3)及d3-agomelatine(x为h,r1为cd3,r2为ch3)。
在本发明的一种实施方案中,x为f、cl、br或i;例如为f或cl。
在本发明的一种实施方案中,r1为ch3。
在本发明的一种实施方案中,r1为cd3。
在本发明的一种实施方案中,x为f、cl、br或i,并且r1为cd3。
在本发明的一种实施方案中,x为f、cl或br,并且r1为cd3。
在本发明的一种实施方案中,x为f或cl,并且r1为cd3。
在本发明的一种实施方案中,x为cl,并且r1为cd3。
在本发明的一种实施方案中,x为cl,并且r1为cd3,r2为ch3。
本发明所提供的药用复合物可包括式i化合物与hcl、hbr、甲磺酸、硫酸、酒石酸、富马酸所形成的复合物形式,也包括其相应的溶剂化物(例如水合物)形式。
在本发明实施方案中所述的化合物,其选自下面的表1中的化合物或其盐/水合物:
表1:本发明的实施例化合物
在本申请中,当化合物的名称与结构式不一致时,以结构式为准。
本发明的一方面提供一种作为褪黑素受体激动剂的药剂,其包括本发明化合物作为活性成分。
本发明的一方面提供一种作为5-ht2c受体拮抗剂的药剂,其包括本发明化合物作为活性成分。
本发明的一方面提供一种既作为褪黑素受体激动剂又作为5-ht2c受体拮抗剂的药剂,其包括本发明化合物作为活性成分。
本发明化合物可用于预防或治疗受试者(包括人类和哺乳动物)的褪黑素能系统疾病、紧张、焦虑症、季节性情感障碍、心血管疾病、消化系统疾病、精神分裂症、恐惧症、抑郁症、严重抑郁症;睡眠障碍、睡眠失调、飞行时差引起的失眠或疲劳;体重失调。例如,上述本发明任一项实施方案所述的化合物或其药学上可接受的盐、溶剂合物或者它们的混合物用于在有此需要的受试者中预防或治疗选自下述的疾病或病症中的用途:抑郁症、焦虑症、睡眠失调、体重失调。
本发明的一方面提供生产药物组合物的方法,该方法包括将根据本申请披露的任意化合物实施方案的至少一种化合物与药用辅料混合.
本发明化合物可配制成药物制剂,包括适用于口服给药的剂型(例如作为片剂、丸剂、糖浆剂、粉末剂、颗粒剂或者胶囊剂),适用于胃肠外注射(例如静脉注射、皮下注射)的剂型(例如作为溶液剂),适用于表面给药的剂型(例如作为软膏剂、贴剂或者乳膏剂),以及适用于直肠给药的剂型(例如作为栓剂)等。
取决于待治疗的疾病和患者以及给药途径,本发明的药物制剂可以以不同剂量每日一次或者多次给药。例如本发明化合物的每日剂量可以为口服给药约0.1-0.4mg/kg体重。
在某些方面,本发明化合物可以单独给药,或与其它化合物(包括其它褪黑素受体激动剂或其它5-ht2c受体拮抗剂或其它治疗剂)组合给药。例如本发明化合物可与选自melatonin、agomelatine、ramelteon、tasimelteon的一种或多种药物组合给药。本申请使用的术语"药物组合"或“组合给药”可涵盖同时或先后给药的情形。
本发明的一方面提供上述的本发明化合物或其药学上可接受的盐、溶剂合物或者它们的混合物的制备方法。
示例性的反应方案(以实施例1、2、8为例):
本发明的另一方面提供一种合成式i化合物的方法,其包括:
使甲氧基苯或者卤素邻位取代的甲氧基苯与丁二酸酐在催化剂作用下发生friedel-crafts反应得到芳香酮即中间体1;
中间体1中的酮羰基用三乙基硅烷还原成亚甲基得到中间体2;
中间体2在酸性催化剂作用下环化得到四氢化萘即中间体3;
中间体3与氰基乙酸发生氰化反应得到二氢萘基乙腈即中间体4;
中间体4脱氢得到萘基乙腈即中间体5;和
中间体5在催化剂六水合氯化镍的存在下与硼氢化钠和乙酸酐/丙酸酐反应得到乙酰胺/丙酰胺化合物。
在本发明的一种实施方案中,本发明的合成方法还包括:
将上述的乙酰胺/丙酰胺化合物溶解在甲苯中与无水三氯化铝作用得到萘酚;和
使所述萘酚与氘代碘甲烷反应得到氘代的乙酰胺/丙酰胺化合物。
在本发明的一种实施方案中,本发明的合成方法还包括:
使上述的乙酰胺/丙酰胺化合物或者氘代的乙酰胺/丙酰胺化合物与酸反应形成盐。
具体操作例如可参考实施例的说明部分。
根据本发明的详细教导以及已有的合成常识,本领域技术人员可以容易地合成本发明的式i化合物。
本发明的再一方面提供一种药物组合物,其包含治疗和/或预防有效量的本发明任一项所述的化合物或其药学上可接受的盐、溶剂合物或者它们的混合物,以及任选的药学上可接受的辅料。
本发明的再一方面提供预防或治疗褪黑素能系统疾病、紧张、焦虑症、季节性情感障碍、心血管疾病、消化系统疾病、精神分裂症、恐惧症、抑郁症、严重抑郁症;睡眠障碍、睡眠失调、飞行时差引起的失眠或疲劳;体重失调等疾病或病症的方法,其包括向有此需要的受试者给药本发明的药物组合物。
本发明的再一方面提供本发明所述的化合物或其药学上可接受的盐、溶剂合物或者它们的混合物用于治疗褪黑素能系统疾病、紧张、焦虑症、季节性情感障碍、心血管疾病、消化系统疾病、精神分裂症、恐惧症、抑郁症、严重抑郁症;睡眠障碍、睡眠失调、飞行时差引起的失眠或疲劳;体重失调等疾病或病症的用途。
在本发明的上下文中,使用如下缩略语:
tlc:薄层色谱法
ddq:2,3-二氯-5,6-二氰基-1,4-苯醌
tfa:三氟乙酸
dmso:二甲基亚砜
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。
实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
第一部分:实施例化合物的合成
实施例1及实施例2、8的合成:
反应路线如上,具体合成操作如下:
中间体1:
3升三口瓶,架上冷凝管。将三氯化铝328克(2.46mol)加入到冰浴下的1.7升二氯甲烷当中,搅拌使其完全溶解。一次性加入邻氯苯甲醚156.8克(138ml,1.10mol),再分批次加入丁二酸酐123克(1.23mol),体系有放热及气体产生,会出现自发性回流。待自发性回流结束后,开始加热回流。回流2小时后,tlc监测反应进度,原料消失即可停止反应。自然冷却后,倾入5升冰水当中。搅拌下,用300毫升浓盐酸酸化,体系出现大量固体,搅拌半小时后过滤,滤饼用1升水洗,然后用乙醇/水重结晶,得到白色或浅粉色粉末。收率:79.2%,熔点186-188℃。
核磁:1h-nmr(400mhz,dmso-d6),δ:2.54-2.57(t,2h,j=6.16hz),3.19-3.23(t,2h,j=6.20hz),3.95(s,3h),7.27-7.29(d,1h,j=9.24hz),7.97-8.00(m,2h),12.16(s,1h)。
中间体2:
121.4克(0.5mol)中间体1加入1升茄形瓶当中,再加入270毫升三氟乙酸、180毫升三乙基硅烷,搅拌回流。回流5小时后,tlc监测反应进度,原料消失即可停止反应。旋蒸至体系无明显溶剂馏出,加入1升乙酸乙酯,用500毫升水×3次洗涤,再用3mol/lnaoh水溶液300毫升×2次洗涤。合并naoh水相,冰浴下用6mol/l盐酸酸化,得到大量白色沉淀。过滤,滤饼干燥得产物粗品,收率:94.6%。粗品可直接投入下一步,也可用乙酸乙酯/环己烷重结晶得无色晶体,熔点:63-66℃。
核磁:1h-nmr(400mhz,dmso-d6),δ:1.73-1.79(m,2h),2.16-2.20(t,2h,j=7.28hz),2.51-2.54(m,2h),3.81(s,3h),7.04-7.06(d,1h,j=8.44hz),7.10-7.13(dd,1h,j1=8.40hz,j2=1.88hz),7.24-7.25(d,1h,j=1.96hz),12.15(s,1h)。
中间体3:
113克中间体2,加入480毫升三氟乙酸、120毫升甲磺酸,混合加热回流7小时后tlc监测反应进度,原料消失即可停止反应。冷却后倾入2.5升冰水当中,搅拌,出现大量浅黄色固体,过滤水洗。滤饼用乙醇/水重结晶,得淡黄色晶体,收率75.6%。熔点:105-108℃
核磁:1h-nmr(400mhz,cdcl3),δ:2.09-2.16(m,2h),2.62-2.65(t,2h,j=6.8hz),2.87-2.90(t,2h,j=6.2hz),3.94(s,3h),7.28(s,1h),7.56(s,1h)。
中间体4:
1升三口瓶当中,加入75.0克中间体3、45.6克氰基乙酸、10克苄胺、12克庚酸以及700毫升甲苯,加上分水器,外温140℃下回流分水。24小时后tlc监测反应结束。冷却后用水洗两次,滤去不溶物,旋干溶剂用乙醇/水重结晶,得淡黄色晶体。收率88.3%,熔点:100-104℃。
核磁:1h-nmr(400mhz,dmso-d6),δ:2.31-2.36(m,2h),2.69-2.73(t,2h,j=8.26hz),3.49(s,2h),3.92(s,3h),6.26-6.28(t,1h,j=4.34hz),6.69(s,1h),7.18(s,1h)。
中间体5:
70.1克中间体4溶解在900毫升二氯甲烷当中,外温冷却下向其中分批次加入ddq75克(0.33mol),控制内温不超过20℃。加完后体系变黑,保温20℃左右反应30min,tlc监测反应结束。过滤去除固体,滤液用饱和碳酸钠水溶液400毫升×2次洗涤至无色,再用饱和食盐水300毫升洗涤一次。有机相用无水硫酸钠干燥,过滤后旋干溶剂,再用环己烷/乙酸乙酯重结晶,得白色晶体。收率90.7%,熔点:140-144℃
核磁:1h-nmr(400mhz,cdcl3),δ:4.05(s,2h),4.08(s,3h),7.12(s,1h),7.35-7.39(dd,1h,j1=8.14,j2=7.28),7.54-7.56(d,1h,j=7.24),7.72-7.74(d,1h,j=8.12),7.93(s,1h)。
中间体6(即实施例2):n-(2-(6-氯-7-甲氧基-萘-1-基)乙基)乙酰胺
36.0克中间体5,溶解于700毫升无水甲醇和1300毫升二氯甲烷的混合溶液当中,-10℃冷却下,向其中加入23克六水合氯化镍,搅拌下使其全部溶解。再向其中加入35毫升乙酸酐,然后分批次加入硼氢化钠26.4克,控制加入速度使内温在0-10℃之间。加完后移入室温搅拌3小时,tlc监测反应完全,冰浴冷却下,向其中加入3mol/l盐酸500毫升,搅拌1小时。再用旋蒸除去有机溶剂,向残余物中加入1升乙酸乙酯,再依次用500毫升的水、饱和碳酸氢钠水溶液、饱和氯化钠水溶液洗涤,有机相用无水硫酸钠干燥后过滤。滤液再加入4.3克活性炭煮沸30分钟,然后过滤,滤液旋干,用环己烷/乙酸乙酯处理,得到白色固体。收率72.1%,熔点:142-145℃。
核磁:1h-nmr(400mhz,dmso-d6),δ:1.83(s,3h),3.11-3.15(m,2h),3.30-3.34(m,2h),4.05(s,3h);7.30-7.36(m,2h);7.70-7.72(d,1h,j=7.60hz);7.79(s,1h);8.07(s,1h);8.14-8.17(t,1h,j=5.60hz).esi-msm/e:278.1([m+1]+)。
中间体7:
23.5克中间体6溶解于1000毫升甲苯当中,加入25.2克无水三氯化铝,回流1.5小时后tlc监测反应完全,冷却后倾去甲苯,向残余物中加入600毫升乙酸乙酯,再依次用300毫升饱和碳酸氢钠水溶液、饱和氯化钠水溶液洗涤,有机相用无水硫酸钠干燥,过滤后旋干溶剂,再用环己烷/乙酸乙酯处理得到浅黄色固体。收率82.0%,熔点:174-176℃。
1h-nmr(400mhz,dmso-d6),δ:1.80(s,3h),3.10-3.14(t,2h,j=7.28hz),3.33-3.38(m,2h),7.23-7.28(m,2h),7.49(s,1h),7.65-7.68(dd,1h,j1=7.32hz,j2=2.28hz),7.98-8.02(m,2h),10.52(s,1h)。
实施例1:n-(2-(6-氯-7-氘代甲氧基-萘-1-基)乙基)乙酰胺
17.3克中间体7溶解于1升丙酮中,向其中加入27.2克碳酸钾、1.3克碘化钾、12.4克(5.31毫升)氘代碘甲烷,室温反应24小时后tlc监测反应完全,过滤,滤液旋干,向残余物中加入400毫升乙酸乙酯,再依次用200毫升水和饱和氯化钠水溶液洗涤,有机相用无水硫酸钠干燥后过滤,滤液再加入2克活性炭煮沸30分钟,然后过滤,旋干,用环己烷/乙酸乙酯处理,得白色粉末状固体。收率81.4%,熔点:148-151℃
1h-nmr(400mhz,dmso-d6),δ:1.83(s,3h),3.11-3.20(m,2h),3.29-3.35(m,2h),7.30-7.36(m,2h),7.70-7.72(dd,1h,j1=7.80hz,j2=1.40hz),7.80(s,1h),8.07(s,1h),8.15-8.18(t,1h,j=5.46hz).esi-msm/e:281.1([m+1]+)。
实施例8:
冰浴下,1.0克实施例1溶解于30毫升乙酸乙酯当中,向其中加入浓盐酸0.50毫升,搅拌1小时后析出大量白色固体,过滤,10毫升冷的乙酸乙酯洗涤,干燥后得到白色固体0.89克,收率78.8%。熔点:102-105℃。1h-nmr(400mhz,dmso-d6),.δ:1.83(s,3h),3.11-3.20(m,2h),3.29-3.35(m,2h),7.30-7.36(m,2h),7.70-7.72(dd,1h,j1=7.80hz,j2=1.40hz),7.80(s,1h),8.07(s,1h),8.15-8.18(t,1h,j=5.46hz).(氢谱数据实际同实施例1,仅水峰位置及面积不同)。
实施例3、4的合成
同实施例1、2的合成,只是将起始原料替换为邻氟苯甲醚。
实施例3
白色固体,熔点:141-144℃。1h-nmr(400mhz,dmso-d6),δ:1.83(s,3h),3.10-3.14(m,2hz),3.29-3.35(m,4h),7.31-7.32(m,2h),7.68-7.71(m,1h),7.72-7.75(d,1h,j=12.32hz),7.82-7.85(d,1h,j=8.96hz),8.15-8.18(t,1h,j=5.62hz).esi-msm/e:265.1([m+1]+)。
实施例4:n-(2-(6-氟-7-甲氧基-萘-1-基)乙基)乙酰胺
白色固体,熔点140-144℃。1h-nmr(400mhz,dmso-d6),δ:1.83(s,3h),3.11-3.15(m,2hz),3.29-3.36(m,4h),4.05(s,3h),7.30-7.32(m,2h),7.69-7.72(m,1h),7.73-7.76(d,1h,j=12.44hz),7.82-7.85(d,1h,j=8.98hz),8.16-8.19(t,1h,j=5.54hz).esi-msm/e:262.1([m+1]+)。
实施例5、6的合成
同实施例1、2的合成,只是在第六步合成时将乙酸酐替换为丙酸酐。
实施例5:n-(2-(6-氯-7-氘代甲氧基-萘-1-基)乙基)丙酰胺
白色固体。1h-nmr(400mhz,dmso-d6),δ:1.00-1.03(t,3h,j=7.56hz),2.07-2.12(q,2h,j=7.56hz),3.12-3.17(m,2h),3.32-3.38(m,2h),7.32-7.38(m,2h),7.72-7.74(dd,1h,j1=6.88hz,j2=1.92hz),7.77(s,1h),8.01-8.03(t,1h,j=5.60hz),8.07(s,1h).esi-msm/e:295.1([m+1]+)。
实施例6:n-(2-(6-氯-7-甲氧基-萘-1-基)乙基)丙酰胺
白色固体。1h-nmr(400mhz,dmso-d6),δ:0.99-1.02(t,3h,j=7.60hz),2.06-2.11(q,2h,j=7.60hz),3.12-3.16(m,2h),3.31-3.37(m,2h),4.05(s,3h),7.30-7.36(m,2h),7.70-7.72(dd,1h,j1=7.12hz,j2=1.96hz),7.76(s,1h),8.00-8.02(t,1h,j=5.50hz),8.06(s,1h).esi-msm/e:292.1([m+1]+)。
实施例7:n-(2-(6-氟-7-甲氧基-萘-1-基)乙基)丙酰胺
合成同实施例4,只是在第六步合成时将乙酸酐替换为丙酸酐。白色固体,1h-nmr(400mhz,dmso-d6),δ:0.98-1.01(t,3h,j=7.52hz),2.05-2.10(q,2h,j=7.52hz),3.10-3.14(m,2hz),3.28-3.35(m,4h),4.04(s,3h),7.30-7.32(m,2h),7.68-7.71(m,1h),7.73-7.76(d,1h,j=12.52hz),7.81-7.84(d,1h,j=9.02hz),8.02-8.04(t,1h,j=5.58hz).esi-msm/e:276.1([m+1]+)。
实施例9-15的合成
实施例9-15的合成同实施例8的合成。冰浴下将1.0克相应的实施例化合物溶解在30毫升乙酸乙酯当中,然后分别加入一定量的酸,搅拌析出沉淀,过滤后用乙酸乙酯洗涤得到白色固体。如果是用无机酸(hcl/hbr/h2so4等),则除水峰面积与位置稍有区别外,新实施例的1h-nmr与原实施例完全一致,在下述实施例当中不再赘述;如果是有有机酸,则新实施例的1h-nmr与原实施例有所区别。具体操作及数据如下:
实施例9:1.0克实施例1,加入2毫升3.5mol/l的无水hcl/乙酸乙酯溶液。熔点106-108℃,收率:77.8%。
实施例10:1.0克实施例2,加入0.50毫升浓盐酸。熔点100-103℃,收率:82.3%。
实施例11:1.0克实施例2,加入2毫升3.5mol/l的hcl/乙酸乙酯溶液。熔点104-107℃,收率:80.5%。
实施例12:1.0克实施例2,加入0.61毫升40%hbr水溶液。熔点145-151℃,收率:76.9%。
实施例13:1.0克实施例2,加入0.23毫升浓硫酸。熔点186-190℃,收率:92.1%。
实施例14:1.0克实施例2,加入0.25毫升甲磺酸。熔点156-159℃,收率:68.4%。1h-nmr(400mhz,dmso-d6),δ:1.84(s,3h),2.33(s,3h),3.13-3.17(m,2h),3.31-3.36(m,2h),4.06(s,3h);7.32-7.38(m,2h);7.72-7.74(d,1h,j=7.28hz);7.81(s,1h);8.09(s,1h);8.16-8.19(t,1h,j=5.44hz).
实施例15:1.0克实施例4,加入0.50毫升浓盐酸。熔点104-107℃,收率76.2%。
对照品d3-agomelatine的合成
对照品为已知化合物,作为活性评价对照品使用。其与实施例1合成方式相同,不同点在于将中间体6替换为agomelatine。白色固体,熔点:95-97℃。1h-nmr(400mhz,dmso-d6),δ:1.83(s,3h);3.10-3.14(m,2h);3.30-3.35(m,2h);7.15-7.18(dd,1h,j1=8.60hz;j2=2.44hz);7.24-7.32(m,2h);7.61-7.60(d,1h,j=2.52hz);7.70-7.72(d,1h,j=7.84hz);7.81-7.83(d,1h,j=8.96hz);8.11-8.14(t,1h,j=5.60hz)。
第二部分:实施例化合物的体外受体结合实验
以agomelatine(缩写为ago)及d3-agomelatine(缩写为d3-ago)作为参照,对实施例化合物进行体外受体结合实验研究,评价受试化合物及放射性配体与受体在体外的结合竞争性结合能力。受体包括mt1/mt2受体及5-ht2c受体。实验分为初筛和复筛两部分,初筛结果以结合百分率表示,复筛结果以ic50值表示(单位m,也即mol/l)。
实验材料和试剂
(1)人源mt1/mt2受体膜蛋白是perkinelmer公司产品es-620(mt1)及es-621(mt2);5-ht2c受体膜蛋白是按照普利莱基因技术有限公司的细胞核-胞浆-胞膜制备试剂盒方法,从大鼠的海马以及稳定转染的hek293细胞系中提取。
(2)试验中所用标记配体为pe公司产品,非标记配体为sigma公司产品;苯甲基磺酰氟(pmsf)为sigma公司产品;闪烁液为pe公司产品;folin-酚试剂为华威科仪公司产品;其他试剂均为分析纯。
(3)tris-hcl缓冲液配比:50mmtris-hclbuffer,1mmedta,5mmmgcl2,0.1%nan3,再加入一定比例的pmsf,调至ph7.4。
(4)受试实施例化合物溶解在dmso当中,配置成10-2m的母液,再用蒸馏水稀释成10-4–10-11m浓度梯度。mt受体结合实验初筛选择10-5m浓度进行;5-ht2c受体结合实验初筛选择10-5和10-7m两个浓度进行。
数据处理及统计分析
用graphpadprism5.0软件进行统计分析。受体结合实验公式:抑制率(%)=[(总结合cpm数-加药管cpm)/(总结合cpm-非特异cpm)]×100%,cpm为放射性强度计数。以特异结合百分率对受试化合物的对数浓度进行非线性拟合,得到竞争抑制曲线并计算ic50值。
1、mt1/mt2受体结合实验
在25℃的反应条件中摆放试管。所有试管中均加入10μl受体膜蛋白mt1或者mt2。非特异结合管中加入50μl浓度为10-4m的相对应的非标记性配体ago,终浓度为10μm,预先反应30分钟。测试管中依次加入30μl受试药物(mt1:10-4–10-10m浓度,mt2:10-4–10-11m浓度);全部试管依次加入40μl[3h]-melotonin。以tris-hcl缓冲液(50mmtris-hcl,1mmedta,5mmmgcl2,0.1mmpmsf,0.1%nan3,ph7.4)补足所有反应管体积为300μl;在25℃反应1小时;然后点样于49型玻璃纤维滤纸上,经负压抽滤,再用冰冷的tris-hcl缓冲液(50mmtris-hclbuffer,1mmedta,5mmmgcl2,0.1%nan3,ph7.4)洗涤,2ml×3次,抽干。滤纸取出烘干后,放在闪烁瓶中,加1ml闪烁液,用液闪计数器测定放射性强度。
根据公式测出结合百分率,进一步得到ic50值。实验结果见表2。
表2实施例化合物mt1/mt2受体结合初筛(10-5m)及复筛结果
2、5-ht2c受体结合实验
在25℃的反应条件中摆放试管,所有试管中均加入50μg受体膜蛋白5-ht2c。非特异结合管中加入50μl浓度为10-4m的相对应的非标记性配体5-ht,终浓度为10μm,预先反应30分钟。测试管中依次加入30μl受试实施例化合物(10-4–10-10m浓度)。全部试管依次加入40μl[3h]-lsd(麦角酸二乙胺),以tris-hcl缓冲液(50mmtris-hcl,1mmedta,5mmmgcl2,0.1%nan3,0.1mmpmsf,ph7.4)补足所有反应管体积为300μl;在25℃反应1小时;然后点样于49型玻璃纤维滤纸上,经负压抽滤;再用冰冷的tris-hcl缓冲液(50mmtris-hclbuffer,1mmedta,5mmmgcl2,0.1%nan3,ph7.4)洗涤,2ml×3次,抽干。滤纸取出烘干后,放在闪烁瓶中,加1ml闪烁液,用液闪计数器测定放射性强度。
根据公式测出结合百分率,进一步得到ic50值。实验结果见表3。
表3实施例化合物5-ht2c受体结合筛选结果
部分实施例化合物的体外受体结合实验图示化结果见附图1。
第三部分:实施例化合物的代谢研究
通过体外(人肝微粒体孵育体系)和体内(大鼠口服/尾静脉注射模型)判断实施例化合物的代谢稳定性。
实验材料与试剂
人肝微粒体(bdgentest公司,货号:452161);乙腈、乌头碱、维拉帕米来自sigma公司;nadph(还原型辅酶ii)来自roche公司;0.1mph7.4pbs(磷酸盐缓冲液,自配);其他试剂均为分析纯。
雄性sd大鼠,体重200±20g,spf级,购自斯贝福。
仪器、条件及参数
美国finnigan公司tsqquantum型液相色谱-质谱联用仪(lc/ms/ms),色谱柱为tskgelamide-80柱(2.0mmi.d.×100mm,5μm);流动相为乙腈-水-甲酸(50:50:0.1);流速0.2ml/min;进样量5μl;柱温为室温。采用电喷雾离子化电离源(esi),喷雾电压4.8kv;毛细管温度(tem)300℃;鞘气n2,流速10psi;辅助气n2,流速1psi;碰撞气(cid)ar,压力1.5mtorr。质谱扫描方式为选择反应监测(srm),采用正离子方式检测。内标为含乌头碱0.2μg/ml的乙腈溶液,最低定量下限5ng/ml,相关系数>0.99。
1、体外代谢研究
以维拉帕米作为参照验证检测体系,以agomelatine(缩写为ago)及d3-agomelatine(缩写为d3-ago)作为参照,通过人肝微粒体孵育体系的体外试验,观察各实施例化合物浓度的降低速率,评价体外代谢稳定性。
精密称量各种待测样品约10mg,dmso0.1ml溶解,以纯净水逐级稀释成10μm、1μm标准储备溶液。冰浴操作,按表4配制检测孵育体系。孵育体系中加nadph启动反应,立即取50μl于150μl乙腈中,作为零时刻样品和1μm标准曲线样品。另取1μm标准储备溶液加入孵育体系中,立即取50μl于150μl乙腈中,作为0.1μm标曲样品。剩余体系在37℃水浴,分别于5min、15min、30min、1h、2h取50μl于150μl乙腈中。各样品经振荡,18000g离心10min,取上清lc/ms/ms进样测定。部分实施例化合物实验数据结果见下表5,图示化结果见附图2。
表4.孵育体系组成
表5待测化合物在各时间点测得浓度(μm)
通过维拉帕米的代谢证明检测体系正常;对照及实施例结果显示化合物在人肝微粒体当中代谢较快,60分钟后均低于最低检测限;实施例化合物的代谢稳定性要强于对照化合物agomelatine及d3-agomelatine;实施例1化合物代谢稳定性最高。
2、体内代谢研究
以agomelatine为对照,通过大鼠口服/尾静脉注射模型试验,比较实施例1化合物与对照药的血浆浓度的暴露等药代动力学参数,评价体内代谢稳定性。
静脉给药溶液配制:精密称取各受试药物约5mg,用50μldmso溶解,再加入适量40%peg400水溶液,配成0.5mg/ml溶液。给药体积为0.2ml/200g体重,按浓度换算则剂量为0.5mg/kg体重。
灌胃给药溶液配制:精密称取各受试药物约5mg,用1%hpmc水溶液助悬分散,配成1mg/ml的混悬液。给药体积为1ml/200g体重,按浓度换算则剂量为5mg/kg体重。
大鼠随机分为4组,每组5只。按上述剂量分别进行口服灌胃及尾静脉给药。给药后2min、5min、15min、30min、1h、1.5h、2h、3h进行眼眶采血,8000rpm离心10min,取血浆50μl,加入50μl内标,150μl乙腈,震荡混匀,18000rpm离心10min,取上清lc/ms/ms进样测定。采用das药代动力学程序对所测数据进行分析,计算主要药代动力学参数。实验结果见下表6。
表6大鼠口服或尾静脉注射给药后主要药代动力学参数。
结果显示,大鼠口服实施例1与口服agomelatine比较,血浆暴露auc(0-t)显著升高(248.8vs51.6),按照给药剂量折算,生物利用度显著升高(50.90%vs5.05%)。
第四部分:实施例化合物的动物行为学研究
实验材料与试剂
动物:昆明小鼠,雄性,体重18-22g;sd大鼠,雄性,体重150-180g。以上动物均为spf级,购自斯贝福,购置后在人工照明环境(光照/黑暗各为12小时)下饲养,在新环境中适应3天再进行实验。进行各种实验前均需禁食12h,实验的给药时间点大致为人工照明周期的黑暗前2小时。
实施例化合物用1%羟丙甲基纤维素(hpmc)水溶液助悬分散,使用前摇匀。设立空白对照组(1%hpmc水溶液)及阳性对照组(ago对照组,agomelatine悬浮于1%hpmc水溶液中)。
给药浓度及给药体积参照servier公司对agomelatine进行的药效学研究文献jpsychiatryneurosci2004;29(2):126-133。小鼠为腹腔注射给药,给药体积为0.5ml/20g;大鼠为灌胃给药,给药体积为2ml/100g。
2.6数据处理及统计分析
实验数据采用graphpadprism5.0软件进行统计分析。
1、小鼠悬尾实验
取昆明小鼠按体重均衡随机分组,每组10只,分别为空白对照组、ago对照组、实施例化合物组(实施例1、2、3、4、5)。连续三天腹腔注射给药,每天给药一次,给药剂量均为10mg/kg,第三天给药30min后进行悬尾实验。
参照文献方法psychopharmacology(berl),1985,85(3):367–670并进行改良。悬尾箱为25×25×35cm,顶板中心绳连一个小夹子,将胶布粘在小鼠尾端2cm处,用夹子夹住胶布,使小鼠呈倒悬体位,观察6min,记录后4min的累计不动时间。结果见表7。
表7化合物(10mg/kg)的小鼠悬尾实验结果
各给药组与空白对照组之间比较,*p<0.05**p<0.01***p<0.001
2、小鼠强迫游泳实验
动物分组、各组给药剂量及给药方法同小鼠悬尾实验。
参照文献方法archintpharmacodynther,1977,229(2):327–336并进行改良。将小鼠放入高20cm,内径12cm,水深10cm、水温25℃的圆形玻璃容器中,观察6min,记录后4min的累计不动时间。结果见表8。
表8化合物(10mg/kg)的小鼠强迫游泳实验结果
各给药组与空白对照组之间比较,*p<0.05**p<0.01***p<0.001
3、大鼠强迫游泳实验
取sd大鼠按体重均衡随机分组,每组8只,分别为空白对照组、ago对照组、实施例化合物组(实施例1、2、3、4、5)。连续三天灌胃给药,每天给药一次,第三天给药1小时后进行强迫游泳实验。
参考文献方法eurjpharmacol,1978,47(4):379–391并进行改良。将大鼠放入高40cm、内径18cm、水深23cm、水温25℃的圆形玻璃缸中游泳6min,记录后5min内累计不动时间。结果见表9。
表9化合物(10mg/kg)的大鼠强迫游泳实验结果
各给药组与空白对照组之间比较,*p<0.05**p<0.01***p<0.001
上述行为学实验结果显示,在多个模型当中实施例化合物均表现出与对照药agomelatine相当或更好的药效;其中实施例1化合物具有最佳药效。
第五部分:实施例化合物初步的安全性评价
实验动物要求同第四部分“行为学研究”。以agomelatine作为对照药,初步判断单次给药的安全性。
1、小鼠急性毒性实验
小鼠按体重随机分组,每10只一组,设立实施例化合物组、ago对照组及空白对照组。灌胃给药,给药剂量为5000mg/kg和2000mg/kg。药物用1%羟丙甲基纤维素(hpmc)水溶液分散,给药体积按照0.2ml/10g计算。给药后观察14天后处死。给药前当天、给药后第1、2、7、14天称量体重。
实施例1,5000mg/kg组:给药15分钟后开始陷入昏迷,在24小时内全部苏醒并恢复正常。给药后14天无任何不良反应,饮食及行为表现正常。体重与空白组无显著性差异。
实施例1,2000mg/kg组:给药后活动量稍变小但无明显不良反应。给药后14天无任何不良反应,饮食及行为表现正常。体重与空白组无显著性差异。
agomelatine,5000mg/kg组:给药15分钟后全部陷入昏迷,并陆续在12小时后死亡。
agomelatine,2000mg/kg组:给药15分钟后全部陷入昏迷,并在12小时内分别死亡4只,其他6只在24小时内全部苏醒并恢复正常。给药后14天无明显不良反应,饮食及行为表现正常。与空白组相比,在给药后第1、2天体重偏轻,有显著性差异,7天、14天恢复正常。
结果:在小鼠模型上,实施例1的最大无毒性反应剂量在2000mg/kg以上,最大耐受量及半数致死量均在5000mg/kg以上,比对照药agomelatine安全性要高。
2、大鼠急性毒性实验
大鼠按体重随机分组,每10只一组,设立实施例化合物组、ago对照组及空白对照组。灌胃给药,给药剂量为2000mg/kg。药物用1%羟丙甲基纤维素(hpmc)水溶液分散。给药后观察14天后处死。给药前当天、给药后第1、2、7、14天称量体重。
实施例1,2000mg/kg组:给药后活动量稍变小但无明显不良反应。给药后14天无任何不良反应,饮食及行为表现正常。体重与空白组无显著性差异。
agomelatine,2000mg/kg组:给药15分钟后有8只行动迟缓或陷入昏睡,在2小时内全部恢复正常。给药后14天无任何不良反应,饮食及行为表现正常。体重与空白组无显著性差异。
结果:在大鼠模型上,实施例1的最大无毒性反应剂量和最大耐受量均在2000mg/kg以上,比对照药agomelatine安全性要高。
第六部分:包含实施例化合物的药物组合物
1000片制剂,每片含有10mg剂量,其配方如下:
尽管本发明的具体实施方式已经得到详细的描述,本领域技术人员将会理解:根据已经公开的所有教导,可以对那些细节进行各种修改和替换,这些改变均在本发明的保护范围之内。本发明的保护范围由所附权利要求及其任何等同物给出。
- 还没有人留言评论。精彩留言会获得点赞!