一种用于猪瘟疫苗效力检验的荧光定量PCR方法与流程
本发明涉及一种用于猪瘟疫苗效力检验的荧光定量pcr方法,属于生物技术领域。
背景技术
猪瘟csf是由猪瘟病毒csfv引起的一种高度接触性传染病,是世界粮农组织和各国政府密切关注的主要传染病之一,oie将其规定为必须申报的动物传染病之一,我国《家畜家禽防疫条例实施细则》将其列为一类传染病。
目前,疫苗接种是控制猪瘟的一种重要手段,广泛使用的疫苗是猪瘟兔化弱毒疫苗,用猪瘟兔化弱毒株接种易感细胞培养,收获培养物冻干而成,由于病毒本身不引起细胞病变,《中国兽药典》规定病毒含量和疫苗效力检验均是使用家兔,通过测定试验兔体温变化反应兔体感染量,实验繁琐、周期长、重复性差、结果受兔体差异和环境温度的影响,耗费大量人力物力,并且,随着对实验动物福利的重视,本着减少和替代的原则,也要求建立新的更快捷准确的代替检验方法来替代兔体法。
实时荧光定量pcr通过定量核酸分子的拷贝数,进而推算出细菌或病毒的感染滴度,此技术具有灵敏度高、特异性好、实时定量、高通量等一系列优势,广泛应用于基因表达水平、病原体定性和定量检测等方面。
技术实现要素:
本发明的主要目的是为了提供一种用于猪瘟疫苗效力检验的荧光定量pcr方法,对同一个猪瘟病毒样品分别用定量pcr方法和兽药典规定的兔体反应热方法检测,确定二者之间相关性,用定量pcr方法替代兔子实验,以克服兔体实验的缺点,减少实验动物的使用,设计一对特异性引物和一条标记的探针,优化反应条件,建立定量pcr方法。方法特异性好,对prv、pcv2、ppv、prrsv、bvdv均无扩增;敏感性高,检出限制为1.29copy;批内批间均有很好的重复性。
本发明的目的可以通过采用如下技术方案达到:
一种用于猪瘟疫苗效力检验的荧光定量pcr方法,
上游引物5'gctagaaacaggccaacaac3'
下游引物5'gagtaaactgccgcactcat3'产物144bp
探针5'ccgcactcatgatccccat3',5’标记fam,3’标记mgb
包括如下步骤:
步骤1:病毒核酸的提取
分别取ppv、prv、prrsv、bvdv、csfv200μl,按生物病毒基因组dna/rna快速提取试剂盒的说明方法提取总dna/rna;
步骤2:cdna的合成
反转录采用10μl体系,反应管中依次加入5×buffer、m-mlv反转录酶、rnasin、10mmdntp、10μm下游引物和病毒rna至10μl,反应后得到cdna模板,保存备用;
步骤3:标准品制备
在25μl体系中进行目的dna片段的pcr扩增,经目的dna片段回收纯化、连接、转化及重组质粒提取,制备标准品;
步骤4:荧光定量pcr特异性试验
荧光定量pcr使用takaratp800荧光定量pcr仪进行,反应体系为:premixextaq,上、下游引物,探针,模板和ddh2o;经预变性,进行40个循环,采集荧光信号,进行taqmanreal-timert-pcr扩增。
进一步的,所述步骤2中,反应管中依次加入:
2μl的5×buffer;
0.5μl的m-mlv反转录酶;
0.25μl的rnasin;
1μl的10mmdntp;
0.5μl的10μm下游引物;
再加入病毒rna至10μl;
在42℃温度条件下,反应1h,或95℃温度条件下,反应10min,得到cdna模板,放4℃温度条件下保存备用。
进一步的,所述步骤3包括如下步骤:
步骤31:目的dna片段的pcr扩增
pcr扩增在25μl体系中进行,反应体系中加入:premixextaq;上、下游引物;cdna产物;ddh2o;进行变性;
步骤32:目的dna片段回收纯化
制作大孔琼脂糖凝胶,对目的dna进行琼脂糖凝胶电泳;在紫外灯下迅速切下含有目的dna的琼脂糖凝胶块放置在离心管中,用axygen凝胶回收试剂盒回收目的条带,最后加30μlelutionbuffer洗脱dna,保存于-20℃条件下备用;
步骤33:目的dna片段的连接与转化
将大孔琼脂糖凝胶回收纯化后的pcr产物,采用pmd18-t载体dna连接试剂盒,反应体系中加入试剂,试剂加完后瞬时离心,混匀,连接过夜,将连接产物加入感受态细胞dh5a中,混匀后,加入lb液体培养基培养,将培养物离心,过滤上清,再将沉淀混匀涂布于lb琼脂平板上培养;
步骤34:含目的dna片段的重组质粒提取
挑取经pcr鉴定为阳性的菌落,接种到含有amp的lb液体培养基中,摇动培养过夜,用axygen制备质粒试剂盒提取质粒,加入含有rnase的te缓冲液中,水浴,在紫外分光光度计od260测定质粒的质量浓度,作为定量pcr的标准品,保存,备用。
进一步的,所述步骤31中,反应体系中加入:premixextaq12.5μl;上、下游引物各0.5μl;cdna产物1μl;加ddh2o至25μl;反应在95℃条件下变性5min;变性参数如下:在94℃条件下变性40s;在55℃条件下退火30s;在72℃条件下延伸30s;连续进行34个循环,循环结束后,在72℃条件下延伸5min。
进一步的,所述步骤33包括如下步骤:
步骤331:目的片段回收
将大孔琼脂糖凝胶回收纯化后的pcr产物,采用pmd18-t载体dna连接试剂盒,反应体系为10μl,反应体系中包括以下试剂:回收纯化后的pcr产物,pmd19-t,soiutioni,试剂加完后瞬时离心,混匀,置于4℃条件下连接过夜;
步骤332:转化
将连接产物加入感受态细胞dh5a中,混匀后,先冰浴,再水浴,然后再冰浴,加入lb液体培养基培养,将培养物离心,在无菌条件下过滤掉上清,再将沉淀混匀,涂布于lb琼脂平板上,倒置平板于温箱中培养。
进一步的,所述步骤331中,反应体系中包括:回收纯化后的pcr产物5.0μl,pmd19-t0.5μl,soiutioni4.5μl。
进一步的,所述步骤332中,将连接产物5μl加入100μl感受态细胞dh5a中,混匀后,先冰浴30min,再在42℃条件下水浴90s,然后再冰浴2min,加入1mllb液体培养基,37℃条件下培养60min,将培养物以3500rpm的转速离心4min,在无菌条件下过滤掉上清,再将沉淀混匀,均匀涂布于含有amp的lb琼脂平板上,倒置平板于37℃温箱中培养12~16h。
进一步的,所述步骤34中,挑取经pcr鉴定为阳性的菌落,接种到2ml含有质量浓度为100μg/mlamp的lb液体培养基中,37℃摇动培养过夜,用axygen制备质粒试剂盒提取质粒,加入10μl含有质量浓度为20μg/mlrnase的te缓冲液中,37℃水浴1h,在紫外分光光度计od260测定质粒的质量浓度;
紫外分光光度计od260测定的公式为:
{[x(g/μl)dna/dna长度bp×660]×6.02×1023}=y(拷贝/μl)
测定浓度为1.29*109拷贝/μl作为定量pcr的标准品,在-70℃条件下保存,备用。
进一步的,所述步骤4中,荧光定量pcr使用takaratp800荧光定量pcr仪进行;
反应体系为:premixextaq12.5μl,上、下游引物各0.5μl,探针0.5μl,模板1μl,加ddh2o至25μl;
反应程序:95℃预变性2min,然后94℃预变性10s;60℃预变性10s,进行40个循环,60℃时采集荧光信号。
进一步的,所述模板包括ppv、prv、prrsv、bvdv、csfv的cdna,荧光定量pcr特异性试验时分别以ppv、prv、prrsv、bvdv、csfv的cdna各1μl作为模板,进行taqmanreal-timert-pcr扩增。
本发明的有益技术效果:按照本发明的用于猪瘟疫苗效力检验的荧光定量pcr方法,本发明提供的用于猪瘟疫苗效力检验的荧光定量pcr方法,猪瘟病毒的实时荧光定量pcr方法检测结果与兔体检测结果进行比对,二者之间具有良好的相关性,可以作为猪瘟活疫苗效力检验的替代方法,设计一对特异性引物和一条标记的探针,优化反应条件,建立定量pcr方法,方法特异性好,对prv、pcv2、ppv、prrrsv、bvdv均无扩增,敏感性高,检出限制为1.29copy,批内批间均有很好的重复性,分别用该荧光定量pcr方法和《中国兽药典》规定的兔体法对公司的猪瘟活疫苗半成品和成品进行检测,结果表明兔体定型热反应法与荧光定量rt-pcr方法两者有良好的相关性,该荧光定量pcr方法,可在8-10h之内完成大量样品的检测,克服兔体实验的缺点,敏感特异,重复性良好,减少实验兔的使用。
附图说明
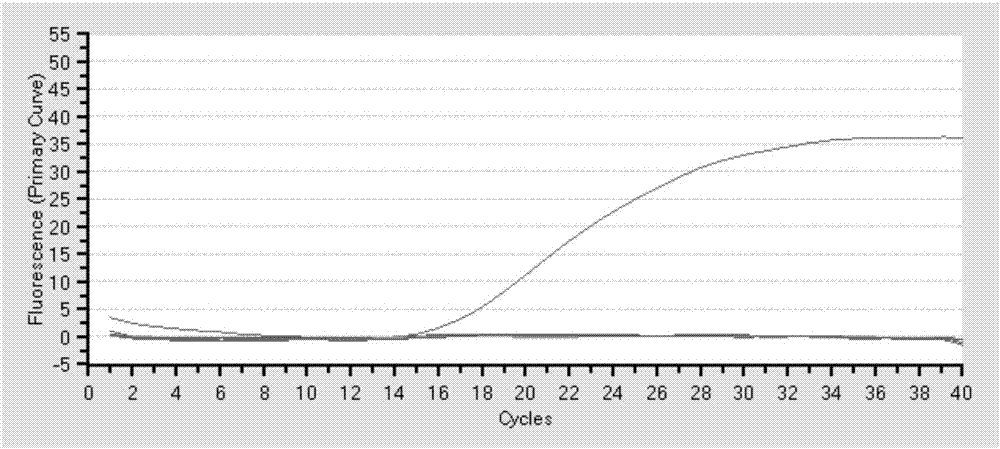
图1为按照本发明的用于猪瘟疫苗效力检验的荧光定量pcr方法的一优选实施例的进行taqmanreal-timert-pcr扩增的扩增曲线图;
图2为按照本发明的用于猪瘟疫苗效力检验的荧光定量pcr方法的一优选实施例的荧光定量pcr扩增得到的扩增曲线图;
图3为按照本发明的用于猪瘟疫苗效力检验的荧光定量pcr方法的一优选实施例的以ct值为纵坐标,以质粒dna拷贝数的对数为横坐标,得到标准曲线图。
具体实施方式
为使本领域技术人员更加清楚和明确本发明的技术方案,下面结合实施例及附图对本发明作进一步详细的描述,但本发明的实施方式不限于此。
实施例1:
本实施例提供的一种用于猪瘟疫苗效力检验的荧光定量pcr方法,对同一个猪瘟病毒样品分别用定量pcr方法和兽药典规定的兔体反应热方法检测,确定二者之间相关性,用定量pcr方法替代兔子实验,以克服兔体实验的缺点,减少实验动物的使用,设计一对特异性引物和一条标记的探针,优化反应条件,建立定量pcr方法。方法特异性好,对prv、pcv2、ppv、prrsv、bvdv均无扩增;敏感性高,检出限制为1.29copy;批内批间均有很好的重复性。
上游引物5'gctagaaacaggccaacaac3'
下游引物5'gagtaaactgccgcactcat3'产物144bp
探针5'ccgcactcatgatccccat3',5’标记fam,3’标记mgb
包括如下步骤:
步骤1:病毒核酸的提取
分别取ppv、prv、prrsv、bvdv、csfv200μl,按博迈德生物病毒基因组dna/rna快速提取试剂盒的说明方法提取总dna/rna;
步骤2:cdna的合成
反转录采用10μl体系,反应管中依次加入:2μl的5×buffer;0.5μl的m-mlv反转录酶;0.25μl的rnasin;1μl的10mmdntp;0.5μl的10μm下游引物;再加入病毒rna至10μl;在42℃温度条件下,反应1h,或95℃温度条件下,反应10min,得到cdna模板,放4℃温度条件下保存备用;
步骤3:标准品制备
在25μl体系中进行目的dna片段的pcr扩增,经目的dna片段回收纯化、连接、转化及重组质粒提取,制备标准品;
步骤4:荧光定量pcr特异性试验
荧光定量pcr使用takaratp800荧光定量pcr仪进行;
反应体系为:premixextaq12.5μl,上、下游引物各0.5μl,探针0.5μl,模板1μl,加ddh2o至25μl;
反应程序:95℃预变性2min,然后94℃预变性10s;60℃预变性10s,进行40个循环,60℃时采集荧光信号;
所述模板包括ppv、prv、prrsv、bvdv、csfv的cdna,荧光定量pcr特异性试验时分别以ppv、prv、prrsv、bvdv、csfv的cdna各1μl作为模板,进行taqmanreal-timert-pcr扩增,结果如图1所示,可见除csfv外其他病毒均无扩增曲线,建立的方法特异性好。
进一步的,在本实施例中,所述步骤3包括如下步骤:
步骤31:目的dna片段的pcr扩增
pcr扩增在25μl体系中进行,反应体系中加入:premixextaq12.5μl;上、下游引物各0.5μl;cdna产物1μl;加ddh2o至25μl;反应在95℃条件下变性5min;变性参数如下:在94℃条件下变性40s;在55℃条件下退火30s;在72℃条件下延伸30s;连续进行34个循环,循环结束后,在72℃条件下延伸5min;
步骤32:目的dna片段回收纯化
制作大孔琼脂糖凝胶,对目的dna进行琼脂糖凝胶电泳;在紫外灯下迅速切下含有目的dna的琼脂糖凝胶块放置在离心管中,用axygen凝胶回收试剂盒回收目的条带,最后加30μlelutionbuffer洗脱dna,保存于-20℃条件下备用;
步骤33:目的dna片段的连接与转化
将大孔琼脂糖凝胶回收纯化后的pcr产物,采用pmd18-t载体dna连接试剂盒,反应体系中加入试剂,试剂加完后瞬时离心,混匀,连接过夜,将连接产物加入感受态细胞dh5a中,混匀后,加入lb液体培养基培养,将培养物离心,过滤上清,再将沉淀混匀涂布于lb琼脂平板上培养;
步骤34:含目的dna片段的重组质粒提取
挑取经pcr鉴定为阳性的菌落,接种到2ml含有质量浓度为100μg/mlamp的lb液体培养基中,37℃摇动培养过夜,用axygen制备质粒试剂盒提取质粒,加入10μl含有质量浓度为20μg/mlrnase的te缓冲液中,37℃水浴1h,在紫外分光光度计od260测定质粒的质量浓度;
紫外分光光度计od260测定的公式为:
{[x(g/μl)dna/dna长度bp×660]×6.02×1023}=y(拷贝/μl)
测定浓度为1.29*109拷贝/μl作为定量pcr的标准品,在-70℃条件下保存,备用。
进一步的,在本实施例中,所述步骤33包括如下步骤:
步骤331:目的片段回收
将大孔琼脂糖凝胶回收纯化后的pcr产物,采用pmd18-t载体dna连接试剂盒,反应体系为10μl,反应体系中包括:回收纯化后的pcr产物5.0μl,pmd19-t0.5μl,soiutioni4.5μl,试剂加完后瞬时离心,混匀,置于4℃条件下连接过夜;
步骤332:转化
将连接产物5μl加入100μl感受态细胞dh5a中,混匀后,先冰浴30min,再在42℃条件下水浴90s,然后再冰浴2min,加入1mllb液体培养基,37℃条件下培养60min,将培养物以3500rpm的转速离心4min,在无菌条件下过滤掉上清,再将沉淀混匀,均匀涂布于含有amp的lb琼脂平板上,倒置平板于37℃温箱中培养12~16h。
进一步的,在本实施例中,重复性试验包括:
批内重复:01、02、03批csfv样品,分别提取rna,反转录后作为模板进行荧光定量pcr,每份样品做3个重复(a、b、c),采用步骤4的体系和程序进行荧光定量pcr,结果见表1,可见建立的方法有良好的批内重复性。
表13批样品的批内重复性
批间重复:对上述的3个批次csfv样品,先后提取3次rna,反转录,用同一仪器,同一反应程序下进行3次独立的荧光定量rt-pcr检测,结果见表2,可见建立的方法有良好的批间重复性
表23批样品的批间重复性
标准曲线的建立:
对步骤3.4中制备的标准品进行10倍系列稀释,以步骤4中的体系和程序进行荧光定量pcr扩增,得到扩增曲线,如图2所示,以ct值为纵坐标,以质粒dna拷贝数的对数为横坐标,得到一条标准曲线,如图3所示,pcr方法的最低检测量为1.92拷贝/μl,且在较广的范围内(102~107拷贝/μl)有很好的线性关系,相关系数r2=0.999。
实施例2:
分别用建立的荧光定量pcr方法和兔体反应热方法对51批次猪瘟兔化弱毒疫苗进行检测。
兔体反应热按《猪瘟活疫苗制造与检验规程》附录进行,具体如下:每头份疫苗稀释10000倍,接种1.5~3.0kg家兔两只,每只兔耳静脉注射1ml。家兔接毒后,上下午各测体温一次,48h后,每隔6h测体温一次,根据体温反应和攻毒结果进行综合判定。
家兔接种疫苗后,体温反应标准如下:
定型热反应(++)潜伏期48~96h,体温上升呈明显曲线,至少3个温次超过常温1℃,并稽留18~36h。如稽留42h以上,必须攻毒,攻毒后无反应可判为定型热。
轻型热反应(+)潜伏期48~96h,体温上升呈明显曲线,至少2个温次超过常温1℃,并稽留12~36h。
可疑热反应(±)潜伏期48~96h,体温曲线起伏不定,稽留不到12h,或潜伏期在24h以上,不足48h及超过96h至120h出现热反应。
体温反应呈两次高峰,有一次高峰符合定型热反应(++)或轻型热反应(+)标准者,均需攻毒。攻毒后无反应时,该兔体反应可判为定型热或轻型热。
结果判定注苗后,当2只家兔均呈定型热反应(++),或1只兔呈定型热反应(++)、另一只呈轻型热反应(+)时,每毫升该稀释度的疫苗含有一个兔体反应热(rid)。
注苗后,当1只家兔呈定型热反应(++)或轻型热反应(+),另一只呈可疑热反应(±);或2只兔子均呈轻型热反应(+)时,可在注苗后7~10日攻毒(接种新鲜脾淋毒或冻干毒)。攻毒时,加对照兔2只,攻毒剂量为50~100倍乳剂。每兔耳静脉注射1ml。
攻毒后的体温反应标准如下:
热反应(+)潜伏期24~72h,体温上升呈明显曲线,超过常温1℃,稽留12~36h。
可疑热反应(±)潜伏期不到24h或72h以上,体温曲线起伏不定,稽留不到12h或超过36h而不下降。
无反应(-)体温正常。
攻毒后,当2只对照兔均呈定型热反应(++),或1只兔呈定型热反应(++),另一只兔呈轻型热反应(+),而两只注苗兔均无反应(-),该稀释度的疫苗判为一个兔体反应热。
注苗后,如有1只兔呈定型热反应(++)或轻型热反应(+),另一只兔呈可疑热反应(±)或无反应(-),可对可疑反应兔或无反应兔采用剖啥或才心血分离病毒的方法,判明是否隐性感染;或注苗后,2只兔均呈轻热反应,亦可对其中1只兔分离病毒。方法是:接种疫苗后96~120h之间,将兔剖杀,取其脾脏,用生理盐水制成50倍稀释乳剂(脾乳剂应无菌),或采取心血(全血),接种2只家兔,每只兔耳静脉注射1ml。凡有1只潜伏期24~72h出现定型热反应(++),每毫升该稀释度的疫苗含有一个兔体反应热(rid)。
注苗后,出现其他反应情况无法判定时,可重检。用家兔做效力检验,不应超过3次。
2007年农业部对该规程进行修订,新修订的规程(暂行)将抗原标准提高到每毫升应含病毒≥100000rid,成品每头份稀释7500倍,有定型热反应,即每头份≥7500rid。
结果见表3,结果表明:结果表明:当荧光定量pcr法检测每毫升抗原液病毒粒子数大于108数量级时,兔检合格,当病毒数低于107以下时,兔检不合格。
表3荧光定量pcr和兔体反应热实验结果的相关性
本发明所建立的定量pcr的方法,与兔体法有很好的相关性,代替繁琐的兔体实验,克服兔体实验的缺点,可在8-10h之内完成大量样品的检测,敏感特异,重复性良好,最重要的是减少实验兔的使用,大大改善实验动物福利。
综上所述,在本实施例中,用于猪瘟疫苗效力检验的荧光定量pcr方法,本实施例提供的用于猪瘟疫苗效力检验的荧光定量pcr方法,猪瘟病毒的实时荧光定量pcr方法检测结果与兔体检测结果进行比对,二者之间具有良好的相关性,可以作为猪瘟活疫苗效力检验的替代方法,设计一对特异性引物和一条标记的探针,优化反应条件,建立定量pcr方法,方法特异性好,对prv、pcv2、ppv、prrrsv、bvdv均无扩增,敏感性高,检出限制为1.29copy,批内批间均有很好的重复性,分别用该荧光定量pcr方法和《中国兽药典》规定的兔体法对公司的猪瘟活疫苗半成品和成品进行检测,结果表明兔体定型热反应法与荧光定量rt-pcr方法两者有良好的相关性,该荧光定量pcr方法,可在8-10个h之内完成大量样品的检测,克服兔体实验的缺点,敏感特异,重复性良好,减少实验兔的使用。
以上所述,仅为本发明进一步的实施例,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明所公开的范围内,根据本发明的技术方案及其构思加以等同替换或改变,都属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!