提高芳香族氨基酸生物合成途径中的化合物及其衍生物产量的方法与流程
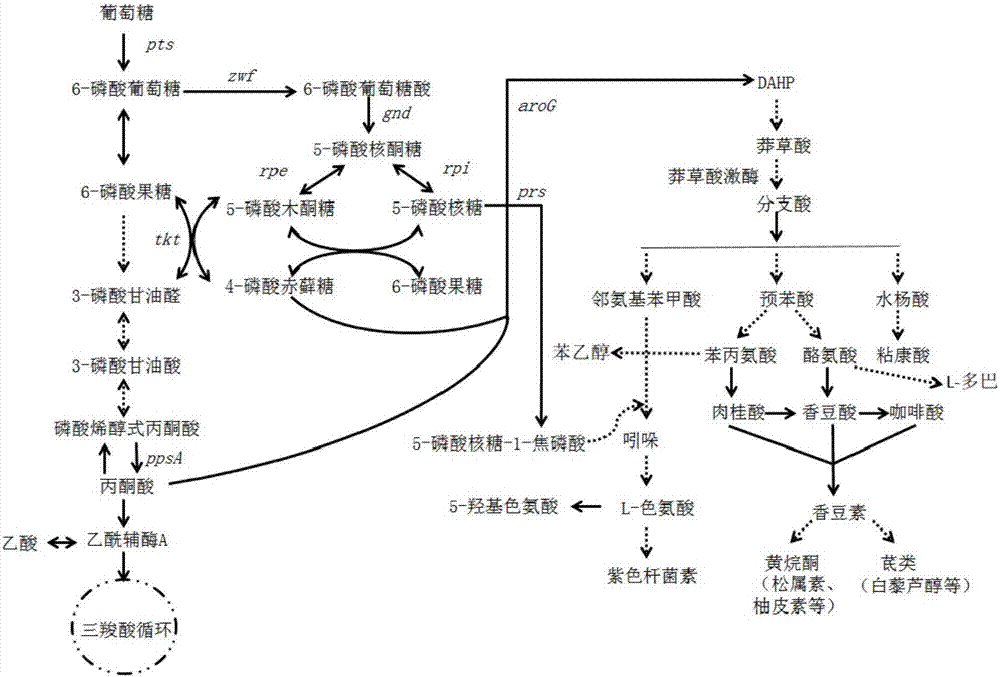
本发明涉及微生物发酵工程领域。更具体而言,本发明通过对工程细菌的芳香族氨基酸生物合成途径进行改进,增强莽草酸途经的碳代谢流,来提高芳香族氨基酸生物合成途径中间产物、终产物和衍生物的产量。
背景技术:
天然的芳香族氨基酸包括l-色氨酸、l-苯丙氨酸和l-酪氨酸。在生物体内,芳香族氨基酸通常经由莽草酸途径合成。如图1所示,首先是磷酸烯醇式丙酮酸(pep)和赤藓糖-4-磷酸(e4p)缩合生成3-脱氧-d-阿拉伯庚酮糖酸-7-磷酸(dahp),随后经催化生成莽草酸和分支酸。然后,通过不同的途径生成l-苯丙氨酸、l-酪氨酸或l-色氨酸。在莽草酸途径中,生产芳香族氨基酸的重要代谢前体之一是分支酸。分支酸不但参与芳香族氨基酸的合成,它也是重要的有机酸(例如水杨酸和黏糠酸)或类苯基丙烷类(例如羟化肉桂酸类、香豆素类、黄酮类和茋类)合成途径中的前体物质。
在微生物发酵工程领域,已经报道多种方法对发酵工艺进行改良。例如,通过调整搅拌和氧气供给、优化培养基组成、实时调控发酵液中的糖浓度或产物浓度等,或者借助传统的诱变筛选方法来弱化竞争性通路或降低中间产物反馈抑制,从而提高氨基酸发酵产量(de102008040352a1和ca2663711a1)。然而,由于芳香族氨基酸生物合成路线较长,其调控步骤多、调控网络复杂,可能的关键性节点较多,通过传统的工艺改良方式仅能有限地提高氨基酸的产量(ikedam,appl.microbiol.biotechnol.2006,69:615-626)。
近二十年发展的遗传工程和代谢工程方法使得能够对细菌自身的氨基酸合成通路进行定向优化设计,去除通路瓶颈或代谢反馈、调整碳中心代谢途径以增加前体供应量;另外,还可增强芳香族氨基酸的转运出胞以减少胞内的产物积累,从而提高发酵产量。
本领域已经提出,可通过增强莽草酸途经的碳代谢流来提高分支酸的产量,这种对芳香族氨基酸合成共同通路的改进能够使得芳香族氨基酸合成通路中多种化合物或衍生物的产量提高。例如,ikedam等在产色氨酸的谷氨酸棒状杆菌中过表达tkta,增加e4p的供应量(ikeadm,productionoftryptophanbycorynebacteriumglutamicumwiththemodifiedpentosephosphatepathway,1999)。berrya提出在大肠杆菌中过表达去除反馈抑制的arog和trpedcba基因,使得葡萄糖的糖酸转化率超过22%(berrya,improvingproductionofaromaticcompoundsinescherichiacolibymetabolicengineering,1996)。
然而,芳香族氨基酸合成途经的关键前体pep及e4p等分别来自不同的代谢通路:pep来自糖酵解(emp)途径,而e4p来自于磷酸戊糖(ppp,也称为hmp)途径。因此,对于莽草酸途经的调控不但需要增强这些来自不同代谢流的前体的产量,还需要进行流平衡(cn104388330a)。本领域仍存在对莽草酸途经进行优化的进一步需求。
技术实现要素:
本发明提出可通过对磷酸戊糖途径氧化阶段催化不可逆反应的酶进行改造,减弱或阻断磷酸戊糖途径的氧化阶段,减少由于脱羧造成的碳损失,增加碳中心代谢流,从而提高莽草酸途经的碳代谢流,由此增强芳香族氨基酸合成通路中的化合物和衍生物的产量。
在第一方面,本发明提供了提高细菌中芳香族氨基酸生物合成途径中的化合物及其衍生物产量的方法,所述方法包括对所述细菌进行修饰,使得所述细菌中磷酸戊糖途径氧化阶段催化不可逆反应的酶的表达水平和/或活性降低。
在第二方面,本发明提供了细菌在发酵生产芳香族氨基酸生物合成途径中的化合物及其衍生物方面的用途,其中,所述细菌中磷酸戊糖途径氧化阶段催化不可逆反应的酶具有降低的表达水平和/或活性。
在本发明的实施方式中,所述磷酸戊糖途径氧化阶段催化不可逆反应的酶为6-磷酸葡萄糖脱氢酶和/或6-磷酸葡萄糖酸脱氢酶;所述芳香族氨基酸生物合成途径中的化合物及其衍生物选自于由如下物质所组成的组中的任一种:莽草酸、分支酸、邻氨基苯甲酸、吲哚、5-羟基色氨酸、紫色杆菌素、预苯酸、l-苯丙氨酸、苯乙醇、l-多巴、l-酪氨酸、肉桂酸、香豆酸、咖啡酸、阿魏酸、香豆素、黄酮类、水杨酸和粘糠酸。
附图说明
图1为细菌芳香族氨基酸合成通路的关键步骤示意图。其中,双箭头表示可逆反应,虚线表示多步反应。dahp:3-脱氧-d-阿拉伯庚酮糖酸-7-磷酸;pts:编码磷酸烯醇式丙酮酸-糖磷酸转移酶系统的基因;zwf:编码6-磷酸葡萄糖脱氢酶的基因;gnd:编码6-磷酸葡萄糖酸脱氢酶的基因;tkt:编码转酮醇酶的基因;rpe:编码核酮糖-5-磷酸差向异构酶的基因;rpi:编码核糖-5-磷酸异构酶的基因;ppsa:编码磷酸烯醇式丙酮酸合成酶的基因;prs:编码磷酸核糖焦磷酸合成酶a的基因;arog:编码dahp合成酶的基因。
图2显示根据本发明的实施例2,ts102、ts52、ts41和ts49菌株在摇瓶条件下发酵生产l-色氨酸的相对产量、相对得率和生物量。
图3显示根据本发明的实施例3,ts102、ts401和ts412菌株在摇瓶条件下发酵生产l-色氨酸的相对产量、相对得率和生物量。
在图2和图3中,相对产量和相对得率均以ts102菌株为100%计算。
图4显示根据本发明的实施例4,ts557和ts558菌株发酵生产莽草酸的产量。
具体实施方式
如上所述,本发明以改造磷酸戊糖途径的氧化阶段作为切入点,通过降低磷酸戊糖途径氧化阶段催化不可逆反应的酶的表达水平和/或活性,减弱或阻断芳香族氨基酸发酵菌株中磷酸戊糖途径的氧化阶段,从而减少由于脱羧造成的碳损失,增加碳中心代谢流。在优选的实施方式中,在去除脱羧造成的碳损失的基础上通过对碳中心代谢流进行再平衡、提高前体供应、对辅酶代谢途径进行重构和/或去除反馈抑制,大幅提高芳香族氨基酸合成通路中的化合物及衍生物的生产效率。在本发明中,对芳香族氨基酸合成通路的改造可包括如下的一种或多种方式:磷酸戊糖途径的氧化阶段的阻断或弱化、磷酸戊糖途径的非氧化阶段的强化、nadph循环的重构以及磷酸烯醇式丙酮酸-糖磷酸转移酶系统的改造。
磷酸戊糖途径的氧化阶段的阻断或弱化
如图1所示,磷酸戊糖途径是葡萄糖氧化的旁路,该途径可分为氧化和非氧化两个阶段。在氧化阶段,6-磷酸葡萄糖在6-磷酸葡萄糖脱氢酶(g6pd)的催化下脱氢生成6-磷酸葡萄糖酸内酯,并水解为6-磷酸葡萄糖酸,6-磷酸葡萄糖酸在6-磷酸葡萄糖酸脱氢酶(6gpd)的催化下再次脱氢并自发脱羧,生成核酮糖-5-磷酸(也称为5-磷酸核酮糖)。核酮糖-5-磷酸经异构生成5-磷酸核糖。氧化磷酸戊糖阶段产生2分子nadph和1分子co2。该步骤的限速酶是6-磷酸葡萄糖脱氢酶。通过阻断g6pd能够实现对从6-磷酸葡萄糖生成核酮糖-5-磷酸这一过程的阻断。此外,由于6-磷酸葡萄糖酸脱氢酶催化的也是不可逆反应,通过阻断g6pd或6pgd,均可实现对从6-磷酸葡萄糖生成核酮糖-5-磷酸这一过程的阻断。6-磷酸葡萄糖脱氢酶在本领域中也称为葡萄糖-6-磷酸脱氢酶。
本领域已提出对编码6-磷酸葡萄糖脱氢酶的zwf基因进行修饰来提高芳香族氨基酸的产量。例如,cn101029310b公开了通过增强zwf基因的表达来提高前体供应,从而提高包括l-色氨酸在内的l-氨基酸的产量。然而,该方法并未提及通过减少碳损失来提高l-氨基酸的产量。
在本发明的实施方式中,通过降低细菌中6-磷酸葡萄糖脱氢酶(ec1.1.1.49)和/或6-磷酸葡萄糖酸脱氢酶(ec1.1.1.44)的表达水平和/或活性,减少由于二氧化碳的释放而造成的碳损失。
以l-色氨酸为例,葡萄糖经emp和ppp生成l-色氨酸的总反应为:
2.5×d-葡萄糖+2×h3n<=>l-色氨酸+4co2;该途径下葡萄糖的理论糖酸转化率为204.2/(2.5×180)=45.4%。
葡萄糖不经ppp生成l-色氨酸的总反应为:
2×d-葡萄糖+2×h3n<=>l-色氨酸+co2;该途径下葡萄糖的理论糖酸转化率为204.2/(2×180)=56.7%。
可见,从合成途径的理论得率来计算,在阻断或弱化磷酸戊糖途径的氧化阶段后,葡萄糖的理论糖酸转化率能够由45.4%提高到56.7%。
本领域知晓降低某一基因表达或活性的方法,例如将基因组上编码该基因的片段进行整体或部分删除、在一个或多个位点插入无功能片段、或者通过对一个或多个位点进行替换来改变蛋白的活性,使得该片段不能编码蛋白或编码的蛋白活性降低;也可对启动子区域进行调整、通过添加降解标签来缩短蛋白的半衰期等。还可通过改变培养基的组分和培养条件,实现相关基因的降低表达。可通过如上所述的任何方式降低g6pd和/或6gdp的表达或活性,例如敲除基因组上zwf和/或gnd基因的一部分(例如编码区域的一部分和/或启动子区域的一部分)。
磷酸戊糖途径的非氧化阶段的强化
如上所述,降低g6pd和/或6gdp的表达水平和/或活性能够减少碳损失。然而,磷酸戊糖途径的氧化阶段的阻断可能引起包括4-磷酸赤藓糖(e4p)和5-磷酸核糖在内的磷酸戊糖途径中间产物的减少。4-磷酸赤藓糖与磷酸烯醇式丙酮酸(pep)共同为分支酸途径的前体。并且,5-磷酸核糖参与下游5-磷酸核糖-1-焦磷酸(prpp)的生成。prpp能够与邻苯二甲酸反应形成磷酸核糖邻氨基苯甲酸,并经重排、脱羧和关环形成吲哚甘油磷酸,然后在色氨酸合成酶催化下先脱去3-磷酸甘油醛生成吲哚,最后吲哚与丝氨酸缩合生成色氨酸以及5-羟基色氨酸。可以通过对培养基进行调整来实现4-磷酸赤藓糖以及5-磷酸核糖的回补。在优选的实施方式中,通过对磷酸戊糖途径中的非氧化阶段步骤进行加强,回补由于磷酸戊糖途径氧化阶段的阻断造成的4-磷酸赤藓糖和5-磷酸核糖的减少。
如图1所示,磷酸戊糖途径的非氧化阶段实质上是通过一系列基团的重排,将5-磷酸核酮糖转变成6-磷酸果糖和3-磷酸甘油醛而进入糖酵解途径。为了提高4-磷酸赤藓糖和5-磷酸核糖的浓度,可通过提高如下的一种或多种酶的表达或活性,促进糖酵解途径中间产物进入磷酸戊糖途径的非氧化阶段:转酮醇酶(大肠杆菌内源表达两种转酮醇酶,分别为转酮醇酶a和转酮醇酶b;谷氨酸棒状杆菌仅内源表达一种转酮醇酶)、核酮糖-5-磷酸差向异构酶、核糖-5-磷酸异构酶(大肠杆菌内源表达核糖-5-磷酸异构酶a和核糖-5-磷酸异构酶b,谷氨酸棒状杆菌仅内源表达一种核糖-5-磷酸异构酶)和磷酸核糖焦磷酸合成酶a。
本领域知晓提高某一基因表达或活性的方法,例如增加质粒或基因组上该基因的拷贝数、对启动子区域进行调整(例如将启动子替换为强启动子)、延长mrna的寿命、减少酶的分解等。也可通过改变培养基的组分和培养条件,获得相关基因的增加表达。对于大肠杆菌而言,可通过如上任一种方法提高tkta、tktb、rpe、rpia、rpib和/或prs的表达。优选地,过表达tkta、tktb、rpe、rpia、rpib和/或prs。对于谷氨酸棒状杆菌而言,可通过如上任一种方法提高tkt、rpe、rpi和/或prs的表达。优选地,过表达tkt、rpe、rpi和/或prs。不希望被理论所限地,也可表达外源的上述基因(例如,在谷氨酸棒状杆菌中表达大肠杆菌的tkta、tktb、rpe、rpia、rpib和/或prs基因,或者在大肠杆菌中表达谷氨酸棒状杆菌的上述基因)来提高相关蛋白表达。
辅酶nadph循环的重构
如上所述,氧化磷酸戊糖阶段产生2分子nadph和1分子co2。对该阶段的阻断使得磷酸戊糖途径不再产生nadph,由此可能造成细胞内的还原力不足。因此,设想可通过促进nadh向nadph的转化来补足还原力,进而实现nadp+/nadph平衡。可通过对培养基进行调整从外部补足还原力。在优选的实施方式中,通过促进nadh向nadph的转化来重构nadp+/nadph平衡。例如,在大肠杆菌中,通过使得nad(p)h转氢酶a和/或nad(p)h转氢酶b的表达或活性增强来促进nadh向nadph的转化。可通过在质粒或基因组上过表达pnta和/或pntb来消除磷酸戊糖途径氧化阶段的阻断造成的nadp+/nadph比例的升高甚至nadp+的积累。在谷氨酸棒状杆菌中,可以通过外源表达大肠杆菌的nad(p)h转氢酶a和/或nad(p)h转氢酶b来促进nadh向nadph的转化。可通过在质粒或基因组上过表达pnta和/或pntb来消除磷酸戊糖途径氧化阶段的阻断造成的nadp/nadph比例的升高甚至nadp的积累。
磷酸烯醇式丙酮酸-糖磷酸转移酶系统的改造
本领域已知的是,野生型大肠杆菌利用磷酸烯醇式丙酮酸-糖磷酸转移酶系统(简称pts系统)转运并磷酸化葡萄糖。pts系统转运1摩尔葡萄糖需消耗1摩尔磷酸烯醇式丙酮酸(pep)。当大肠杆菌在以葡萄糖为碳源的限制性培养基中生长时,pts系统消耗了约50%的pep用于葡萄糖的转运和磷酸化,直接影响芳香族氨基酸合成途径中以pep为前体的下游产物和衍生物的合成。pts系统缺陷型大肠杆菌可通过半乳糖/氢离子协同转运蛋白(d-galactose/h+symporter,galp,也称为半乳糖透过酶)和葡萄糖激酶(glucokinase,glk)协同作用转运葡萄糖入胞。因此,在优选的实施方式中,可通过使得pts系统的酶表达水平和/或活性降低,并增强半乳糖转运通路来进一步提高作为前体的pep的供应(cn105543154a)。
因此,在进一步优选的实施方式中,可通过对pts的改造进一步增加pep前体的供应。优选地,所述pts系统的蛋白选自于由如下基因编码的蛋白中的一种或多种:ptsh、ptsi、crr或ptsg,优选为ptsg。优选地,所述半乳糖转运通路的蛋白选自于如下的一种或多种蛋白:半乳糖透过酶或葡萄糖激酶,优选同时提高半乳糖透过酶和葡萄糖激酶的表达水平和/或活性。优选地,同时过表达galp和glk。
解除中间产物的反馈抑制
如前所述,本领域知晓能够通过解除dahp合成酶和分支酸变位酶的反馈抑制使得分支酸能够在细胞内积累,进而提高芳香族氨基酸合成途径下游产物的产量。例如,可通过敲除或失活基因组arof、arog和/或trpedcba操纵子,并表达对负反馈不敏感的突变酶aroffbr或arogfbr和/或trpefbrdcba来解除反馈抑制(us5,939,295a)。在以莽草酸作为终产物的实施方式中,也可通过敲除arol来解除反馈抑制(大肠杆菌arol基因敲除及其对莽草酸合成的影响,《复旦学报(自然科学版))》2007年第46卷第3期)。
另外,对于l-色氨酸合成支路,可通过增强3-磷酸甘油酸脱氢酶的表达水平或活性来积累l-色氨酸合成支路前体——吲哚(iledam,2006)。
对于以上提及的细菌芳香族氨基酸合成通路中的酶和编码这些酶的基因,本领域已就多种模式菌和工程菌中的这些酶及其编码基因进行了研究和表征。表1和表2分别示出本发明主要涉及的酶在大肠杆菌和谷氨酸棒状杆菌中相应的蛋白和基因序列的ncbi登录号。本领域技术人员能够基于表中的编号获取上述蛋白和基因的序列。
表1
表2
在本发明的多个实施方式中,本发明的生产芳香族氨基酸及其衍生物的大肠杆菌可具有如下的一种或多种特征:
6-磷酸葡萄糖脱氢酶和/或6-磷酸葡萄糖酸脱氢酶的表达水平和/或活性降低;
磷酸戊糖途径的非氧化阶段的一种或多种酶的表达水平和/或活性增强,所述磷酸戊糖途径的非氧化阶段的酶选自于转酮醇酶a、转酮醇酶b、核酮糖-5-磷酸差向异构酶、核糖-5-磷酸异构酶a、核糖-5-磷酸异构酶b以及磷酸核糖焦磷酸合成酶a;
nad(p)h转氢酶a和/或nad(p)h转氢酶b的表达水平和/或活性增强;
pts系统蛋白的表达水平和/或活性降低,且一个或多个非pep底物的葡萄糖转运蛋白的表达水平和/或活性增强;
表达突变酶aroffbr或arogfbr和/或trpefbrdcba,且arof、arog和/或trpedcba操纵子被敲除或失活;以及
3-磷酸甘油酸脱氢酶的表达水平和/或活性升高。
在更为优选的实施方式中,本发明的细菌可为大肠杆菌ts412菌株,其分类命名为大肠埃希氏菌escherichiacoli,其保藏于中国微生物菌种保藏管理委员会普通微生物中心(地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所),cgmcc编号为14047,保藏日期为2017年4月19日。
在本发明的多个实施方式中,本发明的生产芳香族氨基酸及其衍生物的谷氨酸棒状杆菌可具有如下的一种或多种特征:
6-磷酸葡萄糖脱氢酶和/或6-磷酸葡萄糖酸脱氢酶的表达水平和/或活性降低;
磷酸戊糖途径的非氧化阶段的一种或多种酶的表达水平和/或活性增强,所述磷酸戊糖途径的非氧化阶段的酶选自于转酮醇酶、核酮糖-5-磷酸差向异构酶、核糖-5-磷酸异构酶以及磷酸核糖焦磷酸合成酶a;
表达大肠杆菌的pnta和/或pntb;
pts系统蛋白的表达水平和/或活性降低,且一个或多个非pep底物的葡萄糖转运蛋白的表达水平和/或活性增强;
表达突变酶aroffbr或arogfbr和/或trpefbrdcba,且arof、arog和/或trpedcba操纵子被敲除或失活;以及3-磷酸甘油酸脱氢酶的表达水平和/或活性升高。
在一些实施方式中,将本发明的细菌用于发酵生产莽草酸。优选地,该细菌中莽草酸激酶i(由arok编码)和/或莽草酸激酶ii(由arol编码)的表达和/或活性降低。
本领域已知的是,莽草酸途径是生产芳香族氨基酸(l-色氨酸、l-酪氨酸和l-苯丙氨酸)、其衍生物(例如紫色杆菌素、5-羟基色氨酸、肉桂酸(其前体为苯丙氨酸))、以及一些有机酸、类苯基丙烷类(phenylpropanoid)等的共同上游途径;其中,所述有机酸包括水杨酸以及粘糠酸(也称为黏糠酸);所述类苯基丙烷类包括羟化肉桂酸类(例如香豆酸,阿魏酸,咖啡酸以及咖啡酸的衍生物迷迭酸、绿原酸、奎尼酸和莽草酸酯)、香豆素类(包括双香豆素、4-羟基香豆素、7-羟基香豆素、6,7-二羟基香豆素)、黄酮类(包括黄酮、黄烷酮、异黄酮、黄酮醇和黄烷醇,包括大豆异黄酮、柚皮素、松属素和圣草酚等)和芪类(即,对称苯代二乙烯类似物,包括白芦藜醇)。由于莽草酸是上述化合物的前体,对莽草酸途经的增强能够提高上述化合物的发酵产量(《生物合成芳香族氨基酸及其衍生物的研究进展》,生物技术通报,2017,33(1):24-34;engineeringescherichiacolitooverproducearomaticaminoacidsandderivedcompounds,rodriguez等,microbialcellfactories2014,13:126)。由于本发明的技术方案为对芳香族氨基酸合成途径共用通路的调整,能够将本发明的菌株用于发酵生产上述任一种化合物。此外,本领域已经报道发酵生产上述各化合物的多种菌株。本领域技术人员能够预料的是,能够将本发明的对于共同途径莽草酸途经的改进与已有的对各合成支路的改进进行结合,以实现针对其中特定化合物的发酵工艺的改进。
定义
本文使用的术语“莽草酸途经”(shikimicacidpathway)也称为分支酸途径(chorismatepathway),是细菌、真菌、藻类、一些原生动物寄生虫和植物合成叶酸和芳香族氨基酸(苯丙氨酸、酪氨酸和色氨酸)时共用的7步代谢途径。该通路的起始物是磷酸烯醇式丙酮酸和赤藓糖-4-磷酸,最终产物是分支酸;催化莽草酸途径的7个酶分别为dahp合成酶、3-脱氢秋水仙碱合酶、3-脱氢奎尼酸脱水酶、莽草酸脱氢酶、莽草酸激酶、epsp合成酶和分支酸合成酶。分支酸是芳香族氨基酸、吲哚及其衍生物、水杨酸以及多种生物碱的前体。
虽然本发明实施例主要利用大肠杆菌(escherichiacoli)实现,然而如上所述,在几乎所有的工程菌,甚至多种真核生物(例如子囊菌(ascomycetes)、顶复门原生动物(apicomplexans)和植物)中,芳香族氨基酸的生物合成均利用极为相似的途径,首先是磷酸烯醇式丙酮酸(pep)和赤藓糖-4-磷酸(e4p)缩合生成3-脱氧d-阿拉伯庚酮糖酸-7-磷酸(dahp),随后经催化产生分支酸(rodriguez等,microbialcellfactories2014,13:126)。因此,本发明的原理同样适用于本领域公知的发酵工程菌,特别是谷氨酸棒状杆菌、乳酸发酵短杆菌(brevibacteriumlactofermentum)、黄色短杆菌(brevibacteriumflavum)、嗜乙酰乙酸棒杆菌(corynebacteriumacetoacidophilum)和corynebacteriumefficiens。本发明的大肠杆菌可为任何大肠杆菌菌株,包括但不限于k12、w3110、bw25113、mg1655、bl21(de3)、jm109、dh5a、dh10b、c600、er2925、hb101、jm110、s17-1、t1r、top10、w、xl1-blue、sure、rr1、le392、mc1061、ij1126、ag1以及ab1157。
本文所使用的全部术语“减少/降低”、“抑制”或“阻断”通常是指相对于未进行基因改造的对照菌株而言降低了统计学上显著的量。然而,为了避免疑义,“降低”、“减少”、“抑制”或“阻断”通常是指与未进行改造的对照相比,减少至少10%,并且可包括例如:与对照相比,减少至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约98%、至少约99%,并包括相对于对照而言完全不存在给定的实体或参数(例如,突变的酶可完全失活,或者在基因敲除的情况下完全不表达该酶)。
本文使用的全部术语“增加/增高”、“增强”、“活化”或“过表达”通常是指相对于未进行基因改造的对照菌株而言增高了统计学上显著的量;为了避免疑义,术语“增加/增高”、“增强”、“活化”或“过表达”通常是相对于未进行基因改造的对照菌株而言增高至少10%,例如:与未进行基因改造的对照菌株相比而言,增高至少约20%、或至少约30%、或至少约40%、或至少约50%、或至少约60%、或至少约70%、或至少约80%、或至少约90%、或上至并包括100%增高,或与对照相比而言的10%-100%之间的任意增高;或与对照相比,增高至少约2倍、或至少约3倍、或至少约4倍、或至少约5倍、或至少约10倍,或2倍至10倍以上的任意增高。特别地,增强表达包括在宿主细菌内表达外源的相应蛋白。
本文所述各方面的实施方式可由如下编号的段落说明:
1.一种提高细菌中芳香族氨基酸生物合成途径中的化合物及其衍生物产量的方法,所述方法包括对所述细菌进行修饰,使得所述细菌中磷酸戊糖途径氧化阶段催化不可逆反应的酶的表达水平和/或活性降低;其中,所述磷酸戊糖途径氧化阶段催化不可逆反应的酶为6-磷酸葡萄糖脱氢酶和/或6-磷酸葡萄糖酸脱氢酶;其中,所述芳香族氨基酸生物合成途径中的化合物及其衍生物选自于由如下物质所组成的组中的任一种:莽草酸、分支酸、邻氨基苯甲酸、吲哚、5-羟基色氨酸、紫色杆菌素、预苯酸、l-苯丙氨酸、苯乙醇、l-多巴、l-酪氨酸、肉桂酸、香豆酸、咖啡酸、阿魏酸、香豆素、黄酮类、水杨酸和粘糠酸。
2.如段落1所述的方法,其中,所述香豆素选自于双香豆素、4-羟基香豆素、7-羟基香豆素以及6,7-二羟基香豆素;所述黄酮类选自于黄酮、黄烷酮、异黄酮、黄酮醇和黄烷醇,更优选大豆异黄酮、柚皮素、松属素以及圣草酚;所述芪类选自于白芦藜醇。
3.如段落1或2所述的方法,其中,所述方法进一步包括:将所述细菌中的zwf基因敲除或失活,使得所述细菌中6-磷酸葡萄糖脱氢酶的表达水平和/或活性降低;优选地,对所述zwf基因的启动子进行改造,使得所述细菌中的zwf基因失活。
4.如段落1-3中任一项所述的方法,其中,所述方法进一步包括:将所述细菌中的gnd基因敲除或失活,使得所述细菌中6-磷酸葡萄糖酸脱氢酶的表达水平和/或活性降低;优选地,对所述gnd基因的启动子进行改造,使得所述细菌中的gnd基因失活。
5.如段落1-4中任一项所述的方法,其中,所述细菌选自于由如下细菌所组成的组:大肠杆菌、谷氨酸棒状杆菌、乳酸发酵短杆菌、黄色短杆菌、嗜乙酰乙酸棒杆菌和corynebacteriumefficiens。
6.如段落5所述的方法,其中,所述细菌为大肠杆菌。
7.如段落6所述的方法,所述方法进一步包括:对所述细菌进行基因修饰,使得所述细菌中磷酸戊糖途径的非氧化阶段的一种或多种酶的表达水平和/或活性增强,其中,所述磷酸戊糖途径的非氧化阶段的酶选自于转酮醇酶a、转酮醇酶b、核酮糖-5-磷酸差向异构酶、核糖-5-磷酸异构酶a、核糖-5-磷酸异构酶b以及磷酸核糖焦磷酸合成酶a;优选地,通过将如下的一个或多个基因过表达,使得所述细菌中磷酸戊糖途径的非氧化阶段的一种或多种酶的表达水平和/或活性增强:tkta、tktb、rpe、rpia、rpib以及prs。
8.如段落6或7所述的方法,所述方法进一步包括:对所述细菌进行基因修饰,使得所述细菌中nad(p)h转氢酶a和/或nad(p)h转氢酶b的表达水平和/或活性增强,优选地,通过将pnta和/或pntb基因过表达,使得所述细菌中nad(p)h转氢酶a和/或nad(p)h转氢酶b的表达水平和/或活性增强。
9.如段落6-8中任一项所述的方法,所述方法进一步包括:对所述细菌进行基因修饰,使得所述细菌中pts系统蛋白的表达水平和/或活性降低,且一个或多个非pep底物的葡萄糖转运蛋白的表达水平和/或活性升高;优选地,所述非pep底物的葡萄糖转运蛋白为半乳糖透过酶和/或葡萄糖激酶;更优选地,将如下的一个或多个基因敲除或失活,使得所述细菌中pts系统蛋白的表达水平和/或活性降低:ptsh、ptsi、crr或ptsg;更优选地,将ptsg基因敲除或失活,使得所述细菌中pts系统蛋白的表达水平和/或活性降低。
10.如段落9所述的方法,其中,将如下的一个或多个基因过表达,使得一个或多个非pep底物的葡萄糖转运蛋白的表达水平和/或活性升高:galp和glk;优选地,同时过表达galp和glk。
11.如段落6-10中任一项所述的方法,所述方法进一步包括:对所述细菌进行基因修饰,使得所述细菌表达突变酶aroffbr或arogfbr和/或trpefbrdcba,并且敲除或失活所述细菌的arof、arog和/或trpedcba操纵子。
12.如段落6-11中任一项所述的方法,其中,所述芳香族氨基酸生物合成途径中的化合物为吲哚、5-羟基色氨酸或紫色杆菌素,所述方法进一步包括:对所述细菌进行基因修饰,使得所述细菌中3-磷酸甘油酸脱氢酶的表达水平和/或活性升高;优选地,使得所述细菌过表达sera,从而所述细菌中3-磷酸甘油酸脱氢酶的表达水平和/或活性升高。
13.如段落6-11中任一项所述的方法,其中,所述芳香族氨基酸生物合成途径中的化合物为莽草酸,所述方法进一步包括:对所述细菌进行基因修饰,使得所述细菌中莽草酸激酶i和/或莽草酸激酶ii的表达和/或活性降低;优选地,将所述细菌中的arok和/或arol基因敲除或失活,使得所述细菌中莽草酸激酶i和/或莽草酸激酶ii的表达水平和/或活性降低。
14.如段落5所述的方法,其中,所述细菌为谷氨酸棒状杆菌。
15.如段落14所述的方法,所述方法进一步包括:对所述细菌进行基因修饰,使得所述细菌中磷酸戊糖途径的非氧化阶段的一种或多种酶的表达水平和/或活性增强,其中,所述磷酸戊糖途径的非氧化阶段的酶选自于转酮醇酶、核酮糖-5-磷酸差向异构酶、核糖-5-磷酸异构酶以及磷酸核糖焦磷酸合成酶a;优选地,通过将如下的一个或多个基因过表达,使得所述细菌中磷酸戊糖途径的非氧化阶段的一种或多种酶的表达水平和/或活性增强:tkt、rpe、rpi以及prs。
16.如段落14或15所述的方法,所述方法进一步包括:对所述细菌进行基因修饰,使得所述细菌表达大肠杆菌的nad(p)h转氢酶a和/或nad(p)h转氢酶b;优选地,将大肠杆菌的pnta和/或pntb基因转入所述细菌,使得所述细菌表达大肠杆菌的nad(p)h转氢酶a和/或nad(p)h转氢酶b。
17.如段落14-16中任一项所述的方法,所述方法进一步包括:对所述细菌进行基因修饰,使得所述细菌中pts系统蛋白的表达水平和/或活性降低,且一个或多个非pep底物的葡萄糖转运蛋白的表达水平和/或活性升高;优选地,所述非pep底物的葡萄糖转运蛋白为半乳糖透过酶和/或葡萄糖激酶;优选地,将如下的一个或多个基因敲除或失活,使得所述细菌中pts系统蛋白的表达水平和/或活性降低:ptsh、ptsi、crr或ptsg;更优选地,将ptsg基因敲除或失活,使得所述细菌中pts系统蛋白的表达水平和/或活性降低。
18.如段落17所述的方法,其中,将如下的一个或多个基因过表达,使得一个或多个非pep底物的葡萄糖转运蛋白的表达水平和/或活性升高:galp和glk;优选地,同时过表达galp和glk。
19.如段落14-18中任一项所述的方法,所述方法进一步包括:对所述细菌进行基因修饰,使得所述细菌表达突变酶aroffbr或arogfbr和/或trpefbrdcba,并且敲除或失活所述细菌的arof、arog和/或trpedcba操纵子。
20.如段落14-19中任一项所述的方法,其中,所述芳香族氨基酸生物合成途径中的化合物为莽草酸,所述方法进一步包括,对所述细菌进行基因修饰,使得所述细菌中莽草酸激酶i和/或莽草酸激酶ii的表达和/或活性降低;优选地,将所述细菌中的arok和/或arol基因敲除或失活,使得所述细菌中莽草酸激酶i和/或莽草酸激酶ii的表达水平和/或活性降低。
21.如段落14-19中任一项所述的方法,其中,所述芳香族氨基酸生物合成途径中的化合物为吲哚、5-羟基色氨酸或紫色杆菌素,所述方法进一步包括:对所述细菌进行基因修饰,使得所述细菌中3-磷酸甘油酸脱氢酶的表达水平和/或活性升高;优选地,使得所述细菌过表达sera,从而所述细菌中3-磷酸甘油酸脱氢酶的表达水平和/或活性升高。
22.一种细菌在发酵生产芳香族氨基酸生物合成途径中的化合物及其衍生物方面的用途,其中,所述细菌中磷酸戊糖途径氧化阶段催化不可逆反应的酶具有降低的表达水平和/或活性;其中,所述磷酸戊糖途径氧化阶段催化不可逆反应的酶为6-磷酸葡萄糖脱氢酶和/或6-磷酸葡萄糖酸脱氢酶;其中,所述芳香族氨基酸生物合成途径中的化合物及其衍生物选自于由如下物质所组成的组中的任一种:莽草酸、分支酸、邻氨基苯甲酸、吲哚、5-羟基色氨酸、紫色杆菌素、预苯酸、l-苯丙氨酸、苯乙醇、l-多巴、l-酪氨酸、肉桂酸、香豆酸、咖啡酸、阿魏酸、香豆素、黄酮类、水杨酸和粘糠酸。
23.如段落22所述的用途,其中,所述香豆素选自于双香豆素、4-羟基香豆素、7-羟基香豆素以及6,7-二羟基香豆素;所述黄酮类选自于黄酮、黄烷酮、异黄酮、黄酮醇和黄烷醇,更优选大豆异黄酮、柚皮素、松属素以及圣草酚;所述芪类选自于白芦藜醇。
24.如段落22或23所述的用途,其中,所述细菌中的zwf基因被敲除或失活,从而所述细菌中6-磷酸葡萄糖脱氢酶的表达水平和/或活性降低;优选地,所述细菌中所述zwf基因的启动子被改造,从而所述细菌中的zwf基因失活。
25.如段落22-24中任一项所述的用途,其中,所述细菌中的gnd基因被敲除或失活,从而所述细菌中6-磷酸葡萄糖酸脱氢酶的表达水平和/或活性降低;优选地,所述细菌中所述gnd基因的启动子被改造,从而所述细菌中的gnd基因失活。
26.如段落22-25中任一项所述的用途,其中,所述细菌选自于由如下细菌所组成的组:大肠杆菌、谷氨酸棒状杆菌、乳酸发酵短杆菌、黄色短杆菌、嗜乙酰乙酸棒杆菌和corynebacteriumefficiens。
27.如段落26所述的用途,其中,所述细菌为大肠杆菌。
28.如段落27所述的用途,其中,所述细菌中磷酸戊糖途径的非氧化阶段的一种或多种酶的表达水平和/或活性增强,其中,所述磷酸戊糖途径的非氧化阶段的酶选自于转酮醇酶a、转酮醇酶b、核酮糖-5-磷酸差向异构酶、核糖-5-磷酸异构酶a、核糖-5-磷酸异构酶b以及磷酸核糖焦磷酸合成酶a;优选地,所述细菌过表达如下的一种或多种基因:tkta、tktb、rpe、rpia、rpib以及prs。
29.如段落27或28所述的用途,其中,所述细菌中nad(p)h转氢酶a和/或nad(p)h转氢酶b的表达水平和/或活性增强,优选地,所述细菌过表达pnta和/或pntb基因。
30.如段落27-29中任一项所述的用途,其中,所述细菌中pts系统蛋白的表达水平和/或活性降低,且一个或多个非pep底物的葡萄糖转运蛋白的表达水平和/或活性升高;优选地,所述非pep底物的葡萄糖转运蛋白为半乳糖透过酶和/或葡萄糖激酶;更优选地,所述细菌中一个或多个如下的基因被敲除或失活,从而所述细菌中pts系统蛋白的表达水平和/或活性降低:ptsh、ptsi、crr或ptsg;更优选地,所述细菌中ptsg基因被敲除或失活。
31.如段落30所述的用途,其中,所述细菌过表达galp和/或glk;优选地,所述细菌同时过表达galp和glk。
32.如段落27-31中任一项所述的用途,其中,所述细菌表达突变酶aroffbr或arogfbr和/或trpefbrdcba,且arof、arog和/或trpedcba操纵子被敲除或失活。
33.如段落27-32中任一项所述的用途,其中,所述芳香族氨基酸生物合成途径中的化合物为吲哚、5-羟基色氨酸或紫色杆菌素,其中,所述细菌中3-磷酸甘油酸脱氢酶的表达水平和/或活性升高;优选地,所述细菌过表达sera。
34.如段落27所述的用途,其中,所述细菌为大肠埃希氏菌ts412菌株,所述细菌保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为cgmccno.:14047,保藏日期为2017年4月19日。
35.如段落27-32中任一项所述的用途,其中,所述芳香族氨基酸生物合成途径中的化合物为莽草酸,其中,所述细菌中莽草酸激酶i和/或莽草酸激酶ii的表达和/或活性降低;优选地,所述细菌中的arok和/或arol基因被敲除或失活。
36.如段落27所述的用途,其中,所述细菌为谷氨酸棒状杆菌。
37.如段落36所述的用途,其中,所述细菌中磷酸戊糖途径的非氧化阶段的一种或多种酶的表达水平和/或活性增强,其中,所述磷酸戊糖途径的非氧化阶段的酶选自于转酮醇酶、核酮糖-5-磷酸差向异构酶、核糖-5-磷酸异构酶以及磷酸核糖焦磷酸合成酶a;优选地,所述细菌过表达如下的一种或多种基因:tkt、rpe、rpi以及prs。
38.如段落36或37所述的用途,其中,所述细菌表达大肠杆菌的nad(p)h转氢酶a和/或nad(p)h转氢酶b;优选地,所述细菌表达大肠杆菌的pnta和/或pntb基因。
39.如段落36-38中任一项所述的用途,其中,所述细菌中pts系统蛋白的表达水平和/或活性降低,且一个或多个非pep底物的葡萄糖转运蛋白的表达水平和/或活性升高;优选地,所述非pep底物的葡萄糖转运蛋白为半乳糖透过酶和/或葡萄糖激酶;优选地,所述细菌中如下的一种或多种基因被敲除或失活,使得所述细菌中pts系统蛋白的表达水平和/或活性降低:ptsh、ptsi、crr或ptsg;更优选地,所述细菌中ptsg基因被敲除或失活。
40.如段落39所述的用途,其中,将如下的一个或多个基因过表达,使得一个或多个非pep底物的葡萄糖转运蛋白的表达水平和/或活性升高:galp和glk;优选地,同时过表达galp和glk。
41.如段落36-40中任一项所述的用途,其中,所述细菌表达突变酶aroffbr或arogfbr和/或trpefbrdcba,且所述细菌的arof、arog和/或trpedcba操纵子被敲除或失活。
42.如段落36-41中任一项所述的用途,其中,所述芳香族氨基酸生物合成途径中的化合物为莽草酸,其中,所述细菌中莽草酸激酶i和/或莽草酸激酶ii的表达和/或活性降低;优选地,所述细菌中的arok和/或arol基因被敲除或失活。
43.如段落36-41中任一项所述的用途,其中,所述芳香族氨基酸生物合成途径中的化合物为吲哚、5-羟基色氨酸或紫色杆菌素,其中,所述细菌中3-磷酸甘油酸脱氢酶的表达水平和/或活性升高;优选地,所述细菌过表达sera。
44.一种用于生产莽草酸的大肠杆菌细菌,其中,所述细菌具有降低的6-磷酸葡萄糖脱氢酶或6-磷酸葡萄糖酸脱氢酶的表达水平和/或活性,且所述细菌中莽草酸激酶i和/或莽草酸激酶ii被敲除或失活。
45.如段落44所述的细菌,所述细菌中的zwf基因被敲除或失活,从而所述细菌中6-磷酸葡萄糖脱氢酶的表达水平和/或活性降低;优选地,所述细菌中所述zwf基因的启动子被改造,从而所述细菌中的zwf基因失活。
46.如段落44或45所述的细菌,其中,所述细菌中的gnd基因被敲除或失活,从而所述细菌中6-磷酸葡萄糖酸脱氢酶的表达水平和/或活性降低;优选地,所述细菌中所述gnd基因的启动子被改造,从而所述细菌中的gnd基因失活。
47.如段落44-46中任一项所述的细菌,其中,所述细菌中磷酸戊糖途径的非氧化阶段的一种或多种酶的表达水平和/或活性增强,其中,所述磷酸戊糖途径的非氧化阶段的酶选自于转酮醇酶a、转酮醇酶b、核酮糖-5-磷酸差向异构酶、核糖-5-磷酸异构酶a、核糖-5-磷酸异构酶b以及磷酸核糖焦磷酸合成酶a;优选地,所述细菌过表达如下的一种或多种基因:tkta、tktb、rpe、rpia、rpib以及prs。
48.如段落44-47中任一项所述的细菌,其中,所述细菌中nad(p)h转氢酶a和/或nad(p)h转氢酶b的表达水平和/或活性增强,优选地,所述细菌过表达pnta和/或pntb基因。
49.如段落44-48中任一项所述的细菌,其中,所述细菌中pts系统蛋白的表达水平和/或活性降低,且一个或多个非pep底物的葡萄糖转运蛋白的表达水平和/或活性升高;优选地,所述非pep底物的葡萄糖转运蛋白为半乳糖透过酶和/或葡萄糖激酶;更优选地,所述细菌中一个或多个如下的基因被敲除或失活,从而所述细菌中pts系统蛋白的表达水平和/或活性降低:ptsh、ptsi、crr或ptsg;更优选地,所述细菌中ptsg基因被敲除或失活。
50.如段落49所述的细菌,其中,所述细菌过表达galp和/或glk;优选地,所述细菌同时过表达galp和glk。
51.如段落44-50中任一项所述的细菌,其中,所述细菌表达突变酶aroffbr或arogfbr和/或trpefbrdcba,且arof、arog和/或trpedcba操纵子被敲除或失活。
实施例
试剂和培养基
如无特别说明,全部试剂来自于fisherscientific。
luria-bertani(lb)液体培养基:
蛋白胨10g/l;
nacl10g/l;
酵母粉5g/l。
调节ph至7.0,121℃高压灭菌20min。
lb固体培养基:与lb液体培养基的配方相同,添加2wt%琼脂粉。
卡那霉素(acros):溶于lb培养基,终浓度50μg/ml。
壮观霉素(acros):溶于lb培养基,终浓度50μg/ml。
氯霉素(acros):溶于lb培养基,终浓度34μg/ml。
氨苄青霉素(acros):溶于lb培养基,终浓度100μg/ml。
异丙基-β-d-1-硫代半乳糖苷(iptg)(usbcorporation)储液浓度1m,终浓度为100μm。
种子培养基:
调节ph至7.2,过滤灭菌。
摇瓶发酵培养基:
调节ph至7.0,过滤灭菌。
种子培养基加葡萄糖10g/l。发酵培养基加葡萄糖20g/l。
莽草酸发酵培养基
莽草酸转化缓冲液
莽草酸发酵培养基和莽草酸转化缓冲液ph均为7.2,定容至1000ml,过滤。
实施例中使用的引物为序列表中的seqidno.:1-seqidno.:54。
实施例1菌株的构建
本发明实施例构建的菌株名称和基因型特征如表3所示。
表3
根据专利申请wo198701130a1及mascarenhas等描述的方法(mascarenhasd,ashworthdj,chencs,deletionofpgialterstryptophanbiosynthesisinageneticallyengineeredstrainofescherichiacoli.,applenvironmicrobiol,1991,57(10):2995-2999)构建菌株ts102,即,对w3110野生型菌株基因组上的基因tnaa、sera和trpr进行敲除。所使用的初始菌株为大肠杆菌野生型w3110(us5,939,295a)。所使用的质粒为p5lrps2,该质粒在us5,939,295a中描述,为pbr322来源,包含sera、arogfbr和trpefbrdcba基因片段。
1.ts05菌株的构建
以ts102菌株作为出发菌株,首先用glk基因序列替换ptsg序列,随后敲除galr,得到ts05菌株。
(1)用j23119-glk片段替换掉ts102菌株基因组上的ptsg片段(ncbigeneid:945651)
利用引物seqidno.:1和seqidno.:2,以glk表达载体ps95s-glk[1]为模板进行扩增,得到p119-glk-trrnb片段。利用gibson同源重组的方法将p119-glk-trrnb片段插入到pslm载体[1]的noti/nhei酶切位点之间。利用引物seqidno.:3和seqidno.:4对所获得的载体进行扩增,得到j23119-glk片段。
j23119-glk片段的1-60bp为上游同源臂,对应于ptsg翻译起始位点-60至-1位;该片段61-218bp为119启动子;237-1203bp为glk基因序列(geneid:946858);1396-1552bp为终止子trrnb;1956-2750bp为卡那霉素编码序列;3014-3073bp为下游同源臂,对应于ptsg翻译起始位点+1414至+1473。
将j23119-glk片段电转化至经阿拉伯糖诱导的ts102(含pkd46质粒)菌株中,在含有卡那霉素的lb平板上筛选阳性克隆。pkd46载体来源于datsenko,ka,blwanner2000.one-stepinactivationofchromosomalgenesinescherichiacolik-12usingpcrproducts.proc.natl.acad.sci.u.s.a.97(12):6640-5.,accessionnumber:ay048746。
同源重组后,上下游同源臂之间的ptsg序列被替换为j23119-glk,并且基因组上带有glk基因和编码卡那霉素的序列。转入重组酶质粒pscre[1],消除卡那霉素抗性。
(2)敲除galr(ncbigeneid:947314)
利用引物seqidno.:5和seqidno.:6,以pslm载体为模板进行扩增,得到同源臂打靶dna片段。该同源臂打靶dna片段1-63bp为上游同源臂,对应于galr翻译起始位点-60至+3位;第458-1252bp为卡那霉素编码序列;第1516-1578位为下游同源臂,对应于galr翻译起始位点+1033至+1092。
将该同源臂打靶dna片段电转化至经阿拉伯糖诱导的第(1)步构建的菌株(含pkd46质粒)中,在含有卡那霉素的lb平板上筛选阳性克隆。
2.ts52和ts401菌株的构建
以ts05和ts102作为出发菌株,分别用如下的方法敲除基因组上的zwf基因,得到ts52和ts401菌株。
以大肠杆菌mg1655菌株(cgsc#:6300)基因组为模板,分别以引物对seqidno.:7和seqidno.:8、seqidno.:9和seqidno.:10进行pcr,扩增得到同源臂u和同源臂r后,进行融合pcr,获得打靶片段。该打靶片段的第1bp-488bp为zwf基因翻译起始位点上游-506到-19bp;第489bp-986bp为zwf基因翻译起始位点+1479到+1976bp。
使用crispr/cas9介导的重组技术[2],分别向ts05和ts102菌株中转入pcas质粒[2]。对于转化后的菌株,在0℃进行100倍稀释接种,加10mm阿拉伯糖摇菌,o.d.600达到0.5左右时,4℃4000rpm离心收菌,10%甘油洗菌4次制作感受态细胞。
在zwf基因上选择序列cgcaggaaatcaatgatcag(seqidno.:55)构建打靶sgrna。以ptarget[2]为模板,利用引物对seqidno.:49和seqidno.:50进行反向pcr后,利用gibsonassembly方法自连;获得对应的sgrna质粒。将sgrna与打靶片段共同电转入经阿拉伯糖诱导的含有pcas质粒的菌株中,在壮观霉素和卡那霉素双抗平板上筛选阳性克隆。
3.ts412菌株的构建
以ts401作为出发菌株,用pntab基因序列替换sera序列,得到ts412菌株。其中,pntab(ncbigeneid:946628和ncbigeneid:946144)为共用一个启动子的pnta和pntb。
以大肠杆菌mg1655菌株基因组为模板,分别以引物对seqidno.:16和seqidno.:17、seqidno.:14和seqidno.:15以及seqidno.:11和seqidno.:12进行pcr,扩增得到上下游同源臂以及pntab片段,将三个片段进行融合pcr,获得打靶片段。该打靶片段的1bp-498bp为sera(ncbigeneid:945258)基因翻译起始位点+844bp到+1341bp;499bp-536bp为启动子j101(cagtttacagctagctcagtcctaggtataatgctagc,seqidno.:56);541bp-3507bp为pntab基因翻译起始位点-39bp到+2932bp;第3508bp-3951bp为sera基因翻译起始位点+1582bp到+2025bp;
在sera基因上选择序列tgcgttgtgtttatttaat(seqidno.:57)构建打靶sgrna。以ptarget[2]为模板,利用引物对seqidno.:48和seqidno.:50进行反向pcr后,利用gibsonassembly方法自连,获得对应的sgrna质粒。将sgrna与打靶片段共同电转入经阿拉伯糖诱导ts401中,在壮观霉素和卡那霉素双抗平板上筛选阳性克隆。
4.ts41和ts49菌株的构建
以ts52作为出发菌株,过表达tkta、rpe、rpia和prs,得到ts41和ts49菌株。
(1)构建质粒tp2、tp4、tp5和tp7。
①以pgrna-bacteria[3]作为模板,利用引物对seqidno.:18和seqidno.:19进行pcr,得到质粒骨架1。
②以大肠杆菌mg1655基因组为模板,利用引物对seqidno.:20和seqidno.:21扩增得到p100-prs(prs的ncbirefseqid:np_415725.1:947420;启动子p100序列为:ttgacggctagctcagtcctaggtacagtgctagc,seqidno.:58)。
③以大肠杆菌mg1655基因组为模板,利用引物对seqidno.:22和seqidno.:23扩增得到prs编码片段(ncbirefseqid:np_415725.1)。
④以大肠杆菌mg1655基因组为模板,利用引物对seqidno.:24和seqidno.:25扩增得到rpia编码片段(ncbirefseqid:np_417389.1)。
⑤以质粒psb1c3(http://parts.igem.org/part:psb1c3)为模板,利用引物对seqidno.:26和seqidno.:27重叠扩增,得到终止子1(序列为:ccaggcatcaaataaaacgaaaggctcagtcgaaagactgggcctttcgttttatctgttgtttgtcggtgaacgctctctactagagtcacactggctcaccttcgggtgggcctttctgcgtttata,seqidno.:59)。
将上述步骤①-⑤获得的各片段混合,利用gibsonassembly连接,得到质粒tp2。
⑥以大肠杆菌mg1655基因组为模板,利用引物对seqidno.:28和seqidno.:29扩增出p106-prs(prs的ncbirefseqid:np_415725.1;启动子p106序列为:tttacggctagctcagtcctaggtatagtgctagc,seqidno.:60)
将上述步骤①和③-⑥获得的各片段混合,利用gibsonassembly连接,得到质粒tp4。
⑦以pgrna-bacteria[3]作为模板,利用引物对seqidno.:30和seqidno.:31进行pcr,得到质粒骨架2。
⑧以大肠杆菌mg1655基因组为模板,利用引物对seqidno.:32和seqidno.:33扩增出j119-tkta(tkta的ncbirefseqid为wp_000098614.1;j119启动子的序列为:ttgacagctagctcagtcctaggtataatgctagc,seqidno.:61)
⑨以大肠杆菌mg1655基因组为模板,利用引物对seqidno.:34和seqidno.:35扩增得到rpe片段(ncbirefseqid:np_417845.1)。
⑩利用引物对seqidno.:36和seqidno.:37重叠扩增,得到终止子2(ctcggtaccaaattccagaaaagaggcctcccgaaaggggggccttttttcgttttggtcc,seqidno.:62)。
将上述步骤⑦-⑩获得的各片段混合,利用gibsonassembly连接,得到质粒tp5。
将上述步骤
利用限制性内切酶eagi和xmai,分别对质粒tp2和tp4进行双酶切。利用限制性内切酶eagi和ngomiv,分别对质粒tp5和tp7进行双酶切。将tp2酶切片段与tp5酶切片段连接,得到质粒tp8。将tp4酶切片段与tp7酶切片段连接,得到质粒tp16。分别利用限制性内切酶eagi和sbfi对质粒tp8(带有p100_prs_rpia-j119_tkta_rpe片段)和tp16(带有p106_prs_rpia-j107_tkta_rpe片段)进行酶切。利用引物对seqidno.:53和seqidno.:54以posip-ko质粒(acssynth.biol.,2013,2(9),pp537-541)为模板进行pcr扩增,得到线性化的posip-ko质粒。通过gibsonassembly分别将线性化的tp8或tp16片段与线性化的posip-ko质粒相连。对连接产物进行转化,37℃复苏培养,卡那霉素抗性筛选。在posip-ko质粒介导下,tp8或tp16片段被整合到基因组。将整合有tp8片段的基因组的克隆命名为ts41。将整合有tp16片段的基因组的克隆命名为ts49。
4.ts557和ts558菌株的构建
以ts102和ts52作为出发菌株,分别依次用如下的方法敲除基因组上的arok和arol基因,得到ts557和ts558菌株。
(1)敲除arok
以大肠杆菌mg1655菌株(cgsc#:6300)基因组为模板,分别以引物对seqidno.:40和seqidno.:41、seqidno.:42和seqidno.:43进行pcr,扩增得到同源臂u和同源臂r后,进行融合pcr,获得打靶片段。该打靶片段的第1bp-461bp为arok基因翻译起始位点上游-458bp到+3bp;第462bp-982bp为arok基因翻译起始位点+469bp到+989bp。
使用crispr/cas9介导的重组技术[2],分别向ts05和ts102菌株中转入pcas质粒[2]。对于转化后的菌株,在0℃进行100倍稀释接种,加10mm阿拉伯糖摇菌,o.d.600达到0.5左右时,4℃4000rpm离心收菌,10%甘油洗菌4次制作感受态细胞。
在arok基因上选择序列atctttctggttgggcctat(seqidno.:64)构建打靶sgrna。以ptarget[2]为模板,利用引物对seqidno.:51和seqidno.:50进行反向pcr后,利用gibsonassembly方法自连,获得对应的sgrna质粒。将sgrna与打靶片段共同电转入经阿拉伯糖诱导的含有pcas质粒的菌株中,在壮观霉素和卡那霉素双抗平板上筛选阳性克隆。
(2)敲除arol
以大肠杆菌mg1655菌株(cgsc#:6300)基因组为模板,分别以引物对seqidno.:44和seqidno.:45、seqidno.:46和seqidno.:47进行pcr,扩增得到同源臂u和同源臂r后,进行融合pcr,获得打靶片段。该打靶片段的第1bp-472bp为arol基因翻译起始位点上游-469bp到+3bp;第473bp-970bp为arol基因翻译起始位点+472bp到+969bp。
使用crispr/cas9介导的重组技术[2],分别向第一步arok敲除的菌株中转入pcas质粒[2]。对于转化后的菌株,在0℃进行100倍稀释接种,加10mm阿拉伯糖摇菌,o.d.600达到0.5左右时,4℃4000rpm离心收菌,10%甘油洗菌4次制作感受态细胞。
在arol基因上选择序列gtcgaaagggaagagtgggc(seqidno.:65)构建打靶sgrna。以ptarget[2]为模板,利用引物对seqidno.:52和seqidno.:50进行反向pcr后,利用gibsonassembly方法自连;对该自连片段进行纯化后,采用epicenterasf3257商用试剂盒实施利用t7rna聚合酶的体外转录,获得对应的sgrna。将sgrna与打靶片段共同电转入经阿拉伯糖诱导的含有pcas质粒的菌株中,在壮观霉素和卡那霉素双抗平板上筛选阳性克隆。
所构建的全部菌株均经测序验证。
上述各步骤的实验条件如下。
pcr扩增体系为:nebq55×缓冲液10μl,dntp(每种dntp各10mm)1μl,正向和反向引物(20μm)各1μl,q5dna聚合酶(2.5u/μl),蒸馏水33.5μl,总体积为50μl。
gibsonassembly:将各dna片段(总体积5μl)加入至15μlgibson反应缓冲液(e2611l,neb),50℃反应1小时。随后,用氯化钙法转化将连接的片段转入大肠杆菌。
氯化钙法转化:取2μl反应液(包含连接产物),加入50μltrans5a(cat.nb.cd201,北京全式金生物技术有限公司),冰浴30分钟,42℃热激45秒,立即置于冰上2分钟。立即加入500μllb培养基,200rpm摇床孵育,37℃复苏1小时。取200μl菌液,涂在含有相应抗性的lb平板上。37℃过夜培养,挑取3个阳性单菌落,进行菌落pcr验证,送样测序分析,结果正确的为阳性克隆。
电转化:首先将宿主细胞制备为感受态细胞,取50μl感受态细胞置于冰上,在其中加入待转化的dna200ng,冰上放置2分钟。随后,将冰浴的混合物转移至0.2cm的bio-rad电击杯。使用micro-pulser(bio-rad)电穿孔仪,电极参数为电压2.5kv。电击后迅速将900μllb培养基转移至电击杯中,反复吹打后转移至试管中,200rpm、30℃孵育1.5小时。取200μl菌液涂在含有壮观霉素和卡那霉素的双抗平板上,37℃过夜培养后,挑选单菌落进行pcr验证。
实施例2ts102、ts52、ts41和ts49菌株发酵生产l-色氨酸效率的测定
从固体平板挑取各菌株,置于含4mllb液体培养基的试管中,35℃、220rpm培养8-14h;按1:500至1:1000的接种量将菌株转接至含有20ml种子培养基的带挡板的锥形瓶中,35℃、220rpm培养10-12h;将菌株转接至含有500ml摇瓶发酵培养基的发酵摇瓶中,使得初始od600为0.6-0.8,35℃、220rpm培养12h。
使用eclipsexdb-c18反相色谱柱对培养基中的l-色氨酸含量进行测定。流动相a组分:20mm醋酸钠+0.2v/v%三乙胺,85%;b组分:甲醇,15v/v%;流速0.6ml/min;检测器:紫外检测器280nm吸收峰。l-色氨酸的产量以每升发酵液的色氨酸浓度(浓度为g/l)计。
通过如下的方法计算转化率:
生物量为根据培养基的o.d.600测得。
图2示出相对于对照菌株ts102而言,ts52、ts41和ts49菌株发酵生产l-色氨酸的相对产量、相对得率(即,相对转化率)以及生物量。培养基中添加20g/l葡萄糖时,ts52相对于ts102产量提高34%,ts41相对于ts102产量提高53%,ts49相对于ts102产量提高53%。对照菌株ts102检测到2.05g/l色氨酸,转化率为9.75%。
实施例3ts102、ts401和ts412菌株发酵生产l-色氨酸效率的测定
根据与实施例2相同的方法,以ts102为对照菌株,测定ts401和ts412菌株发酵生产l-色氨酸的效率。结果如图3所示。ts401菌株相对于ts102产量提高6%,ts412菌株相对于ts102产量提高23%。对照菌株ts102检测到1.74g/l色氨酸,转化率为8.44%。
实施例4ts102、ts52、ts557和ts558菌株发酵生产莽草酸效率的测定
从四环素固体培养基平板挑取菌株至含4ml液体lb培养基的试管中,培养8-12h;1%接种量转接至莽草酸培养基,培养10-12小时,4000rpm,4℃离心收菌,用莽草酸转化缓冲液将菌体浓缩至25od。37℃、220rpm转化7小时。
使用87h离子交换柱对培养基中的莽草酸含量进行测定。流动相为6mm硫酸;检测器:紫外检测器210nm吸收峰,视差遮光检测器。柱温为55℃。莽草酸的产量以每升发酵液的莽草酸浓度(浓度为g/l)计。
图4示出培养12h后的各菌株培养液中莽草酸的产量。
莽草酸激酶催化从莽草酸合成分支酸的不可逆反应。arok和aroj的敲除使得菌株生成的莽草酸积累而不被转化为下游产物,因此便于观察本发明的方法(特别是磷酸戊糖途径的重构)对于莽草酸途经的影响。从图4可以看出,zwf的敲除和磷酸戊糖途径非氧化阶段的强化使得莽草酸的积累量大大增强。能够理解的是,本发明的方法使得莽草酸(以及下游的分支酸)的碳代谢增强,因此利用本发明的方法,能够提高芳香族氨基酸及其衍生物的产量。
参考文献
[1]wangyao,xuyang,chennan,xuxin-yi,liuwei-feng,taoyong.novelefficientstrategyforλ-red-mediatedgeneknock-out/ininescherichiacoliusingsclmsystem[j].microbiologychina,2015,42(4):699-711.
[2]appl.environ.microbiol.april2015vol.81no.72506-2514.
[3]cell.2013feb28;152(5):1173–1183.
序列表
<110>中国科学院微生物研究所
<120>提高芳香族氨基酸生物合成途径中的化合物及其衍生物产量的方法
<160>65
<170>siposequencelisting1.0
<210>1
<211>51
<212>dna
<213>人工序列(artificialsequence)
<400>1
acgttaagggattttgggcggccgcggcatgccacagctaacaccacgtcg51
<210>2
<211>51
<212>dna
<213>人工序列(artificialsequence)
<400>2
atgctataccaagttatgaagctagcaggcccagtctttcgactgagcctt51
<210>3
<211>80
<212>dna
<213>人工序列(artificialsequence)
<400>3
ccccccttgccacgcgtgagaacgtaaaaaaagcacccatactcaggagcactctcaatt60
gcatgccacagctaacacca80
<210>4
<211>80
<212>dna
<213>人工序列(artificialsequence)
<400>4
agccatctggctgccttagtctccccaacgtcttacggattagtggttacggatgtactc60
gacggatccctgcagactag80
<210>5
<211>83
<212>dna
<213>人工序列(artificialsequence)
<400>5
ccaacgggcgttttccgtaacactgaaagaatgtaagcgtttacccactaaggtattttc60
atgataacttggtatagcataca83
<210>6
<211>83
<212>dna
<213>人工序列(artificialsequence)
<400>6
cggttgattcgccgtcgccagaccatcgaagaattactggcgctggaattgctttaactg60
cgggacggatccctgcagactag83
<210>7
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>7
tgcgacagaaacgattcacc20
<210>8
<211>35
<212>dna
<213>人工序列(artificialsequence)
<400>8
aggataagcgcagaactaacccggtacttaagcca35
<210>9
<211>38
<212>dna
<213>人工序列(artificialsequence)
<400>9
taagtaccgggttagttctgcgcttatcctttatggtt38
<210>10
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>10
tctggatagtgttcataaggctg23
<210>11
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>11
tgtgaattcgacaacgtcct20
<210>12
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>12
tgctagcattatacctaggactgagctagctgtaaactgtctggagcagactcgcaaag59
<210>13
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>13
acgttccgcaagtttttgc19
<210>14
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>14
ctagctcagtcctaggtataatgctagcacgtaaccatcatcaataaaaccgatggaag59
<210>15
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>15
ttacagagctttcaggattgcatc24
<210>16
<211>51
<212>dna
<213>人工序列(artificialsequence)
<400>16
agcgtggatgcaatcctgaaagctctgtaaaatcaacgatgtcaatcaggg51
<210>17
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>17
cccagccactcatagaacaac21
<210>18
<211>36
<212>dna
<213>人工序列(artificialsequence)
<400>18
cggccgagatctttagaattccagaaatcatcctta36
<210>19
<211>28
<212>dna
<213>人工序列(artificialsequence)
<400>19
ggatccttactcgagtctagactgcagg28
<210>20
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>20
ttctggaattctaaagatctcggccgttgacggctagctcagtcctaggtacagtgcta59
<210>21
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>21
tgagaagaacctcaggcatgcgtccattggtggaaactgctagcactgtacctaggact59
<210>22
<211>57
<212>dna
<213>人工序列(artificialsequence)
<400>22
caatggacgcatgcctgaggttcttctcatgcctgatatgaagctttttgctggtaa57
<210>23
<211>50
<212>dna
<213>人工序列(artificialsequence)
<400>23
tggtatgaaatttcacacgcattagtgttcgaacatggcagagatcgatt50
<210>24
<211>50
<212>dna
<213>人工序列(artificialsequence)
<400>24
ccatgttcgaacactaatgcgtgtgaaatttcataccacaggcgaaacga50
<210>25
<211>50
<212>dna
<213>人工序列(artificialsequence)
<400>25
gttttatttgatgcctggctcatttcacaatggttttgacaccgtcaggt50
<210>26
<211>50
<212>dna
<213>人工序列(artificialsequence)
<400>26
aaccattgtgaaatgagccaggcatcaaataaaacgaaaggctcagtcga50
<210>27
<211>48
<212>dna
<213>人工序列(artificialsequence)
<400>27
agactcgagtaaggatcccgggtataaacgcagaaaggcccacccgaa48
<210>28
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>28
ttctggaattctaaagatctcggccgtttacggctagctcagtcctaggtatagtgcta59
<210>29
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>29
gagaagaacctcaggcatgcgtccattggtggaaactgctagcactatacctaggactg59
<210>30
<211>55
<212>dna
<213>人工序列(artificialsequence)
<400>30
ggccttttttcgttttggtcctgcaggatccttactcgagtctagactgcaggct55
<210>31
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>31
taggactgagctagctgtcaaggccggccatcggccgagatctttagaattccagaaat59
<210>32
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>32
ttgacagctagctcagtcctaggtataatgctagcagagggcgtgcccttcatcatccg59
<210>33
<211>52
<212>dna
<213>人工序列(artificialsequence)
<400>33
tttcatccgcttctccttgagaattattttttcgcgggtgattacagcagtt52
<210>34
<211>54
<212>dna
<213>人工序列(artificialsequence)
<400>34
taatcacccgcgaaaaaataattctcaaggagaagcggatgaaacagtatttga54
<210>35
<211>51
<212>dna
<213>人工序列(artificialsequence)
<400>35
ttctggaatttggtaccgagttattcatgacttacctttgccagttcactg51
<210>36
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>36
gcaaaggtaagtcatgaataactcggtaccaaattccagaaaagaggcctcccgaaagg59
<210>37
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>37
gtaaggatcctgcaggaccaaaacgaaaaaaggcccccctttcgggaggcctcttttct59
<210>38
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>38
tagggctgagctagccgtaaaggccggccatcggccgagatctttagaattccagaaat59
<210>39
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>39
tttacggctagctcagccctaggtattatgctagcagagggcgtgcccttcatcatccg59
<210>40
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>40
agatgaacgacgcgagttag20
<210>41
<211>54
<212>dna
<213>人工序列(artificialsequence)
<400>41
ggtttgcaaccactttagcgctttgcattttttcggtactactaagactattcg54
<210>42
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>42
caaagcgctaaagtggttgca21
<210>43
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>43
ggaatcgacctgcgacagtaa21
<210>44
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>44
ataacgaaattgtccggcagtg22
<210>45
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>45
catcgtgggttttccccaat20
<210>46
<211>44
<212>dna
<213>人工序列(artificialsequence)
<400>46
ctattggggaaaacccacgatgagccaggtgatttctgaaattc44
<210>47
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>47
ccactgctgacacttacttgt21
<210>48
<211>58
<212>dna
<213>人工序列(artificialsequence)
<400>48
ggtataatactagttgcgttgtgtttatttaatgttttagagctagaaatagcaagtt58
<210>49
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>49
ggtataatactagtcgcaggaaatcaatgatcaggttttagagctagaaatagcaagtt59
<210>50
<211>27
<212>dna
<213>人工序列(artificialsequence)
<400>50
actagtattatacctaggactgagcta27
<210>51
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>51
ggtataatactagtatctttctggttgggcctatgttttagagctagaaatagcaagtt59
<210>52
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>52
ggtataatactagtgtcgaaagggaagagtgggcgttttagagctagaaatagcaagtt59
<210>53
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>53
agacaataaccctgataaatgcttcaataataggatccccgggtaccgagctcgaattc59
<210>54
<211>59
<212>dna
<213>人工序列(artificialsequence)
<400>54
gaaaggggggccttttttcgttttggtcctgcatactagtagcggccgctgcaggcatg59
<210>55
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>55
cgcaggaaatcaatgatcag20
<210>56
<211>38
<212>dna
<213>人工序列(artificialsequence)
<400>56
cagtttacagctagctcagtcctaggtataatgctagc38
<210>57
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>57
tgcgttgtgtttatttaat19
<210>58
<211>35
<212>dna
<213>人工序列(artificialsequence)
<400>58
ttgacggctagctcagtcctaggtacagtgctagc35
<210>59
<211>129
<212>dna
<213>人工序列(artificialsequence)
<400>59
ccaggcatcaaataaaacgaaaggctcagtcgaaagactgggcctttcgttttatctgtt60
gtttgtcggtgaacgctctctactagagtcacactggctcaccttcgggtgggcctttct120
gcgtttata129
<210>60
<211>35
<212>dna
<213>人工序列(artificialsequence)
<400>60
tttacggctagctcagtcctaggtatagtgctagc35
<210>61
<211>35
<212>dna
<213>人工序列(artificialsequence)
<400>61
ttgacagctagctcagtcctaggtataatgctagc35
<210>62
<211>61
<212>dna
<213>人工序列(artificialsequence)
<400>62
ctcggtaccaaattccagaaaagaggcctcccgaaaggggggccttttttcgttttggtc60
c61
<210>63
<211>35
<212>dna
<213>人工序列(artificialsequence)
<400>63
tttacggctagctcagccctaggtattatgctagc35
<210>64
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>64
atctttctggttgggcctat20
<210>65
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>65
gtcgaaagggaagagtgggc20
- 还没有人留言评论。精彩留言会获得点赞!