一种菜籽抗炎肽的分离纯化方法与流程
本发明涉及一种从菜籽饼粕中分离纯化的抗炎肽及其用途,属于食品生物技术领域。
背景技术:
炎症是机体对其组织和细胞受到有毒刺激和病症时,如感染,组织损伤,组织应激和功能障碍等,作出的直接反应。炎症与整体健康状况密不可分,研究表明癌症的发病机制与炎症有关。关于菜籽生物活性肽的研究已经很多,包括降血压肽,抗氧化肽,抗肿瘤肽等。因此,菜籽蛋白水解具有很大的潜力和广阔的市场前景。
由于目标活性肽在反应体系中含量甚微,菜籽功能肽多数是一些相对分子质量小于5000da的短肽,传统分离技术难以达到分离的目的,必须采用膜分离、色谱分离等现代分离技术。目前有关抗炎肽分离纯化的技术较少,而且所得到的活性成分纯度较低,抗炎活力较弱,不能很好的找到抗炎目标组分。
技术实现要素:
本发明的目的是提供一种菜籽抗炎肽的分离纯化方法,以酶解菜籽蛋白水解物为原料,分离菜籽蛋白水解物以得到具有较高抗炎活性的菜籽肽组分,提高菜籽蛋白的利用。
本发明采用以下技术方案:一种菜籽抗炎肽的分离纯化方法,包括以下步骤:
a.将菜籽脱脂处理,得到的菜籽饼粕,并粉碎过筛,得到菜籽粉;将得到的菜籽粉用碱提酸沉的方法制得菜籽蛋白,并冷冻干燥;将得到菜籽蛋白用碱性蛋白酶水解和风味蛋白酶进行分步酶解,得到菜籽蛋白水解物;
b.将步骤a得到的菜籽蛋白水解物通过的超滤膜,收集分子量小于3k的组分;
c.将步骤b收集的分子量小于3k的组分通过葡聚糖凝胶柱分离,得到若干组分,并收集具有紫外吸收峰的组分;
d.将步骤c得到的活性较强的组分通过半制备液相分离,得到若干组分,收集主要的洗脱峰,冷冻干燥后检测各分离组分的抗炎活性,活性最强的即所述菜籽抗炎肽。
具体的,包括以下步骤:
(1)菜籽蛋白酶解产物的制备:将菜籽脱脂处理,得到的菜籽饼粕,并粉碎过筛,得到菜籽粉;取菜籽粉溶于蒸馏水中,调为ph=11,搅拌1h,离心收集上清液,调上清液的ph为4.5,搅拌1h,再次离心,弃上清液,得菜籽蛋白。取菜籽蛋白溶于蒸馏水中,调ph=9,加入碱性蛋白酶,反应3h后,灭酶,将溶液ph调至7,加入风味蛋白酶,反应2h,灭酶冷却后,过0.22μm微滤膜,得到菜籽蛋白水解物。
(2)菜籽蛋白的酶解产物的超滤:利用超滤膜分离技术将其进行纯化,将菜籽蛋白水解物配制成质量浓度为0.5-1%的溶液后,反复几次通过的超滤膜,使其超滤的压力控制在0~1mpa范围内,收集小于3k的组分,并冷冻干燥。
(3)利用葡聚糖凝胶柱分离纯化步骤(2)中的分子量3k的菜籽肽。葡聚糖凝胶过滤层析的洗脱条件为:以双蒸水为流动相进行洗脱样品,上样浓度1-10mg/ml,上样体积5-10ml,上样流速9-18ml/h,洗脱流速9-48ml/h,洗脱温度20-32℃,紫外检测波长为280nm,洗脱液自动部分收集,将同一分离峰合并,冷冻干燥后检测各分离组分的抗炎活性;
(4)用半制备液相进一步分离步骤(3)中活性较强的菜籽多肽组分,液相条件为:洗脱梯度为0-60min,乙腈5-100%;流速为1-2.46ml/min,紫外检测波长215nm,柱温25-35℃,收集主要的洗脱峰,冷冻干燥后检测各分离组分的抗炎活性,活性最强的即所得菜籽抗炎肽。
本发明还公开了利用上述经过超滤,葡聚糖凝胶柱,半制备液相分离纯化得到的抗炎菜籽肽。所述抗炎菜籽肽的纯度为90~98%菜籽抗炎肽,在最大纯度的条件下,菜籽抗炎肽的ic50=377.085μg/ml。
本发明的有益效果:
(1)提高了菜籽饼粕的利用价值,可以从酶解产物中分离出一些具有生理活性的生物活性肽;
(2)通过控制葡聚糖凝胶色谱柱的上样浓度,上样体积,上样流速,洗脱流速,洗脱温度来判断合适的分离条件;以及控制半制备液相中液相条件(上样浓度,洗脱梯度,流速,柱温)来找到合适的制备条件。
(3)菜籽抗炎肽的活力较强,可以作为一种功能性食品和膳食补充剂。
附图说明
图1为本发明实施例2步骤(3)处理后的分离组分的no释放量;
图2为本发明实施例2步骤(4)处理后的分离组分的no释放量;
图3为本发明实施例2制备菜籽抗炎肽的液相色谱图。
具体实施方式
以下结合具体实施例对本发明作进一步说明:
实施例1:
(1)菜籽蛋白酶解产物的制备:将菜籽脱脂处理,得到的菜籽饼粕,并粉碎过筛,得到菜籽粉;取菜籽粉溶于蒸馏水中,调为ph=11,搅拌1h,离心收集上清液,调上清液的ph为4.5,搅拌1h,再次离心,弃上清液,得菜籽蛋白。取菜籽蛋白溶于蒸馏水中,调ph=9,加入碱性蛋白酶,反应3h后,灭酶,将溶液ph调至7,加入风味蛋白酶,反应2h,灭酶冷却后,过0.22μm微滤膜,得到菜籽蛋白水解物。
(2)菜籽蛋白的酶解产物的超滤:利用超滤膜分离技术将其进行纯化,将菜籽蛋白水解物配制成质量浓度为0.5%的溶液后,反复几次通过的超滤膜,使其超滤的压力控制在0-0.2mpa范围内,收集小于3k的组分,并冷冻干燥。
(3)利用葡聚糖凝胶柱分离纯化步骤(2)中的分子量3k的菜籽肽,葡聚糖凝胶过滤层析的洗脱条件为:以双蒸水为流动相进行洗脱样品,上样浓度1mg/ml,上样体积5ml,上样流速9ml/h,洗脱流速9ml/h,洗脱温度25℃,紫外检测波长为280nm,洗脱液自动部分收集,将同一分离峰合并,冷冻干燥后检测各分离组分的抗炎活性。
(4)用半制备液相进一步分离步骤(3)中活性较强的菜籽多肽组分,液相条件为:上样浓度为0.5mg/ml;洗脱梯度为0-60min,乙腈5-40%;流速为1.0ml/min,紫外检测波长215nm,柱温25℃,收集主要的洗脱峰,冷冻干燥后检测各分离组分的抗炎活性,活性最强的即所得菜籽抗炎肽;菜籽抗炎肽的纯度为91%,菜籽抗炎肽的ic50=527.661μg/ml。
实施例2:
(1)菜籽蛋白酶解产物的制备:将菜籽脱脂处理,得到的菜籽饼粕,并粉碎过筛,得到菜籽粉;取菜籽粉溶于蒸馏水中,调为ph=11,搅拌1h,离心收集上清液,调上清液的ph为4.5,搅拌1h,再次离心,弃上清液,得菜籽蛋白。取菜籽蛋白溶于蒸馏水中,调ph=9,加入碱性蛋白酶,反应3h后,灭酶,将溶液ph调至7,加入风味蛋白酶,反应2h,灭酶冷却后,过0.22μm微滤膜,得到菜籽蛋白水解物。
(2)菜籽蛋白的酶解产物的超滤:利用超滤膜分离技术将其进行纯化,将菜籽蛋白水解物配制成质量浓度为0.75%的溶液后,反复几次通过的超滤膜,使其超滤的压力控制在0-0.5mpa范围内,收集小于3k的组分,并冷冻干燥。
(3)利用葡聚糖凝胶柱分离纯化步骤(2)中的分子量3k的菜籽肽,葡聚糖凝胶过滤层析的洗脱条件为:以双蒸水为流动相进行洗脱样品,上样浓度7.5mg/ml,上样体积7.5ml,上样流速16ml/h,洗脱流速18ml/h,洗脱温度20℃,紫外检测波长为280nm,洗脱液自动部分收集,将同一分离峰合并,冷冻干燥后检测各分离组分的抗炎活性。
(4)用半制备液相进一步分离步骤(3)中活性较强的菜籽多肽组分,液相条件为:上样浓度为0-1mg/ml;洗脱梯度为0-20min,乙腈5-80%;流速为2.0ml/min,紫外检测波长215nm,柱温30℃,收集主要的洗脱峰,冷冻干燥后检测各分离组分的抗炎活性,活性最强的即所得菜籽抗炎肽;菜籽抗炎肽的纯度为98%,菜籽抗炎肽的ic50=377.085μg/ml。
实施例3:
(1)菜籽蛋白酶解产物的制备:将菜籽脱脂处理,得到的菜籽饼粕,并粉碎过筛,得到菜籽粉;取菜籽粉溶于蒸馏水中,调为ph=11,搅拌1h,离心收集上清液,调上清液的ph为4.5,搅拌1h,再次离心,弃上清液,得菜籽蛋白。取菜籽蛋白溶于蒸馏水中,调ph=9,加入碱性蛋白酶,反应3h后,灭酶,将溶液ph调至7,加入风味蛋白酶,反应2h,灭酶冷却后,过0.22μm微滤膜,得到菜籽蛋白水解物。
(2)菜籽蛋白的酶解产物的超滤:利用超滤膜分离技术将其进行纯化,将菜籽蛋白水解物配制成质量浓度为1%的溶液后,反复几次通过的超滤膜,使其超滤的压力控制在0~1mpa范围内,收集小于3k的组分,并冷冻干燥。
(3)利用葡聚糖凝胶柱分离纯化步骤(2)中的分子量3k的菜籽肽,葡聚糖凝胶过滤层析的洗脱条件为:以双蒸水为流动相进行洗脱样品,上样浓度10mg/ml,上样体积10ml,上样流速18ml/h,洗脱流速48ml/h,洗脱温度32℃,紫外检测波长为280nm,洗脱液自动部分收集,将同一分离峰合并,冷冻干燥后检测各分离组分的抗炎活性。
(4)用半制备液相(rp-hplc)进一步分离步骤(3)中活性较强的菜籽多肽组分,液相条件为:上样浓度为1mg/ml;洗脱梯度为0-40min,乙腈10-100%;流速为2.46ml/min,紫外检测波长215nm,柱温35℃,收集主要的洗脱峰,冷冻干燥后检测各分离组分的抗炎活性,活性最强的即所得菜籽抗炎肽;菜籽抗炎肽的纯度为95%,菜籽抗炎肽的ic50=453.375μg/ml。
本发明实施例抗炎菜籽肽的活性分析:
建立lps诱导小鼠巨噬细胞raw264.7炎症模型,以抑制no的释放量来评价组分的抗炎活力:将小鼠巨噬细胞raw264.7接种于96孔板中(1×105个/孔),在培养箱(37℃,5%co2)中孵育24h后,加入待测样品,1h后加入浓度为1μg/ml的lps(脂多糖),在培养箱(37℃,5%co2)中孵育24h,24h后收集上清液。使用一氧化氮试剂盒(碧云天公司)测定上清中一氧化氮的浓度。
如图1所示,为本发明实施例1,经过步骤(3),超滤膜分离菜籽蛋白水解物经过葡聚糖凝胶柱分离后,得到两个组分f1和f2,当两个组分的浓度均为400μg/ml时,组分f2处理过的细胞中no的释放量为14.064μm,抑制率为46.15%,优于组分f1的抑制率19.23%。
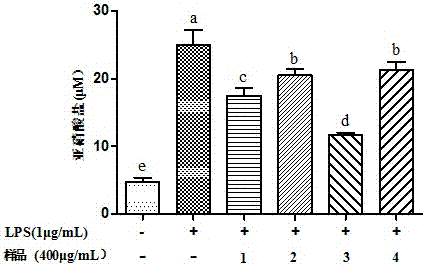
如图2所示,组分f2用半制备液相进一步分离,得到四个组分,当四个组分的浓度均为400μg/ml时,组分3处理过的细胞中no的释放量为11.71μm,抑制率为53.01%,优于其他组分,组分1,2,4的抑制率分别为29.71%,19.67%,14.37%。如图3所示,组分3基本是一个单一组分,纯度为98%,即为本发明菜籽抗炎肽。
- 还没有人留言评论。精彩留言会获得点赞!