非洲猪瘟病毒多表位融合诊断抗原及其制备方法和用途与流程
本发明涉及一种非洲猪瘟病毒(ASFV)多表位融合诊断抗原ASFV-meAg6及其制备方法和用途,属生物技术领域。
背景技术:
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)所引起猪的一种急性、热性、高度接触性传染病。该病毒可感染所有品种和年龄的猪,在临床上病猪以高热、食欲废绝、皮肤和内脏器官出血为特征,死亡率高达100%。
该病在我国被列为一类动物疫病,属于世界动物卫生组织(OIE)的法定报告动物疫病。ASF最初主要在非洲和欧洲东部流行,随后在非洲以外的意大利撒丁岛、西班牙、葡萄牙、加勒比地区、巴西以及东欧等国家或地区发现。2007年,该病传入俄罗斯后不断蔓延,已经传播至俄罗斯的46个地区。2017年3月,与我国接壤的俄罗斯远东地区发生ASF疫情,使得该病传入我国的风险不断增加,因此我国急需提高对该病的检测和监测能力。
非洲猪瘟病毒(African swine fever virus,ASFV)为一种含有囊膜的双链DNA,基因组为线性双链DNA,长度在170~190kb之间,可编码151个蛋白。该病毒是非洲猪瘟病毒科(Asfarviridae)非洲猪瘟病毒属(Asfarvirus)的唯一成员,目前只有1个血清型,但不同地区ASFV分离株基因组存在一定的差异。根据P72基因遗传进化分析,目前可将ASFV分为23个基因型。
在临床上,由于ASF主要以高热和内脏器官出血为主要特征,与猪瘟(CSF)非常相似,因此无法通过临床症状和病理变化进行鉴别诊断,只有依赖于实验室进行确诊。
目前,ASF的实验室诊断包括动物接种、病毒分离、病毒核酸DNA检测和特异性抗体检测等方法。然而,动物接种、病毒分离、病毒核酸DNA检测方法或需要在生物安全三级以上的实验室,或需要昂贵的仪器设备和专业技术人员,或操作繁琐的试验程序以及较长的检测时间,难以满足基层临床检测需要。由于ASF没有疫苗,因此当前ASF的实验室诊断方法主要以检测特异性抗体为主。
酶联免疫吸附试验(ELISA)是一种常用于血清抗体的检测方法,具有操作方便,特异性较好,灵敏度高,适用于大批量样品的检测。
Perez Filgueira等人采用了间接ELISA法对ASFV感染猪的血清样品进行了检测,证实该方法具有敏感性高的优点,能够检测出ASFV早期感染的样品,可以用于 ASFV早期特异性抗体的检测。
Vidal等人建立了检测ASFV抗体的固相ELISA,其检测血清样品的敏感性达0.05 mg/ml。
Hutchings等建立了间接夹心ELISA,试验表明其敏感性高于单抗酶联免疫吸附试验。
西班牙某公司已经研制出阻断ELISA检测试剂盒,并且已经商品化,也是目前世界动物卫生组织指定的参考试剂盒,该试剂盒的敏感性和特异性较好,但由于价格昂贵,限制在发展中国家中广泛应用。
国内有学者以P72纯化蛋白为包被抗原,建立了间接ELISA来检测非洲猪瘟病毒血清抗体。然而,目前国内尚没有商品化的试剂盒。
ASFV血清学检测是诊断动物感染ASFV的重要方法之一。因此筛选和鉴定特异性高和反应原性强的ASFV抗原是研发ASFV诊断试剂的关键。
在现有的ASFV ELISA检测方法中,所使用的ASFV诊断抗原或为细胞培养的全病毒抗原,或为ASFV单一的重组蛋白。然而,研究表明,细胞培养的全病毒抗原虽然敏感性较高,但其特异性较低;单一重组蛋白抗原虽具有较高的特异性,但敏感性不高。
因此,有必要研发和制备高特异性和敏感性的ASFV诊断抗原。
一种具有高特异性和敏感性的非洲猪瘟病毒(ASFV)多表位融合诊断抗原 ASFV-meAg6及其制备方法和用途就应运而生。
技术实现要素:
本发明的目的是提供一种具有高特异性和敏感性的非洲猪瘟病毒(ASFV)多表位融合诊断抗原ASFV-meAg6及其制备方法和用途。
目前的研究发现,在ASFV结构蛋白中,p72、p54、p22、p12、p17、p30、 p14.5、p150、p37、p34及p14等结构蛋白具有较强的免疫原性和反应原性。
本发明通过生物信息学软件对ASFV重要结构蛋白P72、P54、P30和P12基因编码氨基酸的序列进行分析,将筛选得到的优势抗原表位采用柔性氨基酸按照一定顺序进行串联,构建并合成多表位融合抗原(ASFV-meAg)基因,在大肠杆菌中进行表达,通过血清学试验筛选获得具有强反应原性的重组ASFV-meAg。
将纯化的重组ASFV-meAg作为包被抗原建立间接ELISA方法,经对血清样品进行检测,与商品化的检测试剂盒进行结果对比,证实所制备的重组多表位融合抗原 ASFV-meAg6具有高特异性和敏感性,为ASFV血清学诊断方法提供了一种特异性强和敏感性高的诊断抗原蛋白。即<210>3。
本发明的非洲猪瘟病毒(ASFV)多表位融合诊断抗原ASFV-meAg6,即<210>3主要通过以下过程制备:
1、ASFV重要结构蛋白优势抗原表位的预测分析
2、ASFV-meAg多表位融合抗原基因的构建方法
3、ASFV-meAg基因在大肠杆菌中的表达
4、ASFV-meAg6抗原蛋白的纯化
5、基于ASFV-meAg6抗原蛋白建立间接ELISA方法及条件的优化
6、ASFV-meAg6-ELISA法与商品化ASFV间接ELISA方法的检测结果的比对
具体如下:
1、ASFV重要抗原基因优势抗原表位的预测分析。
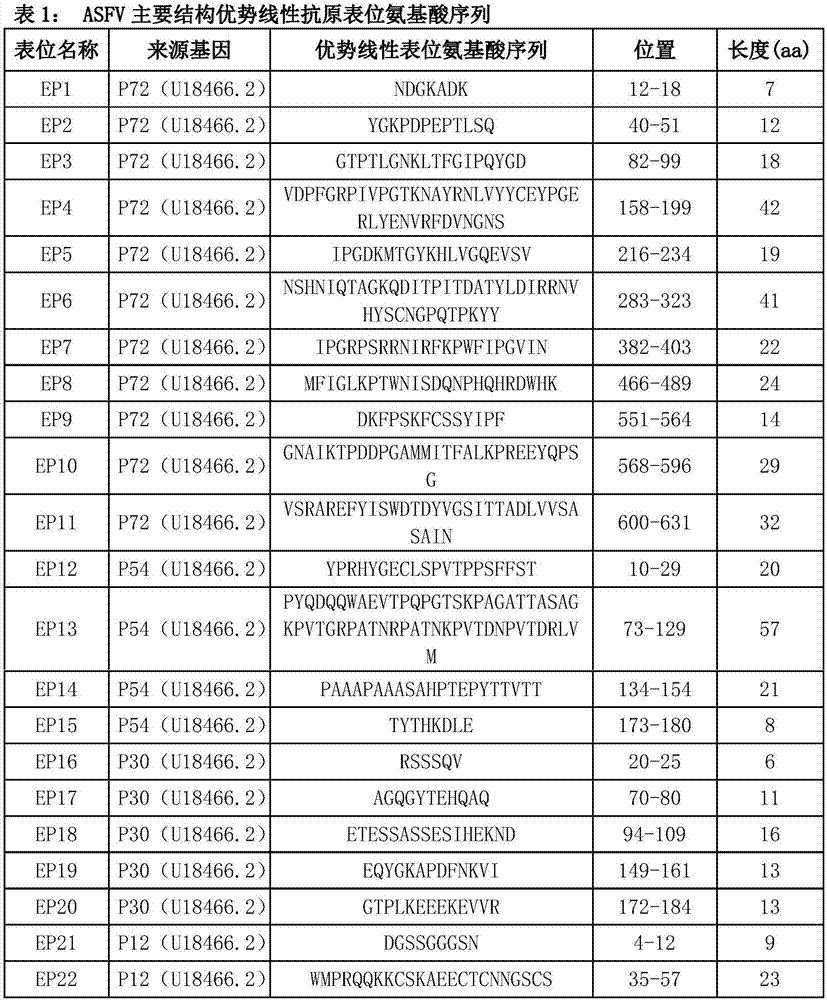
根据ASFV全基因组序列对ASFV重要抗原基因(P72、P54、P30和P12)所编码氨基酸序列的抗原表位进行预测分析,综合四种不同的预测方法寻找出存在共同优势线性抗原表位的序列(表1)。
2、ASFV多表位融合抗原基因的构建。
通过编码柔性氨基酸(GPG)的核苷酸序列(GGCCCGGGC)将编码优势抗原表位的基因按照一定的排列组合串联在一起,构建了6个含有多表位的融合抗原基因(命名为ASFV-meAg 1-6)。经过稀有密码子在线软件 (http://nihserver.mbi.ucla.edu/RACC/)对融合基因ASFV-meAg 1-6中的大肠杆菌稀有密码子进行分析,并用编码相同氨基酸的大肠杆菌偏爱密码子核苷酸替换大肠杆菌的稀有密码子,使最终合成的多表位融合基因中不含有大肠杆菌稀有密码子,以易于重组蛋白在大肠杆菌中表达。
通过上述不同的排列组合方式构建ASFV多表位融合抗原蛋白基因。
3、ASFV多表位融合抗原(ASFV-meAg)基因在大肠杆菌中的表达。
通过标准的分子克隆技术构建pT-ASFV-meAg重组质粒,采用EcoR I和Xho I 分别对pT-ASFV-meAg质粒和pET-28a(+)质粒进行双酶切,采用T4DNA连接酶构建一个pET-ASFV-meAg重组质粒。将该质粒转入感受态细胞E.coli DH5α中,涂布于含有Kan抗性的固体LB平板上,37℃培养12h,挑取单个菌落进行菌液PCR验证,同时提取阳性菌落质粒进行双酶切验证,将筛选的阳性菌进行测序。
将鉴定正确的pET-ASFV-meAg重组表达质粒转化表达工程菌E.coli BL21,37℃培养12h,挑取菌落并用PCR进行筛选,将筛选出的阳性菌转接到含有卡那霉素的液体LB培养基中,37℃培养至OD600nm为0.6~0.8,加入终浓度为1mmol/L的IPTG 进行诱导,诱导8h后收集菌液,同时设置空载体对照和未加IPTG诱导的重组菌作为对照,进行SDS-PAGE电泳分析;同时用ASFV阳性血清作为一抗,HRP标记的兔抗猪IgG酶标抗体为二抗,进行Western blot分析。
根据分析结果找到反应原性最强的蛋白即为本发明的非洲猪瘟病毒(ASFV)多表位融合诊断抗原,即<210>3。
进一步地,ASFV-meAg6多表位融合抗原蛋白最好进行纯化。
按照Ni-NTA Purification System(Invitrogen,USA)说明书进行蛋白的纯化。 Ni柱纯化的重组蛋白ASFV-meAg1终浓度为20mg/mL。
基于ASFV-meAg6抗原蛋白建立间接ELISA方法的建立及条件的优化。
(1)最佳反应条件的确定:
①用0.05M pH 9.6的碳酸盐缓冲液对纯化的蛋白进行稀释,将纯化的重组抗原按64、32、16、8、4和2ug/mL依次作倍比稀释,包被96孔ELISA板,每孔包被 100μL。包被条件:ELISA板包被好后,4℃过夜,取出,PBST洗涤3次,每次3min。
②选用1%明胶、5%脱脂奶粉和5%BSA为封闭液,200μL/孔,37℃分别封闭0.5h、1h、1.5h、2h和4h,洗涤3次。
③ASFV阳性血清分别做1:50、1:100和1:200倍比稀释,100μL/孔,血清作用时间设定为1h,同一样品作3个重复孔,同时作空白对照,洗涤3次。
④酶标抗体先进行1:2 000、1:4000和1:8000稀释,100μL/孔,分别于 37℃反应0.5h、1h和1.5h,洗涤3次。
⑤加入可溶性单组分TMB底物溶液,100μL/孔,37℃避光反应30min,最后加入2M的H2SO4终止反应,100μL/孔,在酶标仪上测定D450nm值。采用方阵滴定法确定最适包被浓度和条件、封闭液的成分和封闭时间、血清和酶标二抗的稀释度和作用时间,底物显色时间等。以阳性血清OD450nm=1,且P/N值最大组合所对应的条件作为间接ELISA最佳工作条件。P/N=(被检血清OD450nm值-空白对照OD450nm值)/(阴性血清OD450nm值-空白对照OD450nm值)。
试验结果表明,当封闭液为5%脱脂奶粉时,阳性血清OD450nm值更接近1.0, P/N值最大,因此选用5%脱脂奶粉为最佳封闭液。当封闭时间为2h时,阳性血清 1:100倍稀释,OD450nm值更接近1.0,P/N值最大,故最佳封闭时间为2h。当酶标抗体的稀释度为1:4000时,阳性血清OD450nm值更接近1.0,且P/N值最大,因此酶标抗体的最适工作浓度为1:4000。当酶标抗体工作时间为1h时,阳性血清 OD450nm值更接近1.0,P/N值为最大,故酶标抗体的最佳工作时间为1h。
基于ASFV-meAg6抗原蛋白建立间接ELISA方法的结果判定。
以30份ASFV阴性血清为样本,按照血清1:100稀释度进行稀释,采用建立的间接ELISA进行检测,测定OD450nm值,计算平均值(X)和标准差(S),按公式:X+3S 作为阴阳性判定标准(cut-off值)。结果30份ASFV阴性血清的OD450nm值在 0.12-0.16之间。经统计学软件对数据进行分析,阴性血清样本的平均值(X)为0.142,标准差(S)为0.031,其置信区间上限cut-off值=X+3S=0.235。
间接ELISA判定标准的确定:样品OD450nm值大于0.235可判为阳性,小于或等于0.235可判为阴性。
基于ASFV-meAg6抗原蛋白的间接ELISA方法特异性和敏感性分析。
(1)特异性试验:用建立的ASFV meAg6-ELISA法对10份猪瘟阳性血清、10猪蓝耳病阳性血清、10份猪圆环病毒病阳性血清、10份猪伪狂犬病阳性血清、10份非洲猪瘟阳性血清进行检测。结果显示,10份非洲猪瘟阳性血清检测结果均为阳性,其余的血清样品检测结果均为阴性,表明重组蛋白ASFV meAg6与其他病毒的阳性血清无交叉反应,具有较高的特异性。
(2)敏感性试验:选择10份ASFV阳性血清,以1:10、1:50、1:100、1:200、 1:400进行倍比稀释,用建立的ASFV meAg6-ELISA法进行检测。当血清稀释度为1:200 时,结果仍为阳性,表明该方法具有良好的敏感性。
ASFV-meAg6-ELISA法与商品化ASFV间接ELISA方法的检测结果的比对
采用ASFV-meAg6-ELISA法和商品化ASFV间接ELISA检测方法(西班牙)对89 份猪血清样品进行ASFV抗体检测。采用SPSS 13.0软件进行数据分析。结果ASFV meAg6-ELISA法和商品化ASFV间接ELISA检出ASFV阳性血清和阴性血清份数见表3。经统计学分析,ASFV meAg6-ELISA法的敏感性和特异性分别为93.94%和94.64%;两种检测方法结果的符合率为94.38%(表3)。两种方法比对结果表明,ASFV-meAg6 具有高特异性和敏感性,是一种有应用价值的ASF血清学诊断抗原蛋白。
进一步地,将所述的非洲猪瘟病毒多表位融合诊断抗原用于制备对由非洲猪瘟病毒(African swine fever virus,ASFV)所引起猪的一种急性、热性、高度接触性传染病的诊断制剂中。
本发明具有如下优点:通过编码柔性肽氨基酸的核苷酸将具有ASFV重要结构蛋白(P72、P54、P30和P12)的优势抗原表位编码基因片段按照一定顺序串联在一起,构建多表位融合抗原基因,制备具有高特异性和敏感性的多表位融合抗原蛋白,为 ASFV血清学诊断方法提供了一个特异性强和敏感性高的诊断抗原蛋白。
附图说明
图1为表1,为实施例中ASFV主要结构优势线性抗原表位氨基酸序列。
图2为表2,为实施例中ASFV主要结构蛋白优势线性抗原表位核苷酸序列。
图3为表3,为实施例中ASFV主要结构蛋白多表位融合蛋白ASFV-Me-Ag的构建策略。
图4为表4,为实施例中ASFV-meAg6-ELISA法与商品化ASFV间接ELISA检测方法结果的比较。
图5-10为实施例中,构建的6个多表位融合抗原(ASFV-meAg)的氨基酸与核苷酸序列。
图5-10中:第1行数据:氨基酸序列;第2行数据:优化前的核苷酸序列;第3 行数据:优化后核苷酸序列。加部分为:柔性肽序列;加删除线“——”部分为:优化前密码子;加下划线“”部分为:优化后密码子。
图11为实施例中重组ASFV-meAg6的SDS-PAGE和Western blot分析结果。
图11中:M:蛋白质分子质量;1:pET28a(+)空载体;2~6:IPTG分别诱导 pET32a-IF-1重组质粒诱导0、4、6、8h;7:纯化的重组抗原蛋白ASFV-meAg6;8: Western blot。
具体实施方式
下面通过具体实施例对本发明进行进一步详述。
1、ASFV重要抗原基因优势抗原表位的预测分析。
根据ASFV全基因组序列(GenBank登录号:U18466.2),利用生物在线软件 ABCPred(http://www.imtech.res.in/raghava/abcpred/)、BepiPred 1.0 Server (http://www.cbs.dtu.dk/services/BepiPred/)、Immunomedicine Group (http://imed.med.ucm.es/Tools/antigenic.pl)及DNAStar-Protean软件对ASFV 重要抗原基因(P72、P54、P30和P12)所编码氨基酸序列的抗原表位进行预测分析,综合四种不同的预测方法寻找出存在共同优势线性抗原表位的序列(表1)。
2、ASFV多表位融合抗原基因的构建。
通过编码柔性氨基酸(GPG)的核苷酸序列(GGCCCGGGC)将编码优势抗原表位的基因按照一定的排列组合串联在一起,构建了6个含有多表位的融合抗原基因(命名为ASFV-meAg 1-6)。经过稀有密码子在线软件 (http://nihserver.mbi.ucla.edu/RACC/)对融合基因ASFV-meAg 1-6中的大肠杆菌稀有密码子进行分析,并用编码相同氨基酸的大肠杆菌偏爱密码子核苷酸替换大肠杆菌的稀有密码子,使最终合成的多表位融合基因中不含有大肠杆菌稀有密码子(图3,序列表),易于重组蛋白在大肠杆菌中表达。通过不同的排列组合方式构建了6个ASFV 多表位融合抗原蛋白基因(ASFV-meAg1、ASFV-meAg2、ASFV-meAg3、ASFV-meAg4、 ASFV-meAg5和ASFV-meAg6)。
3、ASFV多表位融合抗原(ASFV-meAg)基因在大肠杆菌中的表达。
通过标准的分子克隆技术构建pT-ASFV-meAg重组质粒,采用EcoR I和Xho I 分别对pT-ASFV-meAg质粒和pET-28a(+)质粒进行双酶切,采用T4DNA连接酶构建一个pET-ASFV-meAg重组质粒。将该质粒转入感受态细胞E.coli DH5α中,涂布于含有Kan抗性的固体LB平板上,37℃培养12h,挑取单个菌落进行菌液PCR验证,同时提取阳性菌落质粒进行双酶切验证,将筛选的阳性菌送至华大基因生物公司测序。
将鉴定正确的pET-ASFV-meAg重组表达质粒转化表达工程菌E.coli BL21,37℃培养12h,挑取菌落并用PCR进行筛选,将筛选出的阳性菌转接到含有卡那霉素的液体LB培养基中,37℃培养至OD600nm为0.6~0.8,加入终浓度为1mmol/L的IPTG 进行诱导,诱导8h后收集菌液,同时设置空载体对照和未加IPTG诱导的重组菌作为对照,进行SDS-PAGE电泳分析;同时用ASFV阳性血清作为一抗,HRP标记的兔抗猪IgG酶标抗体为二抗,进行Western blot分析。SDS-PAGE分析结果表明,成功获得了ASFV-meAg1、ASFV-meAg2、ASFV-meAg3、ASFV-meAg4、ASFV-meAg5和ASFV-meAg6 六个重组蛋白,分子量在21.5-26.5kDa之间(图2),与预期大小一致。Western blot 分析结果表明,ASFV-meAg6蛋白的反应原性最强,要高于ASFV-meAg1、ASFV-meAg2、 ASFV-meAg3、ASFV-meAg4和ASFV-meAg5。
4、ASFV-meAg6多表位融合抗原蛋白的纯化。
按照Ni-NTA Purification System(Invitrogen,USA)说明书进行蛋白的纯化。 Ni柱纯化的重组蛋白ASFV-meAg1终浓度为20mg/mL。
5、基于ASFV-meAg6抗原蛋白建立间接ELISA方法的建立及条件的优化。
(1)最佳反应条件的确定:
①用0.05M pH 9.6的碳酸盐缓冲液对纯化的蛋白进行稀释,将纯化的重组抗原按64、32、16、8、4和2ug/mL依次作倍比稀释,包被96孔ELISA板,每孔包被 100μL。包被条件:ELISA板包被好后,4℃过夜,取出,PBST洗涤3次,每次3min、
②选用1%明胶、5%脱脂奶粉和5%BSA为封闭液,200μL/孔,37℃分别封闭0.5h、1h、1.5h、2h和4h,洗涤3次。
③ASFV阳性血清分别做1:50、1:100和1:200倍比稀释,100μL/孔,血清作用时间设定为1h,同一样品作3个重复孔,同时作空白对照,洗涤3次。
④酶标抗体先进行1:2 000、1:4000和1:8000稀释,100μL/孔,分别于 37℃反应0.5h、1h和1.5h,洗涤3次。
⑤加入可溶性单组分TMB底物溶液,100μL/孔,37℃避光反应30min,最后加入2M的H2SO4终止反应,100μL/孔,在酶标仪上测定D450nm值。采用方阵滴定法确定最适包被浓度和条件、封闭液的成分和封闭时间、血清和酶标二抗的稀释度和作用时间,底物显色时间等。以阳性血清OD450nm=1,且P/N值最大组合所对应的条件作为间接ELISA最佳工作条件。P/N=(被检血清OD450nm值-空白对照OD450nm值)/(阴性血清OD450nm值-空白对照OD450nm值)。
试验结果表明,当封闭液为5%脱脂奶粉时,阳性血清OD450nm值更接近1.0, P/N值最大,因此选用5%脱脂奶粉为最佳封闭液。当封闭时间为2h时,阳性血清 1:100倍稀释,OD450nm值更接近1.0,P/N值最大,故最佳封闭时间为2h。当酶标抗体的稀释度为1:4000时,阳性血清OD450nm值更接近1.0,且P/N值最大,因此酶标抗体的最适工作浓度为1:4000。当酶标抗体工作时间为1h时,阳性血清 OD450nm值更接近1.0,P/N值为最大,故酶标抗体的最佳工作时间为1h。
6、基于ASFV-meAg6抗原蛋白建立间接ELISA方法的结果判定。
以30份ASFV阴性血清为样本,按照血清1:100稀释度进行稀释,采用建立的间接ELISA进行检测,测定OD450nm值,计算平均值(X)和标准差(S),按公式:X+3S 作为阴阳性判定标准(cut-off值)。结果30份ASFV阴性血清的OD450nm值在 0.12-0.16之间。经统计学软件对数据进行分析,阴性血清样本的平均值(X)为0.142,标准差(S)为0.031,其置信区间上限cut-off值=X+3S=0.235。
间接ELISA判定标准的确定:样品OD450nm值大于0.235可判为阳性,小于或等于0.235可判为阴性。
7、基于ASFV-meAg6抗原蛋白的间接ELISA方法特异性和敏感性分析。
(1)特异性试验:用建立的ASFV meAg6-ELISA法对10份猪瘟阳性血清、10猪蓝耳病阳性血清、10份猪圆环病毒病阳性血清、10份猪伪狂犬病阳性血清、10份非洲猪瘟阳性血清进行检测。结果显示,10份非洲猪瘟阳性血清检测结果均为阳性,其余的血清样品检测结果均为阴性,表明重组蛋白ASFV meAg6与其他病毒的阳性血清无交叉反应,具有较高的特异性。
(2)敏感性试验:选择10份ASFV阳性血清,以1:10、1:50、1:100、1:200、 1:400进行倍比稀释,用建立的ASFV meAg6-ELISA法进行检测。当血清稀释度为1:200 时,结果仍为阳性,表明该方法具有良好的敏感性。
8、ASFV-meAg6-ELISA法与商品化ASFV间接ELISA方法的检测结果的比对。
采用ASFV-meAg6-ELISA法和商品化ASFV间接ELISA检测方法(西班牙)对89 份猪血清样品进行ASFV抗体检测。采用SPSS 13.0软件进行数据分析。结果ASFV meAg6-ELISA法和商品化ASFV间接ELISA检出ASFV阳性血清和阴性血清份数见表3。经统计学分析,ASFV meAg6-ELISA法的敏感性和特异性分别为93.94%和94.64%;两种检测方法结果的符合率为94.38%(表3)。两种方法比对结果表明,ASFV-meAg6 具有高特异性和敏感性,是一种有应用价值的ASF血清学诊断抗原蛋白。
以上仅是本发明的优选实施方式,应当指出的是,上述优选实施方式不应视为对本发明的限制,本发明的保护范围应当以权利要求所限定的范围为准。对于本技术领域的普通技术人员来说,在不脱离本发明的精神和范围内,还可以做出若干改进和润饰也应视为本发明的保护范围。
<110> 石河子大学
<120> 非洲猪瘟病毒多表位融合诊断抗原及其制备方法和用途
<141>
<160> 3
<210> 1
<211> 167
<212> 氨基酸序列
<213> 非洲猪瘟病毒(African swine fever virus, ASFV)
<220>
<221> misc_feature
<223> ASFV-meAg6蛋白氨基酸序列
<400> 1
MRSSSQVGPGGTPTLGNKLTFGIPQYGDGPGDGSSGGGSNGPGYGKPDPEPTLSQGPGMFIGLKPTWNISDQNPHQHRDWHKGPGAGQGYTEHQAQGPGWMPRQQKKCSKAEECTCNNGSCSGPGPAAAPAAASAHPTEPYTTVTTGPGNDGKADKGPGTYTHKDLE
<210> 2
<211> 504
<212> 核苷酸序列
<213> ASFV-meAg6蛋白基因(密码子未优化)
<220>
<221> misc_feature
<223>ASFV-meAg6蛋白基因核苷酸序列
<400> 1
ATGAGATCATCTTCACAAGTTGGCCCGGGCGGTACCCCCACCTTGGGAAACAAGCTTACCTTTGGTATTCCCCAGTACGGAGACGGCCCGGGCGATGGTTCAAGTGGTGGAGGCTCTAATGGCCCGGGCTATGGGAAACCCGACCCCGAACCCACTTTGAGTCAAGGCCCGGGCATGTTTATAGGATTAAAACCTACCTGGAACATCTCCGATCAAAATCCTCATCAACACCGAGATTGGCACAAGGGCCCGGGCGCAGGGCAAGGGTATACTGAACATCAGGCTCAAGGCCCGGGCTGGATGCCCCGCCAGCAAAAAAAATGTAGCAAGGCTGAAGAATGCACATGTAATAACGGAAGCTGTTCCGGCCCGGGCCCAGCGGCCGCACCTGCGGCCGCGAGTGCTCATCCGACTGAGCCTTACACGACAGTCACTACTGGCCCGGGCAACGATGGGAAGGCCGACAAGGGCCCGGGCACCTATACGCATAAAGACCTAGAATAA
<210> 3
<211> 504
<212>核苷酸序列
<213> ASFV-meAg6蛋白基因(密码子优化后)
<220>
<221> misc_feature
<223> ASFV-meAg6蛋白基因核苷酸序列
<400> 1
ATGCGTTCATCTTCACAAGTTGGCCCGGGCGGTACCCCGACCTTGGGAAACAAGCTTACCTTTGGTATTCCGCAGTACGGAGACGGCCCGGGCGATGGTTCAAGTGGTGGAGGCTCTAATGGCCCGGGCTATGGGAAACCGGACCCGGAACCGACTTTGAGTCAAGGCCCGGGCATGTTTATCGGATTAAAACCTACCTGGAACATCTCCGATCAAAATCCTCATCAACACCGTGATTGGCACAAGGGCCCGGGCGCAGGGCAAGGGTATACTGAACATCAGGCTCAAGGCCCGGGCTGGATGCCGCGCCAGCAAAAAAAATGTAGCAAGGCTGAAGAATGCACATGTAATAACGGAAGCTGTTCCGGCCCGGGCCCAGCGGCCGCACCTGCGGCCGCGAGTGCTCATCCGACTGAGCCTTACACGACAGTCACTACTGGCCCGGGCAACGATGGGAAGGCCGACAAGGGCCCGGGCACCTATACGCATAAAGACCTAGAATAA
- 还没有人留言评论。精彩留言会获得点赞!
- 一种非洲猪瘟病毒检测用酶标板清洗装置的制造方法
- 非洲猪瘟病毒cp530r基因的荧光pcr检测试剂及其制备方法与用图
- 非洲猪瘟病毒、猪瘟病毒和猪繁殖与呼吸综合症病毒的三重荧光rt-pcr检测试剂及其制 ...的制作方法
- 非洲猪瘟病毒cp204l基因的荧光pcr检测试剂及其制备方法与用图
- 非洲猪瘟病毒和猪繁殖与呼吸综合症病毒的二重荧光rt-pcr检测试剂及其制备方法与用图
- 低血清培养st细胞生产猪瘟c株病毒的方法
- 一种非洲猪瘟抗原及其制备的荧光纳米晶试纸条的制作方法
- 非洲猪瘟病毒vp73蛋白特异性多克隆抗体的制备方法及应用的制作方法
- 一种抗非洲猪瘟病毒的特异性IgY抗体及制备方法和用途
- 一种利用间接免疫荧光检测猪瘟活疫苗病毒含量的方法