改造丝心蛋白的制作方法
本发明涉及改造丝心蛋白。更具体而言,本发明涉及甘氨酸残基的含量降低的改造丝心蛋白。另外,本发明还涉及编码改造丝心蛋白的核酸、包含该核酸序列的表达载体、利用该表达载体进行了转化的宿主和由改造丝心蛋白制造的产品。
背景技术:
丝心蛋白为纤维状蛋白质之一,其含有最多达90%的与b片层的形成相关的甘氨酸残基、丙氨酸残基和丝氨酸残基(非专利文献1)。作为丝心蛋白,已知有构成昆虫和蜘蛛类产生的丝的蛋白质(蚕丝蛋白、蜂丝蛋白、蛛丝蛋白)等。
蚕丝蛋白具有优良的机械特性、吸湿特性和除臭特性,是广泛作为衣服原料使用的原材料。另外,蚕丝为免疫耐受的天然纤维,生物亲和性高,因此也用于手术用缝合线等用途。
蜘蛛存在最多达7种的丝腺,分别产生性质不同的丝心蛋白(蛛丝蛋白)。蛛丝蛋白根据其来源的器官被命名为具有高韧性的大壶状腺丝蛋白(majorampullatespiderprotein、masp)、具有高度伸长力的小壶状腺丝蛋白(minorampullatespiderprotein、misp)、以及鞭状腺(flagelliform(flag))、管状腺(tubuliform)、聚合腺(aggregate)、葡萄状腺(aciniform)和梨状腺(pyriform)的各蛛丝蛋白。特别是对由于具有优良的强度(应力和韧度)和伸度而具有高韧性的大壶状腺丝蛋白,集中进行了结构的研究(专利文献1和专利文献2)。
作为丝心蛋白的特异性结构之一,已知有分类为gpgxx、富含丙氨酸残基的伸长区域((a)n或(ga)n)、ggx和间隔区的氨基酸基序重复而成的结构(非专利文献2)。另外,据报道,通过用(a)n基序置换(ga)n基序,伸度减小,但拉伸强度增加;通过增加gpgxx基序的数量,伸度增加;通过用(a)n基序置换若干个gpgxx基序,拉伸强度增加(专利文献2)。另外,认为ggx和gpgxx基序呈对丝赋予弹性的挠性螺旋结构(专利文献3)。
利用一些异种蛋白生产系统产生了重组蛛丝蛋白和重组蚕丝蛋白。例如,利用了转基因山羊、转基因家蚕、或者重组植物或哺乳类细胞(非专利文献3)。但是,这些生产系统的生产速度慢,不适合于与商业水平相应的大量生产(专利文献4和5)。作为能够进行大量生产的生产系统,也报道了很多利用酵母、霉菌、革兰氏阴性细菌、革兰氏阳性细菌等生物进行的重组丝心蛋白生产并取得了一定的成果,但尚未达到能够在工业上大量生产伸度和拉伸强度优良的重组丝心蛋白的程度(专利文献5)。
现有技术文献
专利文献
专利文献1:日本特开2012-55269号公报
专利文献2:日本特表2005-502347号公报
专利文献3:日本特表2009-505668号公报
专利文献4:日本特表2014-502140号公报
专利文献5:国际公开第2015/042164号
非专利文献
非专利文献1:asakura等,encyclopediaofagriculturalscience,美国学术出版社:纽约,ny,1994年,vol.4,pp.1-11
非专利文献2:microbialcellfactories,2004年,3:14
非专利文献3:science,2002年,295卷,pp.472-476
技术实现要素:
发明所要解决的问题
丝心蛋白由于其优良的特性,作为医疗、航空、衣料等各种产业领域中的新材料而受到关注。但是,为了实现与商业水平相应的生产量,需要进一步提高丝心蛋白的生产率。
本发明的目的在于提供在维持丝心蛋白的强度和伸度的同时生产率提高的改造丝心蛋白。
用于解决问题的方法
本发明人对能够在工业上进行大量生产的方法进行了各种研究,结果发现,通过改变被认为与丝心蛋白的伸长相关的ggx基序或gpgxx基序而降低甘氨酸残基的含量,令人意外地能够在维持强度(应力和韧度)和伸度的状态下提高生产率。本发明是基于该新发现而进行的。
即,本发明涉及例如下述各发明。
[1]一种改造丝心蛋白,其为包含式1:[(a)n基序-rep]m所表示的结构域序列的改造丝心蛋白,
上述结构域序列具有与天然来源的丝心蛋白相比相当于至少rep中的一个或两个以上甘氨酸残基被置换为其他氨基酸残基的、甘氨酸残基的含量降低的氨基酸序列。
[式1中,(a)n基序表示由4~20个氨基酸残基构成的氨基酸序列,并且(a)n基序中丙氨酸残基数相对于总氨基酸残基数为83%以上。rep表示由10~200个氨基酸残基构成的氨基酸序列。m表示8~300的整数。两个以上存在的(a)n基序彼此可以为相同的氨基酸序列,也可以为不同的氨基酸序列。两个以上存在的rep彼此可以为相同的氨基酸序列,也可以为不同的氨基酸序列。]
[2]如[1]所述的改造丝心蛋白,其中,上述结构域序列具有与天然来源的丝心蛋白相比相当于在rep中的选自ggx和gpgxx(其中,x表示甘氨酸以外的氨基酸残基)中的至少一种基序序列中至少一个或两个以上该基序序列中的一个甘氨酸残基被置换为其他氨基酸残基的氨基酸序列。
[3]如[2]所述的改造丝心蛋白,其中,相对于全部基序序列,甘氨酸残基被置换为其他氨基酸残基的基序序列的比例为10%以上。
[4]一种改造丝心蛋白,其为包含式1:[(a)n基序-rep]m所表示的结构域序列的改造丝心蛋白,
将从上述结构域序列中除去位于最靠c末端侧的(a)n基序至上述结构域序列的c末端为止的序列而得到的序列中的全部rep中含有的由xgx(其中,x表示甘氨酸以外的氨基酸残基)构成的氨基酸序列的总氨基酸残基数设为z、将从上述结构域序列中除去位于最靠c末端侧的(a)n基序至上述结构域序列的c末端为止的序列而得到的序列中的总氨基酸残基数设为w时,z/w为50.9%以上。
[式1中,(a)n基序表示由4~20个氨基酸残基构成的氨基酸序列,并且(a)n基序中丙氨酸残基数相对于总氨基酸残基数为83%以上。rep表示由10~200个氨基酸残基构成的氨基酸序列。m表示8~300的整数。两个以上存在的(a)n基序彼此可以为相同的氨基酸序列,也可以为不同的氨基酸序列。两个以上存在的rep彼此可以为相同的氨基酸序列,也可以为不同的氨基酸序列。]
[5]如[1]~[4]中任一项所述的改造丝心蛋白,其中,具有与天然来源的丝心蛋白相比在相当于rep中的一个或两个以上甘氨酸残基被置换为其他氨基酸残基的基础上、相当于进一步置换、缺失、插入和/或添加有一个或两个以上氨基酸残基的氨基酸序列。
[6]如[5]所述的改造丝心蛋白,其中,上述天然来源的丝心蛋白为昆虫或蜘蛛类来源的丝心蛋白。
[7]如[5]所述的改造丝心蛋白,其中,上述天然来源的丝心蛋白为蜘蛛类的大壶状腺丝蛋白(masp)或小壶状腺丝蛋白(misp)。
[8]如[5]~[7]中任一项所述的改造丝心蛋白,其中,上述结构域序列具有与上述天然来源的丝心蛋白相比相当于在rep中的选自ggx和gpgxx(其中,x表示甘氨酸以外的氨基酸残基)中的至少一种基序序列中至少一个或两个以上该基序序列中的一个甘氨酸残基被置换为其他氨基酸残基的氨基酸序列,并且,甘氨酸残基被置换为其他氨基酸残基的基序序列相对于全部基序序列的比例为10%以上。
[9]如[8]所述的改造丝心蛋白,其中,上述其他氨基酸残基为选自由谷氨酰胺(q)残基、缬氨酸(v)残基、亮氨酸(l)残基、异亮氨酸(i)残基、甲硫氨酸(m)残基、脯氨酸(p)残基、苯丙氨酸(f)残基、色氨酸(w)残基、天冬酰胺(n)残基、丝氨酸(s)残基、赖氨酸(k)残基和谷氨酸(e)残基组成的组中的氨基酸残基。
[10]如[8]所述的改造丝心蛋白,其中,上述其他氨基酸残基为谷氨酰胺(q)残基。
[11]如[1]~[10]中任一项所述的改造丝心蛋白,其中,上述结构域序列具有与天然来源的丝心蛋白相比进一步相当于至少一个或两个以上(a)n基序发生了缺失的、(a)n基序的含量降低的氨基酸序列。
[12]如[11]所述的改造丝心蛋白,其中,上述结构域序列具有与天然来源的丝心蛋白相比相当于从n末端侧向c末端侧至少每1~3个(a)n基序中一个(a)n基序发生了缺失的氨基酸序列。
[13]如[11]所述的改造丝心蛋白,其中,上述结构域序列具有与天然来源的丝心蛋白相比相当于从n末端侧向c末端侧至少依次重复发生了两个连续的(a)n基序的缺失和一个(a)n基序的缺失的氨基酸序列。
[14]如[11]~[13]中任一项所述的改造丝心蛋白,其中,从n末端侧向c末端侧将相邻的两个[(a)n基序-rep]单元的rep的氨基酸残基数依次进行比较,将氨基酸残基数少的rep的氨基酸残基数设为1时、另一者的rep的氨基酸残基数之比为1.8~11.3的上述相邻的两个[(a)n基序-rep]单元的氨基酸残基数相加得到的合计值设为x,将上述结构域序列的总氨基酸残基数设为y时,x/y的最大值为20%以上。
[15]一种改造丝心蛋白,其包含序列号3、序列号4或序列号10所表示的氨基酸序列、或者与序列号3、序列号4或序列号10所表示的氨基酸序列具有90%以上的序列一致性的氨基酸序列。
[16]如[1]~[15]中任一项所述的改造丝心蛋白,其中,进一步在n末端和c末端中的任意一个末端或两个末端包含标签序列。
[17]如[16]所述的改造丝心蛋白,其中,上述标签序列包含序列号5所表示的氨基酸序列。
[18]一种改造丝心蛋白,其包含序列号8、序列号9或序列号11所表示的氨基酸序列、或者与序列号8、序列号9或序列号11所表示的氨基酸序列具有90%以上的序列一致性的氨基酸序列。
[19]一种核酸,其编码[1]~[18]中任一项所述的改造丝心蛋白。
[20]一种核酸,其在严格条件下与[19]所述的核酸的互补链杂交,并且编码包含式1:[(a)n基序-rep]m所表示的结构域序列的改造丝心蛋白。
[式1中,(a)n基序表示由4~20个氨基酸残基构成的氨基酸序列,并且(a)n基序中丙氨酸残基数相对于总氨基酸残基数为83%以上。rep表示由10~200个氨基酸残基构成的氨基酸序列。m表示8~300的整数。两个以上存在的(a)n基序彼此可以为相同的氨基酸序列,也可以为不同的氨基酸序列。两个以上存在的rep彼此可以为相同的氨基酸序列,也可以为不同的氨基酸序列。]
[21]一种核酸,其与[19]所述的核酸具有90%以上的序列一致性,并且编码包含式1:[(a)n基序-rep]m所表示的结构域序列的改造丝心蛋白。
[式1中,(a)n基序表示由4~20个氨基酸残基构成的氨基酸序列,并且(a)n基序中丙氨酸残基数相对于总氨基酸残基数为83%以上。rep表示由10~200个氨基酸残基构成的氨基酸序列。m表示8~300的整数。两个以上存在的(a)n基序彼此可以为相同的氨基酸序列,也可以为不同的氨基酸序列。两个以上存在的rep彼此可以为相同的氨基酸序列,也可以为不同的氨基酸序列。]
[22]一种表达载体,其具有[19]~[21]中任一项所述的核酸序列和以能够工作的方式与该核酸序列连接的一个或两个以上调节序列。
[23]如[22]所述的表达载体,其中,上述表达载体为质粒载体或病毒载体。
[24]一种宿主,其是利用[22]或[23]所述的表达载体进行转化而得到的。
[25]如[24]所述的宿主,其中,上述宿主为原核生物。
[26]如[25]所述的宿主,其中,上述原核生物为属于选自由埃希氏菌属、短芽孢杆菌属、沙雷氏菌属、芽孢杆菌属、分枝杆菌属、短杆菌属、棒杆菌属属和假单胞菌属组成的组中的属的微生物。
[27]如[24]所述的宿主,其中,上述宿主为真核生物。
[28]如[27]所述的宿主,其中,上述真核生物为酵母、丝状真菌或昆虫细胞。
[29]如[28]所述的宿主,其中,上述酵母为属于选自由酵母属、裂殖酵母属、克鲁维酵母属、丝孢酵母属、许旺酵母属、毕赤酵母属、假丝酵母属、耶氏酵母属和汉逊酵母属组成的组中的属的酵母。
[30]如[29]所述的宿主,其中,属于上述酵母属的酵母为酿酒酵母(saccharomycescerevisiae),属于上述裂殖酵母属的酵母为粟酒裂殖酵母(schizosaccharomycespombe),属于上述克鲁维酵母属的酵母为乳酸克鲁维酵母(kluyveromyceslactis),属于上述丝孢酵母属的酵母为出芽丝孢酵母(trichosporonpullulans),属于上述许旺酵母属的酵母为河岸许旺酵母(schwanniomycesalluvius),属于上述毕赤酵母属的酵母为巴斯德毕赤酵母(pichiapastoris),属于上述假丝酵母属的酵母为白假丝酵母(candidaalbicans),属于上述耶氏酵母属的酵母为解脂耶氏酵母(yarrowialipolytica),属于上述汉逊酵母属的酵母为多形汉逊酵母(hansenulapolymorpha)。
[31]如[28]所述的宿主,其中,上述丝状真菌为属于选自由曲霉属、青霉属和毛霉属组成的组中的属的丝状真菌。
[32]如[31]所述的宿主,其中,属于上述曲霉属的丝状真菌为米曲霉,属于上述青霉属的丝状真菌为产黄青霉,属于上述毛霉属的丝状真菌为易脆毛霉。
[33]如[28]所述的宿主,其中,上述昆虫细胞为鳞翅类的昆虫细胞。
[34]如[28]所述的宿主,其中,上述昆虫细胞为草地夜蛾(spodopterafrugiperda)来源的昆虫细胞或粉纹夜蛾(trichoplusiani)来源的昆虫细胞。
[35]一种产品,其包含[1]~[18]中任一项所述的改造丝心蛋白,并选自由纤维、丝、长丝、膜、发泡体、球体、纳米纤丝、水凝胶、树脂及其等效物组成的组。
发明效果
根据本发明,能够提供在维持丝心蛋白的强度和伸度的同时生产率提高的改造丝心蛋白。丝心蛋白的ggx基序和gpgxx基序被认为与丝心蛋白纤维的伸度相关,因此认为将这些基序的甘氨酸残基(g)置换为其他氨基酸残基会对该丝心蛋白纤维的伸度产生很大影响。但是,本发明人发现,即使将ggx基序和gpgxx基序中的一个g置换为其他氨基酸,通过使另一个g残留,也不会影响丝心蛋白纤维的伸度,并且能够显著提高重组蛋白生产系统中的生产量。根据本发明,发挥出这样的预料不到的效果。
附图说明
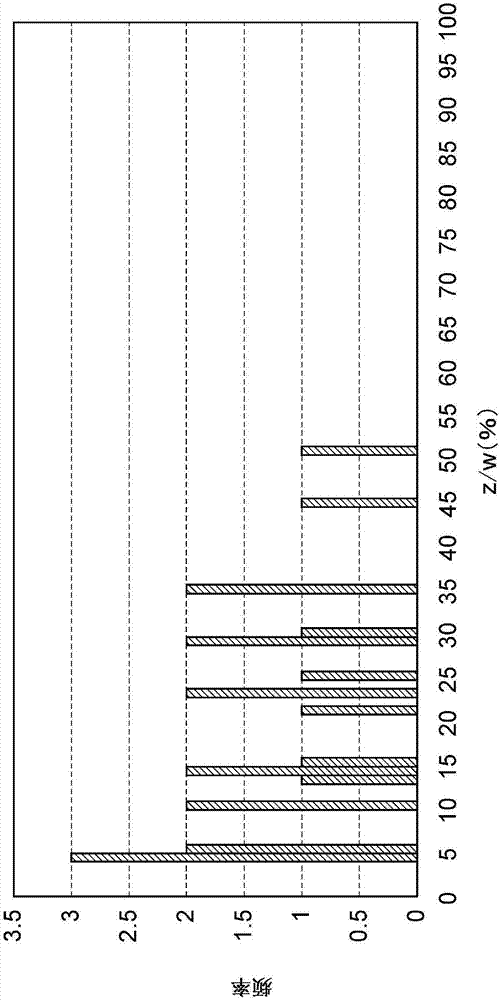
图1是示出天然来源的丝心蛋白的z/w(%)的值的分布的图。
图2是示出改造丝心蛋白的结构域序列的示意图。
图3是示出天然来源的丝心蛋白的x/y(%)的值的分布的图。
具体实施方式
以下,对本具体实施方式详细进行说明。但是,本发明并不限定于以下的实施方式。
[改造丝心蛋白]
本发明的改造丝心蛋白为包含式1:[(a)n基序-rep]m所表示的结构域序列的蛋白质。改造丝心蛋白可以在结构域序列的n末端侧和c末端侧中的任意一个末端侧或两个末端侧进一步附加有氨基酸序列(n末端序列和c末端序列)。n末端序列和c末端序列典型地为不具有丝心蛋白所特有的重复氨基酸基序的区域,由约100个残基的氨基酸构成,但不限于此。
在本说明书中,“改造丝心蛋白”是指其结构域序列与天然来源的丝心蛋白的氨基酸序列不同的丝心蛋白。另外,本说明书中所说的“天然来源的丝心蛋白”也是包含式1:[(a)n基序-rep]m所表示的结构域序列的蛋白质。
“改造丝心蛋白”只要具有本发明中指定的氨基酸序列即可,可以为依据天然来源的丝心蛋白对其氨基酸序列进行改造而得到的丝心蛋白(例如,通过对克隆出的天然来源的丝心蛋白的基因序列进行改造来改造氨基酸序列而得到的丝心蛋白),另外也可以为不依赖于天然来源的丝心蛋白而人为地设计和合成的丝心蛋白(例如,通过化学合成编码所设计的氨基酸序列的核酸而具有所期望的氨基酸序列的丝心蛋白)。
在本说明书中,“结构域序列”为生成丝心蛋白特有的结晶区(典型地,相当于氨基酸序列的(a)n基序)和非晶区(典型地,相当于氨基酸序列的rep)的氨基酸序列,是指式1:[(a)n基序-rep]m所表示的氨基酸序列。在此,(a)n基序表示由4~20个氨基酸残基构成的氨基酸序列,并且(a)n基序中丙氨酸残基数相对于总氨基酸残基数为83%以上。rep表示由10~200个氨基酸残基构成的氨基酸序列。m表示8~300的整数。两个以上存在的(a)n基序彼此可以为相同的氨基酸序列,也可以为不同的氨基酸序列。两个以上存在的rep彼此可以为相同的氨基酸序列,也可以为不同的氨基酸序列。
关于(a)n基序,只要(a)n基序中丙氨酸残基数相对于总氨基酸残基数为83%以上即可,优选为86%以上,更优选为90%以上,进一步优选为95%以上,进一步更优选为100%(是指仅由丙氨酸残基构成的情况)。在结构域序列中两个以上存在的(a)n基序优选至少7个仅由丙氨酸残基构成。仅由丙氨酸残基构成是指(a)n基序具有(a)n(a表示丙氨酸残基,n表示4~20的整数、优选表示4~16的整数)所表示的氨基酸序列。
一个实施方式的改造丝心蛋白中,其结构域序列具有与天然来源的丝心蛋白相比甘氨酸残基的含量降低的氨基酸序列。该改造丝心蛋白可以具有与天然来源的丝心蛋白相比相当于至少rep中的一个或两个以上甘氨酸残基被置换为其他氨基酸残基的氨基酸序列。
本实施方式的改造丝心蛋白优选其结构域序列具有与天然来源的丝心蛋白相比相当于在rep中的选自ggx和gpgxx(其中,x表示甘氨酸以外的氨基酸残基)中的至少一种基序序列中至少一个或两个以上该基序序列中的一个甘氨酸残基被置换为其他氨基酸残基的氨基酸序列。由此,更进一步显著发挥本发明所带来的效果。
本实施方式的改造丝心蛋白更优选上述甘氨酸残基被置换为其他氨基酸残基的基序序列的比例相对于全部基序序列为10%以上。由此,能够更稳定地发挥下述本发明所带来的效果:能够在不减小伸度的情况下显著提高重组蛋白生产系统中的生产量。
本实施方式的改造丝心蛋白在上述的与rep中的甘氨酸残基相关的改造的基础上,可以进一步具有与天然来源的丝心蛋白相比相当于置换、缺失、插入和/或添加有一个或两个以上氨基酸残基的氨基酸序列的改造。
本实施方式的改造丝心蛋白例如可以通过从克隆出的天然来源的丝心蛋白的基因序列中将rep中的一个或两个以上甘氨酸残基置换为其他氨基酸残基而得到。另外,例如也可以通过设计相当于从天然来源的丝心蛋白的氨基酸序列中将rep中的一个或两个以上甘氨酸残基置换为其他氨基酸残基的氨基酸序列,并化学合成编码所设计的氨基酸序列的核酸而得到。在任意一种情况下,都可以在相当于从天然来源的丝心蛋白的氨基酸序列中将rep中的一个或两个以上甘氨酸残基置换为其他氨基酸残基的改造的基础上,进一步进行相当于置换、缺失、插入和/或添加有一个或两个以上氨基酸残基的氨基酸序列的改造。氨基酸残基的置换、缺失、插入和/或添加可以利用定点诱变法等本领域技术人员公知的方法进行。具体而言,可以依据acidres.10,6487(1982);methodsinenzymology,100,448(1983)等文献中记载的方法进行。
天然来源的丝心蛋白为包含式1:[(a)n基序-rep]m所表示的结构域序列的蛋白质,具体而言,可以列举例如昆虫或蜘蛛类产生的丝心蛋白。
作为昆虫产生的丝心蛋白,可以列举例如家蚕(bombyxmori)、野桑蚕(bombyxmandarina)、天蚕(antheraeayamamai)、柞蚕(anteraeapernyi)、枫蚕(eriogynapyretorum)、蓖麻蚕(pilosamiacynthiaricini)、樗蚕(samiacynthia)、樟蚕(caligurajaponica)、印度柞蚕(antheraeamylitta)、琥珀蚕(antheraeaassama)等蚕产生的蚕丝蛋白、雀蜂(vespasimillimaxanthoptera)的幼虫吐出的蜂丝蛋白。
作为昆虫产生的丝心蛋白的更具体的示例,可以列举例如蚕·丝心蛋白l链(genbank登录号m76430(碱基序列)、aaa27840.1(氨基酸序列))。
作为蜘蛛类产生的丝心蛋白,可以列举例如大腹园蛛、十字园蛛、肥胖园蛛、五纹园蛛和野岛园蛛(araneusnojimai)等属于园蛛属(araneus属)的蜘蛛、青新园蛛、嗜水新园蛛、灌木新园蛛和类青新园蛛等属于新园蛛属(neoscona属)的蜘蛛、小岬蛛等属于岬蛛属(pronus属)的蜘蛛、蟾蜍曲腹蛛和对称曲腹蛛等属于曲腹蛛属(cyrtarachne属)的蜘蛛、库氏棘腹蛛和乳突棘腹蛛等属于棘腹蛛属(gasteracantha属)的蜘蛛、何氏瘤腹蛛和六刺瘤腹蛛等属于瘤腹蛛属(ordgarius属)的蜘蛛、悦目金蛛、小悦目金蛛和横纹金蛛等属于金蛛属(argiope属)的蜘蛛、双峰尾园蛛等属于尾园蛛属(arachnura属)的蜘蛛、褐吊叶蛛等属于吊叶蛛属(acusilas属)的蜘蛛、红云斑蛛、花云斑蛛和全色云斑蛛等属于云斑蛛属(cytophora属)的蜘蛛、丑锥头蛛等属于锥头蛛属(poltys属)的蜘蛛、八瘤艾蛛、四突艾蛛、圆腹艾蛛和黑尾艾蛛等属于艾蛛属(cyclosa属)的蜘蛛和日本壮头蛛等属于壮头蛛属(chorizopes属)的蜘蛛所产生的蛛丝蛋白、以及前齿肖蛸、锥腹肖蛸、直伸肖蛸和鳞纹肖蛸等属于肖蛸属(tetragnatha属)的蜘蛛、纵条银鳞蛛、肩斑银鳞蛛和小肩斑银鳞蛛等属于银鳞蛛属(leucauge属)的蜘蛛、棒络新妇和斑络新妇等属于络新妇属(nephila属)的蜘蛛、美丽麦蛛等属于麦蛛属(menosira属)的蜘蛛、柔弱粗螯蛛等属于锯螯蛛属(dyschiriognatha属)的蜘蛛、红斑寇蛛、哈氏寇蛛、几何寇蛛和间斑寇蛛等属于冠蛛属(latrodectus属)的蜘蛛、以及属于育儿网蛛属(euprosthenops属)的蜘蛛等属于肖蛸科(tetragnathidae科)的蜘蛛所产生的蛛丝蛋白。作为蛛丝蛋白,可以列举例如masp(masp1和masp2)、adf(adf3和adf4)等牵引丝蛋白、misp(misp1和misp2)等。
作为蜘蛛类产生的丝心蛋白的更具体的示例,可以列举例如丝心蛋白-3(adf-3)[十字园蛛(araneusdiadematus)来源](genbank登录号aac47010(氨基酸序列)、u47855(碱基序列))、丝心蛋白-4(adf-4)[十字园蛛来源](genbank登录号aac47011(氨基酸序列)、u47856(碱基序列))、牵引丝蛋白蛛丝蛋白1[金纺蜘蛛(nephilaclavipes)来源](genbank登录号aac04504(氨基酸序列)、u37520(碱基序列))、大壶状腺蛛丝蛋白1[黑寡妇蜘蛛(latrodectushesperus)来源](genbank登录号abr68856(氨基酸序列)、ef595246(碱基序列))、牵引丝蛋白蛛丝蛋白2[棒络新妇(nephilaclavata)来源](genbank登录号aal32472(氨基酸序列)、af441245(碱基序列))、大壶状腺蛛丝蛋白1[非洲育儿网蛛(euprosthenopsaustralis)来源](genbank登录号caj00428(氨基酸序列)、aj973155(碱基序列))和大壶状腺蛛丝蛋白2[非洲育儿网蛛](genbank登录号cam32249.1(氨基酸序列)、am490169(碱基序列))、小壶状腺丝蛋白1[金纺蜘蛛](genbank登录号aac14589.1(氨基酸序列))、小壶状腺丝蛋白2[金纺蜘蛛](genbank登录号aac14591.1(氨基酸序列))、小壶状腺蛛丝蛋白样蛋白质[nephilengyscruentata](genbank登录号abr37278.1(氨基酸序列)等。
作为天然来源的丝心蛋白的更具体的示例,可以进一步列举在ncbigenbank中登记了序列信息的丝心蛋白。例如,可以通过从ncbigenbank中登记的序列信息中包含inv作为分类码(division)的序列中提取出在定义(definition)中记载了蛛丝蛋白、壶状腺、丝心蛋白、“丝和多肽”或“丝和蛋白质”作为关键词的序列、从cds中提取出指定产物的字符串、从来源数据(source)中提取出在组织类型(tissuetype)中记载了指定字符串的序列来确认。
另一实施方式的改造丝心蛋白包含式1:[(a)n基序-rep]m所表示的结构域序列,并具有下述氨基酸序列:将从上述结构域序列中除去位于最靠c末端侧的(a)n基序至上述结构域序列的c末端为止的序列而得到的序列中的全部rep中含有的由xgx(其中,x表示甘氨酸以外的氨基酸残基)构成的氨基酸序列的总氨基酸残基数设为z、将从上述结构域序列中除去位于最靠c末端侧的(a)n基序至上述结构域序列的c末端为止的序列而得到的序列中的总氨基酸残基数设为w时,z/w为50.9%以上。本实施方式的改造丝心蛋白的甘氨酸残基的含量降低,因此相当于由xgx构成的氨基酸序列的含有比例的z/w的值落入上述范围的比例提高。
本实施方式的改造丝心蛋白优选通过将ggx基序的一个甘氨酸残基置换为其他氨基酸残基而提高由xgx构成的氨基酸序列的含有比例。本实施方式的改造丝心蛋白的结构域序列中的由ggx构成的氨基酸序列的含有比例优选为6%以下,更优选为4%以下,进一步优选为2%以下。结构域序列中的由ggx构成的氨基酸序列的含有比例可以利用与下述由xgx构成的氨基酸序列的含有比例(z/w)的计算方法同样的方法算出。
进一步详细地说明z/w的计算方法。首先,自从结构域序列中除去位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列而得到的序列中含有的全部rep中提取出由xgx构成的氨基酸序列。构成xgx的氨基酸残基的总数为z。例如,在提取出50个由xgx构成的氨基酸序列的情况下(无重复),z为50×3=150。另外,例如在如由xgxgx构成的氨基酸序列的情况这样存在含有于两个xgx中的x(中央的x)的情况下,扣除重复量来进行计算(xgxgx的情况下为5个氨基酸残基)。w为从结构域序列中除去位于最靠c末端侧的(a)n基序至结构域序列的c末端为止的序列而得到的序列中含有的总氨基酸残基数。例如,在图2所示的结构域序列的情况下,w为4+50+4+100+4+10+4+20+4+30=230(除去了位于最靠c末端侧的(a)n基序)。接着,将z除以w,由此能够算出z/w(%)。
在此,对天然来源的丝心蛋白中的z/w进行说明。首先,如上所述,利用例示出在ncbigenbank中登记了氨基酸序列信息的丝心蛋白的方法进行确认,结果提取出663种丝心蛋白(其中,蜘蛛类来源的丝心蛋白为415种)。根据所提取的全部丝心蛋白中包含式1:[(a)n基序-rep]m所表示的结构域序列、且丝心蛋白中的由ggx构成的氨基酸序列的含有比例为6%以下的天然来源的丝心蛋白的氨基酸序列,利用上述计算方法算出z/w。将其结果示于图1。图1的横轴表示z/w(%),纵轴表示频率。由图1表明,天然来源的丝心蛋白中的z/w均小于50.9%(最高为50.86%)。
在本实施方式的改造丝心蛋白中,z/w优选为50.9%以上,更优选为56.1%以上,进一步优选为58.7%以上,进一步更优选为70%以上,进一步更优选为80%以上。对z/w的上限没有特别限制,例如可以为95%以下。
本实施方式的改造丝心蛋白例如可以通过以下述方式进行改造而得到:从克隆出的天然来源的丝心蛋白的基因序列中对编码甘氨酸残基的碱基序列的至少一部分进行置换,使其编码其他氨基酸残基。此时,可以选择ggx基序和gpgxx基序中的一个甘氨酸残基作为改造的甘氨酸残基,另外也可以进行置换以使z/w为50.9%以上。另外,例如也可以通过根据天然来源的丝心蛋白的氨基酸序列设计满足上述各实施方式的氨基酸序列,并化学合成编码所设计的氨基酸序列的核酸而得到。在任意一种情况下,都可以在相当于从天然来源的丝心蛋白的氨基酸序列中将rep中的甘氨酸残基置换为其他氨基酸残基的改造的基础上,进一步进行相当于置换、缺失、插入和/或添加有一个或两个以上氨基酸残基的氨基酸序列的改造。
作为上述的其他氨基酸残基,只要是甘氨酸残基以外的氨基酸残基则没有特别限制,优选缬氨酸(v)残基、亮氨酸(l)残基、异亮氨酸(i)残基、甲硫氨酸(m)残基、脯氨酸(p)残基、苯丙氨酸(f)残基和色氨酸(w)残基等疏水性氨基酸残基、谷氨酰胺(q)残基、天冬酰胺(n)残基、丝氨酸(s)残基、赖氨酸(k)残基和谷氨酸(e)残基等亲水性氨基酸残基,更优选缬氨酸(v)残基、亮氨酸(l)残基、异亮氨酸(i)残基和谷氨酰胺(q)残基,进一步优选谷氨酰胺(q)残基。
本发明的改造丝心蛋白优选其结构域序列具有与天然来源的丝心蛋白相比除了甘氨酸残基的含量降低以外、(a)n基序的含量也降低的氨基酸序列。由此,更进一步显著发挥本发明所带来的效果。该改造丝心蛋白的结构域序列可以具有与天然来源的丝心蛋白相比相当于除了至少rep中的一个或两个以上甘氨酸残基被置换为其他氨基酸残基以外、至少一个或两个以上(a)n基序进一步发生了缺失的氨基酸序列。
接着,对(a)n基序的含量降低的结构域序列的具体实施方式进行说明。需要说明的是,关于甘氨酸残基的含量的降低,省略其记载,但上述的涉及甘氨酸残基的含量降低的各实施方式与以下的涉及(a)n基序的含量降低的各实施方式可以任意组合。
一个实施方式中的改造丝心蛋白中,结构域序列具有与天然来源的丝心蛋白相比相当于从n末端侧向c末端侧至少每1~3个(a)n基序中一个(a)n基序发生了缺失的氨基酸序列。
另一个实施方式中的改造丝心蛋白中,结构域序列具有与天然来源的丝心蛋白相比相当于从n末端侧向c末端侧至少依次重复发生了两个连续的(a)n基序的缺失和一个(a)n基序的缺失的氨基酸序列。
又一个实施方式中的改造丝心蛋白中,结构域序列具有相当于从n末端侧向c末端侧至少使(a)n基序每隔两个发生了缺失的氨基酸序列。
丝心蛋白的(a)n基序被认为与丝心蛋白的强度(应力和韧度)密切相关,因此迄今为止按照增加(a)n基序的含量的方向进行了研究开发,认为通过减少(a)n基序的含量会使强度显著减小。但是,本发明人发现,即使减少(a)n基序的含量,应力也不会显著减小,并且能够显著提高重组蛋白生产系统中的生产量,进而韧度和伸度也提高。根据本实施方式的改造丝心蛋白,还发挥出这样的预料不到的效果。
在本实施方式中,改造丝心蛋白的结构域序列可以具有相当于从天然来源的丝心蛋白中使10~40%的(a)n基序发生了缺失的氨基酸序列。(a)n基序的含量的减少为该范围内时,能够稳定地发挥下述效果:能够在不显著减小应力的情况下显著提高重组蛋白生产系统中的生产量,并且能够提高韧度和伸度。
又一个实施方式中的改造丝心蛋白具有下述氨基酸序列:从n末端侧向c末端侧将相邻的两个[(a)n基序-rep]单元的rep的氨基酸残基数依次进行比较,将氨基酸残基数少的rep的氨基酸残基数设为1时,另一者的rep的氨基酸残基数之比为2~3.5,将上述相邻的两个[(a)n基序-rep]单元的氨基酸残基数相加得到的合计值设为x、将上述结构域序列的总氨基酸残基数设为y时,x/y的最大值为20%以上。
参考图2进一步详细地说明x/y的计算方法。图2中示出从改造丝心蛋白中除去n末端序列和c末端序列而得到的结构域序列。该结构域序列从n末端侧(左侧)起具有(a)n基序-第一rep(50个氨基酸残基)-(a)n基序-第二rep(100个氨基酸残基)-(a)n基序-第三rep(10个氨基酸残基)-(a)n基序-第四rep(20个氨基酸残基)-(a)n基序-第五rep(30个氨基酸残基)-(a)n基序这样的序列。
从n末端侧向c末端侧依次选择相邻的两个[(a)n基序-rep]单元,使其不重复。此时,可以存在未被选择的[(a)n基序-rep]单元。图2中示出了方式1(第一rep与第二rep的比较、以及第三rep与第四rep的比较)、方式2(第一rep与第二rep的比较、以及第四rep与第五rep的比较)、方式3(第二rep与第三rep的比较、以及第四rep与第五rep的比较)、方式4(第一rep与第二rep的比较)。需要说明的是,除此以外还存在其他选择方法。
接着,对于各方式,将所选择的相邻的两个[(a)n基序-rep]单元中的各rep的氨基酸残基数进行比较。比较通过求出将氨基酸残基数更少的一者设为1时的、另一者的氨基酸残基数之比来进行。例如,在第一rep(50个氨基酸残基)与第二repp(100个氨基酸残基)比较的情况下,将氨基酸残基数更少的第一rep设为1时,第二repp的氨基酸残基数之比为100/50=2。同样地,在第四rep(20个氨基酸残基)与第五rep(30个氨基酸残基)比较的情况下,将氨基酸残基数更少的第四rep设为1时,第五rep的氨基酸残基数之比为30/20=1.5。
图2中,用实线示出了将氨基酸残基数更少的一者设为1时、另一者的氨基酸残基数之比为1.8~11.3的[(a)n基序-rep]单元的组。以下将这样的比称为锯齿比率。将氨基酸残基数更少的一者设为1时、另一者的氨基酸残基数之比小于1.8或超过11.3的[(a)n基序-rep]单元的组用虚线表示。
在各方式中,将用实线表示的相邻的两个[(a)n基序-rep]单元的全部氨基酸残基数相加(不仅是rep的氨基酸残基数,还有(a)n基序的氨基酸残基数)。并且,对相加得到的合计值进行比较,将该合计值最大的方式的合计值(合计值的最大值)设为x。在图2所示的示例中,方式1的合计值最大。
接着,将x除以结构域序列的总氨基酸残基数y,由此可以算出x/y(%)。
在此,对天然来源的丝心蛋白中的x/y进行说明。首先,如上所述,利用例示出在ncbigenbank中登记了氨基酸序列信息的丝心蛋白的方法进行确认,结果提取出663种丝心蛋白(其中,蜘蛛类来源的丝心蛋白为415种)。根据所提取出的全部丝心蛋白中包含式1:[(a)n基序-rep]m所表示的结构域序列、并且在结构域序列中两个以上存在的(a)n基序中的至少7个仅由丙氨酸残基构成的天然来源的丝心蛋白的氨基酸序列,利用上述计算方法算出x/y。将锯齿比率为1∶1.9~4.1的情况的结果示于图3。图3的横轴表示x/y(%),纵轴表示频率。天然来源的丝心蛋白中的x/y小于64.2%(最高为64.14%)。需要说明的是,在包含式1:[(a)n基序-rep]m所表示的结构域序列、并且在结构域序列中两个以上存在的(a)n基序中的至少7个仅由丙氨酸残基构成的天然来源的丝心蛋白(如上所述,天然来源的丝心蛋白中的z/w均小于46.4%)中,只要x/y为20%以上即可确认到效果。
在本实施方式的改造丝心蛋白中,x/y优选为20%以上,优选为40%以上,更优选为50%以上,进一步优选为60%以上,进一步更优选为64.2%以上,进一步更优选为70%以上,特别优选为75%以上,最优选为80%以上。对x/y的上限没有特别限制,只要为100%以下即可。
包含(a)n基序含量降低的结构域序列的改造丝心蛋白例如可以通过从克隆出的天然来源的丝心蛋白的基因序列中使编码(a)n基序的序列中的一个或两个以上发生了缺失以使x/y为20%以上而得到。另外,例如也可以通过设计相当于从天然来源的丝心蛋白的氨基酸序列中使一个或两个以上(a)n基序发生了缺失以使x/y为20%以上的氨基酸序列,并化学合成编码所设计的氨基酸序列的核酸而得到。
作为本发明的改造丝心蛋白的更具体的示例,可以列举(i)包含序列号3、序列号4或序列号10所表示的氨基酸序列的改造丝心蛋白、或者(ii)包含与序列号3、序列号4或序列号10所表示的氨基酸序列具有90%以上的序列一致性的氨基酸序列的改造丝心蛋白。
对(i)的改造丝心蛋白进行说明。序列号3所表示的氨基酸序列是将相当于天然来源的丝心蛋白的序列号1所表示的氨基酸序列的rep中的ggx全部置换为gqx而得到的氨基酸序列。序列号4所表示的氨基酸序列是从序列号3所表示的氨基酸序列中从n末端侧向c末端侧使(a)n基序每隔两个发生了缺失、进一步在c末端序列的近前处插入一个[(a)n基序-rep]而得到的氨基酸序列。序列号10所表示的氨基酸序列是在序列号4所表示的氨基酸序列的各(a)n基序的c末端侧插入两个丙氨酸残基、进一步将一部分谷氨酰胺(q)残基置换为丝氨酸(s)残基、并使n末端侧的一部分氨基酸缺失以使其与序列号4的分子量大致相同而得到的氨基酸序列。需要说明的是,序列号2所表示的氨基酸序列是从序列号1所表示的氨基酸序列中从n末端侧向c末端侧使(a)n基序每隔两个发生了缺失而得到的氨基酸序列。
序列号1所表示的氨基酸序列(相当于天然来源的丝心蛋白)中的z/w的值为46.8%(参考表1)。序列号3所表示的氨基酸序列、序列号4所表示的氨基酸序列和序列号10所表示的氨基酸序列中的z/w的值分别为58.7%、70.1%和66.1%(参考表1)。另外,序列号1、3、4和10所表示的氨基酸序列的锯齿比率为1∶1.8~11.3时的x/y的值分别为15.0%、15.0%、93.4%和92.7%(参考表2~5)。
[表1]
[表2]
[表3]
[表4]
[表5]
(i)的改造丝心蛋白可以由序列号3、序列号4或序列号10所表示的氨基酸序列构成。
(ii)的改造丝心蛋白包含与序列号3、序列号4或序列号10所表示的氨基酸序列具有90%以上的序列一致性的氨基酸序列。并且,(ii)的改造丝心蛋白也是包含式1:[(a)n基序-rep]m所表示的结构域序列的蛋白质。上述序列一致性优选为95%以上。
(ii)的改造丝心蛋白优选:与序列号3、序列号4或序列号10所表示的氨基酸序列具有90%以上的序列一致性,并且将rep中含有的由xgx(其中,x表示甘氨酸以外的氨基酸残基)构成的氨基酸序列的总氨基酸残基数设为z、将上述结构域序列中的rep的总氨基酸残基数设为w时,z/w为50.9%以上。
上述改造丝心蛋白可以在n末端和c末端中的任意一个末端或两个末端包含标签序列。由此,能够进行改造丝心蛋白的分离、固定化、检测和可见化等。
作为标签序列,可以列举例如利用与其他分子的特异性亲和性(结合性、affinity)的亲和性标签。作为亲和性标签的具体例,可以列举组氨酸标签(his标签)。his标签是由约4至10个组氨酸残基排列而成的短肽,具有与镍等的金属离子特异性地结合的性质,因此能够用于通过金属螯合层析(chelatingmetalchromatography)进行的改造丝心蛋白的分离。作为标签序列的具体例,可以列举例如序列号5所表示的氨基酸序列(包含his标签的氨基酸序列)。
另外,也可以利用与谷胱甘肽特异性地结合的谷胱甘肽-s-转移酶(gst)、与麦芽糖特异性地结合的麦芽糖结合蛋白(mbp)等标签序列。
此外,也可以使用利用抗原抗体反应的“表位标签”。通过附加显示抗原性的肽(表位)作为标签序列,能够使针对该表位的抗体进行结合。作为表位标签,可以列举ha(流感病毒的血凝素的肽序列)标签、myc标签、flag标签等。通过利用表位标签,能够以高特异性容易地对改造丝心蛋白进行纯化。
也可以使用进一步利用特定的蛋白酶将标签序列切除而得到的改造丝心蛋白。也可以通过对经由该标签序列吸附的蛋白质进行蛋白酶处理而回收切除标签序列后的改造丝心蛋白。
作为包含标签序列的改造丝心蛋白的更具体的示例,可以列举(iii)包含序列号8、序列号9或序列号11所表示的氨基酸序列的改造丝心蛋白、或者(iv)包含与序列号8、序列号9或序列号11所表示的氨基酸序列具有90%以上的序列一致性的氨基酸序列的改造丝心蛋白。
序列号6、7、8、9和11所表示的氨基酸序列是分别在序列号1、2、3、4和10所表示的氨基酸序列的n末端附加序列号5所表示的氨基酸序列(包含his标签)而得到的氨基酸序列。
(iii)的改造丝心蛋白可以由序列号8、序列号9或序列号11所表示的氨基酸序列构成。
(iv)的改造丝心蛋白包含与序列号8、序列号9或序列号11所表示的氨基酸序列具有90%以上的序列一致性的氨基酸序列。并且,(iv)的改造丝心蛋白也是包含式1:[(a)n基序-rep]m所表示的结构域序列的蛋白质。上述序列一致性优选为95%以上。
(iv)的改造丝心蛋白优选:与序列号8、序列号9或序列号11所表示的氨基酸序列具有90%以上的序列一致性,并且将rep中含有的由xgx(其中,x表示甘氨酸以外的氨基酸残基)构成的氨基酸序列的总氨基酸残基数设为z、将上述结构域序列中的rep的总氨基酸残基数设为w时,z/w为50.9%以上。
上述的改造丝心蛋白可以包含用于将重组蛋白生产系统中生产的蛋白质释放到宿主的外部的分泌信号。分泌信号的序列可以根据宿主的种类适当设定。
[核酸]
本发明的核酸编码本发明的改造丝心蛋白。作为核酸的具体例,可以列举编码包含序列号3、序列号4或序列号10所表示的氨基酸序列的改造丝心蛋白、或者在这些氨基酸序列的n末端和c末端中的任意一个末端或两个末端结合有序列号5所表示的氨基酸序列(标签序列)的蛋白质等的核酸等。
一个实施方式的核酸为下述核酸:在严格条件下与编码本发明的改造丝心蛋白的核酸的互补链杂交,并且编码下述改造丝心蛋白,该改造丝心蛋白包含式1:[(a)n基序-rep]m所表示的结构域序列,将rep中含有的由xgx(其中,x表示甘氨酸以外的氨基酸残基)构成的氨基酸序列的总氨基酸残基数设为z、将上述结构域序列中的rep的总氨基酸残基数设为w时,z/w为50.9%以上。
“严格条件”是指所谓的形成特异性杂交体而不形成非特异性杂交体的条件。“严格条件”可以为低严格条件、中严格条件和高严格条件中的任意一种。低严格条件是指仅在序列间存在至少85%以上的一致性时发生杂交,可以列举例如使用含有0.5%sds的5×ssc在42℃下进行杂交的条件。中严格条件是指仅在序列间存在至少90%以上的一致性时发生杂交,可以列举例如使用含有0.5%sds的5×ssc在50℃下进行杂交的条件。高严格条件是指仅在序列间存在至少95%以上的一致性时发生杂交,可以列举例如使用含有0.5%sds的5×ssc在60℃下进行杂交的条件。
一个实施方式的核酸为下述核酸:与编码本发明的改造丝心蛋白的核酸具有90%以上的序列一致性,并且编码下述改造丝心蛋白,该改造丝心蛋白包含式1:[(a)n基序-rep]m所表示的结构域序列,将rep中含有的由xgx(其中,x表示甘氨酸以外的氨基酸残基)构成的氨基酸序列的总氨基酸残基数设为z、将上述结构域序列中的rep的总氨基酸残基数设为w时,z/w为50.9%以上。序列一致性优选为95%以上。
[宿主和表达载体]
本发明的表达载体具有本发明的核酸序列和以能够工作的方式与该核酸序列连接的一个或两个以上调节序列。调节序列是对宿主中的重组蛋白的表达进行调控的序列(例如启动子、增强子、核糖体结合序列、转录终止序列等),可以根据宿主的种类适当选择。表达载体的种类可以根据宿主的种类适当选择质粒载体、病毒载体、柯斯质粒(cosmid)载体、福斯质粒(fosmid)载体、人造染色体载体等。
本发明的宿主是利用本发明的表达载体进行转化而得到的。作为宿主,原核生物、以及酵母、丝状真菌、昆虫细胞、动物细胞和植物细胞等真核生物均可以优选使用。
作为表达载体,优选使用在宿主细胞中能够自主复制、或者能够并入到宿主的染色体中、且在能够对本发明的核酸进行转录的位置含有启动子的表达载体。
在使用细菌等原核生物作为宿主的情况下,本发明的表达载体优选为在原核生物中能够自主复制的同时包含启动子、核糖体结合序列、本发明的核酸和转录终止序列的载体。也可以包含对启动子进行调控的基因。
作为原核生物,可以列举属于埃希氏菌属、短芽孢杆菌属、沙雷氏菌属、芽孢杆菌属、分枝杆菌属、短杆菌属、棒杆菌属属和假单胞菌属等的微生物。
作为属于埃希氏菌属的微生物,可以列举例如大肠杆菌bl21(novagen公司)、大肠杆菌bl21(de3)(lifetechnologies公司)、大肠杆菌blr(de3)(默克密理博公司)、大肠杆菌dh1、大肠杆菌g1698、大肠杆菌hb101、大肠杆菌jm109、大肠杆菌k5(atcc23506)、大肠杆菌ky3276、大肠杆菌mc1000、大肠杆菌mg1655(atcc47076)、大肠杆菌no.49、大肠杆菌rosetta(de3)(novagen公司)、大肠杆菌tb1、大肠杆菌tuner(novagen公司)、大肠杆菌tuner(de3)(novagen公司)、大肠杆菌w1485、大肠杆菌w3110(atcc27325)、大肠杆菌(escherichiacoli)xl1-blue、大肠杆菌xl2-blue等。
作为属于短芽孢杆菌属的微生物,可以列举例如土壤短芽孢杆菌、波茨坦短芽孢杆菌、中孢短芽孢杆菌、美丽短芽孢杆菌、铫子短芽孢杆菌、侧孢短芽孢杆菌、沼泽短芽孢杆菌、副短短芽孢杆菌、罗伊氏短芽孢杆菌、热红短芽孢杆菌、短短芽孢杆菌47(fermbp-1223)、短短芽孢杆菌47k(fermbp-2308)、短短芽孢杆菌47-5(fermbp-1664)、短短芽孢杆菌47-5q(jcm8975)、桥石短芽孢杆菌hpd31(fermbp-1087)、桥石短芽孢杆菌hpd31-s(fermbp-6623)、桥石短芽孢杆菌hpd31-ok(fermbp-4573)、桥石短芽孢杆菌sp3株(takara公司制)等。
作为属于沙雷氏菌属的微生物,可以列举例如液化沙雷氏菌(serratialiquefacience)atcc14460、嗜虫沙雷氏菌(serratiaentomophila)、无花果沙雷氏菌(serratiaficaria)、居泉沙雷氏菌(serratiafonticola)、格氏沙雷氏菌(serratiagrimesii)、变形斑沙雷氏菌(serratiaproteamaculans)、气味沙雷氏菌(serratiaodorifera)、普城沙雷氏菌(serratiaplymuthica)、深红沙雷氏菌(serratiarubidaea)等。
作为属于芽孢杆菌属的微生物,可以列举例如枯草芽孢杆菌(bacillussubtilis)、解淀粉芽孢杆菌(bacillusamyloliquefaciens)等。
作为属于分枝杆菌属的微生物,可以列举例如嗜氨分枝杆菌atcc15354等。
作为属于短杆菌属的微生物,可以列举例如叉开短杆菌(谷氨酸棒杆菌)atcc14020、黄色短杆菌(谷氨酸棒杆菌atcc14067)atcc13826、atcc14067、乳发酵短杆菌(brevibacteriumimmariophilum)atcc14068、乳酸发酵短杆菌(谷氨酸棒杆菌atcc13869)atcc13665、atcc13869、玫瑰色短杆菌atcc13825、解糖短杆菌(brevibacteriumsaccharolyticum)atcc14066、生硫短杆菌atcc19240、白色短杆菌atcc15111、蜡状短杆菌atcc15112等。
作为属于棒杆菌属的微生物,可以列举例如产氨棒杆菌(corynebacteriumammoniagenes)atcc6871、atcc6872、谷氨酸棒杆菌(corynebacteriumglutamicum)atcc13032、谷氨酸棒杆菌atcc14067、嗜乙酰乙酸棒杆菌(corynebacteriumacetoacidophilum)atcc13870、醋谷棒杆菌atcc15806、解碱棒杆菌atcc21511、帚石南棒杆菌atcc15991、谷氨酸棒杆菌atcc13020,atcc13032,atcc13060、百合棒杆菌atcc15990、栖糖蜜棒杆菌atcc17965、热产氨棒杆菌aj12340(fermbp-1539)、力士棒杆菌atcc13868等。
作为属于假单胞菌属的微生物,可以列举例如恶臭假单胞菌(pseudomonasputida)、荧光假单胞菌(pseudomonasfluorescens)、油菜假单胞菌(pseudomonasbrassicacearum)、黄褐假单胞菌(pseudomonasfulva)和假单胞菌属细菌(pseudomonassp.)d-0110等。
作为向上述宿主细胞中导入表达载体的方法,只要是向上述宿主细胞中导入dna的方法则均可以使用。可以列举例如使用钙离子的方法[proc.natl.acad.sci.usa,69,2110(1972)]、原生质体法(日本特开昭63-248394)、或gene,17,107(1982)、molecular&generalgenetics,168,111(1979)中记载的方法等。
属于短芽孢杆菌属的微生物的转化可以利用例如takahashi等的方法(j.bacterio1.,1983,156:1130-1134)、takagi等的方法(agric.biol.chem.,1989,53:3099-3100)、或okamoto等的方法(biosci.biotechnol.biochem.,1997,61:202-203)来实施。
作为导入本发明的核酸的载体(以下简称为“载体”),可以列举例如pbtrp2、pbtac1、pbtac2(均由boehringermannheim公司销售)、pkk233-2(pharmacia公司制)、pse280(invitrogen公司制)、pgemex-1(promega公司制)、pqe-8(qiagen公司制)、pkyp10(日本特开昭58-110600)、pkyp200[agric.biol.chem.,48,669(1984)]、plsa1[agric.biol.chem.,53,277(1989)]、pgel1[proc.natl.acad.sci.usa,82,4306(1985)]、pbluescriptiisk(-)(stratagene公司制)、ptrs30[由大肠杆菌jm109/ptrs30(fermbp-5407)制备]、ptrs32[由大肠杆菌jm109/ptrs32(fermbp-5408)制备]、pgha2[由大肠杆菌igha2(fermb-400)制备、日本特开昭60-221091]、pgka2[由大肠杆菌igka2(fermbp-6798)制备、日本特开昭60-221091]、pterm2(us4686191、us4939094、us5160735)、psupex、pub110、ptp5、pc194、peg400[j.bacteriol.,172,2392(1990)]、pgex(pharmacia公司制)、pet系统(novagen公司制)等。
在使用大肠杆菌作为宿主的情况下,可以列举puc18、pbluescriptii、psupex、pet22b、pcold等作为优选的载体。
作为属于短芽孢杆菌属的微生物的优选载体的具体例,可以列举作为枯草杆菌载体公知的pub110、或phy500(日本特开平2-31682号公报)、pny700(日本特开平4-278091号公报)、phy4831(j.bacteriol.,1987,1239-1245)、pnu200(鹈高重三、日本农艺化学会志1987,61:669-676)、pnu100(appl.microbiol.biotechnol.,1989,30:75-80)、pnu211(j.biochem.,1992,112:488-491)、pnu211r2l5(日本特开平7-170984号公报)、pnh301(appl.environ.microbiol.,1992,58:525-531)、pnh326、pnh400(j.bacteriol.,1995,177:745-749)、pht210(日本特开平6-133782号公报)、pht110r2l5(appl.microbiol.biotechnol.,1994,42:358-363)、或大肠杆菌与属于短芽孢杆菌属的微生物的穿梭载体pnco2(日本特开2002-238569号公报)等。
作为启动子,只要在宿主细胞中发挥功能则没有限制。可以列举例如trp启动子(ptrp)、lac启动子、pl启动子、pr启动子、t7启动子等来源于大肠杆菌或噬菌体等的启动子。另外,也可以使用将两个ptrp串联而成的启动子(ptrp×2)、tac启动子、lact7启动子、leti启动子这样人为地进行了设计改造的启动子等。
优选使用将作为核糖体结合序列的夏因-达尔加诺(shine-dalgarno)序列与起始密码子之间调节为适当距离(例如6~18个碱基)的质粒。在本发明的表达载体中,本发明的核酸的表达不一定需要转录终止序列,但优选紧挨在结构基因的下游配置转录终止序列。
作为真核生物的宿主,可以列举例如酵母、丝状真菌(霉菌等)和昆虫细胞。
作为酵母,可以列举例如属于酵母(saccharomyces)属、裂殖酵母(schizosaccharomyces)属、克鲁维酵母(kluyveromyces)属、丝孢酵母(trichosporon)属、许旺酵母(schwanniomyces)属、毕赤酵母(pichia)属、假丝酵母(candida)属、耶氏酵母属和汉逊酵母属等的酵母。更具体而言,可以列举酿酒酵母(saccharomycescerevisiae)、粟酒裂殖酵母(schizosaccharomycespombe)、乳酸克鲁维酵母(kluyveromyceslactis)、马克斯克鲁维酵母(kluyveromycesmarxianus)、出芽丝孢酵母(trichosporonpullulans)、河岸许旺酵母(schwanniomycesalluvius)、西方许旺酵母(schwanniomycesoccidentalis)、产朊假丝酵母(candidautilis)、巴斯德毕赤酵母(pichiapastoris、安格斯毕赤酵母(pichiaangusta)、甲醇毕赤酵母(pichiamethanolica)、多形毕赤酵母(pichiapolymorpha)、树干毕赤酵母(pichiastipitis)、解脂耶氏酵母(yarrowialipolytica)、多形汉逊酵母(hansenulapolymorpha)等。
使用酵母作为宿主细胞的情况下的表达载体通常优选包含复制起点(需要在宿主中扩增的情况)和用于大肠杆菌中的载体的增殖的筛选标志物、用于酵母中的重组蛋白表达的启动子和终止子、以及用于酵母的筛选标志物。
在表达载体为非整合载体的情况下,优选进一步包含自主复制序列(ars)。由此,能够提高表达载体在细胞内的稳定性(myers、a.m.、etal.(1986)gene45:299-310)。
作为使用酵母作为宿主的情况下的载体,可以列举例如yep13(atcc37115)、yep24(atcc37051)、ycp50(atcc37419)、yip、phs19、phs15、pa0804、phil3ol、phil-s1、ppic9k、ppiczα、pgapzα、ppiczb等。
作为启动子,只要能够在酵母中表达则没有限制。可以列举例如己糖激酶等糖酵解系统的基因的启动子、pho5启动子、pgk启动子、gap启动子、adh启动子、gal1启动子、gal10启动子、热休克多肽启动子、mfα1启动子、cup1启动子、pgap启动子、pgcw14启动子、aox1启动子、mox启动子等。
作为向酵母中导入表达载体的方法,只要是将dna导入酵母中的方法则均可以使用,可以列举例如电穿孔法(methodsenzymol.,194,182(1990))、原生质球法(proc.natl.acad.sci.,usa,81,4889(1984))、乙酸锂法(j.bacteriol.,153,163(1983))、proc.natl.acad.sci.usa,75,1929(1978)记载的方法等。
作为丝状真菌,可以列举例如属于顶孢霉(acremonium)属、曲霉(aspergillus)属、黑粉霉(ustilago)属、木霉(trichoderma)属、链孢霉(neurospora)属、镰孢霉(fusarium)属、腐质霉(humicola)属、青霉(penicillium)属、毁丝霉(myceliophtora)属、灰霉(botryts)属、稻瘟霉(magnaporthe)属、毛霉(mucor)属、绿僵菌(metarhizium)属、红曲霉(monascus)属、根霉(rhizopus)属和根毛霉属的菌等。
作为丝状真菌的具体例,可以列举阿拉巴马顶孢霉(acremoniumalabamense)、解纤维素顶孢霉(acremoniumcellulolyticus)、棘孢曲霉(aculeatus)(aspergillusaculeatus)、泡盛曲霉(aspergillusawamori)、米曲霉(aspergillusoryzae)、清酒曲霉(aspergillussake)、酱油曲霉(sojae)(aspergillussojae)、塔宾曲霉(aspergillustubigensis)、黑曲霉(aspergillusniger)、构巢曲霉(aspergillusnidulans)、寄生曲霉(aspergillusparasiticus)、无花果曲霉(ficuum)(aspergillusficuum)、海枣曲霉(aspergillusphoeicus)、臭曲霉(foetidus)(aspergillusfoetidus)、黄曲霉(aspergillusflavus)、烟曲霉(aspergillusfumigatus)、日本曲霉(japonicus)(aspergillusjaponicus)、绿色木霉(trichodermaviride)、哈茨木霉(trichodermaharzianum)、里氏木霉(trichodermareseei)、拉克淖金孢子菌(chrysosporiumlucknowense)、嗜热子囊菌(thermoascus)、孢子丝菌(sporotrichum)、嗜纤维素侧孢霉(sporotrichumcellulophilum)、篮状菌(talaromyces)、太瑞斯梭孢壳霉(thielaviaterrestris)、梭孢壳霉(thielavia)、粗糙链孢霉(neurosporacrassa)、尖孢镰孢霉(fusariumoxysporus)、禾谷镰孢霉(fusariumgraminearum)、镶片镰孢霉(fusariumvenenatum)、特异腐质霉(humicolainsolens)、产黄青霉(penicilliumchrysogenum)、卡门培尔青霉(penicilliumcamemberti)、灰白青霉(penicilliumcanescens)、埃默森青霉(penicilliumemersonii)、绳状青霉(penicilliumfuniculosum)、灰玫瑰青霉(penicilliumgriseoroseum)、产紫青霉(penicilliumpurpurogenum)、娄地青霉(penicilliumroqueforti)、嗜热毁丝霉(myceliophtaorathermophilum)、不明毛霉(mucorambiguus)、卷枝毛霉(mucorcircinelloides)、易脆毛霉(mucorfragilis)、冻土毛霉(mucorhiemalis)、不等孢毛霉(mucorinaequisporus)、mucoroblongiellipticus、总状毛霉(mucorracemosus)、反屈毛霉(mucorrecurvus)、土星状毛霉(mocorsaturninus)、mocorsubtilissmus、多形欧加铁菌(ogataeapolymorpha)、黄孢原毛平革菌(phanerochaetechrysosporium)、米黑根毛霉(rhizomucormiehei)、微小根毛霉(rhizomucorpusillus)、少根根霉(rhizopusarrhizus)等。
作为宿主为丝状真菌的情况下的启动子,可以为参与糖酵解系统的基因、参与构成性表达的基因、参与水解的酶基因等的任意一种,具体而言,可以列举amyb、glaa、agda、glab、tef1、xynfltannasegene、no.8an、gpda、pgka、enoa、melo、sodm、cata、catb等。
表达载体向丝状真菌中的导入可以使用现有公知的方法进行。可以列举例如cohen等的方法(氯化钙法)[proc.natl.acad.sci.usa,69:2110(1972)]、原生质体法[mol.gen.genet.,168:111(1979)]、感受态细胞法[j.mol.biol.,56:209(1971)]、电穿孔法等。
作为昆虫细胞,可以列举例如鳞翅类的昆虫细胞,更具体而言,可以列举sf9和sf21等草地夜蛾(spodopterafrugiperda)来源的昆虫细胞、以及high5等粉纹夜蛾(trichoplusiani)来源的昆虫细胞等。
作为使用昆虫细胞作为宿主的情况下的载体,可以列举例如作为感染夜蛾科昆虫的病毒的苜蓿银纹夜蛾核型多角体病毒(autographacalifornicanuclearpolyhedrosisvirus)等杆状病毒(baculovirusexpressionvectors,alaboratorymanual(杆状病毒表达载体实验室手册),w.h.freemanandcompany,纽约(1992))。
在使用昆虫细胞作为宿主的情况下,可以利用例如currentprotocolsinmolecularbiology(分子生物学现行规范);baculovirusexpressionvectors,alaboratorymanual(杆状病毒表达载体实验室手册),w.h.freemanandcompany,纽约(1992);bio/technology,6,47(1988)等中记载的方法对多肽进行表达。即,可以将重组基因导入载体和杆状病毒共导入昆虫细胞中,在昆虫细胞培养上清中得到重组病毒(表达载体)后,进一步使重组病毒感染昆虫细胞,使多肽进行表达。作为该方法中使用的基因导入载体,可以列举例如pvl1392、pvl1393、pbluebaciii(均为invitorogen公司制)等。
作为用于制备重组病毒的、重组基因导入载体和杆状病毒向昆虫细胞中的共导入方法,可以列举例如磷酸钙法(日本特开平2-227075)、脂质体转染法(proc.natl.acad.sci.usa,84,7413(1987))等。
本发明的重组载体优选进一步含有用于转化体选择的选择标志物基因。例如,在大肠杆菌中,作为选择标志物基因,可以使用针对四环素、氨苄青霉素、卡那霉素等各种药剂的抗性基因。也可以使用能够与营养需求性相关的基因变异互补的劣性的选择标志物。在酵母中,作为选择标志物基因,可以使用针对遗传霉素的抗性基因,也可以使用与营养需求性相关的基因变异互补的基因、leu2、ura3、trp1、his3等选择标志物。在丝状真菌中,作为选择标志物基因,可以列举选自由niad(biosci.biotechnol.biochem.,59,1795-1797(1995))、argb(enzymemicrobioltechnol,6,386-389,(1984))、sc(gene,84,329-334,(1989))、ptra(bioscibiotechnolbiochem,64,1416-1421,(2000))、pyrg(biochembiophysrescommun,112,284-289,(1983)),amds(gene,26,205-221,(1983))、金担子素抗性基因(molgengenet,261,290-296,(1999))、苯菌灵抗性基因(procnatlacadsciusa,83,4869-4873,(1986))和潮霉素抗性基因(gene,57,21-26,(1987))组成的组中的标志物基因、亮氨酸需求性互补基因等。另外,在宿主为营养需求性变异株的情况下,也可以使用与该营养需求性互补的野生型基因作为选择标志物基因。
利用本发明的表达载体进行了转化的宿主的选择可以通过使用选择地与本发明的核酸结合的探针的噬菌斑杂交和菌落杂交等来进行。作为该探针,可以使用将基于本发明的核酸的序列信息利用pcr法扩增出的部分dna片段用放射性同位素或地高辛进行修饰而得到的探针。
(改造丝心蛋白的生产)
通过使本发明的核酸在利用本发明的表达载体进行了转化的宿主中表达,能够生产本发明的改造丝心蛋白。作为表达方法,除了直接表达以外,还可以依据分子克隆第二版中记载的方法等进行分泌生产、融合蛋白表达等。在利用酵母、动物细胞、昆虫细胞进行表达的情况下,可以以附加有糖或糖链的多肽的形式得到改造丝心蛋白。
本发明的改造丝心蛋白例如可以通过将利用本发明的表达载体进行了转化的宿主在培养用培养基中进行培养,使本发明的改造丝心蛋白在培养用培养基中生成蓄积,并从该培养用培养基中收集来进行制造。将本发明的宿主在培养用培养基中进行培养的方法可以按照宿主的培养中通常使用的方法来进行。
在本发明的宿主为大肠杆菌等原核生物或酵母等真核生物的情况下,作为本发明的宿主的培养用培养基,只要是含有该宿主可同化的碳源、氮源和无机盐类等、能够高效地进行该宿主的培养的培养基,则可以使用天然培养基、合成培养基中的任意一种。
作为碳源,只要是该宿主可同化的碳源即可,可以使用例如葡萄糖、果糖、蔗糖以及含有这些糖的糖蜜、淀粉和淀粉水解物等碳水化合物、乙酸和丙酸等有机酸、以及乙醇和丙醇等醇类。
作为氮源,可以使用例如氨、氯化铵、硫酸铵、乙酸铵和磷酸铵等无机酸或有机酸的铵盐、其他含氮化合物、以及蛋白胨、肉提取物、酵母提取物、玉米浆、酪蛋白水解物、豆粕和豆粕水解物、各种发酵菌体及其消化产物。
作为无机盐,可以使用例如磷酸二氢钾、磷酸氢二钾、磷酸镁、硫酸镁、氯化钠、硫酸亚铁、硫酸锰、硫酸铜和碳酸钙。
大肠杆菌等原核生物或酵母等真核生物的培养例如可以在振荡培养或深部通气搅拌培养等需氧条件下进行。培养温度例如为15~40℃。培养时间通常为16小时~7天。培养中的培养用培养基的ph优选保持于3.0~9.0。培养用培养基的ph的调节可以使用无机酸、有机酸、碱溶液、尿素、碳酸钙和氨等进行。
另外,培养中,可以根据需要在培养用培养基中添加氨苄青霉素和四环素等抗生素。在对利用使用诱导性启动子作为启动子的表达载体进行了转化的微生物进行培养时,可以根据需要在培养基中添加诱导剂。例如,在对利用使用lac启动子的表达载体进行了转化的微生物进行培养时,可以在培养基中添加异丙基-β-d-硫代吡喃半乳糖苷等;在对利用使用trp启动子的表达载体进行了转化的微生物进行培养时,可以在培养基中添加吲哚丙烯酸等。
作为昆虫细胞的培养用培养基,可以使用通常使用的tnm-fh培养基(pharmingen公司制)、sf-900iisfm培养基(lifetechnologies公司制)、excell400、excell405(均为jrhbiosciences公司制)、grace昆虫培养基(nature,195,788(1962))等。
昆虫细胞的培养例如可以在培养用培养基的ph为6~7、培养温度为25~30℃等条件下使培养时间为1~5天来进行。另外,培养中,可以根据需要在培养用培养基中添加庆大霉素等抗生素。
在宿主为植物细胞的情况下,转化后的植物细胞可以直接进行培养,另外也可以分化为植物的器官来进行培养。作为培养该植物细胞的培养基,可以使用通常使用的murashige&skoog(ms)培养基、怀特(white)培养基、或者在这些培养基中添加生长素、细胞分裂素等植物激素而得到的培养基等。
动物细胞的培养例如可以在培养用培养基的ph为5~9、培养温度为20~40℃等条件下使培养时间为3~60天来进行。另外,培养中,可以根据需要在培养基中添加卡那霉素、潮霉素等抗生素。
作为使用利用本发明的表达载体进行了转化的宿主来生产改造丝心蛋白的方法,有下述方法:在宿主细胞内生产该改造丝心蛋白的方法;使该改造丝心蛋白分泌到宿主细胞外的方法;和在宿主细胞外膜上生产该改造丝心蛋白的方法。可以通过改变所使用的宿主细胞和所生产的改造丝心蛋白的结构来选择这些各方法。
例如,在改造丝心蛋白生产于宿主细胞内或宿主细胞外膜上的情况下,可以通过应用鲍尔森等的方法(j.biol.chem.,264,17619(1989))、row等的方法(proc.natl.acad.sci.usa,86,8227(1989)、genesdevelop.,4,1288(1990))、或日本特开平5-336963号公报、国际公开第94/23021号等中记载的方法来进行变更,以使改造丝心蛋白主动地分泌到宿主细胞外。即,使用基因重组的方法,以在包含改造丝心蛋白的活性部位的多肽上附加有信号肽的形式进行表达,由此能够使改造丝心蛋白主动地分泌到宿主细胞外。
由利用本发明的表达载体进行了转化的宿主生产的改造丝心蛋白可以利用蛋白质的分离纯化中通常使用的方法进行分离和纯化。例如,在改造丝心蛋白以溶解状态在细胞内进行表达的情况下,在培养结束后,通过离心分离回收宿主细胞,悬浮于水系缓冲液中后,利用超声波破碎机、弗氏压碎器、manton-gaulin匀浆器和戴诺研磨机(dyno-mill)等将宿主细胞破碎,得到无细胞提取液。从通过将该无细胞提取液离心分离而得到的上清中,单独或组合使用蛋白质的分离纯化中通常使用的方法、即溶剂提取法、利用硫酸铵等的盐析法、脱盐法、利用有机溶剂的沉淀法、使用二乙基氨基乙基(deae)-琼脂糖、diaionhpa-75(三菱化成公司制)等树脂的阴离子交换层析法、使用s-琼脂糖ff(pharmacia公司制)等树脂的阳离子交换层析法、使用丁基琼脂糖、苯基琼脂糖等树脂的疏水性层析法、使用分子筛的凝胶过滤法、亲和层析法、色谱聚焦法、等电点电泳等电泳法等方法,能够得到纯化制备品。
作为上述层析法,优选使用采用苯基-toyopearl(东曹)、deae-toyopearl(东曹)、sephadexg-150(pharmaciabiotech)的柱层析。
另外,在改造丝心蛋白在细胞内形成不溶体而进行表达的情况下,同样在回收宿主细胞后将其破碎并进行离心分离,由此以沉淀级分的形式回收改造丝心蛋白的不溶体。回收的改造丝心蛋白的不溶体可以利用蛋白变性剂进行可溶化。该操作后,利用与上述同样的分离纯化法能够得到改造丝心蛋白的纯化制备品。
在改造丝心蛋白或在改造丝心蛋白上附加有糖链的衍生物被分泌到细胞外的情况下,可以从培养上清中回收改造丝心蛋白或其衍生物。即,利用离心分离等方法对培养物进行处理,由此获得培养上清,通过使用与上述同样的分离纯化法,能够从该培养上清中得到纯化制备品。
(纺丝)
本发明的改造丝心蛋白在如上所述进行生产和纯化后,可以进一步进行纺丝。本发明的改造丝心蛋白可以利用丝心蛋白的纺丝中通常使用的方法进行纺丝。例如,通过对使本发明的改造丝心蛋白溶解于溶剂中而得到的纺丝液(胶液)进行纺丝,能够得到由本发明的改造丝心蛋白形成的纤维。
纺丝液通过在改造丝心蛋白中添加溶剂并调节至能够纺丝的粘度来制作。溶剂只要能够溶解改造丝心蛋白即可。作为溶剂,可以列举例如包含六氟异丙醇(hfip)、六氟丙酮(hfa)、二甲亚砜(dmso)、n,n-二甲基甲酰胺(dmf)、甲酸、尿素、胍、十二烷基硫酸钠(sds)、溴化锂、氯化钙、硫氰酸锂等的水溶液等。
纺丝液中可以根据需要添加无机盐。作为无机盐,可以列举例如由以下所示的路易斯酸和路易斯碱构成的无机盐。作为路易斯碱,可以列举例如含氧酸根离子(硝酸根离子、高氯酸根离子等)、金属含氧酸根离子(高锰酸根离子等)、卤离子、硫氰酸根离子、氰酸根离子等。作为路易斯酸,可以列举例如碱金属离子、碱土金属离子等金属离子、铵根离子等多原子离子、络离子等。作为由路易斯酸和路易斯碱构成的无机盐的具体例,可以列举氯化锂、溴化锂、碘化锂、硝酸锂、高氯酸锂和硫氰酸锂等锂盐、氯化钙、溴化钙、碘化钙、硝酸钙、高氯酸钙和硫氰酸钙等钙盐、氯化铁、溴化铁、碘化铁、硝酸铁、高氯酸铁和硫氰酸铁等铁盐、氯化铝、溴化铝、碘化铝、硝酸铝、高氯酸铝和硫氰酸铝等铝盐、氯化钾、溴化钾、碘化钾、硝酸钾、高氯酸钾和硫氰酸钾等钾盐、氯化钠、溴化钠、碘化钠、硝酸钠、高氯酸钠和硫氰酸钠等钠盐、氯化锌、溴化锌、碘化锌、硝酸锌、高氯酸锌和硫氰酸锌等锌盐、氯化镁、溴化镁、碘化镁、硝酸镁、高氯酸镁和硫氰酸镁等镁盐、氯化钡、溴化钡、碘化钡、硝酸钡、高氯酸钡和硫氰酸钡等钡盐、以及氯化锶、溴化锶、碘化锶、硝酸锶、高氯酸锶和硫氰酸锶等锶盐。
纺丝液的粘度根据纺丝方法适当设定即可,例如可以设定为35℃下100~15000cp(厘泊)。纺丝液的粘度可以使用例如京都电子工业公司制造的商品名“ems粘度计”进行测定。
作为纺丝方法,只要是能够将本发明的改造丝心蛋白纺丝的方法则没有特别限制,可以列举例如干式纺丝、熔融纺丝、湿式纺丝等。作为优选的纺丝方法,可以列举湿式纺丝。
在湿式纺丝中,从纺丝喷头(喷嘴)中将溶解有改造丝心蛋白的溶剂挤出到凝固液(凝固液槽)中,使改造丝心蛋白在凝固液中凝固,由此能够得到丝形状的未拉伸丝。作为凝固液,只要是能够脱溶剂的溶液即可,可以列举例如甲醇、乙醇和2-丙醇等碳原子数1~5的低级醇、以及丙酮等。凝固液中可以适当添加水。凝固液的温度优选为0~30℃。在使用具有直径0.1~0.6mm的喷嘴的注射泵作为纺丝喷头的情况下,挤出速度优选为每孔0.2~6.0ml/小时,更优选为1.4~4.0ml/小时。凝固液槽的长度只要是能够高效地进行脱溶剂的长度即可,例如为200~500mm。未拉伸丝的引离速度例如可以为1~20m/分钟,优选为1~3m/分钟。停留时间例如可以为0.01~3分钟,优选为0.05~0.15分钟。另外,可以在凝固液中进行拉伸(预拉伸)。为了抑制低级醇的蒸发,可以将凝固液维持于低温,在未拉伸丝的状态下进行引离。凝固液槽可以设置多段,并且可以根据需要在各段或特定的段中进行拉伸。
利用上述方法得到的未拉伸丝(或预拉伸丝)可以经过拉伸工序制成拉伸丝(丝心蛋白纤维)。作为拉伸方法,可以列举湿热拉伸、干热拉伸等。
湿热拉伸可以在温水中、向温水中添加有机溶剂等而得到的溶液中、蒸气加热中进行。作为温度,例如可以为50~90℃,优选75~85℃。在湿热拉伸中,可以将未拉伸丝(或预拉伸丝)拉伸例如1~10倍,优选拉伸2~8倍。
干热拉伸可以使用管式电热炉、干热板等进行。作为温度,例如可以为140℃~270℃,优选160℃~230℃。在干热拉伸中,可以将未拉伸丝(或预拉伸丝)拉伸例如0.5~8倍,优选拉伸1~4倍。
湿热拉伸和干热拉伸可以分别单独进行,另外也可以将它们以多步或组合进行。即,可以以湿热拉伸进行第一步拉伸,以干热拉伸进行第二步拉伸;或者第一步拉伸进行湿热拉伸,第二步拉伸进行湿热拉伸,进一步以干热拉伸进行第三步拉伸等,可以将湿热拉伸和干热拉伸适当组合进行。
拉伸工序中的最终拉伸倍率相对于未拉伸丝(或预拉伸丝)例如为5~20倍,优选为6~11倍。
本发明的改造丝心蛋白在拉伸制成丝心蛋白纤维后,可以在丝心蛋白纤维内的多肽分子间进行化学交联。能够交联的官能团可以列举例如氨基、羧基、硫醇基和羟基等。例如,多肽中含有的赖氨酸侧链的氨基可以通过脱水缩合以酰胺键与谷氨酸或天冬氨酸侧链的羧基交联。可以通过在真空加热下进行脱水缩合反应而进行交联,也可以利用碳二亚胺等脱水缩合剂进行交联。
多肽分子间的交联可以使用碳二亚胺、戊二醛等交联剂来进行,也可以使用谷氨酰胺转移酶等酶来进行。碳二亚胺为通式r1n=c=nr2(其中,r1和r2各自独立地表示包含碳原子数1~6的烷基、环烷基的有机基团)所表示的化合物。作为碳二亚胺的具体例,可以列举1-乙基-3-(3-二甲氨基丙基)碳二亚胺盐酸盐(edc)、n,n’-二环己基碳二亚胺(dcc)、1-环己基-3-(2-吗啉基乙基)碳二亚胺、二异丙基碳二亚胺(dic)等。这些之中,edc和dic由于多肽分子间的酰胺键形成能力高、易于进行交联反应而优选。
交联处理优选对丝心蛋白纤维赋予交联剂并在真空加热干燥下进行交联。关于交联剂,可以对丝心蛋白纤维赋予纯品,也可以对丝心蛋白纤维赋予利用碳原子数1~5的低级醇和缓冲液等稀释至0.005~10质量%的浓度的交联剂。交联处理优选在20~45℃的温度下进行3~42小时。通过交联处理,能够对丝心蛋白纤维赋予更高的应力(强度)。
[产品]
由本发明的改造丝心蛋白形成的丝心蛋白纤维可以以纤维或丝的形式应用于机织物、针织物、编结物、无纺布等。另外,也可以应用于线环、手术用缝合线、电气部件用的可挠性把手、以及移植用生理活性材料(例如人工韧带和主动脉带)等高强度用途。
另外,本发明的改造丝心蛋白也可以应用于长丝、膜、发泡体、球体、纳米纤丝、水凝胶、树脂及其等效物,这些可以依照日本特开2009-505668号公报、日本特开2009-505668号公报、日本专利第5678283号公报、日本专利第4638735号公报等中记载的方法进行制造。
实施例
以下,基于实施例更具体地对本发明进行说明。但是,本发明并不限定于以下的实施例。
[(1)编码改造丝心蛋白的核酸的合成和表达载体的构建]
基于作为天然来源的丝心蛋白的金纺蜘蛛(genbank登录号:p46804.1、gi:1174415)的碱基序列和氨基酸序列,设计出具有序列号1~4和6~11所表示的氨基酸序列的丝心蛋白和改造丝心蛋白。序列号1所表示的氨基酸序列(met-prt313)是使上述天然来源的丝心蛋白的(a)n基序中的丙氨酸残基连续而成的氨基酸序列发生缺失以使丙氨酸残基的连续数变为5个而得到的氨基酸序列,序列号6所表示的氨基酸序列(prt313)是在序列号1所表示的氨基酸序列的n末端附加序列号5所表示的氨基酸序列(标签序列和铰链序列)而得到的氨基酸序列(比较例1、比较例2)。序列号2所表示的氨基酸序列(met-prt399)是从序列号1所表示的氨基酸序列中从n末端侧向c末端侧使(a)n基序((a)5)每隔两个发生了缺失、进而在c末端序列的近前处插入一个[(a)n基序-rep]而得到的氨基酸序列,序列号7所表示的氨基酸序列(prt399)是在该序列号2所表示的氨基酸序列的n末端附加序列号5所表示的氨基酸序列(标签序列和铰链序列)而得到的氨基酸序列(参考例1、参考例2)。序列号3所表示的氨基酸序列(met-prt380)是将序列号1所表示的氨基酸序列的rep中的ggx全部置换为gqx而得到的氨基酸序列,序列号8所表示的氨基酸序列(prt380)是在该序列号3所表示的氨基酸序列的n末端附加序列号5所表示的氨基酸序列(标签序列和铰链序列)而得到的氨基酸序列(实施例1、实施例4)。序列号4所表示的氨基酸序列(met-prt410)是将序列号2所表示的氨基酸序列的rep中的ggx全部置换为gqx而得到的氨基酸序列,序列号9所表示的氨基酸序列(prt410)是在该序列号4所表示的氨基酸序列的n末端附加序列号5所表示的氨基酸序列(标签序列和铰链序列)而得到的氨基酸序列(实施例2、实施例5)。序列号10所表示的氨基酸序列(met-prt468)是在序列号4所表示的氨基酸序列的各(a)n基序的c末端侧插入两个丙氨酸残基、进一步将一部分谷氨酰胺(q)残基置换为丝氨酸(s)残基、并使n末端侧的一部分氨基酸缺失以使其与序列号4的分子量大致相同而得到的氨基酸序列,序列号11所表示的氨基酸序列(prt468)是在序列号10所表示的氨基酸序列的n末端附加序列号5所表示的氨基酸序列(标签序列和铰链序列)而得到的氨基酸序列(实施例3)。
分别合成编码具有在所设计的序列号1~4和10所表示的氨基酸序列各自的n末端附加有his标签序列和铰链序列(序列号5)的序列号6~9和11所表示的氨基酸序列的蛋白质的核酸。该核酸中,在5’末端附加有ndei位点、在终止密码子下游附加有ecori位点。将这四种核酸克隆至克隆载体(puc118)中。然后,利用ndei和ecori对该核酸进行限制酶处理并将其切出后,重组到蛋白质表达载体pet-22b(+)中得到表达载体。
[(2)蛋白质的表达]
利用包含编码具有序列号6~9和11所表示的氨基酸序列的蛋白质的核酸的pet22b(+)表达载体对大肠杆菌blr(de3)进行转化。将该转化大肠杆菌在含有氨苄青霉素的2ml的lb培养基中培养15小时。将该培养液添加到含有氨苄青霉素的100ml的种子培养用培养基(表6)中,使od600达到0.005。将培养液温度保持于30℃,进行烧瓶培养直至od600达到5为止(约15小时),得到种子培养液。
[表6]
表6.种子培养用培养基
将该种子培养液添加到添加有500ml的生产培养基(表7)的发酵罐中,使od600达到0.05。将培养液温度保持于37℃,在ph6.9下控制恒定而进行培养。另外,将培养液中的溶解氧浓度维持于溶解氧饱和浓度的20%。
[表7]
表7.生产培养基
在生产培养基中的葡萄糖被完全消耗后,立即以1ml/分钟的速度添加补料液(葡萄糖455g/1l、酵母提取物120g/1l)。将培养液温度保持于37℃,在ph6.9下控制恒定而进行培养。另外,将培养液中的溶解氧浓度维持于溶解氧饱和浓度的20%,进行20小时培养。然后,向培养液中添加1m的异丙基-β-硫代吡喃半乳糖苷(iptg)以使终浓度达到1mm,诱导表达目标蛋白质。在添加iptg后经过20小时的时刻,离心分离培养液,回收菌体。使用由添加iptg前和添加iptg后的培养液制备的菌体进行sds-page,根据依赖于iptg添加的目标蛋白质大小的条带的出现,确认到目标蛋白质的表达。
[(3)蛋白质的纯化]
将添加iptg后2小时后回收的菌体用20mmtris-hcl缓冲液(ph7.4)进行清洗。使清洗后的菌体悬浮在包含约1mm的pmsf的20mmtris-hcl缓冲液(ph7.4)中,利用高压均质器(geanirosoavi公司)将细胞破碎。将破碎的细胞离心分离,得到沉淀物。利用20mmtris-hcl缓冲液(ph7.4)清洗所得到的沉淀物,直至达到高纯度为止。将清洗后的沉淀物以达到100mg/ml的浓度的方式悬浮在8m胍缓冲液(8m胍盐酸盐、10mm磷酸二氢钠、20mmnacl、1mmtris-hcl、ph7.0)中,在60℃下用搅拌器搅拌30分钟,使其溶解。溶解后,使用透析管(三光纯药株式会社制造的纤维素管36/32)在水中进行透析。通过离心分离来回收透析后得到的白色凝集蛋白质,利用冷冻干燥机除去水分,回收冷冻干燥粉末。
所得到的冷冻干燥粉末中的目标蛋白质的纯化度通过使用totallab(nonlineardynamicsltd.)对粉末的聚丙烯酰胺凝胶电泳的结果进行图像分析来确认。其结果,任一蛋白质的纯化度均为约85%。
[(4)纺丝液(胶液)的制备]
使用预先溶解有4质量%的氯化锂作为添加物的dmso作为主溶剂,将上述制备的prt313(序列号6:比较例1)、prt399(序列号7:参考例1)、prt380(序列号8:实施例1)、prt410(序列号9:实施例2)和prt468(序列号11:实施例3)蛋白质的冷冻干燥粉末添加到主溶剂中,以使浓度达到24质量%。利用90度的旋转混合器溶解1小时并在80度下溶解15小时后,利用烧结金属过滤器进行过滤,去除杂物。接着,静置1小时而除泡,制成纺丝液(胶液)。纺丝液的粘度根据蛋白质的种类和温度会多少有所不同,在prt410的情况下,在35℃下为5000cp(厘泊)。
[(5)纺丝]
将纺丝液填充到储液罐中,使用齿轮泵从直径0.1mm或0.2mm的多孔喷嘴中向100质量%甲醇凝固浴槽中喷出。喷出量调节为3~6ml/分钟。凝固后,在100质量%甲醇清洗浴槽中进行清洗和拉伸。清洗和拉伸后,使用干热板使其干燥,将所得到的原丝(纤维)进行卷取。
[物性测定]
如下测定所得到的原丝的物性。
(a)使用光学显微镜求出纤维的直径。
(b)在温度20℃、相对湿度65%的条件下使用拉伸试验机(instron3342)对纤维的应力、初期弹性模量、伸度(断裂点位移、位移)进行测定,利用下式算出韧度。在拉伸试验中,以10m秒的间隔进行测定。各样品粘贴在用厚纸制作的模具框中,夹具间距为20mm、拉伸速度为10mm/分钟。载荷传感器容量为10n、夹具为夹式。测定值采用样品数n=5的平均值。
韧度利用下述算式求出。
韧度=[e/(r2×π×l)×1000](单位:mj/m3)
在此,
e:破坏能(单位:j)
r:纤维的半径(单位:mm)
π:圆周率
l:拉伸试验测定时的夹具间距:20mm
将各蛋白质的冷冻粉末的生产量、各原丝的应力、韧度和伸度的测定结果以设prt313(序列号6:比较例1)的值为100时的相对值示于表8。
[表8]
使rep中的甘氨酸残基的含量降低的改造丝心蛋白的生产率显著提高(实施例1)。另外,在rep中的甘氨酸残基的含量降低的基础上还使(a)n基序的含量降低的改造丝心蛋白的生产率进一步显著提高,并且观察到韧度和伸度的提高(实施例2和3)。
接着,如下所示地变更纺丝条件,对上述制备的纯化蛋白质、prt313(序列号6:比较例2)、prt399(序列号7:参考例2)、prt380(序列号8:实施例4)和prt410(序列号9:实施例5)进行纺丝,利用与上述同样的方法测定物性,并进行比较。
纺丝液利用与上述(4)纺丝液(胶液)的制备同样的方法进行制备。将所制备的纺丝液填充到储液罐中,使用齿轮泵从直径0.2mm的喷嘴中向100质量%甲醇凝固浴槽中喷出。喷出量调节为0.050~0.052ml/分钟。凝固后,在100质量%甲醇清洗浴槽中进行清洗,在50度的热水浴中进行3倍拉伸。清洗和拉伸后,使用60度的加热辊使其干燥,将所得到的原丝(纤维)进行卷取。
将各原丝的应力、韧度和伸度的测定结果以设prt313(序列号6:比较例2)的值为100时的相对值示于表9。
[表9]
使rep中的甘氨酸残基的含量降低的改造丝心蛋白维持了强度(应力和韧度)和伸度(实施例4)。另外,在rep中的甘氨酸残基的含量降低的基础上还使(a)n基序的含量降低的改造丝心蛋白在维持应力的状态下观察到韧度和伸度的提高(实施例5)。
- 还没有人留言评论。精彩留言会获得点赞!