用于细胞培养容器的适配器的制作方法
本发明涉及用于细胞培养容器的可灭菌适配器,其包括用作优选液体或气体物质的入口和/或出口的至少一个端口,从而允许在受控培养条件下使用分批、补料分批、重复补料分批和/或连续培养条件(例如,灌注培养条件)在细胞培养容器中进行微生物培养和细胞培养。
背景技术:
在微生物培养和细胞培养中,尤其是在动物、植物和人体细胞的培养中,使用了各种类型的生物反应器。
在商业生物技术过程中,通常在ph、溶解氧浓度、液体液位、温度和废气分析方面受控的条件下在装备齐全的大型生物反应器中执行细胞培养。装备齐全的生物反应器提供用于供给营养液、添加用于ph控制的酸和碱或供给消泡剂的端口,以及用于取样或连续去除细胞悬液或发酵液的端口。在ph、温度和氧供应方面受控的条件确保不同的细胞培养时段之间的可比性以及再现性,这对于一致且可靠的产物品质而言是重要的。取决于细胞类型和待开发和优化的过程,要求分批、补料分批、重复补料分批、灌注和/或连续培养条件,例如灌注培养条件。
在上述生物技术过程的开发和优化期间,多种参数——诸如细胞系、介质和给料——需要改变和调整以便提高产物品质和生产效率。
当改变和调整各个参数以便优化细胞培养条件时,或者需要大量的生物反应器,或者只能够一个接一个地分析各个参数,从而导致非常长的低效率的过程开发时间。此外,在两种情况下,待测试的每个参数都要求设置完整的、装备齐全的细胞培养生物反应器,从而导致极高的成本,特别是在连续细胞培养的情况下导致极高的成本。
因此,存在对简化的系统的需求,该简化的系统允许更快、更高效且成本降低的过程开发,其理想地具有装备齐全的生物反应器在过程控制、给料、取样和监测方面的功能。
已经令人惊讶地发现,该目的能够通过提供如下文描述的用于细胞培养容器的可灭菌适配器来实现。
技术实现要素:
因此,在本文的第一方面中提供了用于细胞培养容器的可灭菌适配器,其包括主体、上连接部和/或盖子、至少一个端口、通风通道、适合于连接到细胞培养容器的下部内连接部,以及细胞保留装置和/或细胞分离装置。
在第二方面中提供了一种装置,其包括如上文描述的可灭菌适配器、细胞培养容器和盖子。
在另一方面中,本文提供了上文描述的装置的用途。
在又另一方面中,本文提供了使用如上文描述的可灭菌适配器和/或如上文描述的装置的细胞培养方法。
附图说明
本领域技术人员将理解,下文描述的附图仅用于说明的目的。附图不意图于限制本发明的范围。
图1示出了包括可灭菌适配器和细胞保留装置的装置的示意性概览。
图2示出了包括液位传感器的可灭菌适配器的示意性概览。
图3示出了从上方看的示例性的可灭菌适配器。
图4示出了图3的示例性装置的侧视图,该装置包括可灭菌适配器和细胞培养容器。
图5示出了包括可灭菌适配器和细胞培养容器的示例性装置的另一视图。
图6示出了示例性细胞保留装置的示图,即过滤膜的示图。
图7示出了示例性可灭菌适配器的示图。
图8示出了包括细胞培养容器和与图4相比的可灭菌适配器的替代性实施例的另一示例性装置。
图9示出了为具有4mm、6mm和10mm的内直径的细胞保留装置确定的针对20.8ml/h和41.6ml/h的灌注速率的pan-x泄漏值的概览。
图10a和图10b示出了细胞保留装置的示例性设备的示图。
具体实施方式
应当理解的是,本文所使用的术语仅用于描述特定实施例的目的,并且不意图为限制性的。如在本说明书中和所附权利要求中使用的词语“一”和“一个”表示“一个或多个”。
本文提供的是用于细胞培养容器的可灭菌适配器,其包括主体、上连接部和/或盖子、至少一个端口、通风通道、适合于连接到细胞培养容器的下部内连接部,和细胞保留装置和/或细胞分离装置。
结合标准细胞培养瓶使用该可灭菌适配器允许在连续培养条件(例如,灌注培养条件)下进行细胞培养。另外,使用该可灭菌适配器还能够执行补料分批、重复补料分批和分批培养。换句话说,通过采用该可灭菌适配器,可以在可再现且可比较的条件下使用标准细胞培养容器执行细胞培养,标准细胞培养容器比装备齐全的生物反应器更容易获得、更易于操作并且更为成本有效
由于小规模,用于开发和优化生物技术过程的成本降低,因为需要更少的培养介质和材料,并且最小化了在装备和花费在培养的维持上的时间方面的要求。
此外,可灭菌适配器与现有技术已知的装置不同,主要因为细胞保留装置和/或细胞分离装置使本文描述的可灭菌适配器适合于小规模细胞培养。由于将待培养的细胞保留在细胞培养容器内的细胞保留装置,所以甚至在小规模上进行连续灌注细胞培养是可行的。如果使用为小培养体积优化的细胞分离装置,则也能在小规模上进行连续灌注细胞培养。因此,通过采用本文描述的可灭菌适配器,可以在可再现且可比较的条件下执行细胞培养,从而在可能具有装备齐全的生物反应器在过程控制、给料、取样和监控方面的功能的情况下允许更快、更高效且成本降低的过程开发。
如本文所使用的,术语“分批”指的是一种培养条件,其中在培养期间不向细胞培养添加细胞培养介质并且不发生细胞培养介质的连续去除。换句话说,同样在分批类型的培养条件下,在培养期间能够在不同的时间点(例如在取样期间)去除细胞培养介质。
如本文所使用的,术语“补料分批”指的是一种培养条件,其中在培养期间向细胞培养添加细胞培养介质,但在培养期间不发生细胞培养介质的连续去除。
如本文所使用的,术语“重复补料分批”指的是一种补料分批培养条件,其中定期地部分地去除细胞培养介质并且随后添加营养液。
例如,所述营养液能够是包含葡萄糖的溶液,并且添加所述营养液直到在再次达到细胞培养介质的原始液位。
如果在处于分批、补料分批或重复补料分批条件下的细胞培养期间不需要可灭菌适配器的细胞保留装置和/或细胞分离装置,则所述细胞保留装置和/或细胞分离装置可以——取决于所采用的可灭菌适配器的类型——仅被封闭或被从所述可灭菌适配器移除。
如本文所使用的,术语“连续”指的是一种培养条件,其中在培养期间诸如细胞培养介质的溶液被添加到细胞培养并且从细胞培养连续地抽出该溶液。
如本文所使用的,术语“灌注”指的是一种类型的连续细胞培养,其中在培养期间细胞培养介质被添加到细胞培养并且连续地从细胞培养去除细胞培养介质。为了维持细胞密度水平,所培养的细胞的至少一部分需要在灌注细胞培养条件下被保留在细胞培养容器中或从被去除的介质分离。在细胞培养容器外分离的情况下,一旦细胞已经从所抽出的溶液中被分离出,就将被送回到细胞培养容器。另外,在灌注培养条件下,所培养的细胞的一部分通常被丢弃,即不被保留在细胞容器中或不送回到细胞容器,以便维持给定的目标细胞密度并且去除不能存活的细胞(“净化”)。
如本文所使用的,术语“可灭菌”指的是以下事实:能够通过已知的方法使所讨论的材料无菌,所述方法例如是高压灭菌、伽马辐射或化学灭活。
所述可灭菌适配器的主体包括选自如下组的至少一种材料,所述组由不锈钢、合成材料和/或半合成材料组成,所述合成材料和/或半合成材料诸如是聚醚醚酮(peek)、聚四氟乙烯(ptfe)、聚偏二氟乙烯(pvdf)或硅树脂弹性体。
在优选实施例中,所述可灭菌适配器的主体由聚醚醚酮(peek)制成。
如本文所使用的,术语“上连接部”指的是所述装置适于附接到盖子的部分,例如附接到所选择的细胞培养容器的原始盖子。
如本文所使用的,术语“适合于连接到细胞培养容器的下部内连接部”指的是所述装置适于附接到细胞培养容器的部分。
所述附接可以是例如通过插入、胶合或旋拧实现。
如本文所使用的,术语“通风通道”指的是允许在细胞培养容器内部的气相与可灭菌适配器的上连接部或盖子以及最终与周围大气之间的气体交换的部件,所述周围大气例如是培养箱或温度受控的培养间。
如本文所使用的,术语“端口”或“连接器”指的是开口,物质能够通过该开口被添加到细胞培养容器内部或从所述细胞培养容器内部去除。
因此,所述端口用作入口和/或出口,并且它们的形状、它们的确切位置、它们的数量以及它们的尺寸能够取决于实验要求而变化。
如本文所使用的,术语“细胞分离装置”指的是在细胞培养容器外将细胞与介质分离的部件。因此,当使用细胞分离装置时,细胞的至少一部分通常在分离之后被送回到细胞培养容器,以便维持细胞密度水平。
如本文所使用的,术语“细胞保留装置”指的是在允许从细胞培养容器去除诸如细胞培养介质的其他物质的同时保留细胞的部件。
换句话说,细胞保留装置或者保留存在于培养容器中的培养介质中的细胞,或者在细胞已经和培养介质一起被抽出之后保留所述细胞。然而,同样在第二种情况下,细胞不离开培养容器。相反,在细胞培养容器内实施细胞保留,即从介质去除细胞。
细胞保留装置的用途能够与细胞分离装置的用途结合。
此外,可以采用超过一个的细胞保留装置和/或细胞分离装置。
细胞保留装置的示例是由例如合成材料、弹性体材料或金属构造材料制成的管件。呈由合成构造材料制成的管件形式的细胞保留装置的示例是塑料管件或硅树脂橡胶管件。呈用于细胞保留的膜形式的细胞保留装置的示例是具有在0.1μm与10μm之间的孔尺寸且由例如聚醚砜或聚丙烯制成的用于细胞保留的膜或脉冲式透析膜。
在一实施例中,呈金属管件形式的细胞保留装置由不锈钢制成。
一种类型的细胞保留装置的用途能够与属于相同类型或属于不同类型的一个或多个其他细胞保留装置的用途结合。
在现有技术中已知采用脉冲式透析膜以用于细胞保留(参阅.meier等2014)。在摇瓶的情况下,上述装置的膜在旋转期间将在细胞培养介质中被携带。
优选地,细胞保留装置保留与细胞保留装置接触的细胞的超过80%,甚至更优选地超过90%,并且最优选地100%。
通过确定灌注速率来计算细胞保留率。灌注速率描述了与发酵罐中的总培养体积相比所收集的培养液的量。灌注速率的单位是体积/天。收集流率以ml/min为单位并且体积以l为单位(1.44将ml/min转换到l/天)。
以体积/天为单位:
k洗涤
k洗涤值以单位%描述在收集中损失的活细胞的百分比:
在收集流中和在生物反应器中的活细胞浓度分别用nh和nf表示。k洗涤,总描述了在收集中损失的总细胞百分比。
以%单位:
在收集流中和在生物反应器中的总细胞浓度分别用nh,总和nf,总表示。为了确定样品中的细胞数量,可以用商业上可购得的细胞计数器来对细胞进行计数,所述细胞计数器诸如是“cedexhires分析仪”,罗氏创新,德国。
k洗涤值优选地在20%-0.1%之间,更优选地在10%-0.1%之间,并且最优选地在2%-0.1%之间。
取决于所培养的细胞和所使用的细胞培养容器,细胞保留装置的几何形状可以变化,例如所述细胞保留装置可以是圆的或矩形的。
因此,取决于所培养的细胞和所使用的细胞培养容器,所述细胞保留装置的内直径、长度、形式和形状可以变化。
细胞保留装置的示例性形式——特别是用作细胞保留装置的弹性体的、塑料的或金属管件形式——是笔直的和/或弯曲的和/或笔直的且相对于水平线以在10゜与90゜之间的角度倾斜,更优选地以在60゜与80゜之间的角度倾斜,并且最优选地以70゜-75゜的角度倾斜。
在优选实施例中,用作细胞保留装置的管件是笔直的并且以在40゜与80゜之间的倾斜角倾斜。
因此,这些细胞保留装置利用重力,即它们是重力细胞沉降器。
换句话说,在一实施例中,本文所描述的用于细胞培养容器的可灭菌适配器的特征在于,所述至少一个细胞保留装置是重力细胞沉降器。
此外,细胞保留装置、特别是用作细胞保留装置的管件可以具有锥形或柱形形状。
此外,细胞保留装置、特别是用作细胞保留装置的管件,可以具有在2mm与20mm之间、更优选地在2mm与12mm之间、最优选地在3mm与10mm之间的内直径。
另外,细胞保留装置、特别是用作细胞保留装置的管件,可以具有在2cm与100cm之间、更优选地在10cm与40cm之间、并且最优选地在12与30cm之间的长度。
在优选实施例中,用作细胞保留装置的管件具有在2mm与20mm之间的内直径和30cm的长度。
上述细胞保留装置是优选的,因为其确保了恒定的细胞保留率,其使细胞损伤最小化,其能够在整个细胞培养时间段上使用,并且其确保保留时间是足够的。
在另一优选实施例中,由弹性体管制成的细胞保留装置是具有4.8mm的直径和163mm的长度的笔直的硅树脂管件。
在另外的优选实施例中,所述细胞保留装置由不锈钢制成,其具有20cm-24cm的长度、8mm-12mm的内直径,并且相对于水平线以70-75゜的角度倾斜。
该实施例具有的效果是:所述细胞保留装置——此处为重力细胞沉降器——在获得并维持高细胞密度的同时有助于小规模细胞培养中的灌注细胞培养。
甚至在其上安装有包括细胞保留装置的该实施例的可灭菌适配器的细胞培养容器是摇瓶(即在恒定的轨道旋转运动期间在摇动的细胞培养条件下进行小规模细胞培养)的情况下,获得并维持这些高细胞密度。这是令人惊讶的,因为——在不希望被理论束缚的情况下——原本以为恒定的轨道旋转运动会干扰细胞在基于重力工作的细胞保留装置中的沉降并且因此不可能获得并维持高细胞密度。
该实施例的一个示例是由不锈钢制成的细胞保留装置,其具有23.5cm的长度、10mm的内直径和相对于水平线成74°的倾斜角。
如本文所使用的,术语“小规模细胞培养”指的是具有1ml至500ml的培养体积的细胞培养。
优选地,小规模细胞培养具有90至170ml的培养体积。
如本文所使用的,术语“高细胞密度”指的是10-80×106个细胞/ml的活细胞数量以及细胞培养始于低于10×106个细胞/ml的细胞密度的事实。此外,一旦达到期望的高细胞密度值后,就贯穿整个细胞培养时间段基本上维持该期望值。在一实施例中,高细胞密度细胞培养具有18-40×106个细胞/ml的活细胞数量。
细胞培养密度取决于若干因素,例如初始细胞数量、细胞的生长率、添加和去除培养介质的速率或收集细胞率。可以例如每天测量细胞培养密度,通过从培养中抽取样本并且用诸如cedexhirex的细胞计数装置对细胞进行计数来测量。替代地或另外的,可以在细胞培养时间段结束时确定细胞培养浓度。
在一示例中,以下培养条件适用:细胞培养容器中10-80×106个细胞/ml的活细胞数量,0.01-5×106个细胞/ml的收集细胞率以及相对细胞培养体积以0.05-1.51/h添加培养介质和去除培养介质的速率【体积/体积/小时】。
典型的细胞培养周期是4至8周。因此,重要的是,细胞保留装置不需要在这个时间期间被更换。更换细胞保留装置的主要原因是阻塞或泄漏。
此外,细胞停留时间,即细胞在细胞保留装置内度过的时间,对给定的细胞类型而言必须是足够的,否则细胞可能由于例如缺氧和/或缺乏营养或者通过形成聚集而损伤。
优选地,细胞分离装置保留与细胞分离装置接触的细胞的超过80%,甚至更优选地超过90%,并且最优选地100%。
细胞分离装置的示例是倾斜通道重力沉降器、过滤装置或离心机。倾斜通道重力沉降器在本文本内被称为“沉降器”。
在优选实施例中,所述细胞分离装置是沉降器。在尤其优选的实施例中,所述沉降器是由热塑性和弹性体构造材料制成的预灭菌的一次性使用的沉降器,如在wo2013124326a1和wo2013124329a1中所描述的。
该实施例允许在细胞培养容器外的小体积中分离细胞。
在本文描述的用于培养容器的可灭菌适配器的一个实施例中,所述培养容器是也被称为摇瓶的摇动器容器,即适合于在摇动的同时培养微生物、酵母、植物细胞和动物细胞的容器。
在摇瓶被用于培养的情况下,本文描述的可灭菌适配器克服了中断摇动过程以用于取样、添加介质或其他成分的需求。因此,所述可灭菌适配器能够在不中断的情况下实现摇瓶中受控且被监测的细胞培养条件,并且因此确保一致的培养条件。这些一致的培养条件是将不同的细胞培养时段进行相互比较并因此调整各个参数以便优化细胞培养条件的先决条件。
此外,在一个培养箱中安装在一个摇动平台上的具有本文描述的可灭菌适配器的若干摇瓶的并行培养显著降低了培养成本和复杂度,因此仍然允许在可再现且可比较的条件下更快、更高效且成本降低的过程-开发。
优选的摇瓶是erlenmeyer瓶。
所述摇瓶优选地是(即摇动条件是)以40至1000rpm摇动,更优选地以100至500rpm摇动,最优选地以80-120rpm摇动。
此外,优选地使用在1mm与50mm之间、更优选地在15mm与35mm之间、最优选地25mm的摇动半径。
此外,优选地采用具有在50ml与5000ml之间、更优选地在100与1000ml之间、最优选地500ml的总体积的摇瓶。
优选地,摇瓶的相对填充体积位于所述摇瓶的总体积的5%与50%之间,更优选地在10%与30%之间,更优选地,所述相对填充体积是20%。
在一实施例中,本文描述的用于细胞培养容器的可灭菌适配器是用于小规模细胞培养的可灭菌适配器。
如上文所描述的,如本文所使用的,术语“小规模细胞培养”指的是具有1ml至500ml的培养体积的细胞培养。
优选地,小规模细胞培养具有90至170ml的培养体积。
最优选地,小规模细胞培养具有100-145ml的培养体积。
如本文所使用的,术语“培养体积”指的是存在于包括可灭菌适配器和细胞培养容器的装置中以及细胞保留装置和/或细胞分离装置中的营养液的总体积。
具有上述小体积的细胞培养允许显著降低用于细胞培养维持的成本,即细胞培养介质、额外的因素、用于处理培养的人员以及空间要求的成本。通过采用本文描述的可灭菌适配器,这些小规模细胞培养将降低成本与可再现且可靠地模拟传统生物反应器中的细胞培养条件的可能性结合,从而提高数据品质。为了能够将在小实验室规模中做出的研究结果按比例放大到标准生产过程,这是重要的。
如上文所述,当使用摇瓶时,优选的是包括如下细胞保留装置的可灭菌适配器:所述细胞保留装置呈由不锈钢制成的重力细胞沉降器形式,其具有20cm-24cm的长度,8mm-12mm的内直径以及相对于水平线成70-75°的倾斜角。
该实施例具有的效果是,细胞保留装置在获得并维持高细胞密度的同时有助于小规模细胞培养中的灌注细胞培养。
甚至在其上安装有包括细胞保留装置的这种实施例的可灭菌适配器的细胞培养容器是摇瓶的情况下,也获得并维持这些高细胞密度,即在恒定的轨道旋转运动期间在摇动的培养条件下进行小规模细胞培养。这是令人惊讶的,因为——在不希望被理论束缚的情况下——原本以为恒定的轨道旋转运动将干扰细胞在利用重力的细胞保留装置中的沉降并且因此将不可能获得并维持高细胞密度。
通常地,其上安装有可灭菌适配器的若干个细胞培养容器在摇动平台上将被放置成紧挨着彼此。
通常将在培养箱中培养其上安装有可灭菌适配器的细胞培养容器,所述培养箱即用于生长并维持微生物培养或细胞培养的装置,其维持最佳温度、湿度和诸如内部大气的二氧化碳(co2)含量和氧含量的其他条件。然而,也可以使用诸如受控培养间的其他系统,其维持最佳温度、湿度和诸如内部大气的二氧化碳(co2)含量和氧含量的其他条件。在摇瓶的情况下,所述摇动器可以位于上述房间中。
本文描述的可灭菌适配器特别适于安装在诸如摇瓶的标准培养容器上。这种组合适于执行若干个摇瓶培养的系统,在所述系统中并行地确保细胞的均匀性,这在本领域中是众所周知的。因此,在上述系统中,对诸如温度、二氧化碳含量、摇动频率和摇动直径的培养条件的设置和维持仅要求一个用于振摇的中央驱动器、一个中央温度控制器、一个通风控制器等。因此,与搅拌生物反应器相比,这种布置通常更为成本有效且节省时间,搅拌生物反应器要求用于每个生物反应器的单独的搅拌器驱动器、温度控制器、气体供应(例如分布器)等。通过使用可灭菌适配器,克服了传统摇瓶培养的以下缺点:每次当必须抽取样本或必须添加给料溶液时,必须使摇动器停止并且必须从培养箱取出培养容器,并且必须移除摇瓶的顶盖。换句话说,不能够以恒定且因此可再现的环境条件在传统摇瓶中执行培养,因为必须从培养箱移出以及顶盖的打开已经改变了例如在ph值、po2值、pco2值、功率输入或温度方面的这些条件,并且每个细胞培养仅从这些突然的变化缓慢且单独地恢复。这导致了所培养的细胞的几乎不可预测的且也不可再现的新陈代谢变化,这进而导致不同的总产物产量或产物品质。然而,通过采用可灭菌适配器,(例如摇瓶中的)培养条件对诸如分批、补料分批、重复的补料分批和/或连续培养条件(例如,灌注培养条件)的细胞培养条件而言变得可再现并且可比较。甚至对小规模细胞培养而言也是如此。因此,所述可灭菌适配器确保在降低成本的同时确定用于按比例放大的参数的过程更有效。
在一实施例中,本文描述的可灭菌适配器还包括至少一个液位传感器。
如本文所使用的,术语“液位传感器”指的是测量变送器,所述测量变送器将液体的液位测量结果转换成机械信号、电信号或气动信号,然后这些信号能够方便地被传输、处理并被记录。所述液位传感器确保细胞培养容器中的液体(例如,营养液或细胞培养介质)的液位在处于给定的培养条件下的所培养的细胞的容忍范围之内是恒定的。
使用液位传感器有助于在连续培养条件(例如,灌注培养条件)下的小规模细胞培养。情况如此,是因为小培养体积总是具有培养容器的液体被耗尽或培养容器被过度填充液体的风险。通过监测液体液位,使这种风险最小化。
在液体液位过低或过高的情况下(例如在灌注培养条件的情况下),体积流率能够被相应地调整。
在一实施例中,液位传感器连接到端口。
在另一实施例中,液位传感器定位在可灭菌适配器的通风通道中。
在另外的实施例中,所述可灭菌适配器的主体包括用于液位传感器的插入件,例如通过螺纹和紧固夹具连接(图8)。
在优选实施例中,在灌注培养的情况下,每天执行一次对细胞培养容器中的液体液位的测量,以及如果必要的话每天执行一次对体积流率的调整。
确定液体液位的不同方式是精确地监测添加的物质和从培养容器去除的物质,所述物质包括在培养期间取出的液体样本。这种方法能够作为补充使用或作为替代方案使用。
在小规模培养体积的情况下,可以采用通过监测被添加和去除的物质来确定细胞培养的液体水平、采用液位传感器的结合,以便特别是在灌注培养条件的情况下严格控制液体液位。
液位传感器的示例是浮动传感器、流体静力传感器、电传感器、热传感器和光学传感器。这些在现有技术中都是已知的。
在本文描述的可灭菌适配器的优选实施例中,所述可灭菌适配器包括至少一个电极和/或至少一个导电探针作为液位传感器。
这种液位传感器的示例是电容液位传感器和电导液位传感器。
电容液位传感器的工作原理在于以下事实:液体液位的增大导致测量电极浸入更深并且因此增大其电容信号。例如,这种测得的电容例如设置液位测量仪的输出。
另一方面,电导液位传感器评价所测量的介质的电阻的变化。这能够例如通过评价两个电导探针之间的电阻变化来实施,或评价电导探针与另一金属物体(例如,容器壁或细胞保留装置)之间的电阻变化来实施。
优选地,所述液位传感器在培养期间监测液体液位并且确保液体液位在期望体积的±50%的范围之内恒定,更优选地在期望体积的±10%的范围之内恒定,最优选地在期望体积的±5%的范围之内恒定。
因此,如果所述水平在该范围之外,则调整条件,例如通过添加更多的液体或去除更少的液体。
优选的电导液位传感器是来自eppendorfag,汉堡,德国的“dasgip®液位传感器”,其具有22cm的长度和3mm的直径。
使用所述可灭菌适配器在能够培养的细胞类型方面不存在限制,例如,其能够用于培养微生物细胞、哺乳动物细胞、昆虫细胞、酵母细胞或植物细胞。换句话说,如本文所使用的,术语“细胞培养”指的是培养微生物细胞、哺乳动物细胞、昆虫细胞、酵母细胞或植物细胞。
优选地,所述所培养的细胞是哺乳动物细胞。
此外,所述可灭菌适配器不只能够用于任何类型的细胞培养,而且还能够用于任何细胞培养目的。尤其优选的目的——如上文所提到的——是对细胞培养条件的优化,以便例如在产物产量、产物品质方面优化生物技术过程,或者以便降低培养成本。
在这一背景下,术语“生物技术”指的是使用微生物或诸如细菌、酵母、昆虫、植物或哺乳动物细胞的细胞来执行特定的工业或制造过程。
上连接部的优选示例是上部外螺纹,因为螺纹有助于可灭菌适配器与合适的盖子的快速且可靠的连接,所述盖子例如是所述适配器所附接到的合适的细胞培养容器的盖子。
替代上连接部或在上连接部的基础上,所述可灭菌适配器还能够包括盖子。
优选地,所述盖子包括允许在细胞培养容器内部与例如细胞培养箱的环境之间的气体交换的膜。
取决于为给定的实验选择的细胞培养容器,上连接部和/或盖子的直径能够变化。
在本文描述的可灭菌适配器的优选实施例中,适合于连接到细胞培养容器的下部内连接部是适合于旋拧入螺纹中的螺纹,因为螺纹有助于可灭菌适配器与具有对应螺纹的合适的细胞培养容器的快速且可靠的连接。
取决于为给定的实验选择的细胞培养容器,适合于连接到细胞培养容器的下部内连接部的直径可以变化。
因此,取决于为给定的实验选择的细胞培养容器,所述可灭菌适配器的直径和尺寸可以变化,以便使所述可灭菌适配器装配到细胞培养容器并适于所述给定的细胞培养容器的原始盖子。
在一实施例中,所述可灭菌适配器具有88mm的高度、顶部处的42mm的直径、50mm的外直径和底部处40mm的内直径、四个端口,每个端口具有46mm的长度和2mm的内直径,以及具有10mm的内直径的通风通道。在图7中描绘了本文描述的可灭菌适配器的该特定实施例。
所述可灭菌适配器可以是一次性的(即用于一次性使用)或能够重复使用。
此外,可能的是,在给定的实验期间改变细胞培养条件,例如,细胞首先在补料分批的条件下培养,随后在灌注条件下培养。
通过可灭菌适配器添加和/或去除的所采用的物质可以呈固体、液体或气体状态。优选地,所添加或去除的物质是液体或气体。
关于可灭菌适配器的端口:通常地,如果给定的端口在给定的实验中用作用于特定物质的入口,那么它将不用作用于另一物质的入口或用作出口。
然而,还有可能的是,给给定的端口分配超过一种功能,例如,细胞培养介质可以通过特定的端口添加,并且此外待培养的细胞可以通过这个端口添加。实现上述目的的一种方式是通过使用连接到所述端口的无菌y形管,其中“y”的一个臂被用于添加细胞培养介质,并且一个臂被用于添加待培养的细胞。
如果在分批培养期间,没有使用所有的连接器,那么它们可以配备有过滤器或被封隔。
优选地,所述可灭菌适配器具有2至20个端口,更优选地2至10个端口,甚至更优选地4至8个端口。
在所述可灭菌适配器的优选实施例中,所述端口是笔直的。
替代地,所述端口是弯曲的,例如“l”形的。
在所述可灭菌适配器的另外的优选实施例中,所述端口在所述适配器的主体内被竖直地定位或以一定的斜度定位。
优选地,所述斜度处于45°角度。
在优选的实施例中,所述适配器的端口是笔直的。因此,在所述端口内不存在无效空间,因此使被添加或去除的物质保留在端口中的风险最小化。所述笔直的端口可以例如竖直地定位或者以45°角度定位。
优选地,所述可灭菌适配器的端口具有1.5-3.5mm的内直径,优选2.3mm。
在优选实施例中,所述可灭菌适配器具有5个端口。在这五个端口中,四个端口就长度和直径方面具有相等的尺寸,而第五个端口被构造成允许收集流通过细胞保留装置流出。
该实施例能够与上文描述的实施例结合,其中,可灭菌适配器的主体包括用于液位传感器的插入件,例如,通过螺纹和紧固夹具连接。这种组合导致如图8中描绘的可灭菌适配器。
此外,如图4中所示,在端口离开可灭菌适配器的主体的位置处,所述可灭菌适配器的外直径可以更小。
如果所述可灭菌适配器具有超过一个的端口,则所述端口可以布置成与彼此距离相等和/或相对于所述可灭菌适配器的总高度处于相同位置处。
在本文描述的可灭菌适配器的另外的优选实施例中,所述细胞保留装置连接到至少一个端口,或者所述细胞保留装置定位在所述适配器的通风通道中。
取决于诸如所培养的细胞类型、选择的细胞培养容器以及选择的细胞培养体积的参数,可以有利的是,所述细胞保留装置定位在所述适配器的通风通道中。
在上述实施例中,在灭菌(例如高压灭菌)之前,所述细胞保留装置优选地安装到所述盖子中,所述盖子将与所述可灭菌适配器一起被使用。
在一实施例中,本文描述的可灭菌适配器包括细胞保留装置,并且所述细胞保留装置的内表面被改性以便进一步提高所选择的表面材料的滑动性质。如果所述表面和/或所述细胞保留装置是例如由不锈钢制成的,则表面的所述改性能够例如通过电解抛光和/或通过镜面抛光实现。如果所述表面/或所述细胞保留装置是例如由玻璃制成的,则玻璃表面可以就其疏水和/或亲水性质方面被改性。本领域技术人员还已知改性其他材料(例如塑料)的表面的另外的方法。
在不希望被理论束缚的情况下,似乎特别是在利用重力的细胞保留装置(即重力细胞沉降器)的情况下,内表面的表面品质会影响细胞滑下细胞保留装置的速率。换句话说,所述表面的滑动性质越好,利用重力的细胞保留装置的细胞保留特性越好。
因此,在另外的优选实施例中,所述细胞保留装置是由不锈钢制成的重力细胞沉降器,其具有20cm至24cm的长度,8mm至12mm的内直径,相对于水平线以70至75°的角度倾斜,并且具有经电解抛光的内表面。
在优选实施例中,所述可灭菌适配器还包括选自如下组的至少一个部件,所述组由:管、过滤器、软管喷嘴、螺钉连接器、鲁尔锁(luerlock)连接器和外部细胞分离器组成。
优选地,所述软管喷嘴是具有近似5cm的长度的金属软管喷嘴。
另一方面,本发明提供包括如上文描述的可灭菌适配器和细胞培养容器的装置。此外,如果该适配器并非已经包括盖子,则所述装置优选地包括盖子。
在图1和图8中描绘了上述装置的示例。
在优选实施例中,所述装置适于1ml至170ml的培养体积。
在特别优选的实施例中,所述装置适于在100ml至145ml的培养体积中培养在灌注类型的细胞培养条件下的高细胞密度。
优选地,所述装置作为整体或其局部是可灭菌的。
优选地,所述盖子是最初属于所述装置的所述细胞培养容器的盖子。
优选地,所述装置还包括选自如下组的部件,所述组由:至少一个ph传感器点、传统ph电极、光密度传感器、溶解氧传感器、电导传感器和/或电容传感器组成。
另外一方面,本发明涉及如上文描述的可灭菌适配器和/或装置的用于在分批、补料分批、重复补料分批和/或诸如灌注的连续培养条件下培养细胞的用途,其中,在灌注培养条件的情况下,所述适配器包括至少2个端口。
在灌注培养的情况下,所述至少两个端口中的一个能够例如用于添加ph设置试剂和细胞培养介质(“给料”),并且所述至少两个端口中的另一个能够用于去除细胞培养介质(“收集”)并且能够从收集流取出样本。
然而,在所述用途的优选实施例中,所述可灭菌适配器包括至少四个端口,因为其容易地允许在灌注培养条件下培养。
在所述用途的另一优选实施例中,所述可灭菌适配器包括5个端口,所述端口中的4个就长度和直径方面具有相等的尺寸,并且第五个端口被构造成允许收集流通过由不锈钢制成的细胞保留装置流出,所述细胞保留装置具有23.5cm的长度、10mm的内直径和相对于水平线成74°的倾斜角。
在所述用途的另外的实施例中,所述可灭菌适配器包括5个端口,所述端口中的一个被构造成允许收集流通过细胞保留装置流出,并且一个端口用于主动顶部空间通气,因此允许为灌注条件下的高细胞密度优化细胞培养条件。
在所述用途的另外一实施例中,所述可灭菌适配器的主体包括用于液位传感器的插入件。
在所述用途的另外的实施例中,所述细胞保留装置定位在所述细胞培养容器的液相中。
因此,在所述用途的一个示例中,所述可灭菌适配器包括5个端口,所述端口中的一个被构造成允许收集流通过细胞保留装置流出,一个端口用于主动顶部空间通气,并且所述细胞保留装置定位在所述细胞培养容器的液相中。
在所述用途的优选实施例中,本文描述的可灭菌适配器和/或装置用于摇动的条件(即,恒定的轨道旋转运动)下的灌注细胞培养。
在另外一方面,本发明涉及用于在分批、补料分批、重复补料分批和/或诸如灌注的连续培养条件下进行细胞培养的方法。
在所述细胞培养方法的优选实施例中,所述方法还包括检测液体液位。
例如可以通过使用电容传感器或通过监测添加到细胞培养容器或从细胞培养容器去除的物质的重量余量来检测液体液位。
检测液体液位有助于连续培养条件(例如,灌注培养条件)下的小规模细胞培养。情况如此,是因为小培养体积总是具有培养的细胞培养介质被耗尽或培养被过度填充细胞培养介质的风险。通过监测细胞培养介质液位,使这种风险最小化。
此外,确保恒定的液体液位还有助于控制其他培养参数,比如溶解氧浓度。
在所述细胞培养方法的优选实施例中,所述可灭菌适配器包括至少两个端口并且所述细胞培养方法是灌注细胞培养。
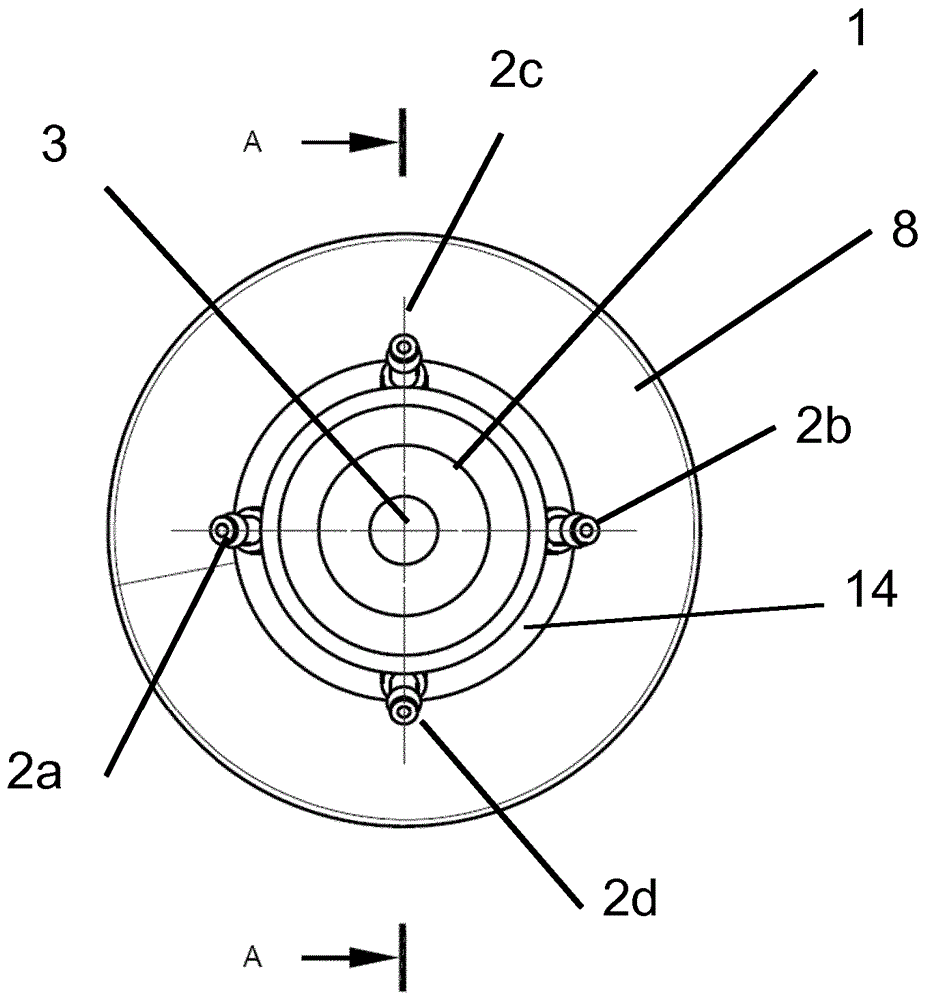
图1示出了如本文描述的可灭菌适配器和包括这种可灭菌适配器的装置(即,细胞培养容器和盖子)的示意性概览。详细地,描绘了用于细胞培养容器(8)的可灭菌适配器(1)。该示例中的可灭菌适配器包括主体(14)、上部外螺纹(4)、四个端口(2a-d)、通风通道(3)、适合于旋拧入螺纹中的内螺纹(6)以及利用重力的细胞保留装置(5)。在该示例中,可灭菌适配器(1)定位在细胞培养容器(8)上并且其用所述细胞培养容器的原始盖子(7)封闭。所述细胞培养容器容纳包括待培养的细胞(11)的细胞培养介质(9)。此外,所述细胞培养容器包括指示ph值和溶解氧分压变化的ph传感器点和溶解氧传感器点(10)。
该可灭菌适配器可以按照如下使用:
在该示例中,细胞培养容器(8)是包括盖子的预灭菌的250ml摇瓶,盖子允许通过膜通风。此外,可灭菌适配器(1)已被高压灭菌。该示例中的端口2a-2d的功能如下:端口2a允许添加待培养的细胞,端口2b允许添加细胞培养介质,端口2c允许收集细胞培养介质并且因此连接到细胞保留装置(5)。最后,端口2d允许在细胞培养时间段期间取出样本。此外,在该示例中,每个端口具有金属软管喷嘴。取决于给定的要求,无菌管和/或过滤器在培养容器内部或培养容器外部被添加到所述端口,以便确保所述细胞培养容器内部的无菌培养环境。
在设置细胞培养之前,在无菌条件下从摇瓶移除盖子(7)。然后,可灭菌适配器(1)通过适合于旋拧入螺纹中的内螺纹(6)被旋拧到细胞培养容器上,并且盖子(7)被旋拧到可灭菌适配器(1)上。之后,整个装置被转移到细胞培养室,此处细胞培养室是培养箱,在培养箱中,在合适的条件下以灌注培养模式培养细胞。
在下一步骤中,通过端口(2b)向细胞培养容器(8)添加100ml的细胞培养介质(9),并且通过端口(2a)向细胞培养容器(8)添加待培养的细胞(11)。
最终,开始灌注细胞培养,其中,通过端口(2b)连续地添加培养介质并且通过端口(2c)吸出培养介质,同时细胞保留装置将待培养的细胞保留在所述介质中。
在该示例中,通过监测添加到细胞培养容器的和从细胞培养容器去除的物质的重量余量来检测细胞培养介质的液位。
总体而言,因此,使用本文描述的适配器能够实现在具有100ml的培养体积的小规模细胞培养中进行如灌注培养的细胞培养。
图2示出了如本文所描述的可灭菌适配器和包括这种可灭菌适配器的装置(即,细胞培养容器和盖子)的概览。详细地,描绘了用于细胞培养容器(8)的可灭菌适配器(1)。该示例中的可灭菌适配器包括主体、上部外螺纹(4)、四个端口(2a-d)、通风通道(3)(虚线箭头指示气体交换)、适合于旋拧入螺纹中的内螺纹(6)、此处为重力细胞沉降器的细胞保留装置(5)、液位传感器(12)——在该例中是电导电极——以及盖子(7)。在该示例中,可灭菌适配器(1)定位在细胞培养容器(8)上。细胞培养容器容纳包括待培养的细胞(11)的细胞培养介质(9)。此外,所述细胞培养容器包括指示ph值变化的ph传感器点(10)。
在设置细胞培养之前,在无菌条件下从摇瓶移除具有液位传感器(12)的盖子(7)。然后,可灭菌适配器(1)通过适合于旋拧入螺纹中的内螺纹(6)被旋拧到细胞培养容器上,并且盖子(7)被旋拧到可灭菌适配器(1)上。之后,整个装置被转移到细胞培养室,此处所述细胞培养室是培养箱,在培养箱中,在合适的条件下以灌注培养模式培养细胞。
在下一步骤中,通过端口(2b)向细胞培养容器(8)添加100ml细胞培养介质(9),并且通过端口(2a)向细胞培养容器(8)添加到待培养的细胞(11)。
最终,开始灌注细胞培养,其中通过端口(2b)连续地添加培养介质并且通过端口(2c)连续地吸出培养介质,同时细胞保留装置将待培养的细胞保留在介质中。在该示例中,细胞培养容器(8)是摇瓶,并且以120rpm(由半圆箭头指示)的恒定的轨道旋转运动培养细胞。
在培养期间,通过液位传感器(12)监测细胞培养介质的液位,并且如果必要的话例如通过添加更多的培养介质或去除更少的培养介质来调整条件,从而确保细胞培养介质的液位在窄范围之内恒定。
总体而言,因此,使用本文描述的适配器能够实现在具有100ml的培养体积的小规模细胞培养中进行如灌注培养的细胞培养。
图3示出了包括来自上文的可灭菌适配器和细胞培养容器的示例性装置。
详细地,描绘了用于细胞培养容器(8)的可灭菌适配器(1)。此外,还示出了四个端口(2a-d)、通风通道(3)和适配器的主体(14)。另外,在可灭菌适配器的该示例中,四个端口被布置成与彼此距离相等。
图4示出了包括可灭菌适配器和细胞培养容器的示例性装置的侧视图。
详细地,描绘了用于细胞培养容器(8)的可灭菌适配器(1)。在该视图中,仅示出了三个端口2a-c,因为第四个端口位于视轴线上,由于在可灭菌适配器的该示例中,四个端口被布置成与彼此距离相等。另外,四个端口还被布置成相对于所述可灭菌适配器的总高度处于相同位置处。在该示例中,端口在细胞培养容器(8)的顶部处终止并且不像图2中描绘的示例性装置的情况中的那样延伸到细胞培养容器(8)中。此外,还描绘了通风通道(3)、主体(13)和包括待培养的细胞的细胞培养介质(9)。
图5示出了包括可灭菌适配器和细胞培养容器的示例性装置的另一视图。所描绘的是用于细胞培养容器(8)的包括主体(13)的可灭菌适配器(1)和用于所述可灭菌适配器的盖子(7),在该示例中所述盖子是所述细胞培养容器的原始盖子。在该视图中,描绘了三个端口,端口2a、2b和2d。
图6示出了示例性细胞保留装置(即过滤主体)的示图。所述细胞保留装置由两个部分组成,在这两个部分之间放置有过滤材料。为了稳定过滤材料,稳定盘也被放置到过滤主体中。所采用的过滤材料是20μm的预过滤器和10μm-过滤材料,即超微过滤器。
图7示出了示例性可灭菌适配器的示图,其包括作为上连接部的螺纹和四个端口,能够看见所述端口中的两个。
图8示出了包括可灭菌适配器和细胞培养容器的另一示例性装置。
详细地,描绘了用于细胞培养容器(8)的可灭菌适配器(1)。该示例中的可灭菌适配器包括主体(14)、上部外螺纹、五个端口(2a-e)、通风通道(3)、适合于旋拧入螺纹中的内螺纹(6)、液位传感器(12)——在该例中是电导电极——以及此处是重力细胞沉降器(5)的细胞保留装置,所述细胞保留装置相对于水平线倾斜74°(角度α)。在该示例中,可灭菌适配器(1)定位在细胞培养容器(8)——此处是摇瓶——上,并且通过上部外螺纹(4)用所述细胞培养容器的原始盖子(7)封闭该适配器。细胞培养容器容纳包括待培养的细胞(11)的细胞培养介质(9)。此外,细胞培养容器包括指示ph值和溶解氧分压的变化的ph传感器点和溶解氧传感器点(10)。
在该示例中,分配给前四个端口(2a-d)的功能如下,所述四个端口就长度和直径方面具有相等尺寸:
1)取样和接种,
2)给料添加
2)碱添加
4)主动顶部空间通气。
另一个端口(2e)被构造成允许收集流通过细胞保留装置(5)流出。
此外,在该示例中,可灭菌适配器的主体(14)包括利用螺纹和紧固夹具连接的用于液位传感器(12)的插入件。
由于该示例中的可灭菌适配器包括具有允许在所述细胞培养容器的内部与环境之间的气体交换的膜的盖子(7),出口气体通过所述膜释放以维持培养瓶内部所包含的培养环境。
此外,用0.2μm的过滤器过滤所供应的空气。
图9示出了利用聚丙烯腈微粒(pan-x)的实验的结果。
类似于用于表示在收集中损失的活细胞的百分比的术语k洗涤,微粒泄漏【%】用于相对于反应器系统中的微粒量表示在收集线中的微粒量。因为微粒泄漏的值不能与k洗涤的值直接比较,所以使用了不同的术语。详细地,为图8中示出的灌注生物反应器系统中的具有4mm、6mm和10mm的内直径的倾斜(74゜)细胞保留装置确定的针对41.6ml/h和20.8ml/h的灌注速率的pan-x泄漏【%】。
图10a和图10b示出了呈重力细胞沉降器形式的细胞保留装置的安装的示图。
示例:
示例1初步实验
在灌注培养条件下测试了包括可灭菌适配器的图4的装置。详细地,所采用的可灭菌适配器具有上连接部、上部外螺纹和作为下部内连接部的螺纹,细胞培养容器的原始盖子被旋拧到所述上部外螺纹上,所述适配器通过所述作为下部内连接部的螺纹被旋拧到所述细胞培养容器上。另外,所述可灭菌适配器具有4个笔直的竖直定位的端口、通风通道、液位传感器和细胞保留装置,此处所述细胞保留装置是重力细胞沉降器,在该例中是弹性体管件。所述细胞保留装置连接到所述端口中的一个。此外,所述端口视情况装配有诸如管、过滤器、软管喷嘴、螺钉连接器和鲁尔锁连接器的部件。
在使用之前,可灭菌适配器通过蒸汽灭菌而被灭菌。之后,在无菌工作台(洁净台)下将细胞保留装置旋拧到所述细胞培养装置上并且组装其他部件。
在所描述的可灭菌适配器的这个示例中,表达人重组凝血因子viii(rfviii)的幼地鼠肾(bhk)细胞被培养了若干周。培养条件被设置成处于36.5℃的培养箱温度——和100转每分钟(rpm)的培养箱摇动平台的摇动频率——所述摇动频率在一端时间之后被调整到120rpm——以便增加氧传递。此外,培养箱的co2水平被设置在4.5%处,培养箱的湿度水平被设置在80%处,并且液体液位(即,细胞培养容器的填充水平)被设置在150ml处。此外,在开始时,ph设置点是7.0——该ph设置点在一段时间之后被调整到ph6.8。
使用包括dasgip®控制软件的dasgip®-发酵罐控制器(dasgip®,eppendorfag,德国汉堡)在包括用于细胞培养容器的摇动平台的培养箱中执行培养。
结果显示,通过采用本文描述的可灭菌适配器,在灌注培养条件下可以在小规模上进行细胞培养,并且生成的代谢数据(数据未示出)与生产发酵罐的数据相当。
图2对不同的细胞保留装置的评定
在不同的实验中,如表1中所示出的长度和形式不同的各种管件被作为细胞保留装置测试。
表1
*相对于水平线倾斜70°
在该示例中,表达rfviii的bhk细胞被培养了若干天。在500ml的摇瓶中用150ml的工作体积执行细胞培养。培养条件被设置到36.5℃的培养箱温度和80至100转每分钟(rpm)的培养箱摇动频率。此外,培养箱的co2-水平被设置在4.5%处,并且培养箱的湿度水平被设置在80%处。此外,ph设置点为6.8,并且溶解氧浓度≥10%。
结果证明,在这种设置中,具有4.86mm的内直径和300mm的长度的笔直且倾斜70°的不锈钢管就细胞保留方面给出了特别好的结果。
示例3——尤其针对高细胞密度进一步评价不同的细胞保留装置。
为了进一步评价利用重力的细胞保留装置的何种几何形状可能特别适于获得并维持高密度细胞培养,使用了聚丙烯腈微粒(pan-x)系统。在该系统被用于评价细胞保留装置的性能之前确定了所述pan-x微粒系统的物理参数(数据未示出)。
关于细胞保留装置的泄漏值研究了细胞保留装置的若干种几何形状。高泄漏值表示许多pan-x微粒都被洗出。
令人惊讶地,发现具有10mm的内直径的倾斜细胞保留装置在摇动的培养条件下达到了低于5%的泄漏值(图9)。该研究结果是出乎意料的,因为——在希望不被理论束缚的情况下——原本以为摇瓶的恒定的轨道旋转运动将干扰沉降并且因此将不可能达到小泄漏值。
示例4——对呈重力细胞沉降器形式的不同细胞保留装置在灌注细胞培养期间的评价。
为了在功能、无菌性和实用性方面评定本文描述的可灭菌适配器,用三种不同的细胞保留装置几何形状来执行一段时间的培养。一式两份地测试了每种细胞保留装置几何形状,以评价系统的以下特征:
l细胞保留装置的细胞保留性能
l培养系统对长期无菌操作的适用性,
l反应器与细胞保留装置的氧传递能力,
l用电导电极作为液位传感器的液位控制系统的准确度
l使用光学传感器点的ph控制系统的功能。
因此,构建了六个可灭菌适配器。每个可灭菌适配器配备有5个端口,给所述端口分配以下功能:
1.取样和接种,
2.给料添加
3.碱添加
4.通气
5.细胞保留/收集。
在该示例中,用于细胞保留装置的端口包括孔,该孔进而包括用于插入细胞保留装置的插入件,此处所述插入件是螺纹。插入——即旋拧入——之后,细胞保留装置用两个螺钉固定:一个用于围绕所述细胞保留装置的外直径的固定,并且一个用于细胞保留装置的向下固定。所述端口具有15mm的外直径,而细胞保留装置具有12mm的外直径。
此外,在该示例中,可灭菌适配器的主体包括利用螺纹和紧固夹具连接的用于液位传感器的插入件——此处是用于液位控制的集成电导电极。所述细胞保留装置作为第二电极与电导传感器结合使用以允许对填充水平进行控制。
出口气体通过可灭菌适配器的盖子上的膜释放以维持培养瓶内部的所包含的培养环境。
一式两份地测试了具有23.5cm的长度和相对于水平线成74°的倾斜角度的三个不锈钢细胞保留装置,所述三个不锈钢细胞保留装置的内直径不同。
摇瓶和包括相应的细胞保留装置以及用于细胞培养介质流入和流出以及液位控制、ph控制、碱添加和氧传递的部件的可灭菌适配器的完整组件在下文中被称为单元。
单元的通气——最初由通过可灭菌适配器的膜的被动气体交换实现——在七天的培养时间之后被切换到主动顶部空间通气。细胞保留装置和细胞培养容器的总的期望培养体积是140ml。仅通过调整入口气体中的co2浓度来控制ph。
在23天的总培养时间段期间没有发生污染。
通过在培养期间确定的活细胞密度(vcd)和k洗涤值(数据未示出)来评定细胞保留性能。
培养后期中的vcd是用于细胞保留性能的良好指标。在那时间期间,细胞保留装置中的细胞量由于摇瓶中的高细胞密度而达到最大值。如果细胞保留性能在灌注期间不足够,则细胞被洗出培养容器并且细胞密度下降。对具有4和6mm的内直径的细胞保留装置而言,该效果是明显可见的。这些单元中的vcd首先最高增大到细胞密度的一定水平,并且然后再次下降。这些单元中没有一个能够达到20×106个细胞/ml的临界细胞密度。比较而言,配备有具有10mm的内直径的细胞保留装置的两个单元,超过了20×106个细胞/ml的临界vcd并且在近似25×106个细胞/ml处保持恒定超过10天的持续时间。因此,通过采用具有10mm的内直径的细胞保留装置,可以获得并维持能够与在生产生物反应器中达到的细胞密度相当的细胞密度。
换句话说,能够证实pan-x实验的出乎意料的结果,并且甚至超过在细胞培养条件下的预期,因为这是小规模灌注系统第一次被证明在灌注培养条件期间(即,在真实连续操作期间)达到高细胞密度。
因此令人惊讶地,本文描述的包括相对简单的细胞保留装置的可灭菌适配器适于在恒定的轨道旋转运动期间在灌注培养条件下保留细胞,并且甚至允许在这些条件下获得并维持高细胞密度。
此外,细胞保留装置的精确定位似乎具有优化细胞培养方法的效果。在不希望被理论束缚的情况下,该研究结果被认为是因为以下事实:细胞保留装置在培养容器的液相中的定位最小化或防止气泡进入细胞保留装置,在没有这种最小化或防止的情况下,气泡的进入可能干扰细胞沉降。
为了在培养容器中精确定位细胞保留装置,该装置被安装成距摇瓶底部的内环有4mm的间隙,如图10中所示。用测量杆来实施该定位(参照图10)。细胞保留装置最终通过紧固夹具的螺钉而被固定。
示例5——对小规模培养属性与传统生物反应器中的属性的可比性的评价。
上文描述的细胞培养实验的结果被用于表示细胞培养适配器最佳设计以用于获得并维持高细胞密度。用8个相同的细胞保留装置(重力细胞沉降器)执行了第二组细胞培养实验,并且所述第二组细胞培养实验聚焦于所述8份相同的培养之间的可比性和细胞培养性能属性与传统生物反应器中的更大规模的细胞培养的可比性。
在第二培养时段期间,仅主动顶部空间通气被用于瓶的通风。与第一次培养相比,仅使用了具有10mm的内直径的细胞保留装置。
为了减少填充体积的变化,液位传感器的阈值被优化至100μs和200μs。通过这些设置,最大填充体积与最小填充体积之间的差仅为7%。另外,除了传统使用的o形环之外,用第二个o形环来稳定液位传感器的安装。这导致104ml的平均填充体积的准确度被改进。通过这些电导率阈值和稳定的液位传感器的安装,优化了填充体积与绝对填充体积的偏差。
总体而言,结果证明,所有的培养单元能够达到超过20×106个细胞/ml的活细胞密度,并且显示,通常而言,在这些实验中生成的小规模培养属性能够与在传统生物反应器中的属性相比。
参考文献
meier等(2014),逆流式透析生物反应器中的准连续发酵,生物化学工程杂质,91卷,2014年10月15日,265-275页。
wo2013124326a1
wo2013124329a1。
- 还没有人留言评论。精彩留言会获得点赞!