抗C5抗体及其用途的制作方法
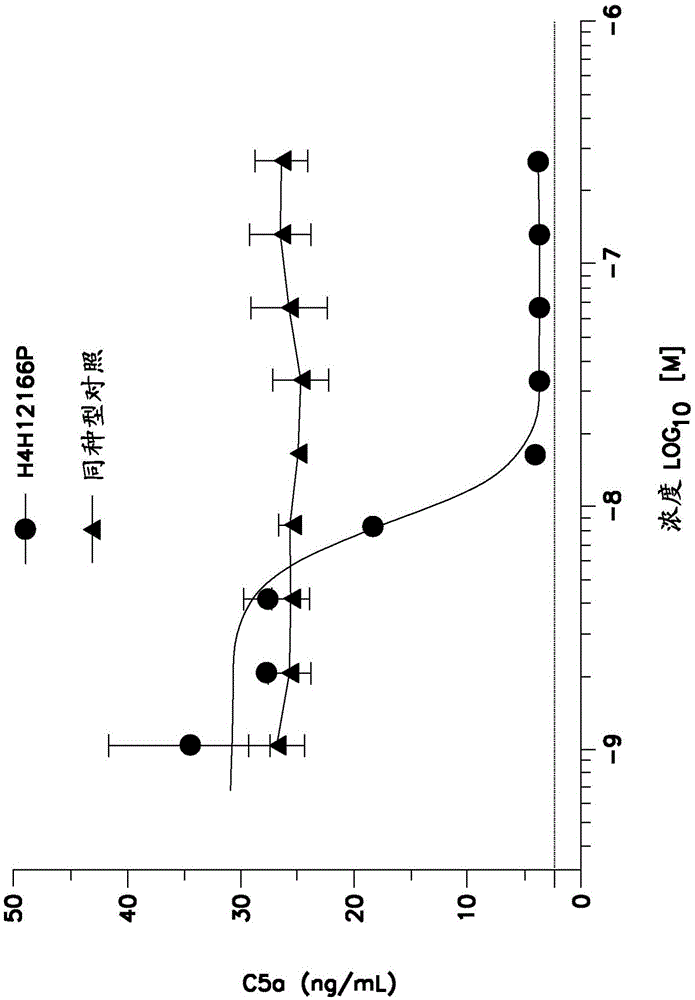
发明领域本发明涉及特异性地结合补体因子c5的抗体和抗体的抗原结合片段,以及使用那些抗体的治疗和诊断方法。发明背景补体系统是一组激活时导致靶细胞裂解并促进通过调理作用(opsonization)的吞噬作用的血浆蛋白。通过三个主要途径,经由一系列蛋白水解步骤,激活补体:经典途径,其通常通过免疫复合物激活,可以通过未受保护的细胞表面诱导的旁路途径,和甘露糖结合凝集素途径。所有这三个补体级联的途径集中于补体组分5(c5)蛋白的蛋白水解裂解。补体组分5(c5)的裂解导致片段c5a和c5b的产生,这是补体级联激活期间的关键过程。c5a可以通过结合其受体产生多向性生理反应(monk等2007,br.j.pharmacol.152:429-448)。c5a是有效的促炎性介质,其诱导趋化移动、增强细胞粘附、刺激突发性氧化作用并诱导各种炎性介质(如组胺或细胞因子)的释放。c5b介导膜-攻击复合物(mac,或c5b-9)的形成,导致补体依赖性细胞毒性(cdc)后期的细胞裂解。此外,在对c5b-9的细胞溶解具有抵抗力的有核细胞中,亚裂解(sublytic)量的c5b-9可以引起细胞激活,这导致细胞增殖,促炎性介质的产生和胞外基质的产生。c5的单克隆抗体是本领域已知的并且已经描述于例如美国专利/公开no.9206251、9107861、9079949、9051365、8999340、8883158、8241628、7999081、7432356、7361339、7279158、6534058、6355245、6074642、20160299305、20160051673、20160031975、20150158936、20140056888、20130022615、20120308559,以及wo2015198243、wo2015134894、wo2015120130、ep2563813b1、ep2328616b1和ep2061810b1中。以高亲和性特异性地结合c5蛋白并且具有提高的药物动力学特性的完全人抗体在多种c5-相关疾病(非典型溶血性尿毒症综合征)的预防和治疗中是重要的。发明简述本发明提供了特异性地结合补体因子5(c5)蛋白的抗体及其抗原结合片段。本发明的抗体对于抑制或中和c5蛋白的活性特别有用。在某些实施方案中,抗体在预防、治疗或缓解受试者中的c5-相关疾病或疾患的至少一种症状或指征中是有用的。在某些实施方案中,可以预防性地或治疗性地将抗体给药于患有c5-相关疾病或疾患或具有c5-相关疾病或疾患风险的受试者。在某些实施方案中,抗c5抗体是以高亲和性结合c5并且具有提高的药物动力学(pk)和药效学(pd)特性的完全人抗体。这样具有提高的pk/pd的高亲和性抗体可以用于给患有c5-相关疾病或疾患的受试者提供较好的效力,以及较低频率的给药。本发明的抗体可以是全长的(例如,igg1或igg4抗体)或可以只包含抗原结合部分(例如,fab、f(ab’)2,或scfv片段),并且可以修饰以实现功能性,例如,提高在宿主中的持久性或消除残余的效应子功能(reddy等,2000,j.immunol.164:1925-1933)。在某些实施方案中,抗体可以是双特异性的。在第一个方面中,本发明提供了分离的特异性地结合c5蛋白的重组单克隆抗体或其抗原结合片段。在一些实施方案中,抗体是完全人的单克隆抗体。本发明的示例性抗c5抗体列于本文的表1和2中。表1列出了示例性抗c5抗体的重链可变区(hcvr)、轻链可变区(lcvr)、重链互补决定区(hcdr1、hcdr2和hcdr3),和轻链互补决定区(lcdr1、lcdr2和lcdr3)的氨基酸序列识别号。表2列出了示例性抗c5抗体的hcvr、lcvr、hcdr1、hcdr2、hcdr3、lcdr1、lcdr2和lcdr3的核酸序列识别号。本发明提供了包含hcvr的抗体,或其抗原结合片段,所述hcvr包含选自表1中所列的任一个hcvr氨基酸序列的氨基酸序列,或与其具有至少90%,至少95%,至少98%或至少99%序列同一性的基本上相似的序列。本发明还提供了包含lcvr的抗体,或其抗原结合片段,所述lcvr包含选自表1中所列的任一个lcvr氨基酸序列的氨基酸序列,或与其具有至少90%,至少95%,至少98%或至少99%序列同一性的基本上相似的序列。本发明还提供了包含hcvr和lcvr氨基酸序列对(hcvr/lcvr)的抗体,或其抗原结合片段,所述hcvr和lcvr氨基酸序列对包含与表1中所列的任一个lcvr氨基酸序列配对的表1中所列的任一个hcvr氨基酸序列。根据某些实施方案中,本发明提供了包含表1中所列的任一个示例性抗c5抗体内所含的hcvr/lcvr氨基酸序列对的抗体,或其抗原结合片段。在某些实施方案中,hcvr/lcvr氨基酸序列对选自seqidno:2/10、18/26、34/42、50/58、66/74、82/90、98/106、98/114、122/106、98/130、138/106、146/106、122/130、146/114、146/130、138/130、154/162、170/178、186/194、202/210、218/226、234/242、250/258、266/258、274/282、290/298、306/314、322/330和338/346。在某些实施方案中,hcvr/lcvr氨基酸序列对选自seqidno:50/58(例如,h4h12161p)、98/106(例如,h4h12166p)、138/106(例如,h4h12166p5),或202/210(例如,h4h12170p)。在某些实施方案中,本发明提供了包含hcvr和lcvr的抗c5抗体或其抗原结合片段,所述hcvr包含表1中所列的具有不超过五个氨基酸置换的氨基酸序列,并且所述lcvr包含表1中所列的具有不超过两个氨基酸置换的氨基酸序列。例如,本发明提供了包含hcvr和lcvr的抗c5抗体或其抗原结合片段,所述hcvr包含具有不超过五个氨基酸置换的seqidno:98的氨基酸序列,并且所述lcvr包含具有不超过两个氨基酸置换的seqidno:106的氨基酸序列。在另一个实施方案中,本发明提供了包含hcvr和lcvr的抗c5抗体或其抗原结合片段,所述hcvr包含具有一个氨基酸置换的seqidno:98的氨基酸序列,并且所述lcvr包含具有一个氨基酸置换的seqidno:106的氨基酸序列。本发明还提供了包含重链cdr1(hcdr1)的抗体,或其抗原结合片段,所述重链cdr1包含选自表1中所列的任一个hcdr1氨基酸序列的氨基酸序列或具有至少90%,至少95%,至少98%或至少99%序列同一性的基本上相似的序列。本发明还提供了包含重链cdr2(hcdr2)的抗体,或其抗原结合片段,所述重链cdr2包含选自表1中所列的任一个hcdr2氨基酸序列的氨基酸序列或具有至少90%,至少95%,至少98%或至少99%序列同一性的基本上相似的序列。本发明还提供了包含重链cdr3(hcdr3)的抗体,或其抗原结合片段,所述重链cdr3包含选自表1中所列的任一个hcdr3氨基酸序列的氨基酸序列或具有至少90%,至少95%,至少98%或至少99%序列同一性的基本上相似的序列。本发明还提供了包含轻链cdr1(lcdr1)的抗体,或其抗原结合片段,所述轻链cdr1包含选自表1中所列的任一个lcdr1氨基酸序列的氨基酸序列或具有至少90%,至少95%,至少98%或至少99%序列同一性的基本上相似的序列。本发明还提供了包含轻链cdr2(lcdr2)的抗体,或其抗原结合片段,所述轻链cdr2包含选自表1中所列的任一个lcdr2氨基酸序列的氨基酸序列或具有至少90%,至少95%,至少98%或至少99%序列同一性的基本上相似的序列。本发明还提供了包含轻链cdr3(lcdr3)的抗体,或其抗原结合片段,所述轻链cdr3包含选自表1中所列的任一个lcdr3氨基酸序列的氨基酸序列或具有至少90%,至少95%,至少98%或至少99%序列同一性的基本上相似的序列。本发明还提供了包含hcdr3和lcdr3氨基酸序列对(hcdr3/lcdr3)的抗体,或其抗原结合片段,所述hcdr3和lcdr3氨基酸序列对包含与表1中所列的任一个lcdr3氨基酸序列配对的表1中所列的任一个hcdr3氨基酸序列。根据某些实施方案,本发明提供了包含表1中所列的任一个示例性抗c5抗体内所含的hcdr3/lcdr3氨基酸序列对的抗体,或其抗原结合片段。在某些实施方案中,hcdr3/lcdr3氨基酸序列对选自56/64(例如,h4h12161p)、104/112(例如,h4h12166p)、144/112(例如,h4h12166p5)和208/216(例如,h4h12170p)。本发明还提供了包含hcvr和lcvr的抗体,或其抗原结合片段,所述hcvr包括包含与表1中所列的氨基酸序列有1个氨基酸不同的氨基酸序列的hcdr1,包含与表1中所列的氨基酸序列有1个氨基酸不同的氨基酸序列的hcdr2和包含与表1中所列的氨基酸序列有1个氨基酸不同的氨基酸序列的hcdr3。在某些实施方案中,本发明提供了包含hcvr和lcvr的抗体,或其抗原结合片段,所述lcvr包括包含与表1中所列的氨基酸序列有1个氨基酸不同的氨基酸序列的lcdr1,包含与表1中所列的氨基酸序列有1个氨基酸不同的氨基酸序列的lcdr2和包含与表1中所列的氨基酸序列有1个氨基酸不同的氨基酸序列的lcdr3。例如,本发明提供了包含hcvr和lcvr的抗c5抗体,或其抗原结合片段,所述hcvr包括包含seqidno:100的氨基酸序列或与seqidno:100有1个氨基酸不同的氨基酸序列的hcdr1,包含seqidno:102的氨基酸序列或与seqidno:102有1个氨基酸不同的氨基酸序列的hcdr2,和包含seqidno:104的氨基酸序列或与seqidno:104有1个氨基酸不同的氨基酸序列的hcdr3。在另一个示例性实施方案中,本发明提供了包含hcvr和lcvr的抗体,或其抗原结合片段,所述lcvr包括包含seqidno:108的氨基酸序列或与seqidno:108有1个氨基酸不同的氨基酸序列的lcdr1,包含seqidno:110的氨基酸序列或与seqidno:110有1个氨基酸不同的氨基酸序列的lcdr2,和包含seqidno:112的氨基酸序列或与seqidno:112有1个氨基酸不同的氨基酸序列的lcdr3。本发明提供了包含重链的抗体,或其抗原结合片段,所述重链包含seqidno:353的氨基酸序列,或与其具有至少80%,至少85%,至少90%,至少95%,至少98%或至少99%序列同一性的基本上相似的序列。本发明还提供了包含轻链的抗体,或其抗原结合片段,所述轻链包含seqidno:354的氨基酸序列,或与其具有至少80%,至少85%,至少90%,至少95%,至少98%或至少99%序列同一性的基本上相似的序列。在某些实施方案中,本发明提供了包含重链和轻链的抗体,或其抗原结合片段,所述重链包含seqidno:353的氨基酸序列,或与其具有至少80%,或至少90%序列同一性的基本上相似的序列;和所述轻链包含seqidno:354的氨基酸序列,或与其具有至少80%,或至少90%序列同一性的基本上相似的序列。本发明还提供了抗体,或其抗原结合片段,其包含表1中所列的任一个示例性抗c5抗体内所含的一组六个cdr(即,hcdr1-hcdr2-hcdr3-lcdr1-lcdr2-lcdr3)。在某些实施方案中,hcdr1-hcdr2-hcdr3-lcdr1-lcdr2-lcdr3氨基酸序列组选自seqidno:52-54-56-60-62-64(例如,h4h12161p),100-102-104-108-110-112(例如,h4h12166p),140-142-144-108-110-112(例如,h4h12166p5),和204-206-208-212-214-216(例如,h4h12170p)。在相关实施方案中,本发明提供了抗体,或其抗原结合片段,其包含表1中所列的任一个示例性抗c5抗体限定的hcvr/lcvr氨基酸序列对内所含的一组六个cdr(即,hcdr1-hcdr2-hcdr3-lcdr1-lcdr2-lcdr3)。例如,本发明包括抗体,或其抗原结合片段,其包含选自seqidno:50/58(例如,h4h12161p)、98/106(例如,h4h12166p)、138/106(例如,h4h12166p5)或202/210(例如,h4h12170p)的hcvr/lcvr氨基酸序列对内所含的hcdr1-hcdr2-hcdr3-lcdr1-lcdr2-lcdr3氨基酸序列组。用于鉴定hcvr和lcvr氨基酸序列内的cdr的方法和技术是本领域公知的,并且可以用于鉴定本文中公开的指定hcvr和/或lcvr氨基酸序列内的cdr。可以用于鉴定cdr边界的示例性惯例包括例如kabat定义、chothia定义和abm定义。在一般术语中,kabat定义是基于序列可变性,chothia定义是基于结构环区域的位置,而abm定义是kabat和chothia方法之间的折中。参见,例如,kabat,“sequencesofproteinsofimmunologicalinterest”,nationalinstitutesofhealth,bethesda,md.(1991);al-lazikani等,j.mol.biol.273:927-948(1997);和martin等,proc.natl.acad.sci.usa86:9268-9272(1989)。公开数据库也可以用于鉴定抗体内的cdr序列。在某些实施方案中,本发明包括特异性地结合c5的抗体或其抗原结合片段,其中抗体或其抗原结合片段包括重链可变区(hcvr)内所含的三个重链互补决定区(cdr)(hcdr1、hcdr2和hcdr3)和轻链可变区(lcvr)内所含的三个轻链cdr(lcdr1、lcdr2和lcdr3),其中hcvr包括:(i)seqidno:98的氨基酸序列;(ii)与seqidno:98具有至少90%同一性的氨基酸序列,(iii)与seqidno:98具有至少95%同一性的氨基酸序列;或(iv)具有不超过5个氨基酸置换的seqidno:98的氨基酸序列;并且lcvr包括:(i)seqidno:106的氨基酸序列;(ii)与seqidno:106具有至少90%同一性的氨基酸序列,(iii)与seqidno:106具有至少95%同一性的氨基酸序列;或(iv)具有不超过5个氨基酸置换的seqidno:106的氨基酸序列。本发明包括具有修饰的糖基化模式的抗c5抗体。在一些实施方案中,除去不合需要的糖基化位点的修饰可能是有用的,或缺乏寡糖链上存在的岩藻糖部分的抗体,例如,以提高抗体依赖性细胞毒性(adcc)功能(参见shield等(2002),jbc277:26733)。在其他应用中,可以进行糖基化的修饰,以改变补体依赖性细胞毒性(cdc)。在某些实施方案中,本发明提供了呈现出ph依赖性的c5结合的抗体及其抗原结合片段。例如,本发明包括在中性ph下以高于酸性ph下的亲和性结合c5的抗体及其抗原结合片段(即,在酸性ph下结合降低)。在某些实施方案中,本发明提供了呈现出提高的药物动力学和药效学特性的抗体和抗原结合片段,例如,本发明提供了具有延长的血清半衰期的抗c5抗体。在某些实施方案中,本发明的抗c5抗体在c5-人源化小鼠中到第40天始终具有高于10μg/ml的血清浓度。在某些实施方案中,本发明的抗c5抗体在给药于c5-人源化小鼠时到第35天始终阻断cp-和ap溶血。本发明还提供了与包含hcvr的cdr和lcvr的cdr的抗体或其抗原结合片段竞争特异性结合c5的抗体及其抗原结合片段,其中hcvr和lcvr各自具有选自表1中所列的hcvr和lcvr序列的氨基酸序列。本发明还提供了与包含hcvr的cdr和lcvr的cdr的参照抗体或其抗原结合片段交叉竞争c5结合的抗体及其抗原结合片段,其中hcvr和lcvr各自具有选自表1中所列的hcvr和lcvr序列的氨基酸序列。本发明还提供了与包含hcvr的cdr和lcvr的cdr的参照抗体或其抗原结合片段结合相同表位的抗体及其抗原结合片段,其中hcvr和lcvr各自具有选自表1中所列的hcvr和lcvr序列的氨基酸序列。在某些实施方案中,本发明提供了与包含hcvr的cdr和lcvr的cdr的参照抗体或其抗原结合片段结合相同表位的抗体及其抗原结合片段,其中hcvr/lcvr氨基酸序列对具有seqidno:98/106。本发明还包括结合c5的α链和/或β链中所含的一个或多个氨基酸残基的抗c5抗体及其抗原结合片段。在某些实施方案中,本发明提供了结合c5的α链中的一个或多个氨基酸和c5的β链中的一个或多个氨基酸的抗体及其抗原结合片段。在某些实施方案中,本发明提供了结合c5的α链和β链中的一个或多个氨基酸的抗体及其抗原结合片段,其中抗体不结合c5a过敏毒素结构域。在某些实施方案中,本发明提供了与人c5(seqidno:359)内所含的一个或多个氨基酸相互作用的抗c5抗体。在某些实施方案中,本发明提供了与人c5(seqidno:359)内所含的一个或多个氨基酸相互作用的抗c5抗体,其中抗体不结合c5的c5a过敏毒素结构域。在某些实施方案中,本发明提供了与选自(a)seqidno:359的氨基酸591至599;(b)seqidno:359的氨基酸593至599;(c)seqidno:359的氨基酸775至787;(d)seqidno:359的氨基酸775至794;和(e)seqidno:359的氨基酸779至787的氨基酸序列相互作用的抗c5抗体及其抗原结合片段。在某些实施方案中,本发明提供了与seqidno:359内所含的一个或多个氨基酸相互作用的抗c5抗体及其抗原结合片段,例如,本发明提供了与seqidno:361内所含的至少5个氨基酸,至少10个氨基酸,或至少15个氨基酸相互作用的抗c5抗体及其抗原结合片段。在某些实施方案中,本发明提供了与seqidno:359内所含的一个或多个氨基酸相互作用的抗c5抗体及其抗原结合片段,例如,本发明提供了与seqidno:360内所含的至少5个氨基酸相互作用的抗c5抗体及其抗原结合片段。在某些实施方案中,本发明提供了与seqidno:360和361内所含的至少5个氨基酸相互作用的抗c5抗体及其抗原结合片段。在某些实施方案中,本发明提供了与seqidno:360的氨基酸序列(对应于seqidno:359的氨基酸591至599)和seqidno:361的氨基酸序列(对应于seqidno:359的氨基酸775至794)相互作用的抗c5抗体及其抗原结合片段。在一些实施方案中,抗体或其抗原结合片段可以以激动剂方式特异性地结合c5,即,其可以增强或刺激c5结合和/或活性;在其他实施方案中,抗体可以以拮抗剂方式特异性地结合c5,即,其可以阻断c5结合和/或活性。本发明还提供了阻断c5与c5转化酶结合的抗体及其抗原结合片段。在一些实施方案中,阻断c5与c5转化酶结合的抗体或其抗原结合片段可以结合c5上与c5转化酶相同的表位或可以结合c5上与c5转化酶不同的表位。在一些实施方案中,本发明提供了阻断c5与猴c5转化酶结合的抗体或其抗原结合片段。在某些实施方案中,本发明的抗体或抗原结合片段是双特异性的,其包括对c5蛋白的第一表位的第一结合特异性和对c5蛋白的第二表位的第二结合特异性,其中第一和第二表位是截然不同的并且是非重叠的。在某些实施方案中,本发明的抗体和抗原结合片段以低于0.5nm的ic50结合c5a。在某些实施方案中,抗体包括hcvr,其包含选自seqidno:290、306、322和338的氨基酸序列。在某些实施方案中,抗体包括lcvr,其包含选自seqidno:298、314、330和346的氨基酸序列。在某些实施方案中,本发明提供了具有一个或多个以下特征的分离抗体或其抗原结合片段:(a)是完全人单克隆抗体;(b)在25℃下以低于0.9nm的解离常数(kd)结合人c5,如在表面等离子体共振分析中测量的;(c)在37℃下以低于0.3nm的kd结合人c5,如在表面等离子体共振分析中测量的;(d)以低于65nm的kd结合猴c5,如在表面等离子体共振分析中测量的;(e)以低于0.5nm的kd结合人c5变体r885h(seqidno:356),如在表面等离子体共振分析中测量的;(f)以低于0.5nm的kd结合人c5变体r885c(seqidno:357),如在表面等离子体共振分析中测量的;(g)阻断超过95%的人c5介导的经典途径(cp)溶血并且具有低于6nm的ic50,如在cp溶血分析中测量的;(h)阻断超过70%的人c5介导的旁路途径(ap)溶血并且具有低于165nm的ic50,如在ap溶血分析中测量的;(i)以低于185nm的ic50抑制非洲绿猴c5介导的cp溶血,如在cp溶血分析中测量的;(j)以低于235nm的ic50抑制非洲绿猴c5介导的ap溶血,如在ap溶血分析中测量的;(k)以低于145nm的ic50抑制食蟹猴c5介导的cp溶血,如在cp溶血分析中测量的;和(l)以低于30nm的ic50抑制食蟹猴c5介导的ap溶血,如在ap溶血分析中测量的。在某些实施方案中,本发明提供了具有一个或多个以下特征的分离的重组单克隆抗c5抗体或其抗原结合片段:(a)包括一组六个cdr,所述cdr包括seqidno:100-102-104-108-110-112的氨基酸序列;(b)在25℃下以低于0.2nm的解离常数(kd)结合人c5,如在表面等离子体共振分析中测量的;(c)在37℃下以低于0.3nm的kd结合人c5,如在表面等离子体共振分析中测量的;(d)在37℃下以低于0.4nm的kd结合人c5变体(r885h),如在表面等离子体共振分析中测量的;(e)抑制经典途径(cp)介导的人血清的溶血,具有低于3nm的ic50;(f)抑制旁路途径(ap)介导的人血清的溶血,具有低于27nm的ic50;(g)抑制cp介导的猴血清的溶血,具有低于21nm的ic50;(g)抑制ap介导的猴血清的溶血,具有低于10nm的ic50;(h)在c5-人源化小鼠中具有超过10天的血清半衰期(t1/2);(i)在给药于c5-人源化小鼠时具有超过10μg/ml的血清浓度直至第40天;(j)在c5-人源化小鼠中阻断cp介导的溶血直至第50天;和(k)结合seqidno:359的α链和/或β链中包含的一个或多个氨基酸,其中抗体不结合c5的c5a过敏毒素结构域。在第二方面中,本发明提供了编码抗c5抗体或其部分的核酸分子。例如,本发明提供了编码表1中所列的任一个hcvr氨基酸序列的核酸分子;在某些实施方案中,核酸分子包括选自表2中所列的任一个hcvr核酸序列的多核苷酸序列,或与其具有至少90%、至少95%、至少98%或至少99%序列同一性的基本上相似的序列。本发明还提供了编码表1中所列的任一个lcvr氨基酸序列的核酸分子;在某些实施方案中,核酸分子包括选自表2中所列的任一个lcvr核酸序列的多核苷酸序列,或与其具有至少90%、至少95%、至少98%或至少99%序列同一性的基本上相似的序列。本发明还提供了编码表1中所列的任一个hcdr1氨基酸序列的核酸分子;在某些实施方案中,核酸分子包括选自表2中所列的任一个hcdr1核酸序列的多核苷酸序列,或与其具有至少90%、至少95%、至少98%或至少99%序列同一性的基本上相似的序列。本发明还提供了编码表1中所列的任一个hcdr2氨基酸序列的核酸分子;在某些实施方案中,核酸分子包括选自表2中所列的任一个hcdr2核酸序列的多核苷酸序列,或与其具有至少90%、至少95%、至少98%或至少99%序列同一性的基本上相似的序列。本发明还提供了编码表1中所列的任一个hcdr3氨基酸序列的核酸分子;在某些实施方案中,核酸分子包括选自表2中所列的任一个hcdr3核酸序列的多核苷酸序列,或与其具有至少90%、至少95%、至少98%或至少99%序列同一性的基本上相似的序列。本发明还提供了编码表1中所列的任一个lcdr1氨基酸序列的核酸分子;在某些实施方案中,核酸分子包括选自表2中所列的任一个lcdr1核酸序列的多核苷酸序列,或与其具有至少90%、至少95%、至少98%或至少99%序列同一性的基本上相似的序列。本发明还提供了编码表1中所列的任一个lcdr2氨基酸序列的核酸分子;在某些实施方案中,核酸分子包括选自表2中所列的任一个lcdr2核酸序列的多核苷酸序列,或与其具有至少90%、至少95%、至少98%或至少99%序列同一性的基本上相似的序列。本发明还提供了编码表1中所列的任一个lcdr3氨基酸序列的核酸分子;在某些实施方案中,核酸分子包括选自表2中所列的任一个lcdr3核酸序列的多核苷酸序列,或与其具有至少90%、至少95%、至少98%或至少99%序列同一性的基本上相似的序列。本发明还提供了编码hcvr的核酸分子,其中hcvr包括一组三个cdr(即,hcdr1-hcdr2-hcdr3),其中hcdr1-hcdr2-hcdr3氨基酸序列组如表1中所列的任一个示例性抗c5抗体限定的。本发明还提供了编码lcvr的核酸分子,其中lcvr包括一组三个cdr(即,lcdr1-lcdr2-lcdr3),其中hcdr1-hcdr2-hcdr3氨基酸序列组如表1中所列的任一个示例性抗c5抗体限定的。本发明还提供了编码hcvr和lcvr的核酸分子,其中hcvr包括表1中所列的任一个hcvr氨基酸序列的氨基酸序列,并且其中lcvr包括表1中所列的任一个lcvr氨基酸序列的氨基酸序列。在某些实施方案中,核酸分子包括选自表2中所列的任一个hcvr核酸分子的多核苷酸序列,或与其具有至少90%、至少95%、至少98%或至少99%序列同一性的基本上相似的序列,以及选自表1中所列的任一个lcvr核酸分子的多核苷酸序列,或与其具有至少90%、至少95%、至少98%或至少99%序列同一性的基本上相似的序列。在某些实施方案中,根据本发明的这个方面,核酸分子编码hcvr和lcvr,其中hcvr和lcvr都源自表1中所列的同一个抗c-5抗体。在相关方面中,本发明提供了能够表达包括抗c5抗体的重链或轻链可变区的多肽的重组表达载体。例如,本发明包括重组表达载体,其包括上述任一个核酸分子,即,编码表2中所列的任一个hcvr、lcvr和/或cdr序列的核酸分子。本发明的范围内还包括其中已经引入了所述载体的宿主细胞,以及通过在允许抗体或抗体片段产生的条件下培养宿主细胞并且收集由此产生的抗体和抗体片段来生产抗体或其部分的方法。在第三个方面中,本发明提供包括治疗有效量的至少一个特异性地结合c5的重组单克隆抗体或其抗原结合片段和可药用载体的药物组合物。在相关方面中,本发明的特征在于一种组合物,其是抗c5抗体和第二种治疗剂的组合。在一个实施方案中,第二种治疗剂是有利地联合抗c5抗体的任何药剂。可以有利地联合抗c5抗体的示例性药剂包括,不限于,结合和/或抑制c5活性的其他药剂(包括其他抗体或其抗原结合片段等)和/或没有直接结合c5但仍然治疗或改善c5-相关疾病或疾患的至少一个症状或指征的药剂。本文中别处公开了涉及本发明的抗c5抗体的其他联合治疗和共同配方。在第四个方面中,本发明提供了使用本发明的抗c5抗体或抗体的抗原结合片段治疗受试者中与c5相关的疾病或疾患的治疗方法,其中治疗方法包括将治疗有效量的药物组合物给药于需要的受试者,所述药物组合物包括本发明的抗体或抗体的抗原结合片段。所治疗的疾患是通过抑制c5活性可以改进、改善、抑制或预防的任何疾病或病症。在某些实施方案中,本发明提供了预防、治疗或改善非典型溶血性尿毒症综合征(ahus)的至少一个症状的方法,所述方法包括将治疗有效量的本发明的抗c5抗体或其抗原结合片段给药于需要的受试者。在一些实施方案中,本发明提供了通过给药本发明的抗c5抗体改善或降低受试者中阵发性夜间血红蛋白尿(pnh)的至少一个症状或指征的严重性的方法。在一些实施方案中,可以预防或治疗性地将抗体或其抗原结合片段给药于患有c5-相关疾病或疾患或处于患有c5-相关疾病或疾患风险中的受试者。在某些实施方案中,本发明的抗体或其抗原结合片段联合第二种治疗剂给药于需要的受试者。第二种治疗剂可以选自抗炎药物(如皮质类固醇和非甾族抗炎药)、c5蛋白的不同的抗体、膳食补充剂(如抗氧化剂)和本领域已知的任何其他药物或治疗。在某些实施方案中,如果副作用必须产生的话,第二种治疗剂可以是帮助抵抗或降低与本发明的抗体或其抗原结合片段相关的任何可能的副作用的药剂。抗体或其片段可以皮下、静脉内、真皮内、腹膜内、口服或肌内给药。抗体或其片段可以以约0.1mg/kg受试者体重至约100mg/kg受试者体重的剂量来给药。在某些实施方案中,本发明的抗体可以在包括50mg至600mg的一个或多个剂量下给药。本发明还包括本发明的抗c5抗体或其抗原结合片段在制造用于治疗将得益于c5结合和/或活性阻断的疾病或疾患的治疗的药物中的用途。从随后详述的阅读,其他实施方案将变得清楚。附图简述图1显示了抗c5抗体h4h12166p以剂量依赖性方式抑制c5a水平,如通过elisa测定的(描述于本文的实施例9中)。图2显示了给雄性食蟹猴单次15mg/kg静脉内注射h4h12166p、h4h12161p或comparator2后的总血清浓度vs.时间(描述于本文的实施例10中)。通过从第一次给药后至低于定量限值(blq)结果,将浓度-时间谱绘制曲线,如果适用,其作为lloq/2输入。每个数据点表示平均(±sd)(n=4只动物/组);分别在第36天和第29天开始,认为受到ada影响的浓度,在h4h412166p组中,有1只动物被排除,在h4h12161p组中,有1只动物被排除。lloq=定量下限。图3显示了给雄性食蟹猴单次静脉内注射h4h12166p、h4h12161p或comparator2后,在离体红细胞(a)经典途经和(b)旁路途径分析中的溶血百分比vs.时间。溶血%(计算为实验vs.最大裂解的比例,从两个值中都减去了%背景裂解),涉及给定时间点血清中存在的特定抗c5抗体抑制的c5的含量。每个数据点表示平均(±sd)。图4显示了选定的抗c5抗体在对于c5人源化的小鼠中的总血清浓度vs.时间谱(描述于本文的实施例11中)。给人源化的c5小鼠给药单个15mg/kg皮下剂量的h4h12166p、comparator1或comparator2。每个数据点表示平均±s.e.m.(各自的n=4-5)。使用夹层elisa,在注射后的第1、10、20、30和40天监测血清中的抗体浓度。图5显示了选定的抗c5抗体在对于c5人源化的小鼠中的离体补体经典途径溶血分析中的百分比溶血vs.时间。给人源化的c5小鼠给药单个15mg/kg皮下剂量的h4h12166p、comparator1或comparator2。每个数据点表示平均±s.e.m.(各自的n=4-5)。在给药前,注射后第10、20、30、40和50天监测血清中的溶血百分比。溶血%(计算为实验vs.最大裂解的比例,从两个值中都减去了%背景裂解),涉及给定时间点血清中存在的特定抗c5抗体抑制的c5的含量。图6显示了选定的抗c5抗体在对于c5人源化的小鼠中的总血清浓度vs.时间谱(描述于本文的实施例11中)。给小鼠给药单个15mg/kg皮下剂量的h4h12166p、h4h12161p、comparator1或igg4p同种型对照。每个数据点表示平均±s.e.m.(各自的n=5)。使用夹层elisa,在注射后的6小时、1、2、3、4、7、10、14、21、30、45和59天监测血清中的抗体水平。图7是显示了用同种型对照或用10mg/kg或50mg/kg的抗c5抗体m1m17628n处理的小鼠中的光学相干断层扫描(oct)评分的图(描述于本文的实施例14中)。****p<0.0001,双因素方差分析(two-wayanova)处理,使用50mg/kg的抗c5抗体vs.无处理或用同种型对照的处理。图8显示了在不存在c3下(a);以及在存在80μg/ml的人c3下(b),通过抗c5抗体m1m17628n的经典途径溶血的抑制(描述于本文的实施例14中)。图9显示了用同种型对照或用10mg/kg或50mg/kg的抗人c5抗体h4h12170p处理的c5人源化小鼠中的细胞簇计数(描述于本文的实施例15中)。对于每组,n=8-12只眼睛。图10是显示了用同种型对照或用10mg/kg或50mg/kg的抗人c5抗体h4h12170p处理的c5人源化小鼠中的oct评分的图(描述于本文的实施例15中)。对于每组,n=8-12只眼睛。图11是显示了用同种型对照、3mg/kg或10mg/kg的抗人c5抗体h4h12166p,或10mg/kg的comparator2处理的c5人源化小鼠中的oct评分。对于每组,n=6-12只眼睛(描述于本文的实施例15中)。图12显示了用同种型对照、3mg/kg或10mg/kg的抗人c5抗体h4h12166p,或10mg/kg的comparator2处理的c5人源化小鼠中的细胞簇计数。对于每组,n=6-12只眼睛(描述于本文的实施例15中)。图13是用同种型对照或用抗c5抗体m1m17628n或m1m17627n处理的nzbwf1小鼠的存活曲线(描述于本文的实施例17中)。图14显示了用同种型对照或用抗c5抗体m1m17628n或mim17627n处理的nzbwf1小鼠中的(a)尿白蛋白和标准化至尿肌酐的(b)尿白蛋白(描述于本文的实施例17中)。图15显示了用同种型或用抗c5抗体m1m17628n或mim17627n处理的nzbwf1小鼠中的血尿素氮水平(描述于本文的实施例17中)。图16是显示了通过抗c5抗体h4h12166p、h4h12170p、comparator1和comparator2对星形细胞的抗体依赖性细胞毒性的抑制的图,如实施例18中所述的。详述在描述本发明的方法之前,将理解本发明不限于所述的特定方法和实验条件,因为这样的方法和条件可以改变。还将理解本文中所用的术语只是用于描述特定实施方案的目的,并且不是打算作为限制,因为本发明的范围只受所附权利要求的限制。除非另外限定,本文中使用的所有技术和科学术语具有本发明所属领域的普通技术人员通常理解的相同含义。尽管与本文中所述那些相似或同等的任何方法和材料可以用于本发明的实施或测试中,但现在将描述优选的方法和材料。本文中提及的所有出版物将其全部按引用并入本文中。定义术语“c5”,也称为“补体组分5”或“补体因子5”也称为补体级联的血清蛋白。c5蛋白是包含两条链α和β的1676个氨基酸的蛋白。该蛋白表示用于三条补体激活途径的集中点:经典途径、旁路途径和甘露糖结合凝集素途径。全长c5蛋白的氨基酸序列通过genbank中作为登录号np_001726.2(seqidno:355)中提供的氨基酸序列来举例说明。术语“c5”包括重组c5蛋白或其片段。该术语还包括结合例如组氨酸标签、鼠或人fc或信号序列(如ror1)的c5蛋白或其片段。例如,该术语包括通过seqidno:356或357中所示的序列举例说明的序列,在c-末端包括组氨酸标签,结合全长c5蛋白的氨基酸残基19-1676。该术语还包括在c-末端包括组氨酸标签,结合全长c5蛋白的氨基酸残基19-1676并具有r885h改变或r885c改变的蛋白变体。如本文中使用的,术语“抗体”意指通过二硫键相互间连接的四条多肽链(两条重(h)链和两条轻(l)链)的免疫球蛋白分子,及其多聚体(例如igm)或其抗原结合片段。每条重链由重链可变区(“hcvr”或“vh”)和重量恒定区(由结构域ch1、ch2和ch3组成)组成。每条轻链由轻链可变区(“lcvr”或“lh”)和轻链恒定区(cl)组成。vh和vl区可以进一步细分成超变区,称为互补决定区(cdr),其间散布着较保守性区域,称为框架区(fr)。每个vh和vl由三个cdr和四个fr组成,以下列顺序从氨基端排列到羧基端:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。在本发明的某些实施例中,抗体(或其抗原结合部分)的fr可与人种系序列相同,或可以是自然或人工修饰的。氨基酸共有序列可以基于两个或更多个cdr的并排(side-by-side)分析来定义。一个或多个cdr残基的置换或一个或多个cdr的省略也是可能的。其中为了结合除去一个或两个cdr的抗体已经描述于科学文献中。padlan等(1995fasebj.9:133-139)基于公开的晶体结构,分析了抗体及其抗原之间的接触区域,并且推断出只有约五分之一至三分之一的cdr残基实际接触了抗原。padlan还发现了许多其中一个或两个cdr没有氨基酸接触抗原的抗体(还可以参见,vajdos等2002jmolbiol320:415-428)。可以基于之前的研究(例如cdrh2中的残基h60-h65常常不需要),从位于chothiacdr外的kabatcdr的区域,通过分子塑模和/或根据经验,鉴定没有接触抗原的cdr残基。如果省略cdr或残基,通常用占据另一个人抗体序列或这些序列的共有序列中相应位置的氨基酸来置换。用于cdr内置换的位置和待置换的氨基酸也可以根据经验来选择。根据经验的置换可以是保守的或非保守置换。与相应的种系序列相比,本文中公开的完全人抗c5单克隆抗体可以在重链和轻链可变结构域的框架和/或cdr区中包括一个或多个氨基酸置换、插入和/或删除。可以通过将本文中公开的氨基酸序列与可获自例如公众抗体序列数据库的种系序列进行比较来容易地确定这样的突变。本发明包括源自本文中公开的任一个氨基酸序列的抗体,及其抗原结合片段,其中一个或多个框架和/或cdr区内的一个或多个氨基酸突变成从其衍生抗体的种系序列的相应残基,或另一个人种系序列的相应残基,或相应种系残基的保守性氨基酸置换(这样的序列变化在本文中总称为“种系突变”)。本领域的普通技术人员,用本文公开的重链和轻链可变区序列开始,可以容易地产生各种包括一个或多个个体种系突变或其组合的抗体和抗原结合片段。在某些实施方案中,vh和/或vl结构域内的所有框架和/或cdr残基突变回从其衍生抗体的原始种系序列中发现的残基。在其他实施方案中,只有某些残基突变回原始种系序列,例如,只在fr1的头8个氨基酸内或fr4的最后8个氨基酸内发现了突变的残基,或只在cdr1、cdr2或cdr3内发现了突变的残基。在其他实施方案中,一个或多个框架和/或cdr残基突变成不同种系序列(即,不同于最初从其衍生抗体的种系序列的种系序列)的相应残基。此外,本发明的抗体可以含有框架和/或cdr区内的两个或多个种系突变的任意组合,例如,其中某些个体的残基突变成特定种系序列的相应残基,而不同于初始种系序列的某些其他残基保持不变或突变成不同种系序列的相应残基。一旦获得,可以容易地测试含有一个或多个种系突变的抗体和抗原结合片段的一个或多个所需的特性,如提高的结合特异性、提高的结合亲和性、提高的或增强的拮抗或激动生物特性(根据可能的情况)、降低的免疫原性等。以这种一般方式获得的抗体和抗原结合片段包括在本发明内。本发明还包括完全人抗c5单克隆抗体,其包括本文中公开的具有一个或多个保守性置换的任一个hcvr、lcvr和/或cdr氨基酸序列的变体。例如,本发明包括相对于本文中公开的任一个hcvr、lcvr和/或cdr氨基酸序列具有例如10个或更少,8个或更少,6个或更少,4个或更少等保守性氨基酸置换的hcvr、lcvr和/或cdr氨基酸序列的抗c5抗体。如本文中使用的,术语“人抗体”用来包括具有源自人种系免疫球蛋白序列的可变区和恒定区的抗体。本发明的人mab可以包括不是由人种系免疫球蛋白序列编码的氨基酸残基(例如,通过体外随机或位点特异性的诱变或通过体内体细胞突变引入的突变),例如,在cdr中,并且特别是在cdr3中。然而,如本文中使用的,术语“人抗体”不打算包括其中已经嫁接至人fr序列上的源自另一个哺乳动物物种(例如,鼠)种系的cdr序列的mab。该术语包括在非人哺乳动物中或在非人哺乳动物的细胞中重组产生的抗体。该术语不打算包括从人受试者分离或在人受试者中产生的抗体。如本文中使用的,术语“重组”,是指如按照重组dna技术(其包括,例如,dna剪接和转基因表达),通过本领域已知的技术或方法形成、表达、分离或获得的本发明的抗体或其抗原结合蛋白。该术语是指在非人哺乳动物(包括转基因非人哺乳动物,例如,转基因小鼠)或细胞(例如,cho细胞)表达系统中表达的或从重组组合人抗体文库分离的抗体。术语“特异性地结合”或“与……特异性地结合”等表示抗体或其抗原结合片段与抗原形成在生理条件下相对稳定的复合物。特异性结合的特征在于至少约1×10-8m或更低的平衡解离常数(例如,越小的kd表示越紧密的结合)。用于确定两个分子是否特异性地结合的方法是本领域公知的,并且包括,例如,平衡渗析、表面等离子体共振等。如本文中所述的,已经通过表面等离子体共振,例如,biacoretm,鉴定了特异性地结合c5的抗体。此外,结合c5中的一个结构域和一个或多个其他抗原的多特异性抗体或结合c5的两个不同区域的双特异性抗体也认为是如本文中使用的“特异性地结合”的抗体。术语“高亲和性”抗体是指对c5具有至少10-8m;优选10-9m;更优选10-10m,甚至更优选10-11m,甚至更优选10-12m的表达为kd的结合亲和性的那些mab,所述kd通过表面等离子共振,例如,biacoretm,或溶液亲和性elisa来测量。术语“缓慢解离速率”、“koff”或“kd”表示抗体以1×10-3s-1或更低,优选1×10-4s-1或更低的速度常数与c5解离,如通过表面等离子共振,例如,biacoretm测定的。如本文中使用的,术语抗体的“抗原结合部分”、抗体的“抗原结合片段”等,包括特异性地结合抗原形成复合物的任何天然产生的、酶解可获得的、合成的或遗传工程化的肽或糖蛋白。如本文中使用的,术语抗体的“抗原结合片段”或“抗体片段”是指抗体的保留结合c5蛋白能力的一个或多个片段。在特定的实施方案中,本发明的抗体或抗体片段可以与一个部分缀合,如配体或治疗部分(“免疫缀合物”)、第二抗c5抗体,或用于治疗c5相关疾病或病症的任何其他治疗部分。如本文中使用的,“分离的抗体”,意指基本上不含具有不同抗原特异性的其他抗体(ab)的抗体(例如,分离的特异性地结合c5的抗体,或其片段,基本上不含特异性地结合c5以外的其他抗原的ab)。如本文中使用的,“阻断抗体”或“中和抗体”(或“中和c5活性的抗体”或“拮抗剂抗体”),意指其与c5的结合导致c5的至少一种生物活性被抑制的抗体。例如,本发明的抗体可以防止或阻断通过经典途径或旁路途径的补体介导的溶血。如本文中使用的,术语“表面等离子体共振”,是指允许通过检测生物传感器基质内的蛋白质浓度改变来分析实时生物分子相互作用的光学现象,例如,使用biacoretm系统(pharmaciabiosensorab,uppsala,swedenandpiscataway,n.j.)。如本文中使用的,术语“kd”,意指特定抗体-抗原相互作用的平衡解离常数。术语“表位”是指与称为抗原互补位(paratope)的抗体分子的可变区中的特定抗原结合位点相互作用的抗原决定簇。单个抗原可以具有超过一个的表位。因此,不同的抗体可以结合抗原上的不同区域并且可以具有不同的生物效应。术语“表位”还指b和/或t细胞响应的抗原上的位点。还指被抗体结合的抗原的区域。表位可以限定为结构性的或功能性的。功能性的表位通常是结构性表位的子集,并且具有直接促成相互作用亲和性的那些残基。表位还可以是构象性的,即,由非线性氨基酸组成。在某些实施方案中,表位可以包括是分子的化学活性表面分组的决定簇,如氨基酸、糖侧链、磷酰基或磺酰基,并且在某些实施方案中,可以具有特定的三维结构特征,和/或特定的电荷特征。如本文中使用的,术语“交叉竞争”,表示结合抗原并且抑制或阻断另一个抗体或其抗原结合片段的结合的抗体或其抗原结合片段。该术语还包括两个方向的两个抗体之间的竞争,即,结合并阻断第二抗体结合的第一抗体,并且反之亦然。在某些实施方案中,第一抗体和第二抗体可以结合相同表位。或者,第一和第二抗体可以结合不同的,但重叠的表位,使得一个的结合抑制或阻断第二抗体的结合,例如,通过位阻。可以通过本领域已知的方法来测量抗体之间的交叉竞争,例如,通过实时、无标记生物层干涉分析。两个抗体之间的交叉竞争可以表示为由于自我-自我结合引起的低于背景信号的第二抗体的结合(其中第一和第二抗体是相同抗体)。2个抗体之间的交叉竞争可以表示为例如低于基线自我-自我背景结合的第二抗体的结合%(其中第一和第二抗体是相同抗体)。术语“实质性同一性”或“基本上相同”,涉及核酸或其片段时,表示,使用合适的核苷酸插入或删除与另一个核酸(或其互补链)最佳比对时,在至少约90%,并且更优选至少约95%、96%、97%、98%或99%的核苷酸碱基中存在核苷酸序列同一性,如通过任何公知的序列同一性算法测量的,如fasta、blast或gap,如以下讨论的。在某些情况中,与参照核酸分子具有实质性同一性的核酸分子编码与参照核酸分子编码的多肽具有相同或基本上相似的氨基酸序列的多肽。同样适用于多肽,术语“实质性相似性”或“基本上相似的”表示两个多肽序列,最佳比对时,如使用缺省缺口权重通过程序gap或bestfit,享有至少90%序列同一性,甚至更优选至少95%,98%或99%序列同一性。优选,不相同的残基位置的差异在于保守性氨基酸置换。“保守性氨基酸置换”是其中氨基酸残基被另一个具有相似化学性质(例如,电荷或疏水性)的侧链(r基团)的氨基酸残基置换的置换。通常,保守性氨基酸置换将不会实质性地改变蛋白质的功能特性。在其中两个或多个氨基酸序列彼此的差异在于保守性置换的情况中,相似性的百分比或程度可以向上调整,以针对置换的保守性性质进行矫正。用于进行这种调整的方式是本领域技术人员公知的。参见,例如,pearson(1994)methodsmol.biol.24:307-331,将其按引用并入本文中。具有相似化学性质的侧链的氨基酸组的实例包括1)脂肪族侧链:甘氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸;2)脂肪族-羟基侧链:丝氨酸和苏氨酸;3)含酰胺侧链:天冬酰胺和谷氨酰胺;4)芳香族侧链:苯丙氨酸、酪氨酸和色氨酸;5)碱性侧链:赖氨酸、精氨酸和组氨酸;6)酸性侧链:天冬酰胺和谷氨酰胺,和7)含硫侧链:半胱氨酸和甲硫氨酸。优选的保守性氨基酸置换组是:缬氨酸-亮氨酸-异亮氨酸,苯丙氨酸-酪氨酸,赖氨酸-精氨酸,丙氨酸-缬氨酸,谷氨酰胺-天冬酰胺和天冬氨酸-谷氨酸。或者,保守性替换是在gonnet等(1992)science256:144345(将其按引用并入本文中)中公开的pam250对数似然(log-likelihood)矩阵中具有正值的任何改变。“适度保守性”替换是在pam250对数似然矩阵中具有非负值的任何改变。通常使用序列分析软件测量多肽的序列相似性。使用分配给不同置换、删除或其他修饰(包括保守性氨基酸置换)的相似性测量,蛋白质分析软件匹配相似的序列。例如,gcg软件含有如gap和bestfit这样的程序,其可以与缺省参数一起使用,以确定密切相关的多肽(如来自不同生物体物种的同源多肽)之间,或野生型蛋白及其突变蛋白质之间的序列同源性或序列同一性。参见,例如,gcg版本6.1。还可以使用缺省或推荐的参数,使用fasta,来比较多肽序列;gcg版本6.1中的一个程序。fasta(例如,fasta2和fasta3)提供了询问和搜索序列之间最佳重叠区域的比对和序列同一性百分比(pearson(2000)上文)。将本发明的序列与含有大量来自不同生物体的序列的数据库比较时,另一个优选的算法是计算机程序blast,尤其是blastp或tblastn,使用缺省参数。参见,例如,altschul等(1990)j.mol.biol.215:403-410和(1997)nucleicacidsres.25:3389-3402,将每篇按引用并入本文中。短语“治疗有效量”表示针对所给药的对象产生所需效应的含量。确切的含量将取决于治疗的目的,并且将由本领域技术人员使用已知技术来确定(参见,例如,lloyd(1999)theart,scienceandtechnologyofpharmaceuticalcompounding)。如本文中使用的,术语“受试者”是指需要改善、预防和/或治疗c5-相关疾病或病症(如非典型溶血性尿毒症综合征(ahus)或阵发性夜间血红蛋白尿(pnh))的动物,优选哺乳动物,更优选人。术语包括患有这样的疾病或病症或处于患有这样的疾病或病症风险中的人受试者。如本文中使用的,术语“治疗(treat)”、“治疗(treatment)”或“治疗(treatment)”是指由于将治疗剂(如本发明的抗体)给药于需要的受试者,c5-相关疾病或病症的至少一个症状或指征的严重性的降低或改善。该术语包括疾病进展或症状/指征恶化的抑制。该术语还包括疾病的积极进展,即,治疗剂(如本发明的抗体)给药时,受试者可以无疾病或可以具有减轻的疾病。可以将治疗剂以治疗剂量给药于受试者。术语“预防(prevent)”、“预防(preventing)”或“预防(prevention)”是指给药本发明的抗体时,c5-相关疾病或病症的呈现或所述疾病或病症的任一个症状或指征的抑制。抗体的抗原结合片段除非特意另外指出,否则如本文中使用,术语“抗体”应当理解为包括包含两条免疫球蛋白重链和两条免疫球蛋白轻链的抗体分子(即,“完全抗体分子”)及其抗原结合片段。如本文中使用的,术语抗体的“抗原结合部分”、抗体的“抗原结合片段”等,包括特异性地结合抗原形成复合物的任何天然产生的、酶解可获得的、合成的或遗传工程化的多肽或糖蛋白。如本文中使用的,术语抗体的“抗原结合片段”,或“抗体片段”是指抗体的保留特异性地结合c5蛋白能力的一个或多个片段。抗体片段可以包括fab片段、f(ab’)2片段、fv片段、dab片段、含有cdr的片段或分离的cdr。在某些实施方案中,术语“抗原结合片段”是指多特异性抗原结合分子的多肽片段。使用任何合适的标准技术,如蛋白水解消化或涉及编码抗体可变和(任选)恒定结构域的dna的操作和表达的重组基因工程化技术,可以从例如完整抗体分子衍生抗体的抗原结合片段。这样的dna是已知的和/或从例如商业来源、dna文库(包括,例如,噬菌体-抗体文库)容易获得的,或可以合成。可以将dna测序并且通过化学操作,或通过使用分子生物学技术来操作,例如,将一个或多个可变和/或恒定结构域排列成合适的构造,或引入密码子,形成半胱氨酸残基,改变、添加或删除氨基酸等。抗原结合片段的非限制性实例包括:(i)fab片段;(ii)f(ab’)2片段;(iii)fd片段;(iv)fv片段;(v)单链fv(scfv)分子;(vi)dab片段;和(vii)由模拟抗体超变区的氨基酸残基组成的最小识别单位(例如,分离的互补决定区(cdr),如cdr3肽),或约束fr3-cdr3-fr4肽。其他工程化的分子,如结构域特异性抗体、单结构域抗体、结构域删除的抗体、嵌合抗体、cdr嫁接的抗体、二抗、三抗、四抗、迷你抗体、纳米抗体(例如,单价纳米抗体、二价纳米抗体等)、小模块免疫药物(smip)和鲨鱼可变ignar结构域,也包括在如本文中所述的表述“抗原结合片段”内。抗体的抗原结合片段通常将包括至少一个可变结构域。可变结构域可以是任何大小或氨基酸组成,并且通常将包括至少一个cdr,其邻近一个或多个框架序列或与一个或多个框架序列在阅读框内。在具有与vl结构域结合的vh结构域的抗原结合片段中,vh和vl结构域可以以合适的排列相对于彼此定位。例如,可变区可以是二聚的,并且含有vh-vh、vh-vl或vl-vl二聚体。或者,抗体的抗原结合片段可以含有单体vh或vl结构域。在某些实施方案中,抗体的抗原结合片段可以含有共价连接至少一个恒定结构域的至少一个可变结构域。可以在本发明的抗体的抗原结合片段内发现的可变和恒定结构域的非限制性、示例性构造包括:(i)vh-ch1;(ii)vh-ch2;(iii)vh-ch3;(iv)vh-ch1-ch2;(v)vh-ch1-ch2-ch3;(vi)vh-ch2-ch3;(vii)vh-cl;(viii)vl-ch1;(ix)vl-ch2;(x)vl-ch3;(xi)vl-ch1-ch2;(xii)vl-ch1-ch2-ch3;(xiii)vl-ch2-ch3和(xiv)vl-cl。在可变和恒定结构域的任一个构造中,包括以上列出的任一个示例性构造,可变和恒定结构域可以彼此直接连接,或可以通过完整或部分铰链或衔接物区连接。铰链区可以由至少2个(例如,5、10、15、20、40、60或更多个)氨基酸组成,其在单个多肽分子的邻近可变和/或恒定结构域之间形成柔性或半柔性键。此外,本发明的抗体的抗原结合片段可以包括以上列出的任一个可变和恒定结构域构造与另一个和/或与一个或多个单体vh或vl结构域以非共价结合(例如,通过二硫键)的同型二聚体或杂二聚体(或其他多聚体)。与完整抗体分子相同,抗原结合片段可以是单特异性的或多特异性的(例如,双特异性的)。抗体的多特异性抗原结合片段通常将包括至少两个不同的可变结构域,其中每个可变结构域能够特异性地结合分开的抗原或同一抗原上的不同表位。对于在本发明的抗体的抗原结合片段的内容中的使用,可以使用本领域可利用的常规技术,采用任一种多特异性抗体格式,包括本文中公开的示例性双特异性抗体格式。人抗体的制备用于在转基因小鼠中生产人抗体的方法是本领域已知的。任何这样的已知方法可以用于本发明的内容中,以制备特异性地结合c5蛋白的人抗体。包含以下任一个的免疫原可以用于产生c5蛋白的抗体。在某些实施方案中,本发明的抗体获自用全长、天然c5蛋白(参见,例如,genbank登录号np_001726.2)(seqidno:355),或用编码其蛋白质或片段的dna免疫的小鼠。或者,可以使用标准生化技术产生蛋白质或其片段,并修饰和用作免疫原。在本发明的某些实施方案中,免疫原是seqidno:355的大约氨基酸残基19-1676范围的c5蛋白的片段。在一些实施方案中,免疫原可以是在大肠杆菌或任何其他真核或哺乳动物细胞(如中国仓鼠卵巢(cho)细胞)中表达的重组c5蛋白或其片段。使用技术(参见,例如,us6,596,541,regeneronpharmaceuticals,)或用于产生单克隆抗体的任何其他已知方法,最初分离具有人可变区和鼠恒定区的c5的高亲和性嵌合抗体。技术涉及产生具有包括可操作地连接内源性鼠恒定区基因座的人重链和轻链可变区的基因组的转基因小鼠,使得所述小鼠响应抗原刺激而产生包含人可变区和鼠恒定区的抗体。分离编码抗体的重链和轻链的可变区的dna并且可操作地连接编码人重链和轻链恒定区的dna。随后在能够表达完全人抗体的细胞中表达dna。通常,用目标抗原攻击小鼠,并且从表达抗体的小鼠收集淋巴细胞(如b-细胞)。可以将淋巴细胞与骨髓瘤细胞系融合来制备永生杂交瘤细胞系,并且筛选和选择这样的杂交瘤细胞系来鉴定产生目标抗原特异性的抗体。可以分离编码重链和轻链可变区的dna并连接所需的重链和轻链的同种型恒定区。这样的抗体蛋白可以在细胞(如cho细胞)中产生。或者,可以从抗原特异性淋巴细胞直接分离编码抗原特异性嵌合抗体或轻链和重链可变结构域的dna。最初,分离具有人可变区和鼠恒定区的高亲和性嵌合抗体。如在以下的实验部分中,将所述抗体进行表征并针对所需的特征进行选择,所需特征包括亲和性、选择性、表位等。用所需的人恒定区替代小鼠恒定区,以产生本发明的完全人抗体,例如,野生型或修饰的igg1或igg4。尽管选择的恒定区可以根据特定的用途而改变,但高亲和性抗原结合和靶特异性特征存在于可变区中。生物等效物本发明的抗c5抗体和抗体片段包括具有不同于所述抗体那些的氨基酸序列但保留结合c5蛋白的能力的蛋白质。与亲本序列相比时,这样的变体抗体和抗体片段包括氨基酸的一个或多个添加、删除或置换,但呈现与所述抗体实质上相等的生物活性。同样,本发明的编码抗体dna序列包括与所公开的序列相比时包括一个或多个核苷酸的添加、删除或置换,但编码与本发明的抗体或抗体片段实质上生物等效的抗体或抗体片段。如果例如在相似实验条件下,以单个剂量或多个剂量的相同摩尔剂量给药时,吸收速率和程度没有显示出显著差异,它们是药物等效物或药物替代物,则认为两个抗原结合蛋白,或抗体,是生物等效的。如果吸收程度是相同的,但吸收速率不同,一些抗体将被认为是等效物或药物替代物,并且仍然可以认为是生物等效物,因为这样的吸收速率差异是有意的,并且反映在标签中,不是例如长期使用时到达有效身体药物浓度必需的,并且在医学上认为对于所研究的特定药品是无关紧要的。在一个实施方案中,如果在其安全性、纯度或效力中不存在临床上有意义的差异,则两个抗原结合蛋白是生物等效的。在一个实施方案中,如果患者可以在参照产品和生物产品之间转换一次或多次而与没有这样转换的持续治疗相比,没有预期的不良作用风险(包括临床上显著的免疫原性的改变或消除的有效性)提高,则两个抗原结合蛋白是生物等效的。在一个实施方案中,如果它们针对病症或使用的病症都通过共同的机制或作用机制起作用至这样的机制已知的程度,则两个抗原结合蛋白是生物等效的。可以通过体内和/或体外方法来证明生物等效性。生物等效性测量包括,例如,(a)人或其他哺乳动物中的体内测试,其中作为时间函数测量了血液、血浆、血清或其他生物流体中的抗体或其代谢产物的浓度;(b)相关的并且合理地预测人体内生物利用率数据的体外测试;(c)其中作为时间函数测量抗体(或其靶)的合适急性药理学作用的人或其他哺乳动物中的体内测试和(d)确定抗体安全性、效力或生物利用率或生物等效性的充分控制的临床试验。例如,可以通过进行残基或序列的各种置换或删除生物活性不需要的末端或内部残基或序列,来构建本发明的抗体的生物等效变体。例如,可以删除或用其他氨基酸来替代对于生物活性不是必需的半胱氨酸残基,以防止在复性时形成不需要的或不正确的分子内二硫键。在其他内容中,生物等效抗体可以包括抗体变体,所述变体包括改变抗体的糖基化特征的氨基酸变化,例如,消除或除去糖基化的突变。包括fc变体的抗c5抗体根据本发明的某些实施方案,提供了包括fc结构域的抗c5抗体,所述fc结构域包括一个或多个突变,与中性ph相比,所述突变增强或降低例如酸性ph下抗体与fcrn受体的结合。例如,本发明包括在fc结构域的ch2或ch3区域中的突变的抗c5抗体,其中突变提高fc结构域在酸性环境下对fcrn的亲和性(例如,在核内体中,其中ph范围为约5.5至约6.0)。这样的突变可以导致抗体给药于动物时血清半衰期的提高。这样的fc修饰的非限制性实例包括,例如,位置250(例如,e或q);250和428(例如,l或f),252(例如,l/y/f/w或t),254(例如,s或t),和256(例如,s/r/q/e/d或t)的修饰;或位置428和/或433(例如,h/l/r/s/p/q或k)和/或434(例如,a、w、h、f或y[n434a、n434w、n434h、n434f或n434y])的修饰;或位置250和/或428的修饰;或位置307或308(例如,308f、v308f)和434的修饰。在一个实施方案中,修饰包括428l(例如,m428l)和434s(例如,n434s)修饰;428l、259i(例如,v259i)和308f(例如,v308f)修饰;433k(例如,h433k)和434(例如,434y)修饰;252、254和256(例如,252y、254t和256e)修饰;250q和428l修饰(例如,t250q和m428l);以及307和/或308修饰(例如,308f或308p)。在再另一个实施方案中,修饰包括265a(例如,d265a)和/或297a(例如,n297a)修饰。例如,本发明包括抗c5抗体,其包括fc结构域,所述fc结构域包括一个或多个选自以下的突变对或组:250q和248l(例如,t250q和m248l);252y、254t和256e(例如,m252y、s254t和t256e);428l和434s(例如,m428l和n434s);257i和311i(例如,p257i和q311i);257i和434h(例如,p257i和n434h);376v和434h(例如,d376v和n434h);307a、380a和434a(例如,t307a、e380a和n434a);以及433k和434f(例如,h433k和n434f)。本文中公开的抗体可变结构域内所有可能的前述fc结构域突变和其他突变的组合包括在本发明的范围内。本发明还包括抗c5抗体,其包括嵌合重链恒定(ch)区,其中嵌合ch区包括源自超过一个免疫球蛋白同种型的ch区的区段。例如,本发明的抗体可以包括嵌合ch区,其包括源自人igg1、人igg2或人igg4分子的部分或全部ch2结构域,结合源自人igg1、人igg2或人igg4分子的部分或全部ch3结构域。根据某些实施方案,本发明的抗体包括具有嵌合铰链区的嵌合ch区。例如,嵌合铰链可以包括源自人igg1、人igg2或人igg4铰链区的“上铰链”氨基酸序列(根据eu编号从位置216到227的氨基酸残基),结合源自人igg1、人igg2或人igg4铰链区的“下铰链”序列(根据eu编号从位置228至236的氨基酸残基。根据某些实施方案,嵌合铰链区包括源自人igg1或人igg4上铰链的氨基酸残基和源自人igg2下铰链的氨基酸残基。在某些实施方案中,本文中所述的包括嵌合ch区的抗体,呈现出改变的fc效应子功能,而没有不利地影响抗体的治疗或药物动力学特性。(参见,例如,美国专利申请公开2014/0243504,将其公开内容全部按引用并入本文中)。抗体的生物学特征通常,本发明的抗体通过结合c5蛋白起作用并防止其裂解成c5a和c6b。例如,本发明包括以低于9nm的kd结合c5蛋白(例如,在25℃或37℃下)的抗体和抗体的抗原结合片段,所述kd如通过表面等离子体共振测量的,例如,使用本文实施例3中限定的分析格式。在某些实施方案中,抗体或其抗原结合片段以低于约9nm、低于约5nm、低于约2nm、低于约1nm、低于约500pm、低于250pm,或低于100pm的kd结合c5,所述kd如通过表面等离子体共振测量的,例如,使用本文实施例3中限定的分析格式,或基本上相似的分析。本发明还包括以高于约2分钟的解离半衰期(t1/2)结合人c5蛋白的抗体及其抗原结合片段,所述解离半衰期如在25℃下通过表面等离子体共振测量的,例如,使用本文实施例4中限定的分析格式,或基本上相似的分析。在某些实施方案中,本发明的抗体或抗原结合片段以高于约5分钟,高于约10分钟,高于约30分钟,高于约50分钟,高于约100分钟,高于约150分钟,高于约200分钟或高于约250分钟的t1/2结合c5蛋白,所述t1/2如在25℃下通过表面等离子体共振测量的,例如,使用本文实施例3中限定的分析格式(例如,mab捕获或抗原捕获格式),或基本上相似的分析。本发明还包括以高于约1.5分钟的解离半衰期(t1/2)结合人c5蛋白的抗体及其抗原结合片段,所述解离半衰期如在37℃下通过表面等离子体共振测量的,例如,使用本文实施例4中限定的分析格式,或基本上相似的分析。在某些实施方案中,本发明的抗体或抗原结合片段以高于约2分钟,高于约5分钟,高于约10分钟,高于约25分钟,高于约50分钟,高于约100分钟,高于约150分钟,高于约200分钟的t1/2结合c5蛋白,所述t1/2如在37℃下通过表面等离子体共振测量的,例如,使用本文实施例3中限定的分析格式(例如,mab捕获或抗原捕获格式),或基本上相似的分析。本发明还包括以低于120nm的kd结合猴c5蛋白(例如,在25℃或37℃下)的抗体和抗体的抗原结合片段,所述kd如通过表面等离子体共振测量的,例如,使用本文实施例3中限定的分析格式。在某些实施方案中,抗体或其抗原结合片段以低于约120nm、低于约100nm、低于约50nm、低于约25nm、低于约10nm、低于5nm、低于1nm、低于约500pm或低于250pm的kd结合猴c5,所述kd如通过表面等离子体共振测量的,例如,使用本文实施例3中限定的分析格式,或基本上相似的分析。本发明还包括以低于70nm的kd结合具有r885h改变的经修饰人c5蛋白(通过seqidno:356来举例说明)的抗体和抗体的抗原结合蛋白,所述kd如通过表面等离子体共振测量的,例如,使用本文实施例3中限定的分析格式。c5变体已经显示出差的对本领域之前公开的抗c5抗体的应答(例如,nishimura等2014,newengl.j.med.370:632-639)。在某些实施方案中,抗体或其抗原结合片段以低于约65nm、低于约50nm、低于约20nm、低于约10nm、低于约5nm、低于3nm、或低于2nm的kd结合修饰的人c5,所述kd如通过表面等离子体共振测量的,例如,使用本文实施例3中限定的分析格式,或基本上相似的分析。本发明还包括以低于160nm的kd结合具有r885c改变的经修饰人c5蛋白(通过seqidno:357来举例说明)的抗体和抗体的抗原结合蛋白,所述kd如通过表面等离子体共振测量的,例如,使用本文实施例3中限定的分析格式。c5变体已经显示出差的对本领域之前公开的抗c5抗体的应答(例如,nishimura等2014,newengl.j.med.370:632-639)。在某些实施方案中,抗体或其抗原结合片段以低于约150nm、低于约100nm、低于约50nm、低于约20nm、低于约10nm、低于5nm、或低于2nm的kd结合修饰的人c5,所述kd如通过表面等离子体共振测量的,例如,使用本文实施例3中限定的分析格式,或基本上相似的分析。本发明还包括以低于10nm的ic50抑制补体依赖性细胞毒性(cdc)的抗体和抗体的抗原结合蛋白,所述ic50如通过发光分析测量的,例如,使用本文实施例6中限定的分析格式。在某些实施方案中,抗体或其抗原结合片段以低于约5nm,低于约3.5nm或低于约2nm的ic50抑制cdc,如通过b细胞发光分析测量,例如,使用本文实施例6中限定的分析格式,或基本上相似的分析。本发明还包括将人c5介导的经典途径(cp)溶血阻断超过94%并且具有低于6nm的ic50的抗体和抗原结合片段,如通过cp溶血分析测量的,例如,使用本文实施例8中限定的分析格式。在某些实施方案中,抗体或其抗原结合片段以低于约6nm,低于约5nm,低于约4nm,低于约3nm,或低于约2nm的ic50阻断cp溶血,如通过cp溶血分析测量的,例如,使用本文实施例8中限定的分析格式,或基本上相似的分析。本发明还包括将人c5介导的旁路途径(ap)溶血阻断超过70%并且具有低于165nm的ic50的抗体和抗原结合片段,如通过ap溶血分析测量的,例如,使用本文实施例8中限定的分析格式。在某些实施方案中,抗体或其抗原结合片段以低于约160nm,低于约150nm,低于约100nm,低于约50nm,或低于约20nm的ic50阻断ap溶血,如通过ap溶血分析测量的,例如,使用本文实施例8中限定的分析格式,或基本上相似的分析。本发明还包括将非洲绿猴c5介导的经典途径(cp)溶血阻断超过40%并且具有低于185nm的ic50的抗体和抗原结合片段,如通过cp溶血分析测量的,例如,使用本文实施例8中限定的分析格式。在某些实施方案中,抗体或其抗原结合片段以低于约180nm,低于约150nm,低于约100nm,低于约75nm,或低于约50nm的ic50阻断cp溶血,如通过cp溶血分析测量的,例如,使用本文实施例8中限定的分析格式,或基本上相似的分析。本发明还包括以低于235nm的ic50阻断非洲绿猴c5介导的旁路途径(ap)溶血的抗体和抗原结合片段,如通过ap溶血分析测量的,例如,使用本文实施例8中限定的分析格式。在某些实施方案中,抗体或其抗原结合片段以低于约200nm,低于约150nm,低于约100nm,低于约50nm,或低于约20nm的ic50阻断ap溶血,如通过ap溶血分析测量的,例如,使用本文实施例8中限定的分析格式,或基本上相似的分析。本发明还包括以低于145nm的ic50将食蟹猴c5介导的经典途径(cp)溶血阻断超过90%的抗体和抗原结合片段,如通过cp溶血分析测量的,例如,使用本文实施例8中限定的分析格式。在某些实施方案中,抗体或其抗原结合片段以低于约140nm,低于约120nm,低于约100nm,低于约75nm,或低于约50nm的ic50阻断cp溶血,如通过cp溶血分析测量的,例如,使用本文实施例8中限定的分析格式,或基本上相似的分析。本发明还包括以低于30nm的ic50阻断食蟹猴c5介导的旁路途径(ap)溶血的抗体和抗原结合片段,如通过ap溶血分析测量的,例如,使用本文实施例8中限定的分析格式。在某些实施方案中,抗体或其抗原结合片段以低于约25nm,低于约20nm,低于约10nm,低于约5nm,或低于约2nm的ic50阻断ap溶血,如通过ap溶血分析测量的,例如,使用本文实施例8中限定的分析格式,或基本上相似的分析。本发明还包括与本领域的抗c5抗体相比显示出提高的药物动力学(pk)和药效学(pd)特性的抗体和抗原结合片段。本发明的抗c5抗体在给药时显示出较低的对靶介导的清除的易感性,如本文实施例9和10中显示的。在某些实施方案中,本发明包括显示出血清浓度持续延长时间段的抗c5抗体及其抗原结合片段,例如,超过20天,超过25天,超过30天,超过35天,超过40天,超过45天,超过50天,超过55天,或超过60天,如本文实施例9和10中所述的。在某些实施方案中,与本领域的抗c5抗体相比,本发明的抗c5抗体显示出超过10天的延长血清半衰期。在某些实施方案中,本发明提供了对人c5具有高亲和性(例如,低于0.3nm的kd)和较低清除(例如,天数超过之前已知的抗c5抗体的延长的血清半衰期、提高的药效学活性)的抗c5抗体及其抗原结合片段。本发明这样的抗体可以有利地以较低频率的给药用于c5相关疾病或病症的受试者中。在一个实施方案中,本发明提供了分离的特异性地结合c5蛋白的重组抗体或其抗原结合片段,其中抗体或其片段呈现出以下的一个或多个特征:(a)是完全人单克隆抗体;(b)在25℃下以低于0.9nm的解离常数(kd)结合人c5,如在表面等离子体共振分析中测量的;(c)在37℃下以低于0.3nm的kd结合人c5,如在表面等离子体共振分析中测量的;(d)在给药于食蟹猴时具有高于10μg/ml的血清浓度直至第70天;(e)在给药于食蟹猴时阻断cp-和ap溶血直至第35天,如在离体溶血分析中测量的;(f)在食蟹猴中具有超过10天的血清半衰期;(g)给药于c5人源化小鼠时,具有超过10μg/ml的血清浓度直至第40天;(h)给药于c5人源化小鼠时,阻断cp溶血直至第30天,如在离体溶血分析中测量的;和(i)在c5人源化小鼠中具有超过10天的血清半衰期。在一个实施方案中,本发明还提供了分离的特异性地结合c5蛋白的重组抗体或其抗原结合片段,其中抗体或其片段呈现出以下的一个或多个特征:(a)是完全人单克隆抗体;(b)在25℃下以低于0.9nm的解离常数(kd)结合人c5,如在表面等离子体共振分析中测量的;(c)在37℃下以低于0.3nm的kd结合人c5,如在表面等离子体共振分析中测量的;(d)以低于65nm的kd结合猴c5,如在表面等离子体共振分析中测量的;(e)以低于0.5nm的kd结合人c5变体r885h(seqidno:356),如在表面等离子体共振分析中测量的;(f)以低于0.5nm的kd结合人c5变体r885c(seqidno:357),如在表面等离子体共振分析中测量的;(g)将人c5-介导的经典途径(cp)溶血阻断超过95%并且具有低于6nm的ic50,如在cp溶血分析中测量的;(h)将人c5-介导的旁路途径(ap)溶血阻断超过70%并且具有低于165nm的ic50,如在ap溶血分析中测量的;(i)以低于185nm的ic50抑制非洲绿猴c5介导的cp溶血,如在cp溶血分析中测量的;(j)以低于235nm的ic50抑制非洲绿猴c5介导的ap溶血,如在ap溶血分析中测量的;(k)以低于145nm的ic50抑制食蟹猴c5介导的cp溶血,如在cp溶血分析中测量的;和(l)以低于30nm的ic50抑制食蟹猴c5介导的ap溶血,如在ap溶血分析中测量的。本发明的抗体可以具有一个或多个上述生物学特征,或其任意组合。从包括本文的工作实施例的本发明公开内容的概述,本发明抗体的其他生物学特征对于本领域普通技术人员而言是显而易见的。表位作图和相关技术本发明包括与c5蛋白分子的一个或多个区域内(包括α多肽和β多肽)发现的一个或多个氨基酸相互作用的抗c5抗体。抗体结合的表位可以由位于上述任一个c5蛋白分子的结构域内的单个连续的3个或更多个(例如,3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或更多个)氨基酸序列组成(例如,结构域中的线性表位)。或者,表位可以由位于任一个或两个上述蛋白分子的结构域内的多个非连续氨基酸(或氨基酸序列)组成(例如,构象表位)。本领域普通技术人员已知的各种技术可以用于确定抗体是否与多肽或蛋白质内的“一个或多个氨基酸相互作用”。示例性技术包括,例如,常规交叉阻断分析,如antibodies,harlow和lane(coldspringharborpress,coldspringharbor,ny)中所述的。其他方法包括丙氨酸扫描突变分析、肽印迹分析(reineke(2004)methodsmol.biol.248:443-63)、肽裂解分析、晶体研究和nmr分析。此外,可以使用如表位切除、表位提取和抗原化学修饰这样的方法(tomer(2000)prot.sci.9:487-496)。可以用于鉴定抗体与其相互作用的多肽内的氨基酸的另一种方法是通过质谱检测的氢/氘交换。概括而言,氢/氘交换方法涉及氘标记目标蛋白,接着将抗体结合氘标记的蛋白。接着,将蛋白质/抗体复合物转移至水中,并且受到抗体复合物保护的氨基酸内的可交换质子以慢于不是界面一部分的氨基酸内的可交换质子的速率经历氘-至-氢的返回-交换。因此,形成蛋白质/抗体界面的一部分的氨基酸可以保持氘并且因此与不包括在界面中的氨基酸相比呈现出相对较高的质量。抗体解离后,将靶蛋白接受蛋白酶裂解和质谱分析,由此揭示对应于抗体与其相互作用的特定氨基酸的氘标记的残基。参见,例如,ehring(1999)analyticalbiochemistry267:252-259;engen和smith(2001)anal.chem.73:256a-265a。术语“表位”是指抗原上b和/或t细胞响应的位点。b细胞表位可以从连续的氨基酸形成或通过蛋白质的三级折叠并列的非连续氨基酸形成。从连续的氨基酸形成的表位通常在暴露于变性溶剂时能够保留,而通过三级折叠形成的表位通常在用变性溶剂处理时丢失。表位通常包括独特空间构象的至少3个,并且更常见地,至少5个或8-10个氨基酸。修饰辅助剖析(map),也称为基于抗原结构的抗体剖析(asap),是根据每个抗体对化学或酶修饰抗原表面的结合谱的相似性将大量针对相同抗原的单克隆抗体(mab)归类的方法(参见us2004/0101920,特意将其全部按引用并入本文中)。每个类别可以反映出截然不同于另一个类别代表的表位的独特表位或部分与另一个类别代表的表位部分重叠的独特表位。这种技术允许快速过滤遗传上相同的抗体,使得表征可以聚焦于遗传上不同的抗体。应用于杂交瘤筛选时,map有助于产生具有所需特征的mab的罕见杂交瘤克隆的鉴定。map可以用于将本发明的抗体分选成结合不同表位的抗体的组。在某些实施方案中,抗c5抗体或其抗原结合片段结合c5蛋白中举例说明的任一个或多个区域内的表位或其片段,所述表位是天然形式的,如seqidno:355中举例说明的,或是重组产生的。在一些实施方案中,本发明的抗体结合包括一个或多个选自人c5蛋白的氨基酸残基19-1676的氨基酸的区域。在某些实施方案中,本发明的抗体,与选自范围从seqidno:355的约位置19至约位置750的氨基酸残基;或范围从约位置751至约位置1676的氨基酸残基的至少一个氨基酸序列相互作用。在某些实施方案中,本发明包括与c5(seqidno:359)的α和/或β链内发现的一个或多个表位相互作用的抗c5抗体及其抗原结合片段。表位可以由一个或多个位于c5的α和/或β链内的3个或更多个(例如,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20或更多个)氨基酸的连续序列组成。或者,表位可以由多个位于c5内的非连续氨基酸(或氨基酸序列)组成。如本文实施例11中所示的,本发明的示例性抗体h4h12166p与其相互作用的c5的表位通过以下来限定:(i)对应于seqidno:359的β链中包括的氨基酸591至599的氨基酸序列nmatgmdsw(seqidno:360);和(ii)氨基酸序列wevhlvprrkqlqfalpdsl(seqidno:361),其对应于seqidno:359的α链中包括的氨基酸775至794。因此,本发明包括与由(i)氨基酸序列nmatgmdsw(seqidno:360)(其对应于seqidno:359的氨基酸591至599);和(ii)氨基酸序列wevhlvprrkqlqfalpdsl(seqidno:361)(其对应于seqidno:359的氨基酸775至794)组成的区域内含有的一个或多个氨基酸相互作用的抗c5抗体。本发明包括与表1中所列的任一个特定示例性抗体结合相同的表位或表位的一部分的抗c5抗体。同样,本发明还包括与表1中所列的任一个特定示例性抗体竞争与c5蛋白或其片段结合的抗c5抗体。例如,本发明包括与表1中所列的一个或多个抗体交叉竞争与c5蛋白结合的抗c5抗体。可以使用本领域已知的常规方法容易地确定抗体是否与参照抗c5抗体结合相同的表位或与参照c5抗体竞争结合。例如,为了确定测试抗体是否与本发明参照抗c5抗体结合相同的表位,允许参照抗体在饱和条件下结合c5蛋白或肽。接着,评价测试抗体结合c5蛋白的能力。如果在参照抗c5抗体饱和结合后,测试抗体能够结合c5,可以推断测试抗体结合不同于参照抗c5抗体的表位。另一方面,如果与参照抗c5抗体饱和结合后测试抗体不能结合c5蛋白,那么测试抗体结合与本发明的参照抗c5抗体结合的表位相同的表位。为了确定抗体是否与参照抗c5抗体竞争结合,以两个方向进行上述结合方法:在第一个方向中,允许参照抗体在饱和条件下结合c5蛋白,接着评价测试抗体与c5分子的结合。在第二个方向中,允许测试抗体在饱和条件下结合c5分子,接着评价参照抗体与c5分子的结合。如果,在两个方向中,只有第一个(饱和)抗体能够结合c5分子,那么推断出测试抗体和参照抗体竞争与c5的结合。如本领域技术人员将认识到的,与参照抗体竞争结合的抗体不是必定与参照抗体结合相同的表位,而是可以通过结合重叠或邻近的表位在空间上阻断参照抗体的结合。如果各自竞争地抑制(阻断)另一个抗体与抗原的结合,则两个抗体结合相同或重叠的表位。即,1-、5-、10-、20-或100-倍过量的一个抗体抑制至少50%,但优选75%,90%或甚至99%的另一个抗体的结合,如在竞争结合分析中测量的(参见,例如,junghans等,cancerres.199050:1495-1502)。或者,如果抗原中降低或消除一个抗体结合的所有氨基酸突变降低或消除另一个抗体的结合,则两个抗体具有相同的表位。如果降低或消除一个抗体结合的一些氨基酸突变降低或消除另一个抗体的结合,则两个抗体具有重叠的表位。随后可以进行另外的常规实验(例如,肽突变和结合分析),以证实所观察到的测试抗体结合的缺乏实际上是由于与参照抗体结合相同的表位引起的或是否空间阻断(或另一种现象)引起所观察到的结合的缺乏。可以使用elisa、ria、表面等离子体共振、流式细胞术或本领域可利用的任何其他定量或定性抗体结合分析,进行此类实验。免疫缀合物本发明包括与治疗部分缀合的人抗c5单克隆抗体(“免疫缀合物”),以治疗c5相关疾病或病症(例如,非典型溶血性尿毒症综合征)。如本文中使用的,术语“免疫缀合物”是指化学上或生物上与放射性试剂、细胞因子、干扰素、靶标或报告部分、酶、肽或蛋白质或治疗剂连接的抗体。抗体可以在沿着分子的任何位置连接放射性试剂、细胞因子、干扰素、靶标或报告部分、酶、肽或治疗剂,只要能够结合其靶标。免疫缀合物的实例包括抗体药物缀合物和抗体-毒素融合蛋白。在一个实施方案中,药剂可以是第二种不同的c5蛋白抗体。可以与抗c5抗体缀合的治疗部分的类型将考虑待治疗的病症和待实现的所需治疗效果。合适的用于形成免疫缀合物的药剂的实例是本领域已知的;参见例如,wo05/103081。多特异性抗体本发明的抗体可以是单特异性的、双特异性的或多特异性的。多特异性抗体可以是对于一个靶多肽的不同表位特异性的或可以含有对超过一个多肽特异性的抗原结合结构域。参见,例如,tutt等,1991,j.immunol.147:60-69;kufer等,2004,trendsbiotechnol.22:238-244。如本领域普通技术人员可知的,可以使用标准分子生物技术(例如,重组dna和蛋白表达技术)来构建本发明的任一个多特异性抗原结合分子,或其变体。在一些实施方案中,以双特异性格式(“双特异性抗体”)来产生c5特异性抗体,其中结合c5蛋白的不同结构域的可变区连接在一起,给予在单个结合分子内的双结构域特异性。适当设计的双特异性可以通过提高特异性和结合亲合力两者来增强整体的c5蛋白抑制效力。对单独的结构域(例如,n-末端结构域的区段)具有特异性的可变区,或可以结合一个结构域内的不同区域的可变区,在结构支架上成对,允许每个区域同时结合分开的表位,或结合一个结构域内的不同区域。在针对双特异性的一个实例中,来自对一个结构域具有特异性的结合子的重链可变区(vh)与来自一系列对第二个结构域具有特异性的结合子的轻链可变区(vl)重组,以鉴定可以与初始vh配对而没有破坏针对该vh的初始特异性的非同源vl伴侣。以这种方式,可以将单个vl区段(例如,vl1)结合两个不同的vh结构域(例如,vh1和vh2),以产生两条结合“臂”的双特异性抗体(vh1-vl1和vh2-vl1)。单个vl区段的使用降低了系统的复杂性并且由此简化并提高了用于产生双特异性抗体的克隆、表达和纯化过程中的效率(参见,例如,ussn13/022759和us2010/0331527)。或者,可以使用本文中公开的技术,或本领域技术人员已知的其他技术,以双特异性的格式,制备结合超过一个结构域和第二靶标(如,但不限于,例如,第二个不同的抗c5抗体)的抗体。结合不同区域的抗体可变区可以与结合例如c5胞外结构域上的相关位点的可变区连接在一起,以给予单个结合分子内的双-抗原特异性。适当设计的这种性质的双特异性抗体起到双重作用。对胞外结构域具有特异性的可变区与对胞外结构域外的具有特异性的可变区在结构支架上成对,允许各自的可变区结合分开的抗原。可以用于本技术实现要素:中的示例性双特异性抗体格式涉及使用第一免疫球蛋白(ig)ch3结构域和第二igch3结构域,其中第一和第二igch3结构域彼此有至少一个氨基酸不同,并且其中与缺少氨基酸差异的双特异性抗体相比,至少一个氨基酸差异降低了双特异性抗体与蛋白a的结合。在一个实施方案中,第一igch3结构域结合蛋白a,而第二igch3结构域含有降低或消除蛋白a结合的突变,如h95r修饰(imgt外显子编号;h435r,eu编号)。第二ch3可以进一步包括y96f修饰(imgt编号;y436f,eu编号)。可以在第二ch3中发现的更多修饰包括:在igg1抗体的情况中,d16e、l18m、n44s、k52n、v57m和v82i(imgt编号;d356e、l358m、n384s、k392n、v397m和v422i,eu编号);在igg2抗体的情况中,n44s、k52n和v82i(imgt编号;n384s、k392n和v422i,eu编号);以及在igg4抗体的情况中,q15r、n44s、k52n、v57m、r69k、e79q和v82i(imgt编号;q355r、n384s、k392n、v397m、r409k、e419q和v422i,eu编号)。上述双特异性抗体格式的变化包括在本发明的范围内。可以用于本
发明内容中的其他示例性双特异性格式包括,不限于,例如,基于scfv的或双抗双特异性格式、igg-scfv融合体、双可变结构域(dvd)-ig、细胞杂交瘤(quadroma)、杵-进-臼(knobs-into-holes)、共同轻链(例如,具有杵-进-臼的共同轻链等)、crossmab、crossfab、(seed)体、亮氨酸拉链、duobody、igg1/igg2、双效fab(daf)-igg和mab2双特异性格式(对于前述格式的概述,参见,例如,klein等,2012,mabs4:6,1-11,以及其中的参考文献)。也可以使用肽/核酸缀合来构建双特异性抗体,例如,其中将具有正交化学反应性的非天然氨基酸用于产生位点特异性的抗体-寡核苷酸缀合物,其随后自我装配成具有限定组成、价和几何形状的多聚复合物。(参见,例如,kazane等,j.am.chem.soc.[epub:2012年12月4日])。治疗给药和制剂本发明提供了包括本发明的抗5c抗体或其抗原结合片段的治疗组合物。根据本发明的治疗组合物将与合适的载体、赋形剂和掺入制剂中的其他药剂一起给药,以提供提高的转移、递送、耐受性等。可以在所有药物化学家已知的处方集中找到许多合适的制剂:remington'spharmaceuticalsciences,mackpublishingcompany,easton,pa。这些制剂包括,例如,粉剂、糊剂、膏剂、凝胶、蜡、油、脂质、含有脂质(阳离子或阴离子)的囊泡(如lipofectintm)、dna缀合物、无水吸收膏、水包油和油包水型乳液、碳蜡乳剂(各种分子量的聚乙二醇)、半固体凝胶和含有碳蜡的半固体混合物。还可以参见powell等“compendiumofexcipientsforparenteralformulations”pda(1998)jpharmscitechnol52:238-311。抗体的剂量可以根据待给药的受试者的年龄和个头、目标疾病、病症、给药途径等改变。将本发明的抗体用于治疗成年患者的疾病或病症,或用于预防这样的疾病时,有利的是通常以约0.1至约100mg/kg体重,更优选约5至约80,约10至约70,或约20至约50mg/kg体重的单个剂量给药本发明的抗体。根据病症的严重性,可以调节治疗的频率和持续时间。在某些实施方案中,本发明的抗体或其抗原结合片段可以作为至少约0.1mg至约800mg,约1至约600mg,约5至约500mg,或约10至约400mg的初始剂量来给药。在某些实施方案中,初级剂量接着给药第二个或多个随后剂量的抗体或其抗原结合片段,其含量可以与初始剂量大致相同或低于初始剂量,其中随后剂量隔开至少1天至3天;至少一周,至少2周;至少3周;至少4周;至少5周;至少6周;至少7周;至少8周,至少9周;至少10周;至少12周;或至少14周。各种递送系统是已知的并且可以用于给药本发明的药物组合物,例如,脂质体中的包囊、微粒、微胶囊、能够表达突变病毒的重组细胞、受体介导的内吞作用(参见,例如,wu等(1987)j.biol.chem.262:4429-4432)。引入的方法包括,但不限于,皮内、经皮、肌内、腹膜内、静脉内、皮下、鼻内、硬膜外和口服途径。组合物可以通过任何便利的途径来给药,例如,通过输注或快速浓注注射,通过上皮或皮肤粘膜内层(例如,口腔粘膜、直肠和肠粘膜等)的吸收,并且可以与其他生物活性剂一起给药。给药可以是全身的或局部的。药物组合物也可以在囊泡中递送,特别是在脂质体中(参见,例如,langer(1990)science249:1527-1533)。本文中还包括使用纳米颗粒来递送本发明的抗体。缀合抗体的纳米颗粒可以用于治疗和诊断应用。缀合抗体的纳米颗粒以及制备和使用方法详细描述于arruebo,m.等,2009(“antibody-conjugatednanoparticlesforbiomedicalapplications”,见j.nanomat.volume2009,articleid439389,第24页,doi:10.1155/2009/439389),按引用并入本文中。可以研发纳米颗粒并与待靶向细胞的药物中所含的抗体缀合。用于药物递送的纳米颗粒也已经描述于例如us8257740或us8246995中,各自全部并入本文中。在某些情况中,可以在受控释放系统中递送药物组合物。在一个实施方案中,可以使用泵。在另一个实施方案中,可以使用聚合材料。在再另一个实施方案中,可以在组合物靶附近放置控制释放系统,因此只需要全身剂量的一部分。注射制剂可以包括用于静脉内、皮下、皮内、颅内、腹膜内和肌内注射、点滴输注等的剂型。可以通过公众已知的方法来制备这些注射制剂。例如,可以通过例如在通常用于注射的无菌水性介质或油性介质中溶解、悬浮或乳化上述抗体或其盐来制备注射制剂。作为用于注射的水性介质,例如,存在生理盐水、含有葡萄糖和其他佐剂的等渗溶液等,其可以与合合适的增溶剂,如醇(例如,乙醇)、多元醇(例如,丙二醇、聚乙二醇)、非离子型表面活性剂[例如,聚山梨酸酯80、hco-50(氢化蓖麻油的聚氧乙烯(50mol)加成物)]等组合使用。作为油性介质,使用例如芝麻油、大豆油等,其可以与增溶剂,如苯甲酸苄酯、苯甲醇等组合使用。因此制备的注射物优选装载合适的安瓿瓶中。本发明的药物组合物可以用标准的针和注射器通过皮下或静脉内来给药。此外,对于皮下递送,笔式递送装置可以容易地应用于本发明的药物组合物的递送中。这样的笔式递送装置可以是可重复使用的或一次性的。可重复使用的笔式递送装置通常利用可替换的含有药物组合物的筒。一旦筒内的全部药物组合物已经给药并且筒是空的,可以容易地丢弃空筒并替换含有药物组合物的新筒。随后可以重复使用笔式递送装置。在一次性的笔式递送装置中,不存在可替换的筒。相反,一次性的笔式递送装置预先装满在装置内的存储器中容纳的药物组合物。一旦存储器排空药物组合物,将整个装置丢弃。各种可重复使用的笔式和自动注射器递送装置在本发明的药物组合物的皮下递送中具有应用。实例包括,但肯定不限于autopentm(owenmumford,inc.,woodstock,uk)、disetronictm笔(disetronicmedicalsystems,burghdorf,switzerland)、humalogmix75/25tm笔、humalogtm笔、humalin70/30tm笔(elilillyandco.,indianapolis,in)、novopentmi,ii和iii(novonordisk,哥本哈根,丹麦)、novopenjuniortm(novonordisk,哥本哈根,丹麦)、bdtm笔(bectondickinson,franklinlakes,nj)、optipentm、optipenprotm、optipenstarlettm和opticliktm(sanofi-aventis,法兰克福,德国),只是举例说明。在本发明的药物组合物的皮下递送中具有应用的一次性笔式递送装置的实例包括,但肯定不限于solostartm笔(sanofi-aventis)、flexpentm(novonordisk)和kwikpentm(elililly)、sureclicktm自动注射器(amgen,thousandoaks,ca)、penlettm(haselmeier,斯图加特,德国)、epipen(dey,l.p.)和humiratmpen(abbottlabs,abbottpark,il),只是举例说明。有利地,将用于上述口服或非肠道使用的药物组合物制成适于装配活性成分剂量的单位剂量的剂型。这样的单位剂量的剂型包括,例如,片剂、丸剂、胶囊、注射剂(安瓿)、栓剂等。所含抗体的含量通常为每单位剂量剂型中约5至约500mg,尤其是注射形式中,对于其他剂型,优选含有约5至约300mg和约10至约300mg的抗体。抗体的治疗用途本发明的抗体可用于治疗,和/或预防与c5相关的疾病或疾患或病症和/或用于改善与这样的疾病、疾患或病症相关的至少一个症状。在某些实施方案中,本发明的抗体或其抗原结合片段可以以治疗剂量给药于患有与c5相关的疾病或疾患或病症的患者。在某些实施方案中,本发明的抗体可用于治疗或预防非典型溶血性尿毒症综合征(ahus)的症状或指征。ahus的症状或指征包括,但不限于,血小板激活、溶血、导致中风的全身性血栓性微血管病(在全身小血管中形成血块)、心脏病发作、肾衰竭和/或死亡、晚期肾病、永久性肾损伤、腹痛、意识模糊、水肿、疲劳、恶心/呕吐、腹泻和微血管病性贫血。在某些实施方案中,本发明的抗体可用于治疗或预防阵发性夜间血红蛋白尿(pnh)的症状或指征。pnh的症状或指征包括,但不限于,红细胞的破坏、血栓(包括深静脉血栓、肺栓塞)、血管内溶血性贫血、红色尿、贫血的症状,如疲劳、呼吸短促和心悸,腹痛和吞咽困难。在某些实施方案中,本发明的抗体可用于治疗或预防选自以下的c5相关疾病或疾患的至少一个症状或指征:神经病学病症、肾疾、多发性硬化、中风、guillainbarre综合征、外伤性脑损伤、帕金森病、不当或不合需要的补体激活的失调、血液透析并发症、超急性同种异体移植排斥、异种移植排斥、il-2治疗期间白细胞间介素-2诱导的毒性、炎性失调、自身免疫疾病的炎症、局限性回肠炎、成人型呼吸窘迫综合征、包括烧伤或冻伤的热伤、缺血后再灌注病况、心肌梗死、毛细血管渗漏综合征、肥胖、糖尿病、阿尔茨海默氏病、精神分裂症、中风、癫痫、动脉粥样硬化、脉管炎、大疱性类天疱疮、c3肾小球病、膜增生性血管球性肾炎(membraneproliferativeglomerulonephritis)、气囊血管成形术、心肺转流或肾转流中的泵后综合征、血液透析、肾缺血、主动脉重建后肠系膜动脉再灌注、传染病或脓毒症、免疫复合性疾病和自身免疫疾病、糖尿病性肾病、alport’s综合征、进行性肾衰竭、蛋白尿性肾病、肾缺血-再灌注损伤、狼疮性肾炎、肾小球病、类风湿性关节炎、系统性红斑狼疮(sle)、sle肾炎、膜增生性肾炎、溶血性贫血、视神经脊髓炎、肾移植、遗传性cd59缺陷、牛皮癣和重症肌无力。在某些其他实施方案中,本发明的抗体可用于治疗或预防选自以下的c5相关疾病或疾患的至少一个症状或指征:肺病和障碍,如呼吸困难、咳血、ards、哮喘、慢性梗阻性肺病(copd)、肺气肿、肺栓塞和梗死、肺炎、纤维性粉尘病、由于惰性粉尘和矿物质(例如,硅、煤尘、铍和石棉)引起的损伤、肺纤维化、有机粉尘病、化学损伤(由于刺激性气体和化学品引起的,例如,氯、光气、二氧化硫、硫化氢、二氧化氮、氨和盐酸)、吸烟损伤、热损伤(例如,烧伤、冻伤)、哮喘、过敏、支气管收缩、过敏性肺炎、寄生虫病、goodpasture's综合征、肺血管炎、遗传性血管性水肿和免疫复合物相关炎症。在某些实施方案中,本发明的抗体可用于治疗患有眼病的受试者,所述眼病如老年性黄斑变性(amd)、糖尿病性黄斑水肿(dme)、糖尿病性视网膜病、眼血管生成(影响脉络膜、角膜或视网膜组织的眼部新生血管)、地图样萎缩(ga)、葡萄膜炎和视神经脊髓炎。本发明的抗体可以用于治疗或改善干amd或湿amd的至少一个症状或指征。在一些实施方案中,本发明的抗体可用于预防或减缓视力损失的速率。在一个实施方案中,本发明的抗体可用于减少干amd受试者眼中的玻璃疣。在一个实施方案中,本发明的抗体可用于预防或降低/减缓amd受试者中的视力损失。可以给药本发明的一个或多个抗体,以缓解或预防或降低眼病或疾患的一个或多个症状或病症/指征的严重性。抗体可以用于改善或降低至少一个症状的严重性,所述症状包括但不限于视力损失、视觉畸变(visualdistortion)、难以适应低光水平、弯曲的中心视野、中央/整体视野模糊的增加、玻璃疣的存在(视网膜上建立的胞外物质的微小聚集)、色素改变、视物变形症形式的视觉变形(其中直线网格呈现为波浪状并且网格的一部分可能呈现为空白)、渗出性变化(眼出血、硬性渗出物、视网膜下/pre下/视网膜内流体)、暴露于亮光后视觉功能恢复缓慢(光应力测试)、早期和地图样萎缩、视敏度急剧下降(两个水平或更多,例如,20/20至20/80)、优敏度视野改变(preferentialhyperacuityperimetrychanges)(对于湿amd)、视力模糊、逐渐丧失中央视力(对于患有非渗出性黄斑变性的那些)、视力丧失的快速发作(常常由患有渗出性黄斑变性的受试者中的异常血管渗滤和出血引起的)、暗点(阴影或视野缺失)、辨别颜色困难、特别从暗色中辨别暗色和从亮色中辨别亮色、对比灵敏度损失、直线在amsler网格中呈现为曲线。本文中还考虑了将本发明的一种或多种抗体预防性地用于处于产生黄斑变性风险中的受试者,如年龄超过50岁的受试者、具有黄斑变性家族史的受试者、抽烟者以及肥胖、高胆固醇、心血管疾病或不健康饮食的受试者。在本发明的再一个实施方案中,将本发明的抗体用于制备用于治疗患有c5相关疾病或疾患的患者的药物组合物或药物。在本发明的另一个实施方案中,将本发明抗体用作本领域技术人员已知用于治疗或改善c5相关疾病或疾患的任何其他药剂或任何其他治疗的辅助治疗。联合治疗联合治疗可以包括本发明的抗c5抗体和可以有利地联合本发明的抗体或本发明抗体的生物活性片段的任何其他治疗剂。本发明的抗体可以协同地联合用于治疗c5相关疾病或疾患的一种或多种药物或治疗。在一些实施方案中,本发明的抗体可以联合第二种治疗剂来改善所述疾病的一个或多个症状。根据c5相关疾病或失调,本发明的抗体可以联合一种或多种其他的治疗剂使用,所述其他治疗剂包括,但不限于,抗凝剂(例如,华法林、阿司匹林、肝素、苯茚二酮、磺达肝素、idraparinux和凝血酶抑制剂,如阿戈托班、来匹卢定(lepirudin)、比伐卢定(bivalirudin)或达比加群(dabigatran))、抗炎药(例如,皮质类固醇和非类固醇抗炎药)、抗高血压药(例如,血管紧张素转化酶抑制剂)、免疫抑制剂(例如,长春新碱、环孢霉素a或甲氨蝶呤)、纤维蛋白溶解剂(例如,安克洛酶(ancrod)、ε-氨基己酸、抗纤维蛋白溶酶-a1、环前列腺素和去纤苷)、降脂剂(如羟甲基戊二酰coa还原酶抑制剂)、抗cd20剂(如利妥昔单抗)、抗tnf剂(如英夫利昔单抗)、抗癫痫剂(例如,硫酸镁)、c3抑制剂或抗血栓形成剂。在某些实施方案中,第二种治疗剂是c5蛋白的另一种抗体。本文中考虑了使用针对c5的具有宽谱的中和或抑制活性的抗体的组合(“混合物”)。在一些实施方案中,可以将非竞争抗体组合并给药于需要的受试者。在一些实施方案中,包含抗体的所述组合结合蛋白质上不同的非重叠表位。包含抗体的所述组合物可以阻断c5结合c5转化酶和/或可以防止/抑制c5裂解成c5a和c5b。在某些实施方案中,第二抗体可以在人血清中具有更长的半衰期。如本文中使用的,术语“联合”表示可以在本发明的抗c5抗体给药之前、同时或之后给药的另外的治疗活性组分。术语“联合”还包括抗c5抗体和第二种治疗剂的按序或同时给药。可以在本发明的抗c5抗体给药之前,将另外的治疗活性组分给药于受试者。例如,如果在第二组分给药前1周、前72小时、前60小时、前48小时、前36小时、前24小时、前12小时、前6小时、前5小时、前4小时、前3小时、前2小时、前1小时、前30分钟、前15分钟、前10分钟、前5分钟或短于1分钟前给药第一组分,则认为在第二组分“之前”给药第一组分。在其他实施方案中,可以在本发明的抗c5抗体给药之后,将另外的治疗活性组分给药于受试者。例如,如果在第二组分给药后1分钟、后5分钟、后10分钟、后15分钟、后30分钟、后1小时、后2小时、后3小时、后4小时、后5小时、后6小时、后12小时、后24小时、后36小时、后48小时、后60小时给药第一组分,则认为在第二组分“之后”给药第一组分。在再另一个实施方案中,另外的治疗活性组分可以与本发明的抗c5抗体同时给药。对于本发明的目的,“同时给药”包括,例如,在单个剂型中将抗c5抗体和另外的治疗活性组分给药于受试者,或在彼此约30分钟或更短时间内在分开的剂型中给药于受试者。如果在分开的剂型中给药,各自的剂型可以通过相同的途径给药(例如,抗c5抗体和另外的治疗活性组分都可以是静脉内给药等);或者,各自的剂型可以通过不同的途径给药(例如,抗c5抗体可以静脉内给药,而另外的治疗活性组分可以口服给药)。对于本发明公开内容的目的,在任何情况中,在单个剂型中、通过相同途径在分开剂型中或通过不同途径在分开剂型中的组分的给药全部认为是“同时给药”。对于本发明公开内容的目的,在另外的治疗活性成分“之前”、“同时”或“之后”(如上文中限定的那些术语)的抗c5抗体的给药认为是“联合”另外的治疗活性成分的抗c5抗体的给药。本发明包括其中本发明的c5抗体与本文别处所述的一种或多种另外的治疗活性组分共同配制的药物组合物。给药方案根据某些实施方案,可以将单剂量的本发明的抗c5抗体(或包含抗c5抗体和本文提及的任一种另外的治疗活性剂的组合的药物组合物)给药于需要的受试者。根据本发明的某些实施方案,可以在限定的时间过程中,将多剂量的抗c5抗体(或包含抗c5抗体和本文提及的任一种另外的治疗活性剂的组合的药物组合物)给药于需要的受试者。根据本发明这个方面的方法包括将多个剂量的本发明的抗c5抗体按序给药于受试者。如本文中使用的,“按序给药”表示在不同的时间点,例如,在隔开预定间隔(例如,数小时、数天、数周或数月)的不同天,将每个剂量的抗c5抗体给药于受试者。本发明包括如下方法:其包括将单个初始剂量的抗c5抗体,接着一个或多个第二剂量的抗c5抗体和任选接着一个或多个第三剂量的抗c5抗体按序给药于患者。术语“初始剂量”、“第二剂量”和“第三剂量”是指本发明的抗c5抗体给药的时间顺序。因此,“初始剂量”是在治疗方案开始时给药的剂量(也称为“基线剂量”);“第二剂量”是初始剂量后给药的剂量;而“第三剂量”是第二剂量后给药的剂量。初始、第二和第三剂量全部含有相同量的抗c5抗体,但就给药频率而言通常彼此可以不同。然而,在某些实施方案中,初始、第二和/或第三剂量中所含的抗c5抗体的含量在治疗过程中彼此不同(例如,按照需要上调或下调)。在某些实施方案中,在治疗方案开始时,将两个或多个(例如,2、3、4或5)剂量作为“负荷剂量”给药,接着给药以较低频率基础给药的随后剂量(例如,“维持剂量”)。在本发明的某些示例性实施方案中,就在前一个剂量后1至48小时(例如,1,11/2,2,21/2,3,31/2,4,41/2,5,51/2,6,61/2,7,71/2,8,81/2,9,91/2,10,101/2,11,111/2,12,121/2,13,131/2,14,141/2,15,151/2,16,161/2,17,171/2,18,181/2,19,191/2,20,201/2,21,211/2,22,221/2,23,231/2,24,241/2,25,251/2,26,261/2或更长)给药每个第二和/或第三剂量。如本文中使用的,短语“就在前一个剂量”表示在多次给药的顺序中,在顺序中紧接着的下一个剂量给药前给药于患者的抗c5抗体剂量,没有介于中间的剂量。根据本发明这个方面的方法可以包括将任何数量的第二和/或第三剂量的抗c5抗体给药于患者。例如,在某些实施方案中,只有单个第二剂量给药于患者。在其他实施方案中,将两个或更多个(例如,2、3、4、5、6、7、8或更多个)第二剂量给药于患者。同样,在某些实施方案中,只有单个第三剂量给药于患者。在其他实施方案中,将两个或更多个(例如,2、3、4、5、6、7、8或更多个)第三剂量给药于患者。在本发明的某些实施方案中,将第二和/或第三剂量给药于患者的频率在治疗方案过程中可以改变。也可以根据临床检查后个体患者的需求,由医生在治疗过程中调节给药频率。抗体的诊断用途本发明的抗c5抗体可以用于检测和/或测量样品中的c5,例如,用于诊断目的。一些实施方案涉及在分析中使用本发明的一种或多种抗体来检测c5相关疾病或疾患。针对c5的示例性诊断分析包括,例如,将获自患者的样品接触本发明的抗c5抗体,其中用可检测标记或报告分子标记抗c5抗体或将抗c5抗体用作捕获配体以选择性地从患者样品分离c5。或者,未标记的抗c5抗体可以结合第二抗体用于诊断应用中,所述第二抗体自身是可检测标记的。可检测标记或报告分子可以是放射性同位素,如3h、14c、32p、35s或125i;荧光或化学发光部分,如异硫氰酸荧光素,或若丹明;或酶,如碱性磷酸酶、β-半乳糖苷酶、辣根过氧化物酶或荧光素酶;可以用于检测或测量样品中的c5的特定示例性分析包括酶联免疫吸附分析(elisa)、放射性免疫分析(ria)和荧光激活的细胞分选(facs)。可以用于根据本发明的c5诊断分析中的样品包括可获自正常或病理状况下的患者的任何组织或流体样品,其含有可检测含量的c5蛋白或其片段。通常,将测量获自健康患者(例如,未患c5相关疾病的患者)的特定样品的c5蛋白的水平,以最初建立c5的基线或标准水平。随后将这个c5的基线水平相对于获自怀疑患有c5相关病症或与该病症相关症状的个体的样品中测量的c5水平进行比较。c5蛋白特异性的抗体可以不含另外的标记或部分,或它们可以含有n-末端或c-末端标记或部分。在一个实施方案中,所述标记或部分是生物素。在结合分析中,标记(如果存在的话)的位置可以确定肽相对于其上结合肽的表面的方向。例如,如果表面包被了抗生物素蛋白,则含有n-末端生物素的肽将如此定向,使得肽的c-末端部分远离表面。选择的实施方案本发明公开内容选择的实施方案包括以下的:在实施方案1中,本发明包括分离的特异性地结合补体因子5(c5)蛋白的抗体或其抗原结合片段,其中抗体或其抗原结合片段与c5(seqidno:359)内所含的一个或多个氨基酸相互作用,如通过氢/氘交换测定的。在实施方案2中,本发明包括实施方案1的分离抗体或抗原结合片段,其中抗体或其抗原结合片段与c5的α链和/或β链内所含的一个或多个氨基酸相互作用,如通过氢/氘交换测定的。在实施方案3中,本发明包括实施方案1或2的分离抗体或抗原结合片段,其中抗体或其抗原结合片段没有与c5的c5a过敏毒素区的氨基酸相互作用,如通过氢/氘交换测定的。在实施方案4中,本发明包括实施方案1至3任一个的分离抗体或抗原结合片段,其中抗体或其抗原结合片段与seqidno:360和/或seqidno:361内所含的一个或多个氨基酸相互作用,如通过氢/氘交换测定的。在实施方案5中,本发明包括实施方案1至4任一个的分离抗体或抗原结合片段,其中抗体或其抗原结合片段与选自(a)seqidno:359的氨基酸591至599;(b)seqidno:359的氨基酸593至599;(c)seqidno:359的氨基酸775至787;(d)seqidno:359的氨基酸775至794;和(e)seqidno:359的氨基酸779至787的氨基酸序列相互作用。在实施方案6中,本发明包括实施方案1至5任一个的分离抗体或其抗原结合片段,其中抗体或其抗原结合片段与选自seqidno:360和361的氨基酸序列内所含的至少五个氨基酸相互作用。在实施方案7中,本发明包括实施方案1至5任一个的分离抗体或其抗原结合片段,其中抗体或其抗原结合片段与seqidno:360和361的氨基酸序列相互作用。在实施方案8中,本发明包括分离的特异性地结合补体因子5(c5)蛋白的抗体或抗原结合片段,其中抗体或其抗原结合片段与至少一个以下的氨基酸残基相互作用:seqidno:359的n591,m592,a593,t594,g595,m596,d597,s598,w599,w775,e776,v777,h778,l779,v780,p781,r782,r783,k784,q785,l786,q787,f788,a789,l790,p791,d792,s793或l794。在实施方案9中,本发明包括实施方案1至8任一个的分离抗体或其抗原结合片段,其中抗体具有一个或多个以下的特征:(a)在给药于食蟹猴时具有高于10μg/ml的血清浓度直至第70天;(b)在给药于食蟹猴时阻断经典途径(cp)溶血直至第35天,如在离体溶血分析中测量的;(c)在给药于食蟹猴时阻断旁路途径(ap)溶血直至第35天,如在离体溶血分析中测量的;(d)在食蟹猴中具有超过10天的血清半衰期;(e)给药于c5人源化小鼠时,具有超过10μg/ml的血清浓度直至第40天;(f)给药于c5人源化小鼠时,阻断cp溶血直至第30天,如在离体溶血分析中测量的;和(g)在c5人源化小鼠中具有超过10天的血清半衰期。在实施方案10中,本发明包括实施方案1至9任一个的分离抗体或其抗原结合片段,其中抗体具有选自以下的其他特征:(a)是完全人单克隆抗体;(b)在25℃下以低于0.9nm的解离常数(kd)结合人c5,如在表面等离子体共振分析中测量的;(c)在37℃下以低于0.3nm的kd结合人c5,如在表面等离子体共振分析中测量的;(d)以低于65nm的kd结合猴c5,如在表面等离子体共振分析中测量的;(e)以低于0.5nm的kd结合人c5变体r885h(seqidno:356),如在表面等离子体共振分析中测量的;(f)以低于0.5nm的kd结合人c5变体r885c(seqidno:357),如在表面等离子体共振分析中测量的;(g)阻断超过95%的人c5介导的经典途径(cp)溶血并且具有低于6nm的ic50,如在cp溶血分析中测量的;(h)阻断超过70%的人c5介导的旁路途径(ap)溶血并且具有低于165nm的ic50,如在ap溶血分析中测量的;(i)以低于185nm的ic50抑制非洲绿猴c5介导的cp溶血,如在cp溶血分析中测量的;(j)以低于235nm的ic50抑制非洲绿猴c5介导的ap溶血,如在ap溶血分析中测量的;(k)以低于145nm的ic50抑制食蟹猴c5介导的cp溶血,如在cp溶血分析中测量的;和(l)以低于30nm的ic50抑制食蟹猴c5介导的ap溶血,如在ap溶血分析中测量的。在实施方案11中,本发明包括实施方案1至10任一个的分离抗体或其抗原结合片段,其中抗体或抗原结合片段包括表1中所列的任一个重链可变区(hcvr)内所含的三个重链互补决定区(cdr)(hcdr1、hcdr2和hcdr3);和表1中所列的任一个轻链可变区(lcvr)内所含的三个轻链cdr(lcdr1、lcdr2和lcdr3)。在实施方案12中,本发明包括实施方案1至11任一个的分离抗体或其抗原结合片段,包括:(a)具有选自seqidno:4,20,36,52,68,84,100,124,140,148,156,172,188,204,220,236,252,268,276,292,308,324和340的氨基酸序列的hcdr1结构域;(b)具有选自seqidno:6,22,38,54,70,86,102,126,142,150,158,174,190,206,222,238,254,270,278,294,310,326和342的氨基酸序列的hcdr2结构域;(c)具有选自8,24,40,56,72,88,104,128,144,152,160,176,192,208,224,240,256,272,280,296,312,328和344的氨基酸序列的hcdr3结构域;(d)具有选自seqidno:12,28,44,60,76,92,108,116,132,164,180,196,212,228,244,260,284,300,316,332和348的氨基酸序列的lcdr1结构域;(e)具有选自seqidno:14,30,46,62,78,94,110,118,134,166,182,198,214,230,246,262,286,302,318,334和350的氨基酸序列的lcdr2结构域;和(f)具有选自seqidno:16,32,48,64,80,96,112,120,136,168,184,200,216,232,248,264,288,304,320,336和352的氨基酸序列的lcdr3结构域。在实施方案13中,本发明包括实施方案1至12任一个的分离抗体或其抗原结合片段,包括具有选自表1中所列的hcvr序列的氨基酸序列的hcvr。在实施方案14中,本发明包括实施方案13的分离抗体或其抗原结合片段,包括具有选自表1中所列的lcvr序列的氨基酸序列的lcvr。在实施方案15中,本发明包括实施方案11至14任一个的分离的抗体或抗原结合片段,包括选自seqidno:2/10,18/26,34/42,50/58,66/74,82/90,98/106,98/114,122/106,98/130,138/106,146/106,122/130,146/114,146/130,138/130,154/162,170/178,186/194,202/210,218/226,234/242,250/258,266/258,274/282,290/298,306/314,322/330和338/346的hcvr//lcvr氨基酸序列对。在实施方案16中,本发明包括实施方案11至15任一个的分离抗体或其抗原结合片段,包括选自seqidno:50、98、138和202的hcvr内所含的三个cdr;和seqidno:58、106和210的lcvr内所含的三个cdr。在实施方案17中,本发明包括实施方案16的分离抗体或其抗原结合片段,包括选自:(a)seqidno:52、54、56、60、62和64;(b)seqidno:100、102、104、108、110和112;(c)seqidno:140、142、144、108、110和112;和(d)seqidno:204、206、208、212、214和216的cdr。在实施方案18中,本发明包括实施方案17的分离抗体或其抗原结合片段,包括选自seqidno:50/58、98/106、138/106和202/210的hcvr/lcvr氨基酸序列对。在实施方案19中,本发明包括与实施方案17的抗体或其抗原结合片段竞争结合c5的抗体或其抗原结合片段。在实施方案20中,本发明包括与实施方案17的抗体或其抗原结合片段结合相同表位的抗体或其抗原结合片段。在实施方案21中,本发明包括实施方案9或10的抗体或其抗原结合片段,包括重链可变区,其包括具有不超过5个氨基酸置换的表1中所列的氨基酸序列。在实施方案22中,本发明包括实施方案21的抗体或其抗原结合片段,包括轻链可变区,其包括具有不超过5个氨基酸置换的表1中所列的氨基酸序列。在实施方案23中,本发明包括实施方案9或10的抗体或其抗原结合片段,包括与seqidno:98具有至少90%序列同一性的重链可变区。在实施方案24中,本发明包括实施方案23的抗体或其抗原结合片段,包括与seqidno:106具有至少90%序列同一性的轻链可变区。在实施方案25中,本发明包括分离的阻断c5裂解成c5a和c5b的单克隆抗体或其抗原结合片段,包括hcvr的三个cdr,其中hcvr具有选自seqidno:2,18,34,50,66,82,98,122,138,146,154,170,186,202,218,234,250,266,274,290,306,322和338的氨基酸序列;和lcvr的三个cdr,其中lcvr具有选自seqidno:10,26,42,58,74,90,106,114,130,162,178,194,210,226,242,258,282,298,314,330和346的氨基酸序列。在实施方案26中,本发明包括药物组合物,其包括根据实施方案1至25任一个的分离的结合c5的抗体或其抗原结合片段和可药用的载体或稀释剂。在实施方案27中,本发明包括分离的多核苷酸分子,其包括编码实施方案1至25任一个中所列抗体的hcvr的多核苷酸序列。在实施方案28中,本发明包括分离的多核苷酸分子,其包括编码实施方案1至25任一个中所列抗体的lcvr的多核苷酸序列。在实施方案29中,本发明包括载体,其包括实施方案27或28的多肽序列。在实施方案30中,本发明包括表达实施方案29的载体的细胞。在实施方案31中,本发明包括预防、治疗或改善c5相关疾病或病症的至少一个症状或指征的方法,所述方法包括将实施方案1至25任一个的抗体或其抗原结合片段给药于需要的受试者。在实施方案32中,本发明包括实施方案31的方法,其中所述疾病或病症选自非典型溶血性尿毒症综合征(ahus)、阵发性夜间血红蛋白尿(pnh)、老年性黄斑变性、地图样萎缩、葡萄膜炎、视神经脊髓炎、多发性硬化、中风、guillainbarre综合征、外伤性脑损伤、帕金森病、不当或不合需要的补体激活的失调、血液透析并发症、超急性同种异体移植排斥、异种移植排斥、il-2治疗期间白细胞间介素-2诱导的毒性、炎性失调、自身免疫疾病的炎症、局限性回肠炎、成人型呼吸窘迫综合征、包括烧伤或冻伤的热伤、缺血后再灌注病况、心肌梗死、毛细血管渗漏综合征、肥胖、糖尿病、阿尔茨海默氏病、精神分裂症、中风、癫痫、动脉粥样硬化、脉管炎、大疱性类天疱疮、c3肾小球病、膜增生性血管球性肾炎、糖尿病性肾病、alport’s综合征、进行性肾衰竭、蛋白尿性肾病、肾缺血-再灌注损伤、狼疮性肾炎、气囊血管成形术、心肺转流或肾转流中的泵后综合征、血液透析、肾缺血、主动脉重建后肠系膜动脉再灌注、传染病或脓毒症、免疫复合性疾病和自身免疫疾病、肾病、类风湿性关节炎、系统性红斑狼疮(sle)、sle肾炎、增生性肾炎、溶血性贫血、哮喘、慢性梗阻性肺病(copd)、肺气肿、肺栓塞和梗死、肺炎和重症肌无力。在实施方案33中,本发明包括实施方案31的方法,其中所述疾病或病症是ahus。在实施方案34中,本发明包括实施方案31的方法,其中所述疾病或病症是pnh。在实施方案35中,本发明包括实施方案31-34任一个的方法,其中将药物组合物预防性地或治疗性地给药于需要的受试者。在实施方案36中,本发明包括实施方案31至35任一个的方法,其中将药物组合物联合第二种治疗剂给药。在实施方案37中,本发明包括实施方案36的方法,其中所述第二种治疗剂选自抗凝剂、抗炎药、抗高血压药、免疫抑制剂、降脂剂、抗cd20剂(如利妥昔单抗)、抗tnf剂(如英夫利昔单抗)、抗癫痫剂、c3抑制剂、第二种抗c5抗体和抗血栓形成剂。在实施方案38中,本发明包括实施方案31至37任一个的方法,其中将药物组合物皮下、静脉内、皮内、腹膜内、口服、肌内或颅内给药。实施例提出以下实施例,以给本领域普通技术人员提供怎样制备和使用本发明的方法和组合物的完整公开和描述,并且不是打算限制发明人认为其发明的范围。努力确保关于所用数字(例如,含量、温度等)的准确性,但应当考虑一些实验误差和偏差。除非另外指出,份数是重量份,分子量是平均分子量,温度是℃,室温为约25℃,并且压力为或接近大气压。实施例1:补体因子5(c5)蛋白的人抗体的产生在包括编码人免疫球蛋白重链和κ轻链可变区的小鼠中产生了c5蛋白的人抗体。用血清纯化的人c5蛋白(calbiochem目录#20-4888)免疫小鼠。通过c5特异性免疫分析监测抗体免疫应答。获得所需免疫应答时,收集脾细胞并与小鼠骨髓瘤细胞融合,以保存其生活力并形成杂交瘤细胞系。筛选并选择杂交瘤细胞系,以鉴定产生c5特异性抗体的细胞系。将细胞系用于获得几个抗c5嵌合抗体(即,具有人可变结构域和小鼠恒定结构域的抗体);将这种方式产生的示例性抗体称为h2m11683n和h2m11686n。还从抗原阳性小鼠b细胞直接分离了抗c5抗体,没有与骨髓瘤细胞融合,如美国专利7582298中所述的,特意将其全部按引用并入本文中。使用这种方法,获得了几个完全人抗c5抗体(即,具有人可变结构域和人恒定结构域的抗体);将这种方式产生的示例性抗体称为h4h12159p,h4h12161p,h4h12163p,h4h12164p,h4h12166p,h4h12167p,h4h12168p,h4h12169p,h4h12170p,h4h12171p,h4h12175p,h4h12176p2,h4h12177p2和h4h12183p2。根据这个实施例的方法产生的示例性抗体的生物性质详细描述于以下列出的实施例中。实施例2:重链和轻链可变区氨基酸和核苷酸序列表1列出了选定的本发明的抗c5抗体的重链和轻链可变区和cdr的氨基酸序列识别号、表1:氨基酸序列识别号相应的核酸序列识别号列于表2中。表2:核酸序列识别号通常根据以下命名法提及本文中的抗体:fc前缀(例如,“h4h”、“h2m”等),接着数字识别号(例如,“11686”、“12166”、“12183”等,如表2中所示的),接着“p”、“p2”或“n”后缀。因此,根据这种命名法,在本文中抗体可以称为,例如,“h2m11686n”、“h4h12183p2”、“h4h12168p”等。本文中所用的抗体名称上的h4h和h2m前缀表示抗体特定的fc区同种型。例如,“h4h”抗体具有在铰链区包括丝氨酸到脯氨酸突变(s108p)的人igg4fc,以促进二聚体稳定,而“h2m”抗体具有小鼠igg2fc(a或b同种型)(全部可变区是完全人的,如通过抗体名称中的第一个“h”表示的)。如本领域普通技术人员将认识的,具有特定fc同种型的抗体可以转变成具有不同fc同种型的抗体(例如,具有小鼠igg1fc的抗体可以转变成具有人igg4的抗体等),但在任何情况中,可变结构域(包括cdr)-其通过表2中显示的数字识别号来表示-将保持相同,并且预期对抗原的结合特性是相同或基本上相似的,与fc结构域的性质无关。在某些实施方案中,选定的具有小鼠igg1fc的抗体转变成具有人igg4fc的抗体。在一个实施方案中,igg4fc结构域包括2个或更多个氨基酸改变,如us20100331527中公开的。为了产生突变的抗体,将h4h12166p的互补决定区(cdr)中的不同残基突变成组氨酸,以产生9个突变的抗体,鉴定为h4h12166p2至h4h12166p10。cdr中的组氨酸突变已经显示出给予ph依赖性的靶抗原结合,导致提高的药物动力学(igawa等,2010,nat.biotechnol.28:1203-1207)。以下实施例中使用的对照构建体将以下对照构建体(抗c5抗体)包括在本文公开的实验中,用于比较目的:“comparator1”,根据美国专利no.6,355,245的具有抗体“h5g1.1”的vh/vl序列的抗人c5的单克隆抗体(alexionpharmaceuticals,inc.);和“comparator2”,根据美国专利申请公开no.2013/0022615的具有抗体“8109”的vh/vl序列的抗人c5的单克隆抗体(novaritis)。实施例3:通过表面等离子体共振测定的抗体与c5的结合使用biacoret200仪器上的实时表面等离子体共振生物传感器分析测定了c5与纯化的抗c5抗体结合的平衡解离常数(kd值)。通过胺偶联衍生化biacore传感器表面,使用单克隆小鼠抗人fc抗体(gehealthcare,#br-1008-39)来捕获与人fc恒定区一起表达的抗c5抗体。在hbst运行缓冲液(0.01mhepesph7.4,0.15mnacl,3mmedta,0.05%v/v表面活性剂p20)中进行了biacore结合研究。人c5获自商业来源(emd)。其他c5试剂与c-末端myc-myc-六组氨酸标签一起表达(随后称为c5-mmh)。还表达了在精氨酸885含有组氨酸和半胱氨酸点突变的人c5-mmh试剂(随后分别称为c5r885h-mmh和c5r885c-mmh)。将在hsbt运行缓冲液中制备的不同浓度的人c5、人c5r885h-mmh(seqidno:356)、人c5r885c-mmh(seqidno:357)和猴c5-mmh(seqidno:358)(范围从100nm至1.23nm,3倍稀释)以30μl/min的流速注射在抗c5抗体捕获的表面上。监测所有c5试剂对每个捕获的单克隆抗体的结合3分钟并且监测其在hbst运行缓冲液中的解离8分钟。所有结合动力学实验在25℃或37℃下进行。使用scrubber2.0c曲线拟合软件,通过将实时传感图拟合到1:1结合模型,来测定动力学结合(ka)和解离(kd)速率常数。按照kd(m)=kd/ka和t1/2(min)=ln2/(60xkd),从动力速率常数计算结合解离平衡常数(kd)和解离半衰期(t1/2)。25℃和37℃下的针对人c5结合抗c5抗体的结合动力学参数显示于表3和4中。表3:25℃下抗c5单克隆抗体结合人c5的结合动力学参数表4:37℃下抗c5单克隆抗体结合人c5的结合动力学参数25℃和37℃下猴c5-mmh与抗c5抗体的结合显示于表5和6中。表5:25℃下抗c5单克隆抗体结合猴c5-mmh的结合动力学参数n/a=不可获得的;*ss=稳态分析表6:37℃下抗c5单克隆抗体结合猴c5-mmh的结合动力学参数25℃下人c5r885h-mmh和人c5r885c-mmh结合抗c5抗体分别显示于表7和8中。表7:25℃下抗c5单克隆抗体结合人c5r885h-mmh的结合动力学参数表8:25℃下抗c5单克隆抗体结合人c5r885c-mmh的结合动力学参数37℃下人c5r885h-mmh和人c5r885c-mmh结合抗c5抗体分别显示于表9和10中。表9:37℃下抗c5单克隆抗体结合人c5r885h-mmh的结合动力学参数表10:37℃下抗c5单克隆抗体结合人c5r885c-mmh的结合动力学参数在25℃下,本发明的全部25个抗c5抗体以73pm至8.4nm范围的kd值结合人c5,如表3中所示。在37℃下,本发明的抗c5抗体以103pm至18.5nm范围的kd值结合人c5,如表4中所示。在25℃下,测试的25个本发明的抗c5抗体中的25个以133pm至64nm范围的kd值结合猴c5-mmh,如表5中所示。在37℃下,测试的25个本发明的抗c5抗体中的25个以133pm至118nm范围的kd值结合猴c5-mmh,如表6中所示。在25℃下,测试的16个本发明的抗c5抗体中的16个以147pm至10.9nm范围的kd值结合人c5r885h-mmh,如表7中所示。在25℃下,测试的16个本发明的抗c5抗体中的16个以251pm至190nm范围的kd值结合人c5r885c-mmh,如表8中所示。在37℃下,测试的16个本发明的抗c5抗体中的16个以1.49nm至69.4nm范围的kd值结合人c5r885h-mmh,如表9中所示。在25℃下,测试的16个本发明的抗c5抗体中的16个以1.74nm至159nm范围的kd值结合人c5r885c-mmh,如表10中所示。实施例4:不同ph下抗体与c5的结合使用biacoret200仪器,使用实时表面等离子体共振,测定了ph对结合纯化的抗c5单克隆抗体的重组人c5的解离速率的影响。首先通过胺偶联衍生化biacore传感器表面,使用单克隆小鼠抗人fc抗体(gehealthcare,#br-1008-39)来捕获与人igg4fc恒定区一起表达的抗c5单克隆抗体。使用两种运行缓冲液pbs-t,ph7.4(0.01mna2hpo4/nah2po4,0.15mnacl,0.05%v/vtween-20,调节至ph7.4)和pbs-t,ph6.0((0.01mna2hpo4/nah2po4,0.15mnacl,0.05%v/vtween-20,调节至ph6.0)进行了所有biacore结合研究。将不同浓度的人c5(emd,目录#204888)或猴c5mmh(在pbs-t,ph7.4运行缓冲液中制备)(范围从100nm至11.11nm,3倍稀释)以50μl/分钟流速在捕获了抗c5单克隆抗体的表面上注射3分钟并且监测它们在两种运行缓冲液pbs-t,ph7.4和pbs-t,ph6.0中的解离6分钟。所有结合动力学实验在25℃和37℃下进行。使用scrubber2.0c曲线拟合软件,通过将实时传感图拟合到1:1结合模型,测定了动力学解离常数(kd)。按照:从kd计算结合解离半衰期(t1/2)。在两种运行缓冲液pbs-t,ph7.4和pbs-t,ph6.0中在25℃和37℃下人c5结合不同的抗c5单克隆抗体的半衰期比例显示于表11和12中。表11:25℃下选定的抗c5抗体对人c5的半衰期比例ic=不确定的表12:37℃下选定的抗c5抗体对人c5的半衰期比例ic=不确定的在两种运行缓冲液pbs-t,ph7.4和pbs-t,ph6.0中在25℃和37℃下猴c5结合不同的抗c5单克隆抗体的半衰期比例显示于表13和14中。表13:25℃下选定的抗c5抗体对猴c5的半衰期比例ic=不确定的表14:37℃下选定的抗c5抗体对猴c5的半衰期比例ic=不确定的如表11-14中所示,选定的抗c5抗体显示出ph依赖性结合,如通过t1/2比例所看到的。实施例5:抗c5抗体之间的octet交叉竞争在octetred384生物传感器(pallfortebiocorp.)上,使用实时、无标记的生物层干涉测量分析,测定了抗c5单克隆抗体(mab)之间的结合竞争。整个实验在0.01mhepesph7.4,0.15mnacl,0.05%v/v表面活性剂tween-20,0.1mg/mlbsa(octethbs-p缓冲液)中在25℃下进行,使用1000rpm速度的平板振荡。为了评价2个抗体是否能够彼此竞争与人c5(从血浆纯化的hc5,emd)上的各自表位的结合,首先通过将尖端浸没在含有50μg/ml抗人c5mab(随后称为mab1)溶液的孔中3分钟,将约1.5nm抗人c5mab捕获在抗hfc抗体包被的octet生物传感器尖端上(pallfortebiocorp.,#18-5060)。随后通过浸入含有200μg/ml阻断mab溶液的孔中4分钟,用阻断h4h同种型对照mab(随后称为阻断mab)将捕获抗体的生物传感器尖端饱和。随后将生物传感器尖端浸入这样的孔中4分钟,所述孔含有已经预先孵育2小时的含有50nmhc5和1μm第二抗人c5mab(随后称为mab2)的共复合溶液。在实验的每个步骤之间,将生物传感器芯片在octethbs-p缓冲液中洗涤。在实验过程中监测实时结合应答并记录每个步骤结束时的结合应答。针对背景结合,校正人c5预先复合的mab2结合mab1的应答,进行比较并确定不同的抗c5单克隆抗体的竞争/非竞争行为。表15明确地限定了两个方向的抗体竞争的关联,与结合的顺序无关。表15:选定的抗c5抗体对之间的交叉竞争实施例6:b细胞生物分析中c5介导的补体依赖性细胞毒性的抑制这个实施例描述了在经典补体途径中使用抗cd20抗体测试c5作用的生物分析。抗b细胞特异性细胞表面抗原cd20的治疗性抗cd20抗体已经显示出导致b细胞的cdc(glennie等,2007,mol.immunol.44:3823-3837),并且使用表达cd20的细胞系的cdc分析之前已经有描述(flieger等,2000,cell.immunol.204:55-63)。使用daudi细胞(表达cd20的人b细胞系)、保存补体的血清或耗尽c5具有外源性c5变体的血清,和抗cd20抗体(来自美国专利8,529,902的包括“2f2”的vh/vl的抗体)来评价cdc中的c5活性的作用。对于c5cdc生物分析,将daudi细胞以10,000细胞/孔接种于96孔分析平板中的含有10%fbs、青霉素/链霉素、l-谷氨酰胺、丙酮酸钠和非必需氨基酸的rpmi(rpmi完全培养基)或含有1%bsa、青霉素/链霉素和l-谷氨酰胺的rpmi(rpmi/bsa)中。在rpmi完全培养基中测试了所有分析,其检测突变的抗hc5抗体,连同检测用含有c5的人血清的未突变的抗体,而在rpmi/bsa培养基中测试了使用非洲绿猴血清和人c5变体的测试未突变抗体的分析。为了使用人或猴血清测量cdc,将抗cd20抗体1:3稀释,从100nm稀释至2pm(包括不含抗体的对照样品)并且与细胞在25℃下孵育10分钟,接着添加1.66%血清或1.66%c5耗尽的血清和6.6nmc5变体蛋白。待添加至c5耗尽的血清的c5蛋白的含量基于所报道的0.37um人血清中的c5浓度值(rawal等2008,j.biol.chem.283:7853-7863)。为了测试cdc的c5抗体抑制,将c5抗体1:3稀释,从100nm稀释至2pm(包括不含抗体的对照样品),并且用1.66%血清或1.66%c5耗尽的血清和6.6nmc5变体蛋白孵育30分钟。在用血清添加抗体至细胞前十分钟,将抗cd20抗体以1nm、2nm、3nm、3.5nm、7nm、10nm或30nm加入细胞中。抗cd20抗体孵育结束时,将抗体/血清混合物加入细胞中。在37℃和5%co2下孵育3.5小时,接着在25℃下孵育15分钟并添加cytotox-glotm试剂(promega,#g9292)后,测量细胞毒性。cytotox-glotm是基于发光的试剂,其测量细胞杀灭,使得随着提高的细胞毒性观察到提高的发光(以相对光单位测量,rlu)。通过添加cytotox-glotm试剂后立即用毛地黄皂苷处理来裂解对照孔中的未处理细胞,以测定最大的细胞杀灭。添加cytotox-glotm后15分钟,通过victorx仪器(perlinelmer)阅读平板的发光。计算时,通过使用以下等式,用rlu值计算细胞毒性的百分比:在这个等式中,“背景细胞裂解”是来自用不含任何抗cd20抗体的单独的培养基和血清处理的细胞的发光,而“最大细胞裂解”是来自用毛地黄皂苷处理的细胞的发光。使用prism5软件(graphpad),使用非线性回归(4-参数逻辑),分析了表示为%细胞毒性或rlu的结果,以获得ec50和ic50值。计算抗体的抑制,使得0-100%抑制是没有抑制剂至0nm抗cd20抗体的分析中所用的抗cd20抗体浓度的抑制范围。结果针对抑制c5的能力,使用抗cd20抗体和人血清(使用正常的hc5或c5变体)或非洲绿猴血清,使用daudi细胞,在cdc分析中总共测试了25个抗人c5抗体,16个未突变的和9个突变的。将h4h12166p的互补决定区(cdr)中的不同残基突变成组氨酸,产生了9个突变的抗体,h4h12166p2-h4h12166p10。cdr中的组氨酸突变已经显示出给予ph依赖性的靶抗原结合,导致提高的药物动力学(igawa等,2010,nat.biotechnol28:1203-1207)。表16:在daudi细胞中使用1.66%血清和抗cd20抗体的cdc的未突变抗hc5抗体抑制*除非另外指出,否则所有抑制是~100%。如表16和17中所示,所有25个抗hc5抗体显示出对1.66%人血清中存在的c5介导的cdc的完全抑制。未突变抗体的ic50范围为1.2至3.4nm。突变抗体的ic50范围为3.0nm至12nm。亲本未突变抗体h4h12166p给出了完全抑制,具有2.6nm和2.9nm的ic50。表17:在daudi细胞中使用1.66%血清和抗cd20抗体的cdc的突变抗hc5抗体抑制*除非另外指出,否则所有抑制是~100%。十六个未突变抗hc5抗体显示出非洲绿猴c5介导的cdc的完全抑制,具有范围从2.0nm至14nm的ic50。9个突变抗体中的四个显示出非洲绿猴c5介导的cdc的完全抑制,具有范围从7.1nm至9.9nm的ic50。剩余六个突变的抗体是阻断剂,具有高于10nm的ic50,以及范围从34%至85%的最大抑制(在100nm抗体下)。亲本未突变抗体h4h12166p给出了完全抑制,具有4.5nm和5.6nm的ic50。为了测试抗hc5抗体是否抑制人c5变体r885h和r885c,用6.6nm的每种c5变体测试了耗尽c5的人血清。所有25个抗hc5抗体显示出c5变体r885h介导的cdc的完全抑制,未突变抗体的ic50范围为0.48nm至4.2nm,而突变抗体的ic50范围从1.3nm至7.0nm。亲本未突变抗体h4h12166p给出了完全抑制,具有1.3nm和1.3nm的ic50。16个未突变抗hc5抗体中的十五个显示出c5变体r885c介导的cdc的完全抑制,ic50范围为0.43nm至1.6nm。一个未突变抗体显示出弱的cdc抑制,最大抑制为67%(在100nm抗体下)和ic50>20nm。所有九个突变的抗体显示出c5变体r885c介导的cdc的完全抑制,ic50范围从0.77nm至3.5nm。亲本未突变抗体h4h12166p给出了完全抑制,具有0.46nm和0.76nm的ic50。抗cd20抗体显示出使用1.66%血清的daudi细胞的cdc,对于人血清具有1.0nm、1.4nm和1.9nm的ec50,对于非洲绿猴血清,2.4nm和2.6nm,对于使用hc5变体r885h的耗尽hc5的血清,1.9nm和6.3nm,以及对于使用hc5变体r885c的耗尽hc5的血清,2.7nm和9.5nm。无关igg对照抗体、对照mab1和对照mab2没有一个显示了任何cdc抑制。实施例7:通过荧光素酶分析测定的c5a活性的抑制这个实施例描述了测试通过其受体之一c5ar1的c5a激活的分析。c5ar1是偶合g-蛋白的受体(gpcr)并且可以启动多种gpcr偶合的信号途径(monk等,2007,br.j.pharmacol.152:429-448)。使用用人c5ar1(登录号no.np_001727.1)和人gα16(登录号no.np_002059.3)连同荧光素酶报告子[nfat应答元件(4x)-荧光素酶]稳定转染的hek293细胞建立了生物分析。gα16是相对混杂的g蛋白,其可以偶合不同类型的gpcr导致plc-β激活和随后的ca++升高,这随后激活nfat易位和报告基因转录(kostenis等,2005,trendspharmacol.sci.26:595-602)。分离所得到的细胞系,hek293/hgα16/hc5ar1/nfat-luc,维持在含有10%fbs、neaa、青霉素/链霉素、500μg/mlg418、100μg/ml潮霉素b和7μg/ml杀稻瘟菌素的10%dmem中。对于c5a荧光素酶生物分析,将hek293/hgα16/hc5ar1/nfat-luc细胞以20,000细胞/孔接种于96-孔分析平板中补充了0.5%bsa、青霉素/链霉素和l-谷氨酰胺的optimem(invitrogen,#31985-070)中,并且随后在37℃和5%co2孵育过夜。用bsa替代fbs,因为血清已经显示出裂解并灭活hc5a(klos等,2013,pharmacol.rev.65:500-543)。第二天早晨,将hc5a从100nm滴定至2pm(包括不含hc5a的对照样品),并加入细胞中,以确定针对该细胞系的剂量应答滴定曲线。为了测试hc5a的hc5a抗体抑制,将500pmhc5a加入细胞中。此后立即,将从100nm1:3稀释至2pm的抗体(包括不含抗体的对照样品)加入细胞中。将细胞在5%co2存在下在37℃下孵育5.5小时。用oneglotm试剂(promega,#e6051)孵育后,检测了荧光素酶活性。oneglotm是测量细胞中存在的荧光素酶含量的基于发光的试剂。在这个分析中,提高的hc5a激活导致提高的荧光素酶产生和发光(以相对光单位测量的,rlu)。使用victorx仪器(perkinelmer)进行了发光测量。使用prism5软件(graphpad),使用非线性回归(4-参数逻辑),分析了结果,以获得ec50和ic50值。计算抗体的抑制,使得0-100%抑制是从不含抑制剂的500pmhc5a至0nmhc5a的抑制范围。通过测量hek293/hgα16/hc5ar1/nfat-luc细胞的500pmhc5a激活的抑制程度,测试了四个抗hc5抗体抑制其受体hc5ar1的hc5a激活的能力。表18:hek293/gα16/hc5ar1/nfat-luc细胞中500pmhc5a的抗hc5抗体抑制如表18中所示,本发明的全部四个抗体,显示出500pmhc5a的完全抑制,ic50范围为0.035nm至0.46nm。无关igg对照抗体、对照mab3,没有证明任何hc5a的抑制。hc5a以0.39nm的ec50激活了hek293/gα16/hc5ar1/nfat-luc细胞。实施例8:溶血生物分析研发了经典途径溶血分析(ch)和旁路途径溶血分析(ah),来测试抗体活性。ch是用于经典补体途径激活的筛选分析,其对所述途径的任何组分的降低、缺失和/或无活性敏感。ch测试经典途径的血清补体组分裂解预先包被兔抗绵羊红细胞抗体(溶血素)的绵羊红细胞(srbc)的功能性能力。用测试血清孵育抗体包被的srbc时,补体的经典途径被激活并导致溶血。如果补体组分不存在,ch水平将是零;如果经典途径的一个或多个组分降低,ch将降低。(nilsson等,1984,j.immunol.meth.72:49-59)。这个分析用于高亲和性抗人c5抗体的表征和筛选。方法(a)经典途径补体溶血分析在gvb++缓冲液中洗涤所需数量的绵羊红细胞(srbc)并且以1×109细胞/ml重悬浮。为了敏化,将srbc与等体积的1:50稀释的兔抗绵羊溶血素(1.5mg/ml)在37℃下混合20分钟。在用于溶血分析之前,将敏化的srbc细胞在gvb++中稀释至2×108细胞/ml。将正常的人血清或食蟹猴血清在gvb++缓冲液中稀释至2%或10%。为了测试c5介导的溶血活性的抑制,在2%-10%正常人或10%食蟹猴血清或非洲绿猴血清中0.6nm至800nm的浓度范围下,将测试抗体在4℃下预先孵育20分钟。使用圆底96孔平板来测量溶血活性。将总共100ul敏化的绵羊rbc(2×108细胞/ml)涂布于96孔平板中,接着添加100ul用测试抗体预先孵育的各个血清样品。将细胞温和混合并在37℃下孵育60分钟。孵育时间后,通过在4℃在1250×g离心沉淀细胞。将总共100ul上清液转移至新鲜的96平底平板中并在spectramax微平板读数器上在412nm下读数。针对所述处理,在1-5%的最终血清浓度下计算溶血活性。如下计算了百分比溶血:在这个等式中,“背景细胞裂解”是来自在不含血清只在gvb++缓冲液中孵育的细胞在a412nm下的od。“最大细胞裂解”是来自用水处理的细胞的在a412nm下的od。使用prism5软件(graphpad),使用非线性回归(4-参数逻辑),分析了表示为%溶血的结果,以获得ic50值。数据表示为平均±平均的标准误差。(b)旁路途径补体溶血分析将所需数量的兔红细胞(rbrbc)在gvb-mg2+/egta缓冲液洗涤,并且以2×108细胞/ml重悬浮。将正常的人或食蟹猴血清在gvb-mg2+/egta缓冲液中稀释至10%。为了测试c5介导的溶血活性的抑制,将浓度范围为3nm至800nm的抗体在5-10%正常人血清或食蟹猴血清中在4℃下预先孵育20分钟。将圆底96孔平板用于测量溶血活性。将总的100ulrbrbc(2×108细胞/ml)涂布于96孔平板中,接着添加100ul预先用抗c5抗体孵育的10%正常人血清或食蟹猴血清或非洲绿猴血清。将细胞温和混合并在37℃下孵育60分钟。孵育时间后,通过在4℃下在1250×g下离心,将细胞沉淀。将总的100ul上清液转移至新鲜的96平底平板并且在spectramax微平板读数器上在412nm下读数。在5%血清的最终血清浓度下计算溶血活性。如下计算了百分比溶血:在这个等式中,“背景细胞裂解”是来自在不含血清或没有任何抗c5抗体的只在gvb-mg/egta缓冲液中孵育的细胞在a412nm下的od。“最大细胞裂解”是来自用水处理的细胞在a412nm下的od。使用prism6软件(graphpad),使用非线性回归(4-参数逻辑),计算了抗c5抗体的抑制,ic50值。结果(a)人c5溶血的抑制在使用敏化绵羊红细胞(srbc)的ch50分析和使用兔红细胞(rrbc)的ah50分析中,测试了总共25个抗人c5(hc5)抗体(16个未突变的和9个突变的)抑制来自正常人血清(nhs)的c5的能力。表19:在1%或5%正常人血清(nhs)中的cp和ap活性的抗hc5抗体抑制如表19中所示的,本发明的十六个抗hc5抗体在1%人血清中存在的c5介导的经典途径(cp)中显示出超过94%的溶血抑制。抗体的ic50范围从2.1至5.9nm并且抑制百分比范围为95%-99%。全部16个抗c5抗体在5%nhs中存在的c5介导的旁路途径(ap)溶血分析中显示出超过60%抑制(除了h4h12169p)。抗体的ic50范围从13至160nm并且百分比抑制活性范围从44%至81%。表20:5%正常人血清(nhs)中cp和ap活性的抗hc5抗体抑制如表20中所示,全部9个突变的抗hc5抗体显示出5%人血清中存在的c5介导的cp和ap溶血活性的抑制。在cp溶血分析中,亲本未突变的抗体h4h12166p显示出超过98%的抑制,具有10.9nm的ic50。八个突变的抗hc5抗体显示出超过90%的抑制,具有10.3nm至24.3nm的ic50范围。突变抗c5抗体12166p10显示出74%的部分抑制。在ap溶血分析中,亲本未突变的抗体h4h12166p显示出超过85%的抑制,具有20.9nm的ic50。突变的抗hc5抗体显示出72-83%的抑制范围并且ic50抗体范围为28nm至0.15μm。(b)猴c5溶血的抑制在使用敏化绵羊红细胞(srbc)的ch50分析和使用兔红细胞(rrbc)的ah50分析中,测试了总共25个抗人c5(hc5)抗体(16个未突变的和9个突变的)抑制来自食蟹猴和非洲绿猴的c5的能力。表21:5%正常非洲绿猴(agm)血清中cp和ap活性的抗hc5抗体抑制如表21中所示,抗hc5抗体显示出5%非洲绿猴血清中cp或ap溶血活性的不同水平的抑制。在cp分析中,16个抗hc5抗体中的两个显示出无溶血活性抑制。十四个抗体显示出抑制范围为43-94%,ic50范围为25nm至180nm。在ap溶血分析中,17个抗体中的十三个显示出17%-93%的抑制活性范围,具有22.5nm至233nm的ic50范围。表22:5%正常食蟹猴(cyno)血清中cp和ap活性的抗hc5抗体抑制食蟹猴血清cp食蟹猴血清cp食蟹猴cp食蟹猴apmabpidic50[m]ic50[m]%最大抑制%最大抑制h4h12183p21.42e-072.96e-0864.6%100.0%h4h12171p8.70e-097.20e-0992.9%98.8%h4h12170p8.20e-097.00e-0999.0%99.2%h4h12159p7.75e-097.05e-0999.3%99.6%h4h12168p1.03e-085.45e-0999.0%99.7%h4h11683n9.00e-097.15e-0998.8%98.9%h4h12176p21.47e-087.70e-0997.5%99.3%h4h12161p2.79e-087.80e-09100.0%98.4%h4h12169p1.99e-087.95e-0992.8%96.30%h4h11686n1.41e-089.00e-0994.5%98.7%h4h12163p1.65e-081.02e-0896.4%98.5%h4h12167p2.13e-087.60e-09100.0%98.30%h4h12175p1.09e-088.05e-0996.7%98.10%h4h12166p2.01e-088.85e-0994.2%98.60%h4h12177p21.71e-088.80e-0994.90%98.10%h4h12164p1.96e-089.10e-0994.7%98.70%同种型对照无活性无活性无活性无活性如表22中所示,抗hc5抗体(除了h4h12183p2,其显示出64%cp抑制)显示出5%食蟹猴血清中cp或ap溶血分析超过90%的抑制。在cp溶血分析中,抗体的ic50范围从7.15nm至142nm。在ap溶血分析中,抗体的ic50范围从5.4至29.6nm。(c)变体人c5溶血的抑制在ch50分析中测试了选定的抗c5抗体抑制来自耗尽c5的人血清的变体人c5的能力(参见本文的实施例3)。在补充了外源性c5变体r885h的耗尽c5的人血清中,h4h12166p和comparator2分别以6.0nm和4.4nm的ic50值以及分别以7.6nm和5.5nm的ic80值阻断了cp溶血。对于变体r885c,h4h12166p和comparator2分别以9.3nm和6.8nm的ic50以及分别以11nm和8.2nm的ic80值阻断了含有外源性c5变体的耗尽c5的人血清中的cp溶血。如预期的,comparator1没有阻断人c5变体的溶血活性。(d)人c5b-6复合物的抑制在ch50分析中测试了选定的抗c5抗体抑制来自耗尽c5的人血清的人c5b-6复合物的能力。h4h12166p有效地阻断了补充了外源性huc5b-6复合物的耗尽c5的人血清中的cp溶血,具有3.8nm的ic50和5.8nm的ic80值。相反,comparator1以较低的效力阻断了c5b-6复合物介导的溶血,分别具有5.0nm的ic50值和46nm的ic80值。comparator1在测试的最高浓度下只抑制了70%的总溶血。comparator2没有阻断人c5b-6复合物溶血活性。实施例9:抗c5抗体阻断cp溶血分析中的c5a的产生为了评价抗c5抗体是否抑制c5a的产生,通过elisa分析了来自用于经典途径(cp)溶血的分析的上清液的c5a水平。c5a,作为c5裂解的结果产生,是74个氨基酸的蛋白质片段。c5a通过血清羧肽酶,通过除去c-末端精氨酸,快速代谢成更稳定的、活性较低的73个氨基酸形式,c5ades-arg。因此,c5ades-arg的定量提供了用于体内和体外监测c5a产生的可靠测量。根据制造商提供的信息,本文使用的microvuec5aelisa试剂盒检测了c5ades-arg。初步实验(数据未显示)表明了还检测到c5a的主要的74个氨基酸形式。对于这个实施例的目的,将这两种形式总称为“c5a”。按照实施例8中所述的,使用预先用h4h12166p或同种型对照抗体孵育的保留补体的正常人血清(nhs),测定了来自cp溶血分析的上清液中的c5a蛋白水平。根据制造商的说明,使用microvuec5aelisa试剂盒,测量了c5a蛋白水平。简而言之,将样品稀释并在预先包被了捕获抗体(对人c5a上的neo表位特异性的小鼠抗c5a)的平板上孵育。将制造商提供的人c5a蛋白用作校准标品。通过缀合hrp的检测抗体(c5的c5a区域的鼠单克隆抗体)检测了上清液中的c5a。加入发色hrp-底物,3,3’,5,5’-四甲基联苯胺(tmb),以检测hrp活性。使用1n盐酸溶液来停止反应,并且在spectramax平板读数器上测量了450nm下的光密度(od450)。使用graphpadprism中的非线性回归(4-参数逻辑),分析了数据。将c5a浓度表示为ng/ml上清液。在使用5%nhs的分析中,h4h12166p以剂量依赖性方式有效地阻断了c5a蛋白水平的提高,具有8.5nm的ic50,而同种型对照抗体对c5a水平没有作用(图1)。与5%血清中最低测试的h4h12166p浓度(1nm)下观察到的34ng/ml(2.8nm)相比,最高测试的h4h12166p浓度(267nm)下的最大阻断导致c5a水平降低~10倍至3.8ng/ml(0.3nm)。针对最大阻断观察到的c5a浓度接近在未处理的5%nhs中的2.3ng/ml(0.2nm)基线c5a水平。实施例10:抗c5抗体在食蟹猴中的药物动力学和药效学的表征这个实施例描述了在雄性食蟹猴中进行的选定的抗c5抗体的药物动力学(pk)和药效学(pd)的表征。在抗c5抗体给药前测定了内源性c5水平并用于将动物剂量组分组。使用人补体c5elisa(abcam,目录#ab125963)测定了食蟹猴中的总循环c5水平,其根据制造商的推荐来进行。测定了猴中的c5蛋白的平均浓度为90.85μg/ml±19.17μg/ml。对于每个抗c5抗体,给4只食蟹猴各自给药了15mg/kg剂量的单次静脉内(iv)注射。从给药前到1680小时(70天),从每只动物收集血样,处理成血清,并在-80℃冷冻,直至分析pk和pd。通过elisa免疫分析的总igg抗体水平分析使用未经确认的直接elisa测量了猴血清样品中的总抗体浓度。elisa方法使用了包被了小鼠抗人igg1/igg4fc单克隆抗体的微滴定平板。将不同的抗c5抗体加入平板中并且使用生物素化的小鼠抗人igg4fc单克隆抗体,接着用缀合辣根过氧化物酶的neutravidin(neutravidinhrp),检测了平板上捕获的抗c5抗体。随后加入过氧化物酶特异性的基于鲁米诺的底物,以获得与总捕获的抗c5抗体浓度成比例的信号强度。使用加权的4参数逻辑等式,来拟合校准标品的相对光单位(rlu)测量及其各自名义上的浓度,以产生描述抗c5抗体浓度和分析的应答关联的校准等式。定量的下限(lloq)在分析中是1.56ng/ml(2%猴血清),并且在纯的猴血清中为78ng/ml。pk参数的测定使用软件(版本6.4,certara,l.p.)和iv快速浓注给药模型,通过无区隔分析(non-compartmentalanalysis,nca)测定了pk参数。所有pk参数源自各自的平均浓度值,包括观察到的血清中的最大浓度(cmax),观察到的峰浓度的时间,tmax,以及估算的观察到的半衰期(t1/2)。对于每个抗体,使用线性插值和统一权重,使用线性梯形法则,测定了直至最后一个可测量浓度的浓度vs.时间曲线下面积(auclast)并从时间零外推至无限(aucinf)。通过离体溶血分析的pd分析使用离体经典途径和旁路途径溶血分析分析了选定的抗c5抗体的药效学。经典途径溶血分析:将绵羊红细胞(srbc)在gvb++缓冲液(含有cacl2和mgcl2的gelatinveronal缓冲液)(bostonbioproducts)中洗涤并以1×109细胞/ml重悬浮。为了敏化srbc,将总的1×109细胞/mlsrbc与等体积的1:50稀释的兔抗绵羊溶血素(1.5mg/ml)在37℃下孵育20分钟。在用于溶血分析前,将敏化的srbc在gvb++缓冲液中稀释至2×108细胞/ml。在给药前和给药后5分钟,4和8小时,以及1、2、3、5、7、10、14、18、21、28、35、42、49、56、63和70天收集食蟹猴血液,用于pd分析。制备血清并冷冻,直至进一步使用。在分析那天,将来自各个时间点的食蟹猴血清在gvb++缓冲液中稀释至10%。使用圆底96孔平板来测量溶血活性。将总的100μl敏化的srbc(2×108细胞/ml)在37℃下涂布于96孔平板中,接着添加100ul来自各个时间点的10%食蟹猴血清。将srbc温和混合并在37℃下孵育10分钟。孵育时间后,将细胞在4℃下在1250×g下离心。将总的100μl上清液转移至新鲜的96孔平底平板中并且在spectramax微平板读数器上在412nm下读数。在5%的最终血清浓度下计算了溶血活性。通过使用以下等式,用吸收值,计算了百分比溶血:在这个等式中,“背景细胞裂解”是来自在不含血清的只在gvb++缓冲液中孵育的srbc的在a412nm下的od。“最大细胞裂解”是来自用水处理的srbc的在a412nm下的od。使用prism5软件(graphpad),使用非线性回归(4-参数逻辑),分析了表示为%溶血的结果,以获得ic50值。将数据表示为平均±平均的标准误差。旁路途径溶血分析:将所需数量的兔红细胞(rbrbc)在gvb-mg2+/egta缓冲液中洗涤并以2×108细胞/ml重悬浮。在给药前,和给药后5分钟,4和8小时,以及1、2、3、5、7、10、14、18、21、28、35、42和49天,收集了食蟹猴血液,用于pd分析。制备血清并冷冻,直至进一步使用。使用圆底96孔平板来测量溶血活性。将总的100μlrbrbc(2×108细胞/ml)在37℃下涂布于96孔平板中,接着添加100ul来自以上所列的各个时间点的10%食蟹猴血清。将rbrbc温和混合并在37℃下孵育60分钟。孵育时间后,将细胞在4℃下在1250×g下离心。将总的100μl上清液转移至新鲜的96孔平底平板中并且在spectramax微平板读数器上在412nm下读数。针对5%的最终血清浓度计算了溶血活性并且表示为通过水的rbc的总溶血的百分比。如上所述计算了溶血百分比。结果在食蟹猴和c5人源化小鼠(描述于实施例10中)中在针对延长的药物动力学谱的初始实验中测试了选定的抗c5抗体(表1中所列的)。选择h4h12166p和h4h12161p因为具有高亲和性和延长的pk并与comparator1和comparator2一起用于本文随后的实验中。给食蟹猴给药单次15mg/kgiv快速浓注剂量的h4h12166p、h4h12161p或comparator2。在70天生命期间的19个时间点测定了总抗体的血清浓度和经典途径(cp)溶血百分比。在50天生命期间的17个时间点测定了旁路途径(ap)溶血。表23概括了针对全部3个抗体的平均抗体浓度。平均总抗体浓度vs.时间图谱显示于图2中。平均pk参数描述于表24中。表23:给雄性食蟹猴单次静脉内注射15mg/kg选定的抗c5抗体后血清中的总igg的平均浓度时间=单剂量注射后以小时计的时间sd=标准偏差;blq=低于定量极限iv快速浓注给药后,通过整个生命期间初始的简短分配阶段,接着单个消除阶段,来表征h4h12166p、h4h12161p和comparator2的总igg浓度-时间谱。峰h4h12166p、h4h12161p和comparator2浓度非常相当,因为所有抗体之间相应的cmax/剂量值在1.1倍内(分别为29.7、30.4和30.6[(ug/ml)/(mg/kg)])(表24)。表24:给雄性食蟹猴单次静脉内注射15mg/kg选定的抗c5抗体后血清中的总igg浓度的平均药物动力学参数iv=静脉内;n=动物数量;cmax=峰浓度;c0=通过外推测定的初始浓度;tmax=至cmax的时间;auc=浓度-时间曲线下的面积;auclast=从时间零至最后的正浓度的时间计算的auc;aucinf=从时间零外推至无限的auc;cl=总的身体清除;vss=稳态下的分布体积;t1/2=半衰期;sd=标准偏差。注意:tmax以名义上的小时数表示。浓度-时间谱的评价揭示了h4h12166p证明了最慢的消除,末端抗体浓度≥10μg/ml直至研究第71天。h4h12166p和comparator2的动力学相似;都证明了比h4h12166p更快的消除,mab浓度≥10μg/ml分别直至第22天和第29天。因此,剂量标准化的暴露(auclast/剂量)表明了h4h12166p在第339天具有最高暴露*(μg/ml)/(mg/kg),而h4h12161p和comparator2具有比h4h12166p低大约2倍的暴露,分别为157和187天*(μg/ml)/(mg/kg)。消除阶段计算的抗体半衰期(t1/2)在给药组的范围为5.5至15.6天并且与暴露关联,因为h4h12166p具有相应最高的15.6天的t1/2,而h4h12161p和comparator2分别具有5.5和5.9天的t1/2值。通过敏化的绵羊红细胞(srbc)的补体经典途径(cp)溶血和兔红细胞(rbrbc)的旁路途径(ap)溶血离体测定了来自食蟹猴血清样品的抗c5抗体的药理作用。针对5%的最终血清浓度计算了溶血活性的抑制并且表示为通过水的rbc的总溶血的百分比。表25概括了3个抗体的离体活性,如通过平均溶血百分比测定的。表25:选定的抗c5抗体的离体经典和旁路途径溶血活性百分比时间=单剂量注射后以小时计的时间;sem=平均的标准误差;blq=低于定量极限;nc=未计算如表25和图2中所示,通过补体cp(10分钟孵育)至第70天测量了pd作用。h4h12166p阻断了超过95%的cp溶血活性直至第35天。到第70天活性回到研究前的最大溶血水平。comparator2阻断了约95%的cp溶血活性直至第10天,并且到第18天活性快速回到研究前的最大溶血水平。还通过补体ap途径(60分钟孵育)溶血分析来测量了pd作用至第49天。如表25和图3中所示,h4h12166p阻断了80%的总ap溶血活性,直至第18天,并且活性在第50天回到研究前最大溶血水平。h4h1216p和comparator2阻断了90%的ap溶血活性直至第7天,并且活性在第21天回到研究前的最大溶血水平。实施例11:抗c5抗体在c5人源化小鼠中的pk/pd的表征在这组实验中,使用技术(valenzuela等,2003,nat.biotechnol.21:652-659)在人源化表达人c5蛋白的小鼠中评价了选定的抗c5抗体的药物动力学和药效学。将人源化小鼠工程化,用人c5基因的外显子2-42替代小鼠c5基因的外显子2至外显子41(公开于美国专利申请公开2015/0313194中,将其全部并入本文中)。使用人补体c5elisa(abcam,目录#ab125963)测定了总循环人c5水平,这根据制造商的推荐来进行。通过elisa测定血清中的总药物水平使用elisa,通过总的人抗体分析,测定了循环的抗c5抗体浓度,c5-结合的和-未结合的。简而言之,将pbs中1μg/ml的山羊抗人igg多克隆抗体固定在96孔平板上过夜;将平板洗涤,除去未结合的igg,并随后用5%bsa阻断。将含有抗c5抗体的血清样品的连续稀释(6个点)和相应抗体的参照标准(12个点)转移至抗人igg包被的平板并孵育一小时。随后使用缀合了辣根过氧化物的山羊抗人igg多克隆抗体检测了结合平板的抗c5抗体。根据制造商推荐的实验方案,用tmb底物显影平板,并且使用perkinelmervictorx4multimode平板读数器记录450nm下的光密度(od)信号。基于使用graphpadprism软件产生的参照标准校准曲线,计算血清中的抗c5抗体浓度。pk参数的测定使用软件(版本6.3,certara,l.p.)和血管外给药模型,通过无区隔分析(nca)测定了pk参数。使用针对每个抗体各自的平均浓度,使用线性插值和统一权重,使用线性梯形法则,测定了全部pk参数,包括估算的观察到的半衰期(t1/2)和浓度vs.时间曲线下的面积直至最后一个可测量的浓度(auclast)。通过溶血分析的pd分析使用经典途径补体溶血分析,测定了选定的抗c5抗体的药效学。将绵羊红细胞(srbc)(alsevers溶液中的绵羊血)在gvb++缓冲液(含有cacl2和mgcl2的gelatinveronal缓冲液)(bostonbioproducts)中洗涤并以1×109细胞/ml重悬浮。为了敏化,将1×109细胞/ml的srbc与等体积的1:50稀释的兔抗绵羊溶血素(1.5mg/ml)在37℃下混合20分钟。在用于溶血分析之前,将敏化的srbc细胞在gvb++中稀释至2×108细胞/ml。将来自给药前动物的或在给药后第10、20、30、40和50天收集的给药了抗c5抗体的人源化c5小鼠的血清样品在gvb++缓冲液中稀释至20%。在37℃下将总的100μl敏化的srbc(2×108细胞/ml)涂布在96孔圆底平板中,接着添加100μl补充了160-180μg/ml人补体3(huc3)蛋白的20%血清。将细胞温和混合并在37℃下孵育1小时。孵育后,通过在4℃在1250×g离心沉淀细胞。将总的100μl上清液转移至新鲜的96平底平板中并在spectramax微平板读数器上在a412nm下读数。使用以下等式,用吸收值计算了溶血百分比:在这个等式中,“背景细胞裂解”是来自在不含血清只在gvb++缓冲液中孵育的srbc在a412nm下的od。“最大细胞裂解”是来自用水处理的srbc的在a412nm下的od。使用prism6软件(graphpad),使用非线性回归(4-参数逻辑),分析了表示为%溶血的结果,以获得ic50值。数据表示为平均±(平均的标准误差)。实验1在这个实验中,在人源化c5小鼠中,与comparator1和comparator2相比,评价了示例性抗体h4h12166p的药物动力学和药效学。使用人补体c5elisa(abcam,目录#ab125963)测定了总的循环人c5水平,这根据制造商的推荐来进行。测定了小鼠中的人c5的平均浓度为39.73μg/ml±17.82μg/ml。在雄性(55.4±1.7μg/ml,n=47)和雌性(24.7±0.6μg/ml,n=49)小鼠之间存在差异。在给药研究之前,根据平均40μg/ml的人c5水平,将雄性和雌性人源化c5小鼠分组。对于每个抗c5抗体,二十二只小鼠的群通过皮下(s.c.)注射接受了单次15mg/kg剂量的h4h12166p、comparator1或comparator2。给药前和注射后一天,将所有小鼠放血,用于pk分析。此外,在注射后10、20、30、40和50天,将来自每个群的4或5只小鼠组安乐死并收集最终的放血,用于pk和pd分析。第1天的血清样品是整个22只小鼠群的平均。将血液加工成血清,并且在-80℃冷冻,直至分析。在50天的生命期间,在7个时间点测定了总的抗体浓度并且在6个时间点测定了溶血活性百分比。总的抗c5抗体浓度概括于表26中。平均总抗体浓度vs.时间谱显示于图4中。平均pk参数描述于表27中。表26:人源化c5小鼠中单次皮下注射15mg/kg抗c5抗体后血清中的平均总igg浓度时间=单剂量注射后以小时计的时间;天=研究那天;sd=标准偏差;sem=平均的标准误差;nd=未检测到;ns=无样品。*对于comparator2,在第50天,由于技术问题,一个样品无法分析,n=三。表27:pk参数cmax=峰浓度;auc=浓度-时间曲线下面积;auclast=从时间零至最后一个正浓度计算的auc;t1/2=估算的观察到的半衰期第1天的平均浓度vs.时间谱显示出三个抗体,h4h12166p、comparator1和comparator2,分别具有178、229和164μg/ml的相当的血清浓度。comparator1具有与h4h12166p相似的消除谱,直至第30天,但在第40和50天,与h4h12166p相比,呈现出清除的快速提高。在第50天,h4h12166p具有大约9μg/ml的平均抗体血清浓度,而comparator1和comparator2都具有低30倍的0.3μg/ml的平均抗体血清浓度。comparator2呈现出三个测试的抗体的最低暴露,与h4h12166p(2801天·μg/ml)和comparator1(2708天·μg/ml)相比,具有低大约2倍的auclast(1408天·μg/ml)。在至第50天测量了来自补充了人c3的人源化c5小鼠血清样品的抗c5抗体的h4h12166p、comparator1和comparator2的药理作用,并且通过敏化srbc的补体经典途径(cp)溶血离体测定。针对每个抗c5抗体的平均溶血百分比概括于表28中,并且平均溶血百分比vs.时间谱显示于图5中。表28:抗人c5抗体的离体经典途径溶血活性百分比时间=单剂量注射后以小时计的时间;天=研究那天;sem=平均的标准误差;nd=未检测到;ns=无样品。*对于comparator2,在第50天,由于技术问题,一个样品无法分析,n=三。h4h12166p、comparator1和comparator2抑制末端补体溶血活性,显示出与抗体暴露相关。h4h12166p阻断了超过85%的溶血活性,直至第30天,到第50天,活性回到给药前基线水平。comparator1和comparator2阻断了约80%溶血活性分别直至第20天和第10天,到第30天,两者的活性都回到基线水平。实验2在这个实验中,在人源化c5小鼠(对于人c5表达纯合的小鼠)中评价了抗c5抗体h4h12166p、h4h12161p、comparator1和同种型对照的药物动力学和药效学。使用人补体c5elisa(abcam,目录#ab125963)测定了总的循环c5水平,这根据制造商的推荐来进行。测定了小鼠中的人c5的平均浓度为48.98μg/ml±15.1μg/ml。在抗体给药前,根据平均50μg/ml的人c5水平,将人源化的雄性和雌性c5小鼠分组。对于每个抗c5mab,五只小鼠的群接受了单次15mg/kg皮下(s.c.)注射的h4h12166p、h4h12161p、comparator1或同种型对照。在给药前,注射后6小时,1、2、3、4、7、10、13、21、30和45天,将所有小鼠放血,用于pk分析。此外,在第59天,将来自每个群的所有小鼠安乐死并收集最终的放血,用于pk和pd分析。将血液加工成血清,并且在-80℃冷冻,直至分析。在59天的生命期间,在12个时间点测定了总的抗体浓度并且在1个时间点测定了溶血活性百分比。针对每个抗c5抗体的总血清抗体浓度概括于表29中。平均总抗体浓度vs.时间谱显示于图6中。平均pk参数描述于表30中。表29:人源化c5小鼠中单次15mg/kg皮下注射选定的抗c5抗体后血清中的平均总igg浓度时间=单剂量注射后以小时计的时间;天=研究那天;sd=标准偏差;sem=平均的标准误差;nd=未检测到;ns=无样品。表30:pk参数cmax=峰浓度;auc=浓度-时间曲线下面积;auclast=从时间零至最后一个正浓度计算的auc;t1/2=估算的观察到的半衰期平均浓度vs.时间谱显示出h4h12166p、h4h12161p、comparator1和同种型对照在第1天至第3天之间达到了最大血清浓度(cmax),分别具有1.3倍内相当的cmax值(178、225、183和221μg/ml)。h4h12166p和同种型对照具有相似的消除谱,在第59天剩余的药物水平大约为4μg/ml。h4h12161p呈现出比h4h12166p和同种型对照更快的清除,但比comparator1清除地慢。在第59天,h4h12161p具有0.6μg/ml的平均血清药物水平,而comparator1具有0.08μg/ml的几乎不可检测的药物水平。同种型对照、h4h12166p和h4h12161p呈现出1.3倍内相当的暴露(auclast)值(分别为4080、3490和304天·μg/ml),而与h4h12166p相比,comparator1呈现出低1.6倍的暴露(2240天·μg/ml)。实施例12:基于lc-mrm-ms的分析来测定总人c5的浓度在这个实施例中,在抗c5抗体h4h121166p的药物动力学/药效学研究中使用结合多反应监测质谱的液相色谱(lc-mrm-ms)方法,测定了总人c5的血清浓度。通过测量作为c5替代物的c5序列中所含的10个氨基酸肽lqgtlpvear(seqidno:359的氨基酸1129-1138)的浓度来测定总人c5的血清浓度。理论上,这种方法还可以检测c5裂解产物,c5b。然而,由于游离c5b的不稳定性,血清中的c5b浓度通常是低的,大部分是mac复合物形式的结合细胞表面的c5b(cooper&muller-eberhard1970,j.exp.med.132:775-93;hadders等,2012,cellrep.1:200-7)。因此,本文分析的加工过的血清样品很可能只含有可忽略含量的c5b产物,如果有的话。方法为了pk/pd研究,小鼠通过皮下(s.c.)注射接受了单个15mg/kg剂量的h4h12166p。在给药前和注射后一天,将所有小鼠放血,用于pk分析。另外,在注射后第10、20、30、40、50和60天,将小鼠安乐死并收集最终的放血,用于pk和pd分析。将人c5用作校准的参照标准;并且将用c-末端稳定的同位素标记的精氨酸残基产生的人c5肽用作内标(lqgtlpvear-13c615n4)。在来自内部产生的c5敲除小鼠(其中小鼠c5基因被删除(c5-/-))的血清中,以3.9至250μg/ml(1:2连续稀释)的浓度范围来使用参照标准。来自c5-/-小鼠的血清还被用作负对照(空白)。将校准标品、空白和研究血清样品(各自10μl)干燥,并随后在100μl的8m脲/20mmtris(2-羧乙基)磷化氢(tcep)缓冲液中在37℃下变性1小时。接着,将10μl的25nm内标加入所有样品中。用10mm的2-碘乙酰胺在室温下将样品烷基化30分钟,并使用50mm碳酸氢铵稀释至500μl的终体积。随后通过胰蛋白酶(1:20w/w)在37℃下将样品消化过夜。使用具有acquityuplc系统的watersxevotq-s,通过lc-nmr-ms检测到源自c5的胰蛋白酶水解的肽lqgtlpvear并定量。将每个处理过的样品(10μl)注射在预先平衡的acquityuplcbehc18柱上。流速为0.6ml/min(移动相a:水:甲酸/100:0.1[v:v]和移动相b:乙腈:甲酸/100:0.1[v:v])。使用masslynxanalystdata软件(waters)测定了停留时间和峰面积。从校准曲线计算了c5分析物的浓度,校准曲线是通过将c5参照标准(通过hc5的胰蛋白酶消化产生的未标记的c5肽lqgtlpvear-12c614n4)与内标(稳定的同位素标记的c5肽)的峰面积比例vs.c5参照标准的名义浓度绘制曲线来构建的。使用线性回归来计算浓度。c5参照标准的最低浓度(3.9μg/ml)在分析的动态范围内并限定为分析的lloq。结果针对给药之前(给药前)经由尾放血和第10、30和35天经由最终放血从相应动物收集的样品评价了血清中总的人c5浓度。h4h12166p给药后的总hc5浓度在给药后第10、30和35天时与给药前水平相似(在~1至0.9倍内)。观察到的较小差异在统计学上没有显著性,如使用graphpadprism软件,通过mann-whitney测试评价的。c5/h4h12166p摩尔比的分析证明了h4h12166p保持以摩尔计超过c5直至给药后第35天(表31)。表31:h4h12166p的pd特征的概括a从相对于第0天的平均%cp溶血值的所示给药后那天的平均%cp溶血值计算了cp溶血活性的抑制百分比。b倍数变化=最终(给药后所示那天)c5:给药前c5。sd=标准偏差;maha=小鼠抗人抗体;n/d=未测定具有maha影响数据的动物完全从计算中排除(第30天,2×,第35天,1×,第40天,2×,第50天,全部4只小鼠)。实施例13:通过氢/氘交换的结合c5的h4h12166p的表位图谱绘制使用质谱进行了h/d交换表位图谱绘制,以确定h4h12166p与其相互作用的hc5的氨基酸残基[(seqidno:359的氨基酸m1-c1676)。h/d交换方法的一般描述列于例如ehring(1999)analyticalbiochemistry267(2):252-259;以及engen和smith(2001)anal.chem.73:256a-265a。在集成watershdx/ms平台上进行了hdx-ms实验,所述平台由用于氘标记的leaptechdxpal系统、用于样品消化和加载的watersacquitym-class(auxiliary溶剂管理器)、用于分析柱梯度的watersacquitym-class(μbinary溶剂管理器)和用于胃蛋白酶分解的肽质量测量的synaptg2-si质谱仪组成。在pd7.0(等于ph6.6)的d2o中的10mmpbs缓冲液中制备了标记溶液。为了氘标记,用56.2μld2o标记溶液孵育3.8μlc5(6pmol/μl)或预先与抗体以1:1摩尔比混合的c5不同时间(例如,未氘化的对照=0秒,标记1min和20min)。通过将50μl样品转移至50μl预冷的淬灭缓冲液(100mm磷酸盐缓冲液中的0.2mtcep,6m氯化胍,ph2.5)中来淬灭氘化,并且将混合的样品在1.0℃下孵育两分钟。随后将淬灭的样品注入watershdxmanager中,用于在线胃蛋白酶/蛋白酶xiii消化。将消化的肽捕获在0℃的acquityuplcbehc181.7-μm,2.1×5mmvanguard前置柱上,并洗脱至分析柱acquityuplcbehc181.7-μm,1.0×50mm,持续5%-40%b(移动相a:水中0.1%甲酸,移动相b:乙腈中0.1%甲酸)的9-分钟梯度分离。将质谱仪设定在37v的锥电压,0.5s的扫描时间和50-1700thomson单位(th)的质量/电荷范围。对于来自人c5的肽的鉴定,将来自未氘化样品的lc-mse数据加工并通过watersproteinlynxglobalserver(plgs)软件相对包括人c5、胃蛋白酶及其随机化序列的数据库进行搜索。将鉴定的肽输入dynamx软件中并通过两个标准来过滤:(1)每个氨基酸的最小产物=0.3和(2)复制文件阈值=3。dynamx软件随后基于通过多个时间点的停留时间和高质量精度(<10ppm)自动测定每个肽的氘吸收,每个时间点3个重复。使用结合mse数据获取的在线胃蛋白酶/蛋白酶xiii柱,在不存在或存在抗体的情况下,鉴定了总共189个来自人c5的肽,代表了62%的序列覆盖。结合h4h12166p时,五个肽具有显著降低的氘化吸收(质心(centroid)δ值>0.9道尔顿,p-值<0.05),并且说明于表32中。表32:结合h4h12166p时人c5肽的氘化所记录的肽质量对应于来自三个重复的质心mh+质量的平均值。这些肽,对应于氨基酸591-599和775-794,在结合h4h12166p时具有较慢的氘化速率。这些鉴定的残基还对应于人c5的残基591-599和775-794,如通过uniprot条目p01031所限定的(co5_human;seqidno:359)。实施例14:抗c5抗体对小鼠中的实验性自身免疫性葡萄膜炎中的眼部炎症的作用进行这个研究来评价c5在实验性自身免疫性葡萄膜炎(eau)中的作用。使用了遗传[c5敲除(ko)、c3/c5双ko小鼠]和药理学(抗c5抗体)实验方法。方法使用了成年c57bl/6j小鼠(n=25,jackson实验室),c5ko(n=13)和c3/c5ko(n=8)小鼠(regeneronpharmaceuticalsinc.)。通过皮下注射完全freund’s佐剂中的人光感受器间视黄醇结合蛋白肽(irbp,newenglandpeptide)和腹膜内注射百日咳毒素来诱导eau。从第5天至第28天,每3天通过皮下注射给药抗小鼠c5mab或同种型对照mab。这个研究中使用的抗小鼠c5抗体(m1m17628n)包括seqidno:362/363的hcvr/lcvr。在第-1、7、14、21和28天,使用hra+oct(heidelbergengineering,inc.)来评价炎症水平。在第28天,将所有动物安乐死,用于收集眼睛和血液。进行使用/未用人c3的溶血分析,来证实补体抑制。通过anova分析了数据。结果与野生型小鼠相比,在c5ko小鼠中,炎症发生率(30-50%)和玻璃体细胞簇计数显著降低(p<0.01)。c5ko小鼠中的光学相干断层扫描(oct)评分在第3周时也显著降低50%(p<0.0001)。有趣地,在c3/c5双ko小鼠中,与野生型小鼠相比,在第28天时存在显著更多的玻璃体细胞簇和更高的疾病评分(p<0.05)。在接受了抗mc5ab(50mg/kg)的动物中,在第21天与未处理或同种型对照相比,炎症发病率和玻璃体细胞簇显著降低(p<0.01)。在第3周和第4周时,与未处理或同种型对照相比,抗c5抗体治疗组中的oct评分显著降低(p<0.0001)(图7)。在第4周时使用/未用人c3的溶血分析证实了抗c5抗体的抑制作用(图8)。结论通过遗传删除或使用特定的抗c5抗体的药理学抑制,通过抑制c5活性,减轻了由于eau引起的眼部炎症。c5耗尽延迟了eau发生和降低的oct疾病评分。这些结果表明c5是针对自身免疫性葡萄膜炎的潜在治疗靶标。抗c5抗体对野生型小鼠中的eau疾病具有保护作用。我们的发现还表明了c3对于小鼠中的eau疾病可能是有益的。实施例15:抗人c5抗体对实验性自身免疫性葡萄膜炎的作用这个实施例描述了在实验性自身免疫性葡萄膜炎(eau)的小鼠模型中抗c5抗体对抗人c5的作用。使用技术(valenzuela等,2003,nat.biotechnol.21:652-659),将用于这个研究的小鼠人源化,以表达人c5蛋白。将人源化小鼠工程化,用人c5基因的外显子2-42替代鼠c5基因的外显子2-外显子41(公开于美国专利申请公开2015/0313194中,在此以其全文并入)。方法在每条大腿中,用0.2ml补充了结核分枝杆菌(mycobacteriumtuberculosis)株h37ra至2.5mg/ml的cfa乳液中的150μg人光感受器间视黄醇结合蛋白(irbp)肽1-20(gpthlfqpslvldmakvlld)(seqidno:364)(avichezer等,2000,invest.ophthalmol.vis.sci.41:127-131)皮下免疫成年雄性小鼠。随后通过腹膜内给小鼠接种1.0μg百日咳毒素(ptx),通过促进免疫应答的th1极化,来促进细胞介导的自体免疫力的诱导(thurau等,1997,clin.exp.immunol.109:370-376;silver等,1999,invest.ophthalmol.vis.sci.40:2898-2905)。一周监测动物体重两次。在第-1天,在eau诱导前以及在第7、14、21和28天,进行了眼科检查。用氯胺酮(120mg/kg,ip)和甲苯噻嗪(5mg/kg,ip),将小鼠麻醉。使用0.5%的托品酰胺滴眼液散瞳,并且使用接触镜检查眼底,所述接触镜具有spectralisheidelberg视网膜血管造影平台(hra)+oct系统(heidelbergengineering,carlsbad,ca,usa)中的眼底照相机。使用spectralishra+oct系统(heidelbergengineering,carlsbad,ca,usa)上的oct功能,针对每只眼睛获得了一系列61个横向(lateral)眼睛切片。oct成像区域集中于视盘,允许视神经头上方和下方等值成像。作为rpe层的底部到眼睛的内界膜之间的距离来测量视网膜厚度。从视盘的1500μm进行测量,并且将来自4个不同视网膜象限(例如,上,下,颞和鼻)的值平均,用于平均的眼视网膜厚度。还通过评价每只眼睛中横断视神经的四个横向oct扫描中的玻璃体中的炎性细胞簇的平均数量,将oct图像中炎性细胞浸润至玻璃体中的严重程度分级。产生了4-点量表,用于评价oct图像中的疾病严重程度(oct评分)(表33)。表33:使用光学相干断层扫描(oct)将体内eau评分统计学分析通过one-wayanova检验和tukey’s多重比较检验,进行了针对参数数据(体重、玻璃体中的炎性细胞簇和视网膜厚度)的统计学分析。对于非参数数据(oct评分和病史评分),相对于同种型对照或无处理组,使用graphpadprism版本5.0d软件,通过kruskal-wallis检验和dunn’s检验,进行了分析。数据显示了平均值±sem。认为低于0.05的p-值是统计学上显著的。结果在第一个研究(研究a)中,从第5天,每3天,给小鼠皮下给药对照抗体(50mg/kg),或10mg/kg或50mg/kgh4h12170p。用10mg/kgh4h12170p处理导致了炎症和视网膜损伤的减轻(图9)。用10mg/kgh4h12170p处理的小鼠也显示出在第21天和第28天oct评分的统计学上显著的降低(图10)。在第二个研究(研究b)中,从第6天,每3天,给小鼠皮下给药同种型对照(10mg/kg),3mg/kg或10mg/kgh4h12166p,或comparator2(参见本文的实施例2;“以下实施例中使用的对照构建体”)。用3mg/kg或10mg/kg的h4h12166p的处理产生了在第14至28天统计学上显著的oct评分的剂量相关降低(图11)。eau诱导后6天开始的c5人源化小鼠中用10mg/kgh4h12166p的处理导致炎症和视网膜损伤的剂量相关减轻,如通过第14天至第28天获得的oct测定的(图12)。对于两个研究,通过oct的非入侵、生命中的评价显示出用irbp免疫后对照动物中渐进性的炎症发展、增加的视网膜厚度和形态异常。结论这些实验提供了更多的c5在自身免疫性葡萄膜炎的发病机理中起着作用的药理学证据。通过完全人抗人c5抗体的人c5的药理学耗尽延缓了eau发病并且降低了疾病严重性,确定了这些抗体在自身免疫性葡萄膜炎中的功效。实施例16:抗c5抗体对肾缺血-再灌注损伤的作用进行这个研究来评价c5在肾缺血-再灌注损伤中的作用。使用了遗传(使用c3敲除和c5敲除小鼠)和药理学方法(使用抗c5抗体)。通过双侧肾蒂夹持45分钟接着48h再灌注来诱导缺血-再灌注模型。假剖腹探查术用作对照。在缺血后立即作为单剂量静脉内给药50mg/kg抗c5抗体(治疗性);或在外科手术第-1天和第1天作为两剂皮下给药(预防性)。用于这个研究的抗c5抗体是包含seqidno:362/363的hcvr/lcvr的m1m17628n。使用血尿素氮(bun)和血清肌酐标志物评价小鼠中的疾病水平和保护。表34:在预防性和治疗性模型中用抗c5抗体(m1m17628n)处理的小鼠中的血尿素氮水平的变化百分比bun,%变化vs.riri+vehriri+同种型对照第2天第2天riri+m1m17628n(预防性)-37.19-34.68riri+m1m17628n(治疗性)-53.70-51.85表35:在预防性和治疗性模型中用抗c5抗体(m1m17628n)处理的小鼠中的血清肌酐水平的变化百分比与野生型小鼠相比,c3和c5敲除小鼠在急性肾损伤的riri模型中显示出明显的功能保护,如通过血尿素氮和血清肌酐水平的降低所证实的。抗c5抗体显示出在预防性和治疗性模式的riri模型中的功能性保护。实施例17:抗c5抗体对狼疮性肾炎的作用这个实施例描述了抗c5抗体在治疗小鼠模型中的狼疮性肾炎中的功效。系统性红斑狼疮(sle)是由失去对自身抗原的耐受性,产生自身抗体并在受伤的组织中沉积补体固定免疫复合物(ic)引起的自身免疫性障碍。sle的特征在于大范围的临床表现和靶向的器官,狼疮性肾炎是最严重的并发症之一。狼疮性肾炎患者的肾脏中的补体激活引起炎症和组织损伤。在nzbwf1小鼠(狼疮性肾炎的自发性小鼠模型)中研究了抗c5抗体在治疗狼疮性肾炎中的功效(yang等,1996,pnas)。小鼠产生了类似人类sle的自身免疫性疾病,核抗原和细胞膜蛋白的自身抗体,高丙球蛋白血症,白蛋白尿,蛋白尿,在35至50周的年龄时开始了免疫复合物血管球性肾炎和肾衰竭的死亡以及终末期肾病。对于这个研究,用30mg/kg同种型对照,或抗c5抗体皮下处理25周大的nzbwf1小鼠,每周两次,持续8周,接着一周三次,持续10周。用于这个研究的抗小鼠c5抗体是m1m17628n和m1m17627n,分别包含seqidno:362/363和365/366的hcvr/lcvr。用抗c5抗体处理显著提高了小鼠中的存活率(图13)。两种抗体在处理8-14周时都改善了白蛋白尿(图14),在处理12-16周时改善了血尿素氮水平(图15)。实施例18:抗c5抗体对抗星形胶质细胞死亡的作用视神经脊髓炎(nmo)是中枢神经系统(cns)的自身免疫性疾病,其主要影响视神经和脊髓。nmo中,抗水通道蛋白-4自身抗体(aqp4-ab)通过激活补体依赖性细胞毒性(cdc)引起星形胶质细胞的损伤。这个研究的目的是评价补体系统在nmo进展中的作用以及对抗补体蛋白的抗体作为用于nmo的潜在治疗性处理的用途。原代大鼠皮质星形胶质细胞获自出生后鼠仔的大脑皮层并用aqp4-ab(来自美国专利申请公开2014/017040的抗体“rab-53”;bennett等,2009,ann.neurol.66:617-629)和补体蛋白培养,以证明细胞介导的细胞毒性。随后,添加抗c5抗体重复实验,以证明星形胶质细胞破坏的阻断。为了量化细胞死亡,进行了cytotox-glotm发光细胞毒性分析。该分析使用了各种浓度的抗c5抗体(0.001μg/ml、0.01μg/ml、0.1μg/ml、1μg/ml、10μg/ml、100μg/ml或1000μg/ml)或同种型对照抗体。为了确定抗c5抗体是否可以阻断aqp4-ab诱导的cdc,将星形胶质细胞涂布并重复了cytotox-glotm细胞毒性分析来发现用于该涂布的最佳aqp4-ab剂量。发现最佳的aqp4-ab浓度为50μg/ml,并且在以下的实验中,使用恒定剂量的aqp4-ab(50μg/ml),而抗c5抗体的剂量是改变的。如图16中所示,看到了随着抗c5抗体含量的增加,rlu降低(平均300k至平均100k),证明了抗c5抗体阻断了星形胶质细胞死亡。对于两个实验,rlu都没有随着同种型对照抗体而改变。如图16中所示,抗c5抗体以15-17nm的ic50抑制了aqp4ab对原代皮质星形胶质细胞诱导的细胞毒性。在随后的研究中,将抗aqp4抗体和抗c5抗体注入大鼠大脑中,以评价对抗cns中的补体介导的星形胶质细胞的细胞毒性的治疗效果。实施例19:内皮细胞分析这个实施例描述了体外肾小球内皮分析,以检测抗c5抗体是否阻断c5b-9和c3沉积。用于评价药物候选物对补体激活的抑制作用的可重复方法对于临床前研发是必需的。由于补体激活途径的复杂性,分析应当使用给定的治疗性适应证的相关细胞和终点。在本文中,使用永生化人肾小球内皮细胞系(hgec),验证了用于评价抗c3或c5mab的阻断活性的补体c3&c5沉积模型。方法将人原代肾脏肾小球内皮细胞(hgec;cellbiologics)在完全培养基中涂布至胶原蛋白i包被的黑色透明底96孔平板中过夜。用pbs(对照)处理细胞或用10umadp激活10min。pbs洗涤后,加入50%人血清(保留补体的、耗尽c3的或耗尽c5的),持续4小时。在处理前,将1mg/ml的抗c5抗体加入血清中。将细胞洗涤并固定,用抗c3b抗体(thermofisher)和/或抗c5b-9抗体(abcam)、二抗探测,并用dapi复染。在imagexpress上捕获图像,并使用高容量图像分析来定量每个图像的荧光染色并对每个条件进行平均。结果在暴露于正常人血清的adp激活的hgec上观察到了c3和c5b-9沉积,但在未激活的hgec上没有(c3:1.5x107±1.0x107;c5:7.9x106±6.6x106,p<0.05vs非-adp-激活的hgec)。暴露于c3或c5耗尽血清的adp激活的hgec上的c3和c5b-9沉积显著降低(c3:3.3x105±4.8x104;c5:1.5x106±6.0x105,p<0.05)。阻断性抗c5mab的添加显著降低了正常人血清衍生的c5b-9沉积在adp激活的hgec上,沉积与c5耗尽的血清相当(c5mab:1.02x106±6.0x105,对照mab3.7x106±1.6x106,p<0.05vs.对照mab)。结论这些数据证明了体外人肾小球内皮分析对模仿补体c3&c5沉积的实用性。除了体外筛选,这个分析给予了作为翻译模型的可能性,以使用患者衍生的血清样品来评价肾病中的抗补体策略。本发明不限于本文中所述的特定实施方案的范围。实际上,本领域技术人员从之前的描述和附图将清楚除了本文中所述那些以外的本发明的各种改变。确定这样的改变落入所附权利要求的范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1