三维体外肺泡肺模型、所述模型的制备方法以及其用于确定和/或预测可吸入物的致敏效果的用途与流程
本发明涉及一种三维体外肺泡肺模型及所述模型的制备方法。
本发明还涉及其用于评估可吸入物(诸如可吸入颗粒或分子)对肺的肺泡屏障的刺激潜力或毒性,以及用于确定和/或预测可吸入物(诸如可吸入颗粒或分子)对肺的肺泡屏障的致敏效果的用途和方法。
背景技术:
由于接触化学产品而引起的呼吸道致敏在过去几十年中增加,导致发病率的增加。例如香料和工业溶剂之类的合成化合物的更广泛使用,导致我们每天可能接触到的物质呈指数增长。已知这些物质中的一些会引起呼吸道致敏,这意味着它们会随着时间的推移引发过敏反应的发展,并可能产生不良的全身性反应。
这可能导致呼吸系统疾病,如哮喘、过敏性鼻炎、鼻结膜炎和鼻窦炎。
为了表征这些化学物质的潜在风险,有必要充分了解肺致敏中所涉及的机制。
在过去,动物研究为了解呼吸道过敏发生中涉及的机制提供了有用的结果。然而,对所涉及的细胞效应的机制理解仍然是有限的。已经提出了几种方法来区分和鉴定过敏原的功能和结构特征,但这些研究都没有得出决定性的结果,这主要是由于生物源和环境混杂的辅助因素。这种知识的缺乏阻碍了预测性体外模型的发展,使体内模型成为表征呼吸道过敏原的唯一工具。然而,尽管缺乏确定和表征呼吸道致敏物的有效方法,但诸如reach(化学品的注册、评估、授权和限制)的法规要求并鼓励使用非动物方法进行毒理学评估。
目前,还没有一种经过验证的体外方法,可以作为体内测试的替代方法,并能够识别和表征作为呼吸道致敏物的化学物质的潜力。
在2013年的出版物(klein等,微粒和纤维毒理学报,2013,10:31)中,作者提出了由肺泡ii型上皮细胞系(a459)、分化巨噬细胞样细胞(thp-1)、肥大细胞(hmc-1)和内皮细胞(ea.hy926)组成的四培养物(tetraculture)模型,这使得模型能够暴露于气-液界面(ali)。然而,观察到细胞在浸没条件下形成异质菌落:这导致过高估计在例如ros(活性氧类)产生和il-8分泌的结果中观察到的效果。此外,klein的模型由于缺乏相关的感受态细胞而不能用于致敏作用的评价,且由于孔径尺寸减小而不允许细胞通过膜迁移。与培养箱对照相比,ali处的暴露对培养物具有引发效应,其呈现更高的基础氧化应激水平。这对于提供毒理学效应更现实估计的外部挑战给出一个更生理学的答案。此外,ali处的暴露允许对于外源性化合物的现实接触,无需在包含许多会与研究中的化学物质相互作用的生物分子的细胞培养基中的前稀释,由此可能改变生物效应的读数,导致不可预知的低估或高估的生物效应。
迄今为止提出的用于呼吸毒理学的所有先前模型通常使用支气管细胞系制成,与呼吸道致敏的背景无关。因此,需要一个相关的工具来研究呼吸道致敏并预测可吸入化学物质和小颗粒的呼吸潜力。
发明目的
本发明的第一个目的是提供一种模拟肺的肺泡表面的体外模型,以评估可吸入物、化学物质以及颗粒的呼吸道致敏潜力。
技术实现要素:
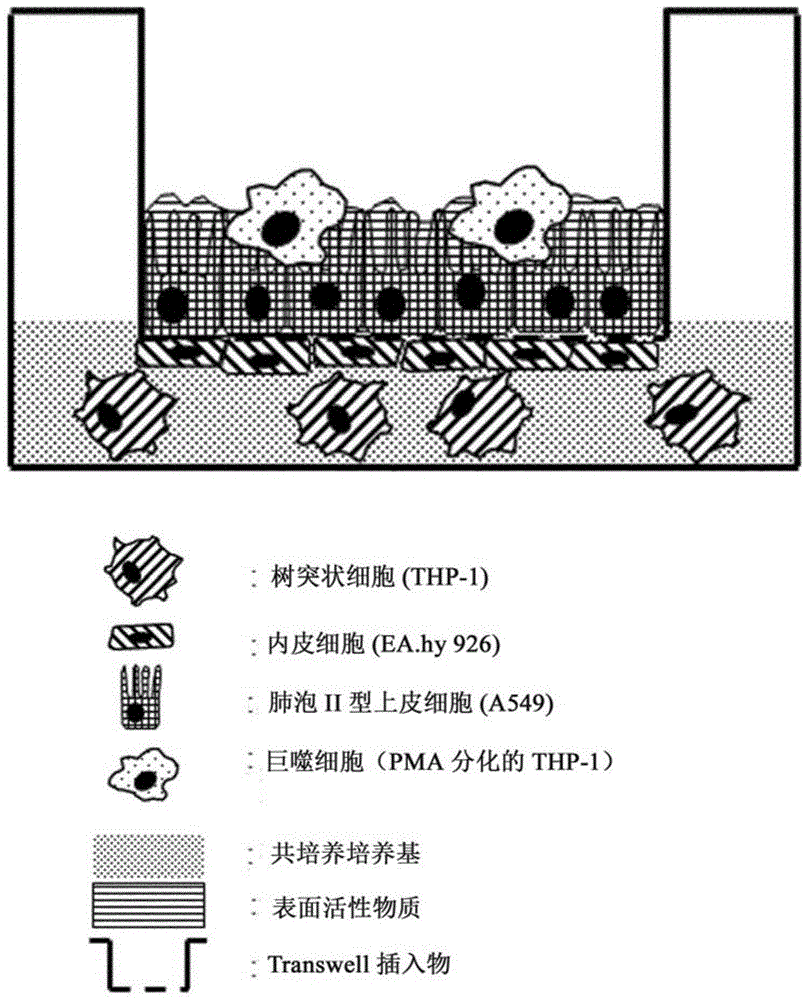
本发明涉及一种三维体外肺泡肺模型,主要包括以下四种细胞类型:
a)能够分泌(肺部铺设)表面活性物质的肺泡ii型上皮细胞,
b)构成提供渗透性屏障的毛细血管内衬层的内皮细胞,
c)树突状细胞(连接先天性和适应性免疫),
d)巨噬细胞样细胞,能够通过吞噬作用摄入外来物质,从而参与防御机制,其中:
所述三维体外肺泡肺模型是培养孔的形式,所述培养孔配备有多孔膜,该多孔膜将孔分成暴露于气-液界面的顶部隔室,以及浸没在培养基中的基底侧隔室,所述上皮细胞和所述巨噬细胞存在于顶部隔室中,且所述内皮细胞和所述树突状细胞存在于基底侧隔室并浸入在培养基中,
所述多孔膜具有2μm至10μm的孔,以使树突状细胞能够从基底侧隔室迁移至顶端隔室。
这里所说的“主要”是指所述肺泡肺模型实质上包括上述四种细胞类型,特别是所述肺泡肺模型不包括肥大细胞,其可能导致错误的结果。
所说的“实质上”,特别是指所述模型不包括肥大细胞,其可能在可吸入物的毒性或致敏作用的评估中导致错误的结果。
发明详述
更具体而言,巨噬细胞样细胞是用pma(佛波醇-12-肉豆蔻酸酯-13-乙酸酯)或1,25-二羟基维生素d3分化的thp-1细胞,优选用pma分化。这种分化最好在几天内完成:有利地是3到10天,优选5天。
在本发明的模型中,所有细胞均为永生化哺乳动物细胞系,该细胞系是比原代细胞更为稳定的细胞,并且优选为永生化人类细胞系。
“优选地”,所述肺泡ii型上皮细胞为a549细胞。
且“优选地”,所述内皮细胞为ea.hy926细胞。
而且“优选地”,所述树突状细胞是未分化的thp-1细胞,其为人类树突细胞的孔建立模型。
树突细胞在致敏过程中至关重要,因为这些细胞负责识别和捕获抗原,从而触发免疫应答。
有利地,本发明的三维体外肺泡肺模型包括:
a)a549细胞,作为肺泡ii型上皮细胞,
b)ea.hy926细胞,作为内皮细胞,
c)未分化的thp-1细胞,作为树突状细胞,
d)用pma分化的thp-1细胞,作为巨噬细胞样细胞,
且不包括肥大细胞。
在本发明的一个优选实施方案中,本发明的三维体外肺泡肺模型仅由以下四培养物组成:
a)a549细胞,作为肺泡ii型上皮细胞,
b)ea.hy926细胞,作为内皮细胞,
c)未分化的thp-1细胞,作为树突状细胞,
d)由pma分化的thp-1细胞,作为巨噬细胞样细胞。
与klein2013年的四培养物模型相比,本模型剔除了肥大细胞,肥大细胞可以改变局部微环境,影响树突状细胞的应答。因此,本模型更精确地模拟了体内情况,其中肥大细胞只存在于过敏性炎症的阶段(诱发阶段),而不存在于过敏性炎症之前的致敏阶段。肥大细胞对各种生物刺激都有应答,其中最重要的是通过b淋巴细胞释放免疫球蛋白e(ige)。由于b淋巴细胞不存在于本发明模型中,而且hmc-1细胞也不存在ige的功能受体,因此在本模型中加入肥大细胞只会增加不必要的复杂性,不会带来任何额外的价值。
分开顶部隔室和基底侧隔室的多孔膜可以是例如
有利地,多孔膜具有3μm至8μm,更优选4μm至6μm的孔。在klein的模型中,四培养物中不存在树突细胞,当然,顶部隔室中也不存在树突细胞。klein模型中树突细胞的缺失使得该模型无法预测呼吸道致敏。树突细胞在致敏过程的诱导阶段起着关键作用,如果没有树突细胞,整个过程就无法研究。
树突状细胞从基底侧隔室迁移到顶部隔室的能力也是该模型的一个重要特征(这在klein的模型中是不可能的)。树突细胞不是天然地不存在于肺泡中的,它们只是在外源性刺激的作用下才被吸收到肺泡中。此外,为了真实地估计致敏潜力,重要的是,树突状细胞不直接暴露于致敏物,致敏物应首先与上皮细胞和驻留的巨噬细胞接触。由于上皮细胞或巨噬细胞的代谢过程,这种接触可能增强或降低吸入物质的致敏潜力。
本发明还涉及一种制备上述三维体外肺泡肺模型的方法,包括在具有多孔膜的插入物中共培养细胞a)至d),步骤顺序如下:
i)在具有2μm至10μm孔的膜插入物的下表面(其将成为基底侧)接种0.24105至0.6105内皮细胞/cm2,
ii)至少4小时后,在膜插入物的另一侧(顶侧)接种肺泡ii型上皮细胞,优选0.12105至1.2105,优选0.5105至1.0105细胞/cm2,
iii)约4天后,在膜插入物的基底侧加入含有10-100万个树突状细胞/ml的细胞悬液,然后
iv)在肺泡ii型上皮细胞孢子上添加巨噬细胞样细胞,优选0.12105至1.2105巨噬细胞样细胞/cm2,最后,
v)将膜插入物引入培养基中,使所述内皮细胞和所述树突状细胞(存在于基底侧隔室)浸入共培养基中,并且所述上皮细胞和所述巨噬细胞样细胞存在于顶部隔室的气-液界面(ali)处。
优选在上述方法中,所述巨噬细胞样细胞为用pma(佛波醇-12-肉豆蔻酸酯-13-乙酸酯)分化的thp-1细胞,和/或所述肺泡ii型上皮细胞为a549细胞,和/或所述内皮细胞为ea.hy926细胞,和/或所述树突状细胞为未分化的thp-1细胞。
本发明的三维体外肺泡肺模型发现了有趣的应用,特别是:
-用于评估可吸入物(诸如颗粒或分子)对肺的肺泡屏障的刺激潜力或毒性;
-用于确定和/或预测可吸入物(诸如颗粒或分子)对肺的肺泡屏障的致敏作用。
本发明还涉及一种用于确定和/或预测可吸入物(诸如颗粒或分子)对肺的肺泡屏障的致敏作用和/或刺激潜力或毒性的方法,包括:
a)通过在根据权利要求1至8中任一项所述的三维体外肺泡肺模型的顶部隔室上粉碎/雾化待测试的可吸入物进行暴露的步骤,所述三维体外肺泡肺模型是培养孔的形式,所述培养孔配备有具有2μm至10μm的孔的多孔膜,所述上皮细胞和所述巨噬细胞存在于膜的顶侧,并且所述内皮细胞和所述树突状细胞存在于膜的基底侧,所述内皮细胞和所述树突状细胞浸没在共培养基中,所述暴露导致树突状细胞活化,
b)共培养所述活化的树突状细胞和t淋巴母细胞系的步骤。
优选地,如果待测试的物质是疑似呼吸道致敏物,t细胞应该呈现辅助性2型(th2)特征。
呼吸道致敏潜力的标志物可通过流式细胞术(facs,如cd40、cd54、cd86、tslpr、il-1ra、ox40l)和/或酶联免疫吸附测定(elisa,tslp、il33、il-25、rantes、mcp-1、mip-3a、il-6、il-7、il-10和gm-csf)进行测定。
进一步的生物学终点,如白细胞介素的释放、基因毒性、致敏生物标志物、蛋白质组、转录组、代谢活化也可以测定。
本发明的三维体外肺泡肺模型具有以下主要优点:
-不存在可能导致错误结果的肥大细胞;
-使用气体、液体或粉末作为待测试材料,在气-液界面(ali)暴露的可能性;
-检测化学物质和颗粒以下两方面的可能性:它们的炎症或致敏潜力,相对的,klein等人2013年的模型只能用于刺激潜力;
-测定大批生物学终点(如白细胞介素释放、基因毒性、致敏生物标志物、蛋白质组、转录组、代谢活化等)的可能性。
附图说明
本发明肺模型的进一步优点和方面可以参照附图,从下面实施例部分中给出的实施方案的描述中推导得出,其中:
图1是带有本发明的四培养物的
图2a至2e是显示暴露于hdm24h后,四培养物肺模型中thp-1细胞的细胞表面上各细胞表面标志物cd86、cd40、il7ra、cd54和ox40l表达的直方图;
图3a和3b是表示暴露于不同浓度的化学呼吸道致敏物(分别为偏苯三酸酐(tma)和邻苯二甲酸酐(pa))24小时和48小时后的活力%的图;
图4a、4b和4c是显示暴露于不同浓度的化学呼吸道刺激物(分别为十二烷基硫酸钠(sds)、丙烯醛(acr)和水杨酸甲酯(mesa))24h和48h后的活力%的图;
图5a和5b是显示暴露于致敏物和刺激物24h后,在根据本发明的四培养物体外肺模型(a)中,和在未形成本发明部分的单一培养模型(b)中thp-1细胞上的cd54的细胞表面标志物表达的图(平均+/-标准误差);
图6a和6b是显示暴露于致敏物和刺激物24h后,在根据本发明的四培养物体外肺模型(a)中,和在未形成本发明部分的单一培养模型(b)中thp-1细胞上的cd86的细胞表面标志物表达的图(平均+/-标准误差);
图7是显示暴露于致敏物和刺激物24h后,在根据本发明的四培养物体外肺模型中thp-1细胞上的ilra的细胞表面标志物表达的图(平均+/-标准误差);
图8是显示暴露于致敏物和刺激物24h后,在根据本发明的四培养物体外肺模型中thp-1细胞上的ox40l的细胞表面标志物表达的图(平均+/-标准误差);
图9是显示暴露于致敏物和刺激物24h后,在根据本发明的四培养物体外肺模型中thp-1细胞上的tslpr的细胞表面标志物表达的图(平均+/-标准误差);
图10a和10b是显示暴露于化学致敏物和刺激物24h和48h后,在根据本发明的四培养物体外肺模型中释放的细胞因子的图(a):il-7基础水平:dmso基础水平24h:18.2±0.0pg/ml;48h:19.5±1.2pg/ml;水24h:18.6±0.3pg/ml;48h:18.2±0.0pg/ml(b)gm-csf基础水平:dmso基础水平:dmso:24h:32.4±6.0pg/ml;48h:31.0±3.7pg/ml;水:24h:47.0±9.2pg/ml;48h:43.1±5.4pg/ml(平均+/-标准误差)(字母表示显著性差异(因素方差分析+fisherlsd事后检验,p<0.05显著性水平,n=6)。
图11a和11b是显示在单一培养中浸没条件下暴露于pa(图11a)和tma(图11b)24小时后thp-1细胞的活力的图。在这个图中,测试的最高浓度代表化合物在含有0.2%dmso的介质中的溶解度最大值。
具体实施方式
实施例1
在这个实施例中使用以下细胞系:a549、ea.hy926、thp-1和mφ-thp-1。它们各自的特点如下:
细胞系a549对应于人支气管上皮细胞,具有产生表面活性物质的能力;
ea.hy926细胞系是具有内皮细胞特性的体细胞杂种;
thp-1是人单细胞白血病细胞系;且
mφ-thp-1是来源于thp-1细胞的巨噬细胞,用pma(佛波醇-12-肉豆蔻酸酯-13-乙酸酯)或1,25-二羟基维生素d3分化。
不同培养基的制备:
使用的方案如下:
ea.hy926培养基:
-从新瓶(500ml)中取出60mldmem(dulbecco’s改良的eagle’s培养基)培养基,加入50mlfbs(10%),再加入5mlhepes原液(250mm;无菌,过滤),得到hepes缓冲培养基(25mm),
-用5mlpen/strep(青霉素/链霉素)保存。
共培养10%培养基:
-从新瓶(500ml)中取出5mldmem培养基,加入5mlhepes原液(250mm;无菌,过滤),得到hepes缓冲培养基(25mm),
-混合并取出125ml,
-加入50mlimdm,然后加入75mlrpmi培养基,
-混合并取出55ml,
-然后向培养基中加入50mlfbs(10%)和5mlpen/strep。
共培养1%培养基:
-从新瓶中取出5mldmem培养基,加入5mlhepes原液(250mm;无菌,过滤),得到hepes缓冲培养基(25mm),
-混合并取出125ml,
-加入50mlimdm,然后加入75mlrpmi,
-混合并取出10ml,
-然后向培养基中加入5mlfbs(1%)和5mlpen/strep。
thp-1完全培养基:
-从新瓶(500ml)中取出57.5mlrpmi培养基。从52.5ml中取出10ml转移到离心管中并扔掉剩余的培养基,
-通过将7μl市售液加入10mlrpmi中,在rpmi培养基中制备10mmβ-巯基乙醇的工作液,混合,转移2.5ml到培养基的瓶子中,
-在培养基中加入50mlfbs(10%),然后加入5mlpen/strep。
三维体外肺泡模型的制备:
在这个实施例中,不同步骤的时间表如下:
1.第-2天
分化巨噬细胞(过夜):
用pma(佛波醇-12-肉豆蔻酸酯-13-乙酸酯)或1,25-二羟基维生素d3(80μlpma+40ml培养基+1600万细胞/瓶t125)分化thp-1细胞过夜,然后保存在烧瓶中1-5天,培养基过夜更新。
2.第0天:插入物接种
ea.hy926细胞的制备:
-向每插入物中加入11万至54万个细胞(0.24105至0.6105细胞/cm2,优选0.24105细胞/cm2),
-在这里插入物中接种所需的体积为700μl,
-首先为所有插入物准备细胞悬液(+2额外插入物用于移液错误),混合以使细胞悬液良好均质化,
-正确地把插入物放入板的孔内,
-将板放回,轻轻的把700μlea.hy926放在插入物下,
-然后将板放入培养箱中。
至少4小时后:
a549细胞的制备:
-在这里插入物中接种所需的体积为2ml,
-a549细胞团块被重新悬浮在ea.hy926培养基中:向每插入物中加入27万至54万个细胞(0.12105至1.2105细胞/cm2,优选0.6105细胞/cm2),
-首先为所有插入物准备a549细胞的细胞悬浮液(加入ea.hy926培养基中,算上用于移液错误的2个额外插入物)。将细胞悬液混合/良好均质化。
用接种用插入物制备板,在插入物上接种细胞时,不时将细胞悬液均质化,避免细胞在试管中沉降):
-将板放回,向孔中加入1.5mlea.hy926培养基,
-在显微镜下检查内皮细胞层,
-在插入物中加入2ml的a549细胞。
3.第3天:
更换插入物的板的培养基:
-去除插入物的旧培养基,加入2ml共培养10%培养基,
-去除孔的旧培养基,加入2ml共培养10%培养基,
4.第4天:
在6孔板中制备dc-thp-1:
-在本例中,制备100万个dc-thp-1细胞/ml的细胞悬液(从每毫升10万个细胞到每毫升100万个细胞)。
-取一个新板,在新板的6孔中加入dc-thp-1细胞悬液1ml(即足以恢复ea.hy926细胞的体积),并将插入物从旧板移至新板。
分化的thp-1细胞(mφ-thp-1):
-用pbs洗涤细胞,
-在已分化的thp-1细胞上添加细胞消化液以分离细胞,将烧瓶放入培养箱中15分钟,
-以300g离心5分钟,弃上清,
-将团块溶解在共培养1%中,
-计数细胞,在本例中在700μl共培养1%培养基中向插入物中加入每插入物27万至54万个mφ-thp-1细胞(0.12105至1.2105细胞/cm2,优选0.6105细胞/cm2)。
至少4小时后:从插入物中丢弃培养基,转换到ali隔夜孵化。
在上述方案制备的本发明的三维模型上,将插入物暴露于待测试的可吸入物(颗粒或分子)可在10至12小时(细胞产生表面活性物质所需的时间)后用如图1所示的体外肺模型进行。
5.第5天:
插入物暴露的实施例是在
暴露后,插入物被移回其平板,孵化后(通常24h或48h,视测试的化合物而定),可以进行以下测定。
6.第5、6或7天:测定
根据预期的时间和终点,暴露0到48小时后可以执行生物学终点。
可能要测定的生物学终点为例如:细胞活力或细胞毒性、细胞因子分泌、dc迁移、dc活化、巨噬细胞吞噬、ec活化、巨噬细胞吞噬、免疫细胞化学染色或免疫荧光染色,或rna提取。这个列表并非限制性的。
7.第5天:dc分离和与t细胞共培养的实施例
dc分离使用:
-通过使用不同的t细胞活化所需的标志物,如mhcii、cd86、cd54(恢复活化的thp-1细胞)和cd11a(从ea.hy926细胞中分离细胞),使用流式细胞仪(如bd流式细胞仪aria)对细胞进行分类。为了有足够的细胞与t细胞共培养,可能有必要汇集不同的孔。
-具有不同表面标志物如mhcii、cd86、cd54和cd11a的阳性或阴性分离的磁珠(如免疫磁珠)。
活化dc与t细胞的共培养:
-t细胞应呈现表面标志物,允许细胞活化(tcr和cd4)、存活(cd28结合b7.1或cd80和b7.2或cd86)和分化,
-培养基中共培养细胞:
○与1%fbs共培养(用于四培养物-dc的暴露)
○或含10%fbs的rpmi1640(用于thp-1和t细胞系)
○必须考虑添加几种化合物(如t细胞分化所需的细胞因子……)来模拟继发性淋巴器官的复杂组织环境。
-细胞比率:已经测试了几种细胞比率,因为只有少数初始t细胞能够识别任何给定的表位(106分之一)。dc应该与许多t细胞相互作用,希望能被识别表面抗原的t细胞发现:
○1万dc用于10万t细胞(1/10)
○1万dc用于100万t细胞(1/100)
○1万dc用于1000万t细胞(1/1000)
-根据所选择的t细胞系,应根据atcc/供应商传代培养建议,通过添加新鲜培养基(每2或3天20%至30%体积)更换或补充培养基。
终点测定:
细胞因子分泌(il-4、il-5、il-13)和表面标志物表达应每24小时测定一次,共培养24小时(1天)至120小时(5天)。如果化合物是呼吸道致敏物,t细胞应该呈现辅助性2型(th2)特征。
实施例2:
根据实施例1制备的插入物使用
暴露于hdm(屋尘螨):
屋尘螨是一种非常常见的过敏原,与哮喘和过敏性鼻炎有关。由于没有发现体外暴露的数据,因此本发明肺模型中细胞暴露的浓度是在体内研究的基础上确定的。在体内,小鼠通常鼻内暴露于1μgderp1(hdm的主要蛋白过敏原)。已知小鼠肺泡表面为82.2cm2,计算浓度0.01μg/cm2暴露于插入物(45μg/插入物)。
暴露于化学物质:
插入物暴露在一系列浓度的化学呼吸道刺激物和致敏物中,以便首先使用alamarblue测定法确定组织的活力。刃天青是alamarblue测定法的活性成分,是一种细胞渗透的蓝色非荧光化合物。进入细胞后,刃天青被还原为粉红色的高荧光试卤灵。活细胞持续地将刃天青转化为试卤灵。荧光与细胞活力成正比。
通过vitrocellcloud暴露于化合物24h和48h后,细胞以在共培养1%培养基中稀释的400μmalamarblue孵育1小时。
一旦确定每种化合物的细胞活力,就选择大约75%活力的浓度来测定thp-1dc上细胞表面标志物的表达。
四培养物肺模型暴露于两种已知的化学呼吸道致敏物:邻苯二甲酸酐(pa)或偏苯三酸酐(tma)和两种已知的呼吸道刺激物:丙烯醛(acr)、水杨酸甲酯(mesa)或十二烷基硫酸钠(sds)的几种浓度下。
流式细胞仪测定:
暴露于vitrocellcloud24h和48h后,将thp-1dc在孔内培养基中恢复。以300g离心5分钟后,将细胞用pbs洗涤,并用在下面的表1中列出的抗体(按照制造商的建议稀释)和相应的同种型对照进行染色,以确定该抗体的非特异性结合,并确保所观察到的染色是由于特异性结合而非人为现象。
表1:致敏作用
关于毒性:
采用sytox蓝,激发波长为444nm,发射波长为480nm。
以相对荧光强度(rfi)作为ox40l、il7ra、cd40、cd86和cd54表达的指标,通过下列公式i进行计算:
图2a至2e分别显示了暴露于hdm24h后,在四培养物肺模型中thp-1细胞的细胞表面上的细胞表面标志物cd86、cd40、il7ra、cd54和ox40l的表达。通过流式细胞术测定活细胞上细胞表面标志物的表达。
观察到与对照组相比,暴露于hdm24h后,所有标志物均上调。因此,四培养物肺模型中thp-1细胞的细胞表面上的标志物il7ra、ox40l、cd86、cd40和cd54可用于测定化合物的呼吸道致敏潜力。
图3a和图3b的图显示了暴露于不同浓度的化学呼吸道致敏物(分别为偏苯三酸酐(tma)和邻苯二甲酸酐(pa))24h和48h后的活力。
观察肺泡组织模型的细胞活力的剂量反应。
图4a、图4b和图4c的图显示了暴露于不同浓度的化学呼吸道刺激物(分别为十二烷基硫酸钠(sds)、丙烯醛(acr)、水杨酸甲酯(mesa))24h和48h后的活力。
还观察了肺泡组织模型的细胞活力的剂量反应。
实施例3:
将屋尘螨(hdm)、蛋白betv1(另一种已知的蛋白致敏物)和丙烯醛(acr)在无菌水中稀释。将邻苯二甲酸酐(pa)、偏苯三酸酐(tma)和水杨酸甲酯(mesa)在dmso中稀释。
根据上述实施例2中详述的方案,在暴露后24h和48h使用alamarblue测定法评估活力。
使用实施例2中呈现的图来确定相比于载体对照,导致25%细胞毒性(意指75%活力:cv75)的浓度。
为了测定细胞表面标志物的表达和不同细胞因子的释放,将根据上述实施例1制备的插入物的细胞暴露于cv75,或者当不可能达到75%的活力时,将细胞暴露于化合物溶解度的最大值。
betv1暴露:
由于没有发现体外暴露的数据,因此本发明肺模型中细胞暴露的浓度是在体内研究的基础上确定的。在体内,小鼠被暴露于2μg的betv1(重要花粉蛋白过敏原)。已知小鼠肺泡表面为82.2cm2,计算浓度为0.024μg/cm2。
在24h和48h后,使用流式细胞仪根据上述实施例2中详述的方案对thp-1细胞进行恢复、染色和分析。回收上清液进行细胞因子测量。
暴露于hdm和betv1后没有观察到对活力的影响。
与24h的100.7%+/-1.2%和48h的89.5%+/-4.2%的对照相比,暴露于betv1导致活力。与24h的100.0%+/-0.03%和48h的95.7%+/-0.03%的对照相比,暴露于hdm导致活力。
同时,将thp-1细胞暴露于单一培养的浸没条件中,以重现使用h-clat(人细胞系激活试验)测定法获得的数据。h-clat测定法基于化学物质激活树突状细胞的特性,这种特性对皮肤和呼吸道致敏物都很常见。h-clat是在欧洲水平下验证(ecvam验证)的体外模型。
出于比较目的,cd86和cd54细胞表面标志物的表达也在h-clat中进行评价。目前推荐使用h-clat来评估化学物质的皮肤致敏潜力。由于皮肤和肺具有相同的dc活化特性,因此认为h-clat也可被用于评估化学物质的呼吸道致敏潜力。需要提醒的是,目前市场上还没有经过验证的模型来评估呼吸道致敏。
由于使用不同的抗体、荧光物和设备来测定cds表达,文献中获得的关于h-clat的阈值水平无法与本实施例中所测得的阈值水平进行比较。
然而,图5显示了在四培养物(a)和单一培养物(b)中thp-1细胞上的cd54表达。暴露于化学呼吸道刺激物(pa和tma)后观察到表达增加,而在载体对照(水和dmso)和化学刺激物(丙烯醛)中未见增加(图5a)。与此相反,在图5b中,暴露于呼吸道致敏物后,单一培养物中没有观察到表达增加,暴露于将刺激性化学物质丙烯醛误分类为致敏物的刺激物后,测量到cd54表达增加。
图6显示了在四培养物(a)和单一培养物(b)中thp-1细胞上的cd86表达。暴露于化学呼吸道刺激物(pa和tma)后观察到表达增加,而在载体对照(水和dmso)和化学刺激物(丙烯醛)中未见增加(图6a)。与此相反,暴露于呼吸道致敏物后,单一培养物中没有观察到表达增加,tma暴露后cd86的表达甚至低于载体对照(图6b)。
根据本发明的三维体外肺泡肺模型(四培养物)显示出对化学呼吸道致敏物和刺激物识别的改进。为了增强系统的识别性能,使用了额外的标志物,并将呼吸道蛋白致敏物添加到测试的化合物组中。
图7显示了暴露于致敏物和刺激物24h后,四培养物中thp-1细胞上的il7ra的细胞表面标志物表达。丙烯醛暴露后il7ra表达的降低可作为刺激物和致敏物(无论其类型,化学物质或蛋白质)之间的识别标志。
图8显示了暴露于致敏物和刺激物24h后,四培养物中thp-1细胞上的ox40l的细胞表面标志物表达。蛋白致敏物暴露后ox40l表达的增加可作为蛋白致敏物和化学刺激物/致敏物之间的识别标志。
图9显示了暴露于致敏物和刺激物24h后,四培养物中thp-1细胞上的tslpr的细胞表面标志物表达。化学致敏物暴露后tslpr表达的增加可作为化学致敏物和化学刺激物/蛋白致敏物之间的识别标志。
在丙烯醛和化学呼吸道致敏物pa和tma的暴露后,对系统的其他参数进行了评价。
下列表2给出了测定的所有细胞因子获得的结果总结,其中,
表2
这些结果也在图10中说明,其给出了相对于载体对照的il-7(图10a)和gm-csf(图10b)浓度的更多见解。mcp-1、mip-3a、il-6rantes、gm-csf和il-10释放的增加可作为呼吸道致敏物的标志。随il-7细胞因子释放的增加一起,mcp-1、mip-3a、il-6、gm-csf和il-10释放的降低可作为呼吸道刺激物的标志。
最后,如图11所示,必须注意的是,由于tma和pa的低溶解度,在浸没条件下单一培养物中不可能达到thp-1细胞的任何细胞毒性(图11a和11b),而在暴露于这些化合物后,在四培养物系统中观察到活力降低(图3a和3b)。
虽然本文仅说明和描述了本发明的某些特征,但本领域技术人员现在将会想到许多修改、替换、改变或等同物。因此,应理解,本申请旨在涵盖落入本发明的真正精神内的所有这些修改和变化。
- 还没有人留言评论。精彩留言会获得点赞!