唾液酸甲酯甲苷衍生物及其合成方法和应用与流程
本发明涉及唾液酸甲酯甲苷衍生物,本发明进一步涉及上述衍生物的合成方法以及它们在预防或治疗神经系统疾病中的应用,属于唾液酸甲酯甲苷衍生物及其合成方法和应用领域。
背景技术
由氧化应激和自由基损伤造成的神经细胞的损伤或死亡是许多神经系统疾病(如神经退行性疾病、缺血性中风等)的共同病理过程(neurologia,17(2002)399-401.)。神经退行性疾病的特点是神经元的结构和功能逐渐丧失,包括神经元死亡等(adv.neurol.,69(1996)153-159.)。许多退行性疾病包括帕金森(pd)、阿尔茨海默病(ad)、亨廷顿(hd)等通过这种方式发病。脑缺血是导致神经损伤另一种方式。缺血引起脑低氧,进而经过复杂、渐进、致命的氧化应激和自由基损伤导致脑组织的死亡(biophys.acta,1802(2010)80-91.)。由于这些神经性疾病的病理过程还没有被很好地了解,因此,这些疾病目前并不能根治。现存的药物大多是老药新用,它们只能同过缓解神经损伤的症状。而治疗这种疾病最常见的治疗策略就是使用抗氧化剂和自由基清除剂。
在过去的一些年中,本发明人课题组和其它课题组均发现,苯乙醇苷(phenylethanoidglycosides(pgs))这种新的化学实体具有神经保护活性,如acteoside(lifesci.,79(2006)709-716.),echinacoside(eur.j.pharmacol.,564(2007)66-74;j.ethnopharmacol.,97(2005)59-63.),andcalceolariosidea(biochem.pharmacol.,51(1996)687-691;plantamed.,66(2000)746-748.)等。苯乙醇苷存在于双子叶植物中,是一类含有(羟基、甲氧基)取代苯乙基和(羟基、甲氧基)取代肉桂酞基,通常以中心葡萄糖为母核的含有酯键及氧苷键的天然糖苷(curr.med.chem.,15(2008)2592-2613.)。苯乙醇苷类化合物具有广泛的神经退行性疾病和缺血性中风相关的药理活性,也具有良好的抗氧化和自由基清除活性(plantamed.,68(2002)966-970.)。这些性质使得苯乙醇苷有希望作为新的抗神经损伤候选药物。
尽管如此,有关苯乙醇苷类化合物仍有以下几方面的问题亟待解决:首先,苯乙醇苷类化合物虽然广泛分布于植物界,但因含量较低(0.02%~0.40%),通过艰难的分离提取得到的样品量极少,无法满足生物学研究的需要;其次,由于苯乙醇苷类结构复杂,其合成研究也非常困难。此外,苯乙醇苷良好的亲水性导致膜通透较差,影响其成药性。因此,研究苯乙醇苷类化合物的合成并对其进行结构改造增强其抗氧化、清除自由基、抗凋亡等神经保护活性以及成药性,对于苯乙醇苷类化合物在临床治疗神经系统疾病的应用具有重要的意义。
技术实现要素:
本发明的目的之一是提供一类具有神经保护活性的苯乙醇苷衍生物、唾液酸甲苷甲酯衍生物以及9-脱羧迷迭香酸类化合物;
本发明的目的之二是提供一种合成上述苯乙醇苷衍生物、唾液酸甲苷甲酯衍生物以及9-脱羧迷迭香酸类化合物的方法;
本发明的目的之三是将所述的苯乙醇苷衍生物、唾液酸甲苷甲酯衍生物以及9-脱羧迷迭香酸类化合物应用于预防或治疗神经系统疾病。
本发明的上述目的是通过以下技术方案来实现的:
一种苯乙醇苷衍生物,其为式(i)或式(ii)所示的化合物:
式中:r1选自芳香羧酸中的任何一种;优选的,r1为3,4-二羟基肉桂酰基,3-羟基-4-甲氧基肉桂酰基,4-氯肉桂酰基,3,4-二氟基肉桂酰基,3,4-二甲氧基肉桂酰基,肉桂酰基,4-羟基肉桂酰基或3,4-二羟基苯乙酰。
本发明还提供了一种唾液酸甲酯甲苷衍生物,其为式(ⅲ)所示的化合物:
其中,r1选自芳香羧酸中的任何一种;优选的,r1为3,4-二羟基肉桂酰基。
本发明进一步提供了一种9-脱羧迷迭香酸类似物,其为式(iv)所示的化合物:
其中,r1选自芳香羧酸中的任何一种;优选的,r1为3,4-二羟基肉桂酰基。
本发明提供了一种合成式(i)所述化合物的方法,包括以下步骤:
(1)合成化合物16:(3,4-二烯丙氧基苯基)乙基2,3-二-o-乙酰基-6-o-烯丙氧羰基--d-吡喃葡萄糖苷;
(2)合成下述式(ⅴ)或式(ⅵ)所示的化合物:
其中,r1=r2=oallyl;r1=r2=f;r1=r2=ome或r1=cl,r2=h;
(3)将化合物(3,4-二烯丙氧基苯基)乙基2,3-二-o-乙酰基-6-o-烯丙氧羰基-β-d-吡喃葡萄糖苷与式(ⅴ)或式(ⅵ)所示的化合物进行偶联反应,得到式(ⅷ)或式(ⅸ)所示化合物:
r1=r2=oallyl,r3=ac;r1=r2=f,r3=ac;r1=r2=ome,r3=ac;r1=cl,r2=h,r3=ac;
其中,r=ac;
其中,所述的偶联反应包括:将化合物(3,4-二烯丙氧基苯基)乙基2,3-二-o-乙酰基-6-o-烯丙氧羰基-β-d-吡喃葡萄糖苷与式(ⅴ)或式(ⅵ)所示的化合物溶于二氯甲烷中,在dcc和dmap存在的条件下进行反应;
(4)将步骤(3)中式(ⅷ)或式(ⅸ)所示反应产物溶于混合溶剂(二氯甲烷:甲醇=1:1)中,在乙酰氯存在条件下反应,得到式(ⅹ)或式(ⅺ)所示反应产物;
其中,r1=r2=oallyl,r3=h;r1=r2=f,r3=h;r1=r2=ome,r3=h;r1=cl,r2=h,r3=h;
其中,r=h;
(5)将步骤(4)中式(ⅹ)或式(ⅺ)所示的反应产物溶于混合溶剂(二氯甲烷:甲醇=20:1)中,在pd/c和甲苯磺酸或hclo4存在的条件下反应,得到式(i)所示的化合物。
其中,(3,4-二烯丙氧基苯基)乙基2,3-二-o-乙酰基-6-o-烯丙氧羰基-β-d-吡喃葡萄糖苷(化合物16)的合成可参考下述方法制备得到:
(1)将化合物13和3,4-二烯丙氧基苯乙醇(化合物9a)缩合得到(3,4-二烯丙氧基苯基)乙基2,3-二-o-乙酰基-4,6-o-苯亚甲基-β-d-吡喃葡萄糖苷(化合物14);
(2)将(3,4-二烯丙氧基苯基)乙基2,3-二-o-乙酰基-4,6-o-苯亚甲基-β-d-吡喃葡萄糖苷脱去苄基得到(3,4-二烯丙氧基苯基)乙基2,3-二-o-乙酰基-β-d-吡喃葡萄糖苷(化合物15);
(3)将(3,4-二烯丙氧基苯基)乙基2,3-二-o-乙酰基-β-d-吡喃葡萄糖苷(化合物15)在aocobt、et3n存在下反应得到(3,4-二烯丙氧基苯基)乙基2,3-二-o-乙酰基-6-o-烯丙氧羰基-β-d-吡喃葡萄糖苷。
本发明还提供了一种合成式(ii)所述化合物的方法,包括以下步骤:
(1)合成化合物(3,4-二烯丙氧基苯基)乙基2,3-二-o-乙酰基-β-d-吡喃葡萄糖苷(化合物15):
(2)将化合物(3,4-二烯丙氧基苯基)乙基2,3-二-o-乙酰基-β-d-吡喃葡萄糖苷脱乙酰基,得到式(ii)所述化合物。
其中,化合物(3,4-二烯丙氧基苯基)乙基2,3-二-o-乙酰基-β-d-吡喃葡萄糖苷可参考下述方法制备得到:
(1)将化合物13和3,4-二烯丙氧基苯乙醇缩合得到(3,4-二烯丙氧基苯基)乙基2,3-二-o-乙酰基-4,6-o-苯亚甲基-β-d-吡喃葡萄糖苷(化合物14):
(2)将(3,4-二烯丙氧基苯基)乙基2,3-二-o-乙酰基-4,6-o-苯亚甲基-β-d-吡喃葡萄糖苷脱去苄基得到化合物(3,4-二烯丙氧基苯基)乙基2,3-二-o-乙酰基-β-d-吡喃葡萄糖苷。
本发明又提供了一种式ⅲ所述化合物的方法,包括以下步骤:
将化合物21和3,4-二羟基肉桂酸溶于dmf中在pybop和nmm存在的条件下缩合反应,即得;
本发明进一步提供了一种合成式(iv)所示化合物的方法,包括:
(1)将3,4-二乙酰基肉桂酸和3,4-二乙酰基苯乙醇进行缩合反应,得到9’-脱羧四乙酰基迷迭香酸;
(2)将9’-脱羧四乙酰基迷迭香酸脱乙酰基保护,即得。
优选的,步骤(1)中在下述条件下进行缩合反应:(a)将化合物3,4-二乙酰基肉桂酸(化合物11b)和草酰氯加入到dcm中在室温(20-25℃)下反应;(b)将反应产物浓缩在ar保护下,加入3,4-二乙酰基苯乙醇(化合物9b),dcm和et3n,室温(20-25℃)搅拌反应,即得。
本发明利用生物电子等排体等药物设计原理改造类叶升麻苷,分别以(2r,3r,4s,5s,6r)-2-(3,4-二羟基苯基乙氧基)-6-(羟基甲基)四氢-2氢-吡喃-3,4,5-三醇、(2s,4s,5r,6r)-甲基5-氨基-4-二羟基-2-甲氧基-6-((1r,2r)-1,2,3-三羟基丙基)四羟基-2氢-吡喃-2-羧酸酯,3,4-二羟基苯乙醇为单体与有机酸或有机酰氯连接获得具有神经保护活性的苯乙醇苷衍生物、唾液酸甲苷甲酯衍生物以及9-脱羧迷迭香酸类化合物;神经药理实验研究发现,本发明所提供的上述化合物能够明显增加细胞存活率、降低细胞凋亡率、抑制细胞内活性氧的产生,具有更好的抗氧化,抗凋亡、清除自由基的活性且未发现明显毒副作用。其中,化合物(3,4-二羟基苯乙基)4-o-(3,4-羟基苯乙基)-β-d-吡喃葡萄糖苷(化合物5),9’-脱羧迷迭香酸(化合物6)和2-o-甲基-5-o-(对羟基肉桂酰基)-β-d-唾液酸苷(化合物8)能够通过抗凋亡、抗氧化损伤等途径,以剂量依赖的方式,明显减轻6-ohda对细胞造成的损伤,发挥神经保护作用,且明显优于上市药物依达拉奉(edaravone);本发明所提供的化合物具有抗氧化,抗神经细胞凋亡、清除自由基等神经保护效果,能用于预防和治疗神经退行性疾病、脑缺血等神经性疾病。
由此,本发明还提供一种预防和治疗包括神经退行性疾病、脑缺血等神经性疾病在内的药物组合物,该药物组合物由有效量的苯乙醇苷衍生物、唾液酸甲苷甲酯衍生物或9-脱羧迷迭香酸类化合物与药学上可接受的载体或辅料组成;将有效量的本发明苯乙醇苷衍生物、唾液酸甲苷甲酯衍生物或9-脱羧迷迭香酸类化合物与药学上可接受的载体或辅料组合在一起后可得到抗氧化,抗神经细胞凋亡等神经保护功效的药物组合物。
将本发明的药物组合物中加入制备不同剂型时所需的各种辅料和药学上可接受的赋形剂或载体后,以常规的药物制剂方法将其制备成任何一种临床可接受的适宜制剂,例如,可以是注射制剂(粉针、冻干粉针、水针、输液等)、片剂、口服液、颗粒剂、胶囊剂、软胶囊或滴丸等;其中,所述的辅料可以是抗氧络合剂、填充剂、骨架材料等;所述的药学上可接受的载体是木糖醇、甘露醇、乳糖、果糖、葡聚糖、葡萄糖、聚乙烯吡咯烷酮、低分子右旋糖酐、氯化钠、葡萄糖酸钙或磷酸钙中的一种或几种。
缩略语表
本文公开的本发明使用下列化学命名:
dmfn,n-二甲基甲酰胺
ipa异丙醇
nmm4-甲基吗啉
pybop六氟磷酸苯并三唑-1-基-氧基三吡咯烷基
thf四氢呋喃
nan3叠氮化钠
meoh甲醇
tscl对甲基苯磺酰基氯
pyr吡啶
ch2cl2二氯甲烷
et3n三乙胺
dmap4-二甲氨基吡啶
dcc二环己基碳二亚胺
tscl对甲苯磺酰氯
ppts对甲苯磺酸吡啶盐
allocbt烯丙基苯并三氮唑碳酸酯。
附图说明
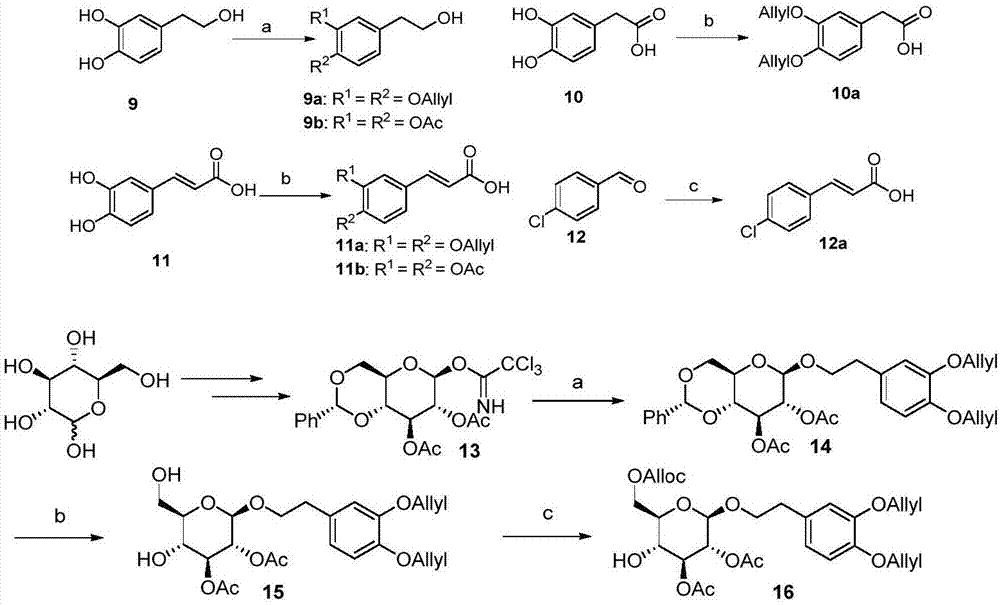
图1本发明化合物10a、12a、14和16的合成路线图。
图2本发明化合物1-8的结构式。
图3本发明化合物1-5的合成路线图。
图4本发明化合物6-8的合成路线图。
图5本发明化合物1-8或维生素c对pc12细胞在h2o2损伤作用下的保护作用.与对照比较,###p<0.001;与模型比较,***p<0.001。
图6本发明化合物1-8对pc12细胞在6-ohda损伤情况下的保护作用.与对照比较,###p<0.001;与模型比较,***p<0.001。
图7annexinv-pi双染法检测本发明化合物5,6和8的神经保护作用。
图8本发明化合物5,6和8对细胞内ros水平的影响实验结果。
具体实施方式
下面结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明技术方案的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
实施例1糖基配体(9a,9b)与肉桂酸衍生物(10a,11a,11b,12a)的合成
试剂和条件:(a)9a:烯丙基溴,k2co3,丙酮,回流过夜,89%;9b:异丙胺,naoh,ac2o,h2o,81%;(b)i)烯丙基溴,k2co3,丙酮,回流过夜;ii)meoh,饱和nahco3溶液,回流2h,88%for10a,80%for11a;11b:dmap,吡啶,ac2o,86%;(c)丙二酸,哌啶,吡啶,回流过夜,70%.
3,4-二烯丙氧基苯乙醇(9a)的合成
向100ml圆底瓶中加入3,4-二羟基苯乙醇(9,0.83g,5.4mmol,1.0equiv),烯丙基溴(2.59g,21.6mmol,4.0equiv),k2co3(3.73g,27mmol,5.0equiv),丙酮(50ml),加热回流12h,tlc监测反应完全,过滤,浓缩,柱层析(乙酸乙酯/石油醚:3/1),得产物1.12g,为无色油状物,收率89%。
1hnmr(400mhz,cdcl3)δ6.84(d,j=8.0hz,1h),6.78-6.73(m,2h),6.12-6.02(m,2h),5.44-5.36(m,2h),5.28-5.24(m,2h),4.62-4.56(m,4h),3.81(t,j=6.5hz,2h),2.78(t,j=6.5hz,2h);13cnmr(100mhz,cdcl3)δ148.6,147.2,133.6,133.5131.5,121.4,117.5,117.4,115.3,114.6,70.1,70.0,63.6,38.6;ms(m/z):计算值c14h18o3:234;found:234[m]+;元素组成:计算值c14h18o3(%):c,71.77;h,7.74;实测值c,71.72;h,7.84.
3,4-二乙酰基苯乙醇(9b)的合成
将0.5g的naoh加入100ml圆底烧瓶中,加入1.5ml水溶解后,一次性加入异丙胺30ml,3,4-二羟基苯乙醇(9,1.0g,6.49mmol,1equiv),乙酸酐1.6ml,室温下搅拌40min。加入150ml乙酸乙酯稀释,用冰水/乙酸乙酯萃取并用乙酸中和。合并有机相,无水硫酸钠干燥,过滤,浓缩,柱层析(乙酸乙酯/石油醚:1/3),得油状物质1.13g收率81%。1hnmr(400mhz,cdcl3)δ7.11(s,2h),7.05(s,1h),3.82(t,j=6.3hz,2h),2.83(t,j=6.3hz,2h),2.28(s,6h),1.76(br,1h);13cnmr(100mhz,cdcl3)δ168.42,168.36,141.9,140.5,137.7,127.2,123.8,123.3,63.2,38.5,20.6;esi-hrms[m+na]+计算值c12h14nao5261.0733,实测值261.0730.
3,4-二烯丙氧基苯乙酸(10a)和3,4-二烯丙氧基肉桂酸(11a)的合成
在250ml的圆底烧瓶中,加入酸化合物10或化合物11(1.0equiv),烯丙基溴(4.0equiv),无水k2co3(5.0equiv)及无水丙酮,搅拌下加热回流12h。滤除不溶物,浓缩。残余物中直接加入饱和的nahco3水溶液及甲醇(1:1),搅拌回流1小时。将反应液冷却至室温,用1mol/l的盐酸调ph值至6。减压过滤得黄色固体。进一步用石油醚和乙酸乙酯的混合溶剂重结晶得到白色固体。
化合物10a由化合物10制备得到,收率为88%。1hnmr(400mhz,cdcl3)δ6.89-6.86(m,2h),6.83(dd,j=1.9hz,8.2hz,1h),6.15-6.05(m,2h),5.47-5.41(m,2h),5.31-5.29(m,2h),4.63-4.62(m,4h),3.60(s,2h);13cnmr(100mhz,cdcl3)δ177.2,148.6,148.0,133.5,133.4,126.2,122.0,117.6,117.5,115.5,114.4,70.1,70.0,40.5;ms(m/z):计算值c14h16o4:248,实测值:248[m]+.元素组成:计算值c14h16o4(%)c,67.73;h,6.50;实测值c,67.51;h,6.75.
化合物11a由化合物11制备得到,收率为80%。1hnmr(400mhz,cdcl3)δ7.70(d,j=15.9hz,1h),7.12-7.10(m,2h),6.88(d,j=8.1hz,1h),6.28(d,j=15.9hz,1h),6.08(m,2h),5.47-5.41(m,2h),5.33-5.29(m,2h),4.66-4.64(m,4h);13cnmr(100mhz,cdcl3)δ172.5,151.1,148.6,146.9,133.0,132.8,127.2,123.1,118.0,117.9,114.9,113.4,112.9,70.0,69.7;esi-hrms[m+h]+计算值c15h17o4261.1121,实测值261.1121.
3,4-二乙酰基肉桂酸(11b)的合成
化合物11(1.0g,5.56mmol,1.0equiv)溶于50ml吡啶溶液中,加入ac2o(2ml),室温搅拌3小时。蒸干溶剂,残留物用硅胶色谱柱分离(乙酸乙酯/石油醚:1/1),得到白色固体1.26克,收率86%。1hnmr(400mhz,cdcl3)δ7.65(d,j=15.9hz,1h),7.36(d,j=8.4hz,1h),7.32(s,1h),7.18(d,j=9.2hz,1h),6.32(d,j=15.9hz,1h),2.24(s,3h),2.23(s,3h);13cnmr(100mhz,cdcl3)δ171.3,168.0,145.0,143.8,142.5,132.9,126.7,124.0,123.0,118.4,20.64,20.59;esi-hrms[m+k]+计算值c13h12ko6303.0842,实测值303.0839.
化合物12a参考文献(eur.j.pharm.sci.,23(2004)363-369.)公开的方法制备制得。
实施例2(3,4-二烯丙氧基苯基)乙基2,3-二-o-乙酰基-6-o-烯丙氧羰基-β-d-吡喃葡萄糖苷(化合物16)的合成
试剂和条件:(a)tmsotf,9a,ch2cl2,
(3,4-二烯丙氧基苯基)乙基2,3-二-o-乙酰基-4,6-o-苯亚甲基-β-d-吡喃葡萄糖苷(化合物14)的合成
250ml两口瓶中加入
[α]d25-17.1(c0.0203,cdcl3);1hnmr(400mhz,cdcl3)δ7.44-7.41(m,2h),7.35-7.34(m,3h),6.81(d,j=8.1hz,1h),6.74(d,j=1.6hz,1h),6.71(dd,j=1.6hz,8.1hz.1h),6.13-6.01(m,2h),5.48(s,1h),5.44-5.36(m,2h),5.31-5.23(m,3h),4.99(t,j=9.1hz,7.9hz,1h),4.60-4.56(m,5h),4.35(dd,j=4.9hz,10.5hz,1h),4.07(dt,j=6.5hz,9.4hz,1h),3.77(t,j=10.3hz,1h),3.71-3.62(m,2h),3.51(dt,j=4.8hz,9.8hz,1h),2.80(t,j=6.4hz,2h),2.03(s,3h),1.82(s,3h);13cnmr(100mhz,cdcl3)δ170.1,169.5,148.4,147.1,145.6,136.8,133.6,133.5,131.0,129.3,128.2,126.1,124.7,121.3,117.43,117.37,115.3,114.4,101.5,101.3,78.3,72.1,71.7,70.9,70.1,69.9,68.5,66.3,35.5,20.7,20.5;esi-hrms[m+h]+计算值c31h37o10569.2381,实测值569.2381.
(3,4-二烯丙氧基苯基)乙基2,3-二-o-乙酰基-β-d-吡喃葡萄糖苷(化合物15)
在250ml圆底烧瓶中加入化合物14(1.00g,1.76mmol,1.0equiv),乙腈90ml和水10ml,以及ppts(840mg,3.35mmol,2.0equiv),加热搅拌回流12小时,tlc监测反应完全后,nahco3洗,h2o洗,na2so4干燥,过滤,浓缩,残留物经柱层析(石油醚:乙酸乙酯=1:1),得到油状物质770mg,收率99%。[α]d25-12.8(c0.027,cdcl3);1hnmr(400mhz,cdcl3)δ6.80(d,j=8.1hz,1h),6.73(d,j=1.8hz,1h),6.70(d,j=1.8hz,8.1hz,1h),6.13-6.01(m,2h),5.44-5.36(m,2h),5.28-5.23(m,2h),4.99(dd,j=9.5hz,9.2hz,1h),4.91(dd,j=7.8hz,9.7hz,1h),4.61-4.56(m,4h),4.49(d,j=7.8hz,1h),4.06(dt,j=6.5hz,9.5hz,1h),3.92(dd,j=3.4hz,11.9hz,1h),3.82(dd,j=4.9hz,12.0hz,1h),3.75(t,j=9.2hz,1h),3.64(dt,j=7.3hz,9.4hz,1h),3.43-3.39(m,1h),2.79(t,j=6.8hz,2h),2.08(s,3h),1.91(s,3h);13cnmr(100mhz,cdcl3)δ171.8,169.5,148.5,147.2,133.7,133.6,131.5,121.4,117.5,117.4,115.5,114.5,100.8,76.2,75.5,71.1,70.8,70.2,70.0,69.6,62.2,35.6,20.8,20.6;esi-hrms[m+na]+计算值c24h32nao10503.1888,实测值503.1890.
(3,4-二烯丙氧基苯基)乙基2,3-二-o-乙酰基-6-o-烯丙氧羰基-β-d-吡喃葡萄糖苷(化合物16)
将化合物15(100mg,0.208mmol,1.0equiv),aocobt(54mg,0.250mmol,1.2equiv),10ml干燥dcm加入25ml烧瓶中,搅拌下加入et3n(140ul,1mmol)tlc监测8h反应完全,加入乙酸中和后旋干,柱层析(石油醚:乙酸乙酯=2:1)得到化合物114mg收率92%。[α]d25-27.1(c0.008,cdcl3);1hnmr(400mhz,cdcl3)δ6.80(d,j=8.1hz,1h),6.73(d,j=1.8hz,1h),6.70(d,j=1.8hz,8.1hz,1h),6.13-6.01(m,2h),5.97-5.87(m,1h),5.45-5.34(m,3h),5.29-5.23(m,3h),4.99(d,j=8.7hz,1h),4.92(d,j=7.8hz,9.6hz,1h),4.64-4.62(m,2h),4.60-4.55(m,4h),4.47-4.44(m,3h),4.06(dt,j=6.5hz,9.5hz,1h),3.68-3.58(m,2h),3.56-3.52(m,1h),2.90(d,j=3.1hz,1h),2.79(d,j=6.9hz,2h),2.08(s,3h),1.91(s,3h);13cnmr(100mhz,cdcl3)δ171.6,169.4,155.3,148.4,147.1,133.7,133.6,131.6,131.3,121.4,119.2,117.5,117.4,115.4,114.5,100.7,75.8,74.0,71.0,70.7,70.2,70.0,69.1,68.9,66.3,35.5,20.8,20.6;esi-hrms[m+na]+计算值c28h36nao12587.2103,实测值587.2104.
实施例3化合物1-5的合成
试剂和条件:(a)dcc,dmap,ch2cl2,0℃tor.t.;(b)accl,meoh,ch2cl2;(c)10%pd/c,meoh,h2o,hclo4或tsoh.
化合物18a-e的通用合成方法
将化合物16(1.0equiv)和相应的酸(1.5equiv)加入溶于二氯甲烷中,0℃下加入dcc(1.5equiv),dmap(1.5equiv),然后室温下搅拌12小时。蒸干溶剂,残留物经柱层析(石油醚:乙酸乙酯=1:4至1:3),得到相应的产物。
(3,4-二烯丙氧基苯基)乙基2,3-二-o-乙酰基-4-o-(3,4-二烯丙氧基苯基)烯丙酰基-6-o-烯丙氧羰基-β-d-吡喃葡萄糖苷(化合物18a)的合成
按照通用的方法,化合物16和9a偶联得到无色油状化合物18a,收率为85%。[α]d25-9.8(c0.008,cdcl3);1hnmr(400mhz,cdcl3)δ7.59(d,j=15.9hz,1h),7.08-7.05(m,2h),6.87(d,j=8.1hz,1h),6.80(d,j=8.1hz,1h),6.75(d,j=1.8hz,1h),6.71(dd,j=1.8hz,8.1hz,1h),6.18(d,j=15.9hz,1h),6.13-6.01(m,4h),5.94-5.84(m,1h),5.46-5.21(m,11h),5.15(t,j=9.6hz,1h),5.01(dd,j=8.0hz,9.6hz,1h),4.65-4.56(m,10h),4.52(d,j=7.9hz,1h),4.22-4.26(m,2h),4.08(dt,j=6.4hz,9,4hz,1h),3.81-3.77(m,1h),3.65(dt,j=6.4hz,9,4hz,1h),2.80(t,j=6.8hz,2h),1.96(s,3h),1.91(s,3h);13cnmr(100mhz,cdcl3)δ170.2,169.3,165.6,154.6,151.1,148.7,148.5,147.2,146.6,133.7,133.6,133.0,132.8,131.6,131.4,127.1,123.2,121.4,119.0,118.0,117.9,117.4,117.3,115.5,114.6,113.9,113.5,112.9,100.7,72.6,72.1,71.3,70.7,70.2,70.03,70.00,69.7,68.7,66.2,35.6,20.6,20.5;esi-hrms[m+na]+计算值c43h50nao15829.3042,实测值829.3052.
(3,4-二烯丙氧基苯乙基)2,3-o-乙酰基-4-o-(3,4-二氟肉桂酰基)-6-o-烯丙氧羰基-β-d-吡喃葡萄糖苷(化合物18b)的合成
按照通用的方法,化合物16和17a(从百灵威公司购得)偶联得到无色油状化合物18b,收率为86%。[α]d25-16.5(c0.018,cdcl3);1hnmr(400mhz,cdcl3)δ7.58(d,j=15.9hz,1h),7.36-7.31(m,1h),7.25-7.15(m,2h),6.81(d,j=8.2hz,1h),6.75(d,j=1.9hz,1h),6.71(dd,j=1.9hz,8.3hz,1h),6.27(d,j=15.9hz,1h),6.13-6.01(m,2h),5.94-5.84(m,1h),5.45-5.22(m,7h),5.15(t,j=9.6hz,1h),5.02(dd,j=8.0hz,9.6hz,1h),4.64-4.55(m,6h),4.53(d,j=7.9hz,1h),4.31-4.24(m,2h),4.09(dt,j=6.4hz,9.5hz,1h),3.82-3.77(m,1h),3.65(dt,j=6.4hz,9.5hz,1h),2.81(t,j=6.8hz,2h),1.97(s,3h),1.92(s,3h);13cnmr(100mhz,cdcl3)δ170.2,169.2,164.8,154.6,148.5,147.1,144.2,133.7,133.6,131.6,131.3,125.1,121.4,119.0,118.0,117.8,117.5,117.4,116.7,116.5,115.4,114.6,100.7,72.5,71.9,71.2,70.8,70.2,70.0,69.1,68.7,66.0,35.5,20.55,20.48;esi-hrms[m+na]+计算值c37h40nao13f2753.2329,实测值753.2337.
(3,4-二烯丙氧基苯基)乙基2,3-二-o-乙酰基-4-o-(3,4-二甲氧基肉桂酰基)-6-o-烯丙氧羰基-β-d-吡喃葡萄糖苷(化合物18c)的合成
按照通用的方法,化合物16和17b(从百灵威公司购得)偶联得到无色油状化合物18c,收率为98%。[α]d25-9.3(c0.013,cdcl3);1hnmr(400mhz,cdcl3)δ7.63(d,j=15.9hz,1h),7.11-7.03(m,2h),6.86(d,j=8.3hz,1h),6.81(d,j=8.2hz,1h),6.74-6.70(m,2h),6.22(d,j=15.9hz,1h),6.13-6.02(m,2h),5.94-5.85(m,1h),5.45-5.21(m,7h),5.15(t,j=9.6hz,1h),5.02(dd,j=8.1hz,9.5hz,1h),4.60-4.52(m,7h),4.28-4.27(m,2h),4.09(dt,j=6.3hz,9.4hz,1h),3.91(s,6h),3.82-3.77(m,1h),3.65(dt,j=7.4hz,9.4hz,1h),2.81(t,j=6.8hz,2h),1.97(s,3h),1.89(s,3h);13cnmr(100mhz,cdcl3)δ170.2,169.2,165.6,154.6,151.6,149.3,148.5,147.1,146.7,133.7,133.6,131.6,131.3,126.9,123.2,121.4,119.0,117.4,117.3,115.4,114.6,113.8,111.0,109.7,100.7,72.7,72.6,72.1,71.3,70.7,70.2,69.9,68.7,66.2,56.0,55.9,35.5,20.620.5;esi-hrms[m+na]+计算值c39h46nao15777.2729,实测值777.2764.
(3,4-二烯丙氧基苯基)乙基2,3-二-o-乙酰基-4-o-对氯肉桂酰基-6-o-烯丙氧羰基-β-d-吡喃葡萄糖苷(化合物18d)的合成
按照通用的方法,化合物16和12a偶联得到无色油状化合物18d,收率为87%。[α]d25-22.6(c0.019,cdcl3);1hnmr(400mhz,cdcl3)δ7.62(d,j=15.9hz,1h),7.44(d,j=8.5hz,2h),7.36(d,j=8.5hz,2h),6.81(d,j=8.4hz,1h),6.74(d,j=1.9hz,1h),6.71(d,j=1.9hz,8.2hz,1h),6.33(d,j=15.9hz,1h),6.12-6.02(m,2h),5.94-5.84(m,1h),5.45-5.36(m,2h),5.34-5.21(m,5h),5.15(t,j=9.6hz,1h),5.01(dd,j=8.0hz,9.6hz,1h),4.62-4.55(m,6h),4.53(d,j=7.9hz,1h),4.27-4.25(m,2h),4.08(dt,j=6.4hz,9.5hz,1h),3.80(m,1h),3.65(ddd,j=7.3hz,7.5hz,9.5hz,1h),2.80(d,j=6.8hz,2h),1.96(s,3h),1.91(s,3h);13cnmr(100mhz,cdcl3)δ170.2,169.3,165.1,154.6,147.1,145.2,136.8,133.7,133.6,132.4,131.5,131.3,129.5,129.2,121.4,119.0,117.5,117.45,117.4,116.8,115.3,114.5,100.7,72.5,71.9,71.2,70.8,70.2,69.9,69.0,68.8,66.1,35.5,20.6,20.5;esi-hrms[m+nh4]+计算值c37h45no13cl746.2574,实测值746.2564.
(3,4-二烯丙氧基苯基)乙基2,3-二-o-乙酰基-4-o-(3,4-烯丙氧基苯基)乙酰基-6-o-烯丙氧羰基-β-d-吡喃葡萄糖苷(化合物18e)的合成
按照通用的方法,化合物16和10a偶联得到无色油状化合物18e,收率为95%。[α]d25-10.3(c0.016,cdcl3);1hnmr(400mhz,cdcl3)δ6.85-6.68(m,6h),6.12-6.00(m,4h),5.95-5.86(m,1h),5.46-5.32(m,5h),5.29-5.22(m,5h),5.18(t,j=9.5hz,1h),5.00(dd,j=9.6hz,9.8hz,1h),4.93(dd,j=9.0hz,9.7hz,1h),4.62-4.55(m,10h),4.47(d,j=8.0hz,1h),4.21-4.10(m,2h),4.05(dt,j=6.5hz,9.5hz,1h),3.71-3.66(m,1h),3.62(dt,j=9.5hz,6.5hz,1h),3.48(dd,j=14.6hz,2.6hz,2h),2.78(t,j=6.8hz,2h),1.88(s,3h),1.75(s,3h);13cnmr(100mhz,cdcl3)δ170.3,170.0,169.1,154.5,148.6,148.4,147.9,147.1.133.7,133.6,133.4,133.3,131.5,131.3,126.0,121.8,119.0,117.5,117.46,117.37,117.3,115.4,115.2,114.6,114.4,100.6,72.3,71.7,71.2,70.7,70.1,70.0,69.93,69.87,68.9,68.7,65.8,40.5,35.5,20.4,20.3;esi-hrms[m+nh4]+计算值c42h54no15812.3488,实测值812.3465.
化合物19a-e的通用合成方法
将化合物18a-e溶于混合溶剂(二氯甲烷:甲醇=1:1)中,加入乙酰氯,常温搅拌12小时。tlc监测反应完全,加入少量饱和nahco3溶液中和,浓缩,残留物经柱层析分离,得到相应的产物。
3,4-二烯丙氧基苯基)乙基4-o-(3,4-二烯丙氧基肉桂酰基)-6-o-烯丙氧羰基-β-d-吡喃葡萄糖苷(化合物19a)的合成
按照通用方法,化合物18a经脱乙酰基得到(洗脱剂为石油醚:乙酸乙酯=2:1)白色固体19d,收率为91%。[α]d25-3.2(c0.018,cdcl3);1hnmr(400mhz,cdcl3)δ7.67-7.63(d,j=15.9hz,1h),7.07-7.06(m,2h),6.87-6.73(m,4h),6.26(d,j=15.9hz,1h),6.12-6.01(m,4h),5.91-5.83(m,1h),5.44-5.20(m,10h),4.96(t,j=9.6hz,1h),4.64-4.56(m,10h),4.33-4.27(m,3h),4.10(dt,j=6.9hz,9.3hz,1h),3.76-3.69(m,3h),3.49(dd,j=8.3hz,8.7hz,1h),2.94(br,1h),2.87(t,j=7.5hz,2h),2.60(br,1h);13cnmr(125mhz,cdcl3):δ166.8,154.7,151.0,148.51,148.48,147.1,146.6,133.6,133.5,133.0,132.8,131.3,131.2,127.1,123.1,121.3,119.1,118.0,117.9,117.5,117.4,115.1,114.4,114.2,113.3,112.7,102.4,74.6,74.0,72.1,70.9,70.1,70.0,69.9,69.7,68.7,66.5,35.6;esi-hrms[m+h]+计算值c39h47o13723.3011,实测值723.2986.
(3,4-二烯丙氧基苯乙基)4-o-(3,4-二氟肉桂酰基)-6-o-烯丙氧羰基-β-d-吡喃葡萄糖苷(化合物19b)的合成
按照通用方法,经18b脱乙酰基得到(洗脱剂为石油醚:乙酸乙酯=3:1)白色固体19b,收率为98%。[α]d25-4.8(c0.002,cdcl3);1hnmr(400mhz,cdcl3)δ7.63(d,j=15.9hz,1h),7.37-7.32(m,1h),7.28-7.24(m,1h),7.24-7.15(m,1h),6.82(d,j=8.1hz,1h),6.78-6.73(m,2h),6.36(d,j=15.9hz,1h),6.13-6.02(m,2h),5.93-5.83(m,1h),5.44-5.21(m,6h),4.99(t,j=9.7hz,1h),4.60-4.57(m,6h),4.32(d,j=7.8hz,1h),4.28-4.26(m,2h),4.12(dt,j=7.1hz,9.6hz,1h),3.77-3.68(m,3h),3.48(dt,j=2.2hz,8.5hz,1h),2.87(t,j=7.6hz,2h),2.76(d,j=3.5hz,1h),2.49(d,j=2.2hz,1h);13cnmr(100mhz,cdcl3)δ165.9,154.7,148.6,147.3,144.2,133.6,133.58,131.4,131.3,125.0,121.4,119.0,118.0,117.95,117.94,117.8,117.5,117.4,116.6,116.4,115.3,114.6,102.5,74.5,74.1,72.1,71.2,71.0,70.2,70.0,68.7,66.4,35.6;esi-hrms[m+nh4]+计算值c33h40no11f2664.2564,实测值664.2565.
(3,4-二烯丙氧基苯乙基)4-o-(3,4-二甲氧基肉桂酰基)-6-o-烯丙氧羰基-β-d-吡喃葡萄糖苷(化合物19c)的合成
按照通用方法,经18c脱乙酰基得到(洗脱剂为石油醚:乙酸乙酯=2:1)白色固体19c,收率为90%。[α]d25-48.0(c0.0007,cdcl3);1hnmr(400mhz,cdcl3)δ7.68(d,j=15.9hz,1h),7.11-7.05(m,2h),6.87-6.73(m,4h),6.31(d,j=15.9hz,1h),6.13-6.02(m,2h),5.93-5.83(m,1h),5.44-5.21(m,6h),4.97(t,j=9.6hz,1h),4.60-4.57(m,5h),4.33(d,j=7.8hz,1h),4.29(m,2h),4.11(dt,j=7.0hz,9.4hz,1h),3.92-3.88(m,6h),3.80-3.69(m,4h),3.50(t,j=9.2hz,1h),2.97(d,j=3.0hz,1h),2.87(t,j=7.6hz,2h),2.60(s,1h);13cnmr(100mhz,cdcl3)δ166.8,154.7,151.5,149.3,148.6,147.2,146.7,133.63,133.57,131.4,131.3,127.0,123.1,121.4,119.0,117.5,117.4,115.3,114.5,114.2,111.1,109.8,102.5,74.7,74.1,72.1,71.02,70.96,70.1,70.0,66.5,56.0,55.9,35.6;esi-hrms[m+h]+计算值c35h43o13671.2698,实测值671.2698.
(3,4-二烯丙氧基苯基)乙基4-o-对氯肉桂酰基-6-o-烯丙氧羰基-β-d-吡喃葡萄糖苷(化合物19d)的合成
按照通用方法,经18d脱乙酰基得到(洗脱剂为石油醚:乙酸乙酯=2:1)白色固体19d,收率为98%。[α]d25-12.5(c0.004,cdcl3);1hnmr(400mhz,cdcl3)δ7.69(d,j=16.0hz,1h),7.45(m,2h),7.37(m,2h),6.82(d,j=8.1hz,1h),6.78(d,j=1.6hz,1h),6.74(dd,j=1.6hz,8.0hz,1h),6.41(d,j=16.0hz,1h),6.13-6.02(m,2h),5.93-5.83(m,1h),5.45-5.37(m,2h),5.35-5.20(m,4h),4.99(t,j=9.6hz,1h),4.61-4.56(m,6h),4.32(d,j=7.7hz,1h),4.28-4.27(m,2h),4.12(dt,j=7.2hz,9.6hz,1h),3.77-3.68(m,3h),3.51-3.46(m,1h),2.87(t,j=7.8hz,2h),2.74(d,j=3.3hz,1h),2.43(d,j=2.0hz,1h);13cnmr(100mhz,cdcl3)δ166.2,154.7,148.6,147.3,145.2,136.7,133.7,133.6,132.5,131.4,131.3,129.3,121.4,119.0,117.5,117.4,117.3,115.3,114.5,102.5,74.5,74.1,72.1,71.1,71.0,70.2,70.0,68.7,66.4,35.6;esi-hrms[m+h]+计算值c33h38o11cl645.2097,实测值645.2071.
(3,4-二烯丙氧基苯基)乙基4-o-(3,4-二烯丙氧基肉桂酰基)-6-o-烯丙氧羰基-β-d-吡喃葡萄糖苷(化合物19e)的合成
按照通用方法,经18e脱乙酰基得到(洗脱剂为石油醚:乙酸乙酯=2:1)白色固体19e,收率为99%。[α]d25-7.6(c0.003,cdcl3);1hnmr(400mhz,cdcl3)δ6.87-6.71(m,6h),6.12-6.01(m,4h),5.94-5.84(m,1h),5.45-5.35(m,5h),5.30-5.23(m,5h),4.84(t,j=9.6hz,1h),4.57(br,10h),4.25(d,j=7.7hz,1h),4.17(dd,j=5.9hz,11.8hz,1h),4.10-4.04(m,2h),3.71-3.57(m,5h),3.41(dd,j=8.1hz,8.8hz,1h),2.84(t,j=7.4hz,2h);13cnmr(125mhz,cdcl3)δ171.4,154.6,148.6,148.5,147.8,147.2,133.6,133.5,133.44,133.36,131.2,126.2,121.3,119.1,117.6,117.54,117.49,115.2,115.1,114.4,114.3,102.4,74.4,74.0,71.9,71.2,71.0,70.1,71.0,70.1,70.0,69.9,68.7,66.1,40.7,35.6;esi-hrms[m+nh4]+计算值c38h50no13728.3277,实测值728.3290.
化合物1-5的通用合成方法:
将化合物19a-e溶于混合溶剂(二氯甲烷:甲醇=20:1)中,加入10%pd/c和催化量的对甲苯磺酸(或hclo4),60℃下反应12小时。过滤,浓缩,制备薄层技术分离(二氯甲烷/甲醇,10:1至5:1)得到相应的产物。
(3,4-二羟基苯基)乙基4-o-(3,4-二羟基肉桂酰基)-β-d-吡喃葡萄糖苷(化合物1)的合成
按照通用方法,化合物19a经反应后分离(二氯甲烷:甲醇=8:1)得黄色油状化合物1,收率为62%。[α]d25-25.7(c0.026,meoh);1hnmr(400mhz,cd3od)δ7.58(d,j=15.8hz,1h),7.04(d,j=1.3hz,1h),6.94(d,j=8.1hz,1h),6.79(d,j=8.2hz,1h),6.70(m,2h),6.58(m,1h),6.28(d,j=15.8hz,1h),4.35(d,j=7.8hz,1h),4.08(m,2h),3.74(m,1h),3.65(m,2h),3.55(m,2h),3.35-3.25(m,1h),2.81(t,j=6.5hz,2h);13cnmr(100mhz,cd3od)δ168.6,149.7,147.6,146.8,146.1,144.6,131.5,127.7,123.1,121.3,117.1,116.5,116.3,115.2,114.7,104.4,76.1,75.8,75.2,72.5,72.2,62.5,36.6;esi-hrms[m+na]+计算值c23h26nao11501.1367,实测值501.1369.
(3,4-二烯丙氧基苯乙基)4-o-(3,4-二氟肉桂酰基)-β-d-吡喃葡萄糖苷(化合物2)的合成
按照通用方法,化合物19b经反应后分离(二氯甲烷:甲醇=10:1)得无色油状化合物2,收率为35%。[α]d25-10.6(c0.012,cd3od);1hnmr(400mhz,cd3od)δ7.68(d,j=16.0hz,1h),7.66-7.58(m,1h),7.46-7.43(m,1h),7.34-7.27(m,1h),6.70-6.66(m,2h),6.58-6.54(m,2h),4.88(t,j=9.4hz,1h),4.36(d,j=7.8hz,1h),4.08-4.02(m,1h),3.75-3.70(m,1h),3.64(m,2h),3.58-3.49(m,2h),3.35-3.28(m,1h),2.80(dt,j=2.3hz,7.5hz,2h);13cnmr(100mhz,cd3od)δ167.5,146.1,144.7,144.4,133.4,131.5,126.6,126.5,121.3,120.1,119.0,118.8,117.7,117.5,117.1,116.3,104.4,76.0,75.8,75.2,72.9,72.2,62.4,36.6;esi-hrms[m+na]+计算值c23h24nao9f2505.1281,实测值505.1286.
(3,4-羟基基苯乙基)4-o-(3,4-二甲氧基肉桂酰基)-β-d-吡喃葡萄糖苷(化合物3)的合成
按照通用方法,化合物19c经反应后分离(二氯甲烷:甲醇=10:1)得黄色油状化合物3,收率为34%。[α]d25-5.4(c0.010,meoh);1hnmr(400mhz,cd3od)δ7.67(d,j=15.9hz,1h),7.22(d,j=1.9hz,1h),7.17(dd,j=1.8hz,8.4hz,1h),6.97(d,j=8.4hz,1h),6.68-6.65(m,2h),6.55(dd,j=2.1hz,8.1hz,1h),6.44(d,j=15.9hz,1h),4.86(t,j=9.4hz,1h),4.36(d,j=7.8hz,1h),4.07-4.01(m,1h),3.85(m,6h),3.74-3.68(m,1h),3.64-3.58(m,2h),3.56-3.48(m,2h),3.32-3.28(m,1h),2.79(m,2h);13cnmr(100mhz,cd3od)δ168.4,153.0,150.8,147.0,146.1,144.7,131.5,128.8,124.1,121.3,117.1,116.3,116.2,112.7,111.7,104.4,76.1,75.9,75.3,72.6,72.2,62.5,56.5,36.6;esi-hrms[m+h]+计算值c25h31o11507.1861,实测值507.1867.
(3,4-二羟基苯基)乙基4-o-对氯肉桂酰基-β-d-吡喃葡萄糖苷(化合物4)的合成
按照通用方法,化合物19d经反应后分离(二氯甲烷:甲醇=12:1)得黄色油状化合物4,收率为32%。[α]d25-13.7(c0.010,meoh);1hnmr(400mhz,cd3od)δ7.69(d,j=16.0hz,1h),7.59(d,j=8.5hz,2h),7.40(d,j=8.5hz,2h),6.69-6.65(m,2h),6.58-654(m,2h),4.87(t,j=9.4hz,1h),4.36(d,j=7.8hz,1h),4.08-4.01(m,1h),3.74-3.68(m,1h),3.66-3.61(m,2h),3.56-3.49(m,2h),3.33-3.28(m,1h),2.79(ddd,j=2.3hz,2.5hz,7.7hz,2h);13cnmr(100mhz,cd3od)δ167.7,146.1,145.3,144.7,137.4,134.5,131.5,130.8,130.2,121.3,119.4,117.1116.3,104.4,76.0,75.8,75.2,72.8,72.2,62.4,36.6;esi-hrms[m+nh4]+计算值c23h29clno9498.1525,实测值498.1525.
(3,4-二羟基苯乙基)4-o-(3,4-羟基苯乙基)-β-d-吡喃葡萄糖苷(化合物5)的合成
按照通用方法,化合物19e经反应后分离(二氯甲烷:甲醇=8:1)得黄色油状化合物5,收率为37%。[α]d25-6.4(c0.004,meoh);1hnmr(400mhz,cd3od)δ6.76-6.81(m,5h),6.56-6.62(m,1h),4.30(d,j=7.6hz,1h),4.14-3.98(m,2h),3.89-3.79(m,2h),3.65-3.76(m,3h),3.27-3.38(m,1h),3.15-3.22(m,2h),2.84(t,j=6.8hz,2h);13cnmr(100mhz,cd3od)δ173.9,146.3,146.1,145.5,144.7,131.6,126.9,131.7,121.3,117.4,117.1,116.4,116.3,104.4,77.9,75.4,75.0,72.1,71.7,65.0,41.4,36.6;esi-hrms[m+na]+计算值c22h26nao11489.1367,实测值489.1376.
实施例4化合物6-8的合成
试剂和条件:(a)草酰氯,ch2cl2,et3n,69%;(b)accl,ch2cl2,meoh,82%;(c)i)10%pd/c,meoh,h2o,hclo4;ii)accl,ch2cl2,meoh,两步总收率为92%;(d)pybop,nmm,dmf,39%.
9’-脱羧四乙酰基迷迭香酸(化合物20)的合成
将化合物11b(100mg,0.379mmol,1equiv),草酰氯0.11ml加入2mldcm中,室温搅拌6h,浓缩。在ar保护下,加入化合物9b(90.2mg,0.379mmol,1.0equiv),dcm(5ml),et3n(0.5ml),室温搅拌12h后,蒸干溶剂。残留物经柱层析(石油醚/乙酸乙酯=3:1)得到油状物126mg,收率69%。1hnmr(400mhz,cdcl3)δ7.60(d,j=16.0hz,1h),7.42-7.36(m,2h),7.22(d,j=8.0hz,1h),7.14-7.01(m,3h),6.36(d,j=16.0hz,1h),4.42(t,j=6.7hz,2h),3.00(t,j=6.7hz,2h),2.30(m,12h);13cnmr(100mhz,cdcl3)δ168.3,168.2,168.0,167.9,166.4,143.5,143.1,142.4,142.0,140.7,136.7,133.3,127.0,126.4,123.9,123.4,122.8,119.1,64.5,34.5,20.6,20.5;esi-hrms[m+na]+计算值c25h24nao10507.1272,实测值507.1262.
9’-脱羧迷迭香酸(化合物6)的合成
以化合物20为原料,脱除乙酰基保护(方法同实施例3中1-5的脱乙酰基步骤)。柱层析洗脱剂二氯甲烷:甲醇=10:1,得到黄色油状化合物,收率82%。1hnmr(400mhz,cd3od)δ7.52(d,j=15.8hz,1h),7.04(s,1h),6.94(d,j=8.1hz,1h),6.78(d,j=8.0hz,1h),6.71(m,2h),6.58(d,j=8.0hz,1h),6.24(d,j=15.8hz,1h),4.30(t,j=6.9hz,2h),2.84(t,j=6.9hz,2h);13cnmr(100mhz,cd3od)δ169.3,149.6,146.9,146.3,144.9,146.8,130.8,127.7,122.9,121.2,117.1,116.5,116.4,115.2,115.1,66.5,35.6;esi-hrms[m+na]+计算值c17h16o6na339.0842,实测值339.0839.
(3,4-二羟基苯乙基)β-d-吡喃葡萄糖苷(化合物7)的合成
将化合物15(150mg,0.315mmol,1equiv)溶于meoh/h2o(20:1,8ml)中,加入催化量10%pd/c和催化量的hclo4。蒸干溶剂,残留物经脱除乙酰基保护(方法同实施例3中1-5的脱乙酰基步骤)后分离(洗脱剂为二氯甲烷:甲醇=1:1)得到白色固体12mg,收率92%。[α]d25-0.59(c0.025,cd3od);1hnmr(400mhz,cd3od)δ6.68-6.65(m,2h),6.55(d,j=8.1hz,1h),4.28(d,j=7.3hz,1h),4.01(dd,j=8.6hz,8.3hz,1h),3.83(m,2h),3.75-3.70(m,1h),3.70-3.60(m,3h),3.17(t,j=8.2hz,1h),2.77(t,j=7.3hz,2h);13cnmr(100mhz,cd3od)δ146.0,144.6,131.6,121.3,117.1,116.3,104,3,78.1,77.9,75.1,72.0,71.6,62.7,36.6;esi-hrms[m+h]+计算值c14h21o8317.1231,实测值317.1229。
2-o-甲基-5-o-(对羟基肉桂酰基)-β-d-唾液酸苷(化合物8)的合成
将化合物21(100.0mg,0.34mmol,1.0equiv,按照文献(tetrahedronasymmetry22(2011)338–344)公开的方法进行合成)和化合物11(91.6mg,0.51mmol,1.5equiv)溶于dmf(50ml)中,加入pybop(265.0mg,0.51mmol,1.5equiv)和nmm(103.0mg,1.02mmol,3.0equiv),室温搅拌24小时,浓缩,残留物经柱层析(乙酸乙酯:乙醇=10:1)分离,得到黄色油状物60mg,收率39%。[α]d25-11.3(c0.006,meoh);1hnmr(400mhz,cd3od)δ7.44(d,j=15.6hz,1h),7.03(d,j=1.7hz,1h),6.91(dd,j=2.1hz,8.2hz,1h),6.77(d,j=8.2hz,1h),6.43(d,j=15.6hz,1h),4.09(td,j=4.8hz,10.7hz,1h),3.99(t,j=10.2hz,1h),3.81-3.91(m,3h),3.75-3.80(m,3h),3.68(dd,j=5.0hz,11.1hz,1h),3.55(d,j=8.0hz,1h),3.29(s,3h),2.38(dd,j=5.0hz,12.9hz,1h),1.69(dd,j=1.6hz,12.8hz,1h);13cnmr(100mhz,cd3od)δ171.1,170.6,148.9,146.8,143.0,128.2,122.3,118.0,116.5,115.0,100.5,72.6,71.4,70.1,67.7,65.2,53.8,53.3,51.7,41.6;esi-hrms[m-h]-计算值c20h26no11456.1506,实测值456.1511.
实验例1本发明化合物的细胞保护活性评价实验
1、供试化合物:实施例3和实施例4制备的化合物1-8。
2、实验材料
大鼠肾上腺嗜铬细胞瘤细胞株(pc12细胞),购自中国科学院上海细胞库;6-ohda等(sigma公司);ros试剂盒(碧云天生物技术研究所);annexinv-fitc细胞凋亡检测试剂盒(凯基生物)。
3、实验方法
细胞存活率的测定:取对数生长期pc12细胞,以1×105的密度铺入96孔板,每孔100μl,每组样本设3个平行孔,5%co2、37℃的co2孵箱内培养24小时后,加入供试化合物预处理6小时,加入300μmh2o2在37℃培养1小时或6-ohda损伤24小时后,加入20μlmtt(5mg/ml)继续培养4小时,然后加入dmso溶液,待结晶完全溶解后,使用酶标仪在570nm波长测量其吸光度值。
4、实验结果
实验结果见图5和图6。就h2o2(图5)和6-ohda(图6)损伤pc12细胞模型的细胞相对存活率来看,与正常对照组相比,模型组细胞相对存活率显著降低,存在统计学差异(p<0.05),说明造模成功。与模型组相比,本发明化合物5,化合物6和化合物8表现出较强的细胞保护作用且呈现明显的剂量依赖关系,说明本发明化合物5,化合物6和化合物8均具有较好的神经保护作用。
实验例2annexinv-pi双染法检测化合物5,6和8的神经保护作用实验
1、供试化合物:(3,4-二羟基苯乙基)4-o-(3,4-羟基苯乙基)-β-d-吡喃葡萄糖苷(化合物5),9’-脱羧迷迭香酸(化合物6)和2-o-甲基-5-o-(对羟基肉桂酰基)-β-d-唾液酸苷(化合物8);
2、实验方法
(1)取对数生长期pc12细胞,以1×105的密度铺入含有盖玻片的24孔板中,每孔500μl,5%co2、37℃培养24小时。给予化合物5、化合物8、化合物6预处理6小时后,用终浓度为100μm6-ohda处理细胞,继续培养24小时;
(2)用pbs洗涤细胞2次;
(3)在100μl的bindingbuffer中加入1μlannexinv-fitc,1μlpi,混匀;
(4)去除培养基,将上述溶液滴加于盖玻片表面,使盖玻片表面均匀覆盖;
(5)避光,室温反应5min;
(6)将盖玻片倒置于载玻片上,于共聚焦显微镜下观察:annexinv-fitc荧光信号呈绿色,pi荧光信号呈红色。
3、实验结果
从annexinv-pi双染法检测化合物5,化合物6和化合物8对细胞凋亡影响的结果来看(图7),正常对照组annexinv、pi均低染,说明细胞处于正常状态;模型组annexinv、pi均高染,说明给予6-ohda损伤后,pc12细胞进入凋亡晚期阶段,并出现坏死细胞;而给予化合物5,6和8预保护之后,不仅将细胞控制在凋亡初期阶段,而且随着给药剂量的增加,细胞损伤情况明显减少甚至消失,说明本发明化合物5,化合物6和化合物8通过抑制细胞凋亡的途径发挥神经保护的作用。
实验例3本发明化合物5,6和8对细胞内ros水平的影响实验
1、供试化合物:(3,4-二羟基苯乙基)4-o-(3,4-羟基苯乙基)-β-d-吡喃葡萄糖苷(化合物5),9’-脱羧迷迭香酸(化合物6)和2-o-甲基-5-o-(对羟基肉桂酰基)-β-d-唾液酸苷(化合物8);
2、实验方法
取对数生长期pc12细胞,以1×105的密度铺入96孔板,每孔100μl,5%co2、37℃孵箱内培养24小时后,加入化合物5,8和6预处理6小时,然后加入6-ohda损伤24小时后,去除培养基,每孔加入40μldcfh-da溶液(原装贮备液按1:1000用无血清培养基稀释),37℃细胞培养箱避光孵育30min,pbs洗涤三次,于荧光显微镜下观察。
3、实验结果
通过对细胞内ros水平的检测可以看出(图8),正常细胞内ros有所表达,但是水平较低;给予6-ohda损伤后,细胞内ros表达水平显著增加,说明6-ohda引起了细胞内的氧化应激;而在给予本发明化合物5,6和8的细胞中,与模型组相比,ros的表达水平明显降低,且这种抑制表达的作用与化合物的剂量呈正相关,说明本发明化合物5,6和8通过抗氧化应激的方式发挥神经保护作用。
综上所述,本发明化合物5,化合物6和化合物8能够通过抗凋亡、抗氧化损伤等途径,以剂量依赖的方式,明显减轻6-ohda对细胞造成的损伤,发挥神经保护作用且无明显毒副作用。说明本发明化合物5,化合物6和化合物8作为潜在的预防和治疗神经性疾病的新药具有较大的开发价值。
- 还没有人留言评论。精彩留言会获得点赞!