一种免疫缺陷大鼠动物模型的构建方法及应用与流程
本发明属于动物基因工程和遗传修饰领域,尤其是涉及一种基于基因敲除技术的免疫缺陷大鼠动物模型的构建方法及应用。
背景技术:
人源化动物模型体内重建了人源免疫系统,能够更好的模拟人体肿瘤微环境,在肿瘤的在体研究中越来越受到重视。目前,人源化小鼠模型已经应用在新型抗癌药物的筛选以及治疗方法(如细胞治疗和抗体治疗)的探索等各方面。在小鼠中敲除重组活性基因(recombinationactivationgenes,rag1或rag2)能够导致t细胞受体和b细胞的免疫球蛋白编码基因区域的基因重组的障碍,造成小鼠的严重免疫缺陷表型il2rg基因编码一种跨膜蛋白,是几种白介素受体复合物的共同亚基,在免疫细胞分化和功能中起重要作用。敲除il2rg基因能够清除小鼠体内的nk细胞,因此在建立免疫缺陷动物模型方面有着重要的作用。通过移植人胎儿胸腺、淋巴结、脾脏的同时从尾静脉注射胎儿肝脏细胞,或者移植造血干细胞(hematopoieticstemcell,hsc),能够建立人源化小鼠模型。已知rag和il2rg基因敲除品系小鼠提高了人源组织和细胞的移植效率,成功在小鼠体内分化出了不同亚型的造血细胞,包括t、b淋巴细胞、髓系的巨噬细胞、树突状细胞和血小板、红细胞等。
虽然人源化小鼠模型在研究肿瘤药物中已经得到较广泛的应用,但其局限性也是明显的。小鼠的体型小,血液量少;而且受到伦理学的限制,在pdx模型中肿瘤的大小不能超过动物体重的十分之一。如果采用与人类更加接近的大型哺乳动物甚至非人灵长类动物,研究成本又将无法有效控制,因此也不现实。大鼠的体型(体重)是小鼠10倍,所以能够提供更多的样品,而且大鼠的生理结构比小鼠更接近人类。因此,大鼠模型在相关研究中要比小鼠具有更大的优势。
技术实现要素:
本发明的目的之一是提供一种免疫缺陷大鼠动物模型的构建方法及应用。本发明通过crispr/cas9技术构建大鼠rag1基因第2外显子、rag2基因第3外显子、il2rg基因第1外显子的sgrna的表达载体,通过体外转录表达,分别获得同时敲除了rag1基因和rag2基因的大鼠以及il2rg基因被敲除的大鼠,然后通过杂交继而获得rag1、rag2和il2rg基因均被敲除的大鼠。
本发明提出了一种免疫缺陷大鼠动物模型的构建方法,包括以下步骤:
(1)分别构建特异性靶向大鼠rag1基因第2外显子的sgrna的表达载体、rag2基因第3外显子的sgrna的表达载体、il2rg基因第1外显子的sgrna的表达载体;
(2)通过体外转录分别表达得到大鼠rag1基因第2外显子的sgrna、rag2基因第3外显子的sgrna、il2rg基因第1外显子的sgrna、以及cas9mrna;
(3)将大鼠rag1基因第2外显子的sgrna、rag2基因第3外显子的sgrna和cas9mrna分别纯化后,混合,注射入大鼠受精卵细胞中,移植入大鼠输卵管中,获得同时敲除了rag1基因和rag2基因的大鼠;
将大鼠il2rg基因第1外显子的sgrna和cas9mrna分别纯化后,混合,注射入大鼠受精卵细胞中,移植入大鼠输卵管中,获得il2rg基因被敲除的大鼠;
(4)通过将步骤(3)得到的同时敲除rag1和rag2基因的大鼠和il2rg基因被敲除的大鼠进行杂交,获得rag1、rag2和il2rg基因均被敲除的大鼠即命名为免疫缺陷大鼠动物模型sd-rg。
其中,所述大鼠rag1基因第2外显子的核苷酸序列如seqidno.4所示,即:5’-gtagcttcgccaaaatggctgtccccttgccatctaccctgagactcagttctgcacctgatgaaattcagcacccgcacatcaaattttccgagtggaaatttaagctgtttagggtgagatccttt-3’。
其中,所述大鼠rag2基因第3外显子的核苷酸序列如seqidno.5所示,即:5’-ataaaagacctactcacaatcaaaaaatgtccctgcagatggttacagtgggtcataacatagccttaattcaaccaggcttctcactgatgaattttgatggtcaagtttttttctttggccaaaaaggctggcctaagagatcctgccctactgga-3’。
其中,所述大鼠il2rg基因第1外显子的核苷酸序列如seqidno.6所示,即:5’-atgttgaaaccattattgccatctagatccttcttactccttcagctgcttctgctgagggtagggtggagctccaaggtcctcatgtccagtgggaatgaagacaccaaatctg-3’。
优选地,所述步骤(1)中,利用crispr/cas9技术,针对大鼠rag1基因第2外显子、大鼠rag2基因第3外显子、大鼠il2rg基因第1外显子分别设计靶向dna序列,分别构建大鼠rag1基因第2外显子的sgrna的表达载体、大鼠rag2基因第3外显子的sgrna的表达载体、大鼠il2rg基因第1外显子的sgrna的表达载体;所述靶向dna序列即sgrna分别为seqidno.1、seqidno.2、seqidno.3序列。
所述步骤(2)中,通过转录分别得到的cas9mrna、大鼠rag1基因第2外显子的sgrna、大鼠rag2基因第3外显子的sgrna、大鼠il2rg基因第1外显子的sgrna分别进行吸附柱纯化,将纯化后的cas9mrna、各sgrna分别利用分光光度计测定浓度。
本发明中,优选地,纯化后的cas9mrna的终浓度为20-100ng/μl,纯化后的大鼠rag1基因第2外显子的sgrna、大鼠rag2基因第3外显子的sgrna、大鼠il2rg基因第1外显子的sgrna的终浓度分别为10-50ng/μl。
本发明创新提出在转录步骤之后进行吸附柱纯化,以避免dna和蛋白污染,显著提高了后续受精卵注射的效率。且优选地符合纯化后cas9mrna、sgrna终浓度要求。
所述步骤(3)中,所述sgrna与cas9mrna混合时,两者的质量比为1:2。即,混合时大鼠rag1基因第2外显子的sgrna与rag2基因第3外显子的sgrna之和与cas9mrna的质量比为1:2。混合时大鼠il2rg基因第1外显子的sgrna与cas9mrna的质量比为1:2。
本发明还提出了一种表达载体,分别为含有特异性靶向所述大鼠rag1基因第2外显子、rag2基因第3外显子、il2rg基因第1外显子的sgrna的dna序列的载体。优选地,所述表达载体含有px330,所述表达载体含有载体px330和与所述载体px330连接的靶向dna,所述靶向dna序列分别为seqidno.1、seqidno.2、seqidno.3序列。
本发明还提出了单链寡聚核苷酸序列,所述序列分别为:
一对正反单链seqidno.7和seqidno.8,经退火可形成seqidno.1;
一对正反单链seqidno.9和seqidno.10,经退火可形成seqidno.2;
一对正反单链seqidno.11和seqidno.12,经退火可形成seqidno.3。
其中,所述seqidno.7和seqidno.8针对rag1基因第2外显子的sgrna靶点。seqidno.9和seqidno.10针对rag2基因第3外显子的sgrna靶点。seqidno.11和seqidno.12针对il2rg基因第1外显子的sgrna靶点。
其中,特异性靶向rag1基因第2外显子、rag2基因第3外显子和il2rg基因第1外显子的sgrna的表达载体,由载体px330和与载体px330连接的靶向dna构成,靶向dna序列即sgrna为seqidno.1、seqidno.2、seqidno.3序列。
本发明还提出了一种非人类哺乳动物细胞,所述细胞内含有sgrna和cas9mrna。其中,所述sgrna分别为如seqidno.1所示的大鼠rag1基因第2外显子的sgrna、如seqidno.2所示的大鼠rag2基因第3外显子的sgrna、以及如seqidno.3所示的大鼠il2rg基因第1外显子的sgrna。
本发明还提出了分别用于敲除大鼠rag1、rag2、il2rg基因的crispr-cas9表达系统,分别含有特异性靶向大鼠rag1基因第2外显子、rag2基因第3外显子和il2rg基因第1外显子的sgrna的表达载体。px330载体能表达cas9mrna。所述表达载体包括px330载体。
本发明还提出按本发明方法构建得到的免疫缺陷大鼠动物模型、表达载体、非人类哺乳动物细胞在筛选或制备免疫调节药物或抗肿瘤药物筛选中的应用。
本发明还提出了大鼠rag1基因第2外显子、rag2基因第3外显子、il2rg基因第1外显子在制备免疫缺陷大鼠动物模型中的用途。所述大鼠rag1基因第2外显子的核苷酸序列如seqidno.4所示;所述大鼠rag2基因第3外显子的核苷酸序列如seqidno.5所示;所述大鼠il2rg基因第1外显子的核苷酸序列如seqidno.6所示。
本发明还提出了大鼠rag1基因第2外显子、大鼠rag2基因第3外显子、il2rg基因第1外显子的sgrna在敲除大鼠rag1基因第2外显子、大鼠rag2基因第3外显子、大鼠il2rg基因第1外显子中的应用。所述大鼠rag1基因第2外显子的核苷酸序列如seqidno.4所示;所述大鼠rag2基因第3外显子的核苷酸序列如seqidno.5所示;所述大鼠il2rg基因的核苷酸序列如seqidno.6所示。
本发明还提出了一种用于敲除大鼠rag1、rag2和il2rg基因的crispr-cas9表达系统,所述表达系统分别含有特异性靶向大鼠rag1基因第2外显子的sgrna、大鼠rag2基因第3外显子的sgrna、大鼠il2rg基因第1外显子的sgrna的表达载体。所述sgrna分别为seqidno.1、seqidno.2、seqidno.3序列。
本发明还提出了一种按本发明方法构建的免疫缺陷大鼠动物模型sd-rg,其特征可通过以下检测指标验证:(1)sd-rg大鼠的dna具有相应的突变序列;(2)sd-rg大鼠免疫组织中缺乏t、b和nk细胞;(3)皮下移植肿瘤在sd-rg大鼠中的生长速率超过小鼠等其他动物模型。
本发明提出的免疫缺陷大鼠动物模型及其构建方法和应用,通过crispr/cas9技术获得rag1、rag2、il2rg基因敲除的大鼠(sd-rg免疫缺陷大鼠动物模型),与现有技术传统打靶技术(嵌合体小鼠)比较,本发明效率更高,时间周期更短,且大鼠具有小鼠不具备的优势。本发明构建的sd-rg大鼠严重免疫缺陷,免疫组织中缺乏t、b和nk细胞,移植肿瘤的生长速率显著超过小鼠等其他动物模型,为免疫和肿瘤相关领域研究提供一种可靠的动物模型。本发明不仅可以促进免疫系统相关领域的基础研究,而且可以为肿瘤等疾病的新药研发提供高水平的动物模型。
本发明中,rag1和rag2在同一染色体,同时敲除后,再与il2rg杂交,这样可以同时得到不同基因型的免疫缺陷型大鼠,通过本发明方法,可以得到双基因(rag1、rag2)敲除的大鼠,也可以得到单基因(il2rg)敲除的大鼠,也可以得到三基因(rag1、rag2、il2rg)敲除的大鼠。而且简化了鉴定的流程。
本发明采取先分别敲除再杂合的步骤,即,先敲除大鼠在一条染色体上的两个基因rag1、rag2,敲除另一只大鼠的单个基因il2rg,然后再将两只大鼠进行杂交,从而获得三基因(rag1、rag2、il2rg)敲除的大鼠。本发明方法避免了现有技术存在的问题,如,现有技术中一次敲除多个基因时会因敲除不完全而导致的数个基因之间参差不齐排列组合,造成敲后再筛选的工作困难,获得目的物的效率低。
本发明方法提出了同时敲除大鼠的两个基因rag1、rag2,彻底造成了t细胞和b细胞的免疫缺陷,从而通过本发明方法可以得到更理想的免疫缺陷动物模型,避免了现有技术中在缺失rag1但具有rag2、或缺失rag2但具有rag1的情形下会发生的动物表型上呈现不彻底免疫缺陷的问题。
本发明中,grna和cas9mrna纯化后,并按质量比为1:2进行受精卵注射,提高了敲除效率。
本发明构建得到的sd-rg大鼠能够进行肿瘤细胞和组织移植,肿瘤的生长速率远远高于小鼠等已有模型。这极大缩短了实验时间,提高了实验效率。且sd-rg大鼠体型大,比小鼠手术实验简便,更适合原位移植。
此外,小鼠的体型和代谢特点都不适合病理和毒理实验,而本发明构建的sd-rg大鼠可以在移植的同时直接进行病理和毒理实验,提高了肿瘤pdx模型的利用效率。
附图说明
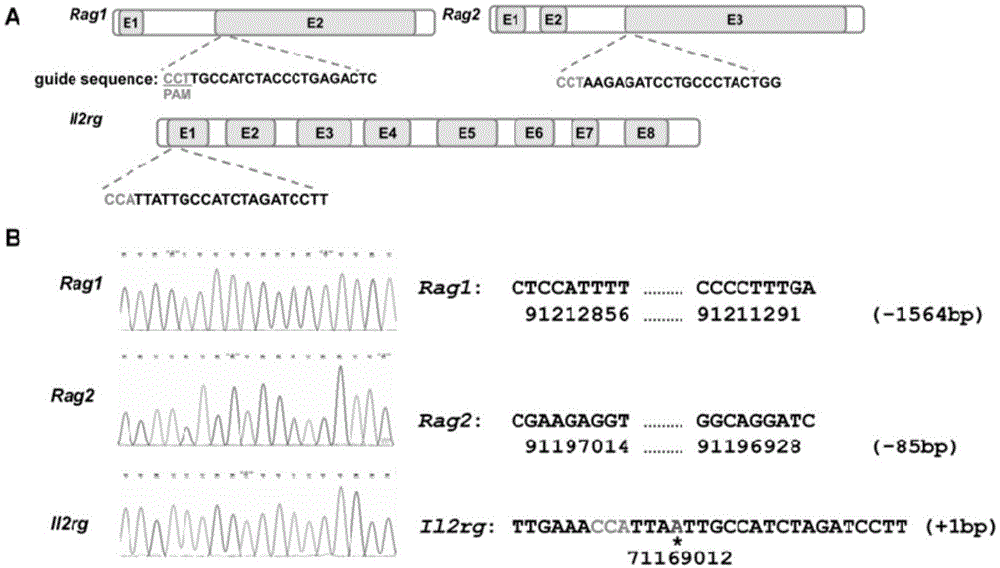
图1表示利用crispr/cas9技术建立本发明il2rg基因敲除小鼠的示意图。
图2表示了本发明构建的sd-rg大鼠免疫组织中缺乏t、b和nk细胞;其中,a表示sd-rg胸腺中的cd4+cd8+双阳性t细胞、cd3+cd4+单阳性t细胞、cd3+cd8+单阳性t细胞显著降低;b表示sd-rg骨髓中的pro/preb细胞和非成熟b细胞显著降低;c表示sd-rg外周血中的总t、b、nk细胞都显著降低;d表示sd-rg脾脏中的总t、b、nk细胞显著降低。
图3表示了皮下移植肿瘤在本发明方法构建的sd-rg大鼠中的生长速率超过小鼠等其他动物模型;其中,a表示本发明sd-rg大鼠、对照组(野生型(wt)、rag1rag2双敲除、il2rg单敲除大鼠、免疫缺陷型小鼠nsg);b表示sd-rg大鼠中的肿瘤生长速度显著高于野生型(wt)、rag1rag2双敲除、il2rg单敲除大鼠以及免疫缺陷型小鼠nsg;c表示通过he染色显示sd-rg大鼠的移植肿瘤忠实的保留了原始细胞成瘤的组化特性,同时抗体染色显示移植肿瘤含有nci-h460细胞系特有的pan-ck标志物。
具体实施方式
以下实施例和附图用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料均为市售商品。以下实施例中未作具体说明的分子生物学实验方法,均参照《分子克隆实验指南》(第三版)j.萨姆布鲁克一书中描述的具体方法进行,或者按照试剂盒和产品说明书进行。
实施例1针对rag1、rag2和il2rg基因的crispr-cas9表达系统的构建
利用crispr/cas9技术建立rag1、rag2和il2rg基因敲除小鼠。
如图1所示,图1中的a表示:针对rag1基因第2外显子、rag2基因第3外显子和il2rg基因第1外显子分别设计靶向序列。图1中的b表示:产生的碱基缺失和插入的突变。
1、根据大鼠rag1、rag2和il2rg基因序列,进行sgrna的设计并获得了sgrna的序列信息。
其中,特异性靶向rag1基因第2外显子的sgrna,其dna序列如seqidno.1所示(gagtctcagggtagatggca)。其中,seqidno.1靶向seqidno.4(seqidno.4为rag1基因的一部分)。分别合成正反单链seqidno.7和seqidno.8,然后退火形成seqidno.1。
其中,特异性靶向rag2基因第3外显子的sgrna,其dna序列如seqidno.2所示(aagagatcctgccctactgg)。其中seqidno.2靶向seqidno.5(seqidno.5为rag2基因的一部分)。分别合成正反单链seqidno.9和seqidno.10,然后退火形成seqidno.2。
其中,特异性靶向il2rg基因第1外显子的sgrna,其dna序列如seqidno.3所示(aaggatctagatggcaataa)。其中seqidno.3靶向seqidno.6(seqidno.6为il2rg基因的一部分)。分别合成正反单链seqidno.11和seqidno.12,然后退火形成seqidno.3。
2、sgrna载体质粒的构建:
(1)分别设计并合成识别rag1基因第2外显子、rag2基因第3外显子和il2rg基因第1外显子的sgrna识别区dna序列,即seqidno.7和seqidno.8,seqidno.9和seqidno.10,seqidno.11和seqidno.12,具体如表2;
(2)每个dna先合成单链,合成后的单链sgrna序列进行磷酸化后梯度降温退火,形成双链dna;具体步骤为将合成的oligodna(seqidno.7、seqidno.9和eqidno.11作为正链oligodna,seqidno.8、seqidno.10和eqidno.12作为反链序列,将正、反链oligodna与10×t4dna连接酶缓冲液和t4多核苷酸激酶以2:2:1的体积比例混合后再加入3倍体积的水补齐体系,然后37℃孵育30min,再95℃,5min变性,之后在以5℃每分钟的速率降温至25℃完成反应以产生磷酸化粘性末端;同时bbsi酶切载体px330产生粘性末端;退火反应体系如表1所示。
表1退火反应体系
表2sgrna识别区dna序列
(3)以t4dna连接酶将seqidno.1、seqidno.2和seqidno.3的双链dna分别与px330进行连接,获得真核crispr-cas9表达系统载体。连接反应体系如表3。连接反应的温度为16摄氏度,连接反应时间为1h-3h。
表3连接反应体系
剪切过的px330是指使用bbsi限制性内切酶进行线性化处理后的px330。
实施例2体外转录
利用t7-cas9pcr和t7-sgrnapcr产物进行以t7启动子介导的体外转录,即以t7启动子作为体外转录的启动子,利用rna聚合酶在体外实现从dna到mrna的转录过程,具体方法为:用mmessagemmachinet7ultrakit(lifetechnologies)体外转录t7-cas9pcr产物,用megashortscriptt7kit(lifetechnologies)体外转录t7-sgrnapcr产物。将转录产生的mrna进行纯化,具体方法为:cas9mrna用megaclearkit(lifetechnologies)纯化,sgrnas用乙醇沉淀方法纯化,用纯水溶解mrna,将纯化后的mrna利用分光光度计测定浓度。
t7-cas9pcr引物见表4,t7-sgrnapcr引物见表5,grna-rag1-f、grna-rag2-f、grna-il2rg-f分别为针对seqidno.1、seqidno.2、seqidno.3的正向引物,反向引物为grna-r。pcr反应体系见表6,pcr反应条件见表7。
表4t7-cas9pcr引物
表5t7-sgrnapcr引物
表6pcr反应体系
表7pcr反应条件
实施例3利用针对rag1、rag2和il2rg基因的crispr-cas9系统mrna制备基因敲除大鼠
1、原核注射及胚胎移植
取大鼠的原核期受精卵,利用显微注射仪将前述实施例2中获得的预混好的cas9mrna/sgrna混合物(cas9mrna终浓度为20ng/μl,sgrna终浓度为10ng/μl),注射至大鼠受精卵细胞质,然后移植至受体母鼠的输卵管中,生产基因打靶大鼠,前述cas9mrna/sgrna混合物的注射量为0.5-1ul。
2、基因型鉴定
代孕母鼠生产后,待仔鼠长至2周龄剪取1cm左右鼠尾,蛋白酶k,55℃消化后酚仿抽提提取鼠尾基因组dna。以大鼠基因组dna为模板,分别设计针对rag1基因第2外显子、rag2基因第3外显子和il2rg基因第1外显子的引物,进行扩增,对获得的pcr产物进行测序,引物序列如下表8。
其中,rag1-l和rag1-r对应于seqidno.4;rag1-l和rag1-r对应于seqidno.5;il2rg-f和il2rg-r对应于seqidno.6。
表8基因打靶小鼠的鉴定引物
如测序结果打靶位点附近出现双峰的情况,则可能为打靶成功。选择双峰的样品再次pcr,产物胶回收后ta克隆至t载体中,转化后挑取阳性克隆再次进行测序。
如测序结果rag1、rag2和il2rg基因靶位点附近发生碱基插入或碱基缺失,导致阅读框移码突变,则可判断为rag1、rag2和il2rg基因敲除。
如图1b中,针对seqidno.1、seqidno.2和seqidno.3的基因敲除大鼠均在特定的位点发生了碱基缺失和/或插入。其中,rag1基因出现1564个碱基(bp)的缺失,rag2基因出现86个碱基(bp)的缺失,而il2rg基因则出现1个碱基(bp)的插入。这些突变导致相关基因表达时的移码突变,从而造成相关基因的表达缺失,即基因敲除。
实施例4利用流式细胞验证本发明获得的免疫缺陷大鼠动物模型
取上述实施例3中获得的sd-rg大鼠的免疫组织,裂红后用t、b、nk细胞相应的抗体孵育(分别是抗cd3、cd4、cd8、cd45和cd161的抗体),通过流式细胞仪分析。与野生型(wt)、rag1rag2双敲除以及il2rg单敲除大鼠相比,如图2a,免疫缺陷大鼠sd-rg胸腺中的cd4+cd8+双阳性t细胞(cd4+cd8+dp)、cd3+cd4+单阳性t细胞(cd3+cd4+sp)和cd3+cd8+单阳性t细胞(cd3+cd8+sp)显著降低;如图2b,sd-rg骨髓中的pro/preb细胞(pro/prebcells)和非成熟b细胞(immaturebcells)显著降低;如图2c,sd-rg外周血中的总t、b、nk细胞都显著降低;如图2d,sd-rg脾脏中的总t、b、nk细胞都显著降低。这些都说明sd-rg大鼠其具有最严重的免疫缺陷表型。
实施例5移植肿瘤实验验证sd-rg大鼠的先进性
能够在sd-rg大鼠皮下注射nci-h460等肿瘤细胞系以及移植病人的肿瘤组织。以nci-h460肿瘤细胞系为例,如图3a所示,以野生型(wt)、rag1rag2双敲除、il2rg单敲除大鼠以及免疫缺陷型小鼠nsg为对照组,皮下注射的初始浓度均为2.5x106。如图3b所示,sd-rg大鼠中的肿瘤生长速度显著高于野生型(wt)、rag1rag2双敲除、il2rg单敲除大鼠以及免疫缺陷型小鼠nsg。在注射20天后,sd-rg大鼠中的肿瘤体积超过了20cm3,优于rag1rag2双敲除和il2rg单敲除大鼠,而显著高于nsg小鼠模型和野生型(wt)大鼠。同时,如图3c所示,he染色显示sd-rg大鼠的移植肿瘤忠实的保留了原始细胞成瘤的组化特性,同时抗体染色显示移植肿瘤含有nci-h460细胞系特有的pan-ck标志物。
综上所述仅是以一般性说明、具体实施例等方式对本发明加以详尽描述,并非是对本发明权利范围的限制。在不偏离本发明基础上,本领域技术人员在本发明基础上所做的进一步修改或改进,均属于本发明要求保护的权利范围。
sequencelisting
<110>江苏艾尔康生物医药科技有限公司
<120>一种免疫缺陷大鼠动物模型的构建方法及应用
<160>24
<170>patentinversion3.3
<210>1
<211>20
<212>dna
<213>人工序列
<400>1
gagtctcagggtagatggca20
<210>2
<211>20
<212>dna
<213>人工序列
<400>2
aagagatcctgccctactgg20
<210>3
<211>20
<212>dna
<213>人工序列
<400>3
aaggatctagatggcaataa20
<210>4
<211>128
<212>dna
<213>人工序列
<400>4
gtagcttcgccaaaatggctgtccccttgccatctaccctgagactcagttctgcacctg60
atgaaattcagcacccgcacatcaaattttccgagtggaaatttaagctgtttagggtga120
gatccttt128
<210>5
<211>158
<212>dna
<213>人工序列
<400>5
ataaaagacctactcacaatcaaaaaatgtccctgcagatggttacagtgggtcataaca60
tagccttaattcaaccaggcttctcactgatgaattttgatggtcaagtttttttctttg120
gccaaaaaggctggcctaagagatcctgccctactgga158
<210>6
<211>115
<212>dna
<213>人工序列
<400>6
atgttgaaaccattattgccatctagatccttcttactccttcagctgcttctgctgagg60
gtagggtggagctccaaggtcctcatgtccagtgggaatgaagacaccaaatctg115
<210>7
<211>24
<212>dna
<213>人工序列
<400>7
caccgagtctcagggtagatggca24
<210>8
<211>24
<212>dna
<213>人工序列
<400>8
aaactgccatctaccctgagactc24
<210>9
<211>24
<212>dna
<213>人工序列
<400>9
caccaagagatcctgccctactgg24
<210>10
<211>24
<212>dna
<213>人工序列
<400>10
aaacgtagggcaggatctcttagg24
<210>11
<211>24
<212>dna
<213>人工序列
<400>11
caccaaggatctagatggcaataa24
<210>12
<211>24
<212>dna
<213>人工序列
<400>12
aaacaaggatctagatggcaataa24
<210>13
<211>38
<212>dna
<213>人工序列
<400>13
taatacgactcactataggcacatcaggaagcgtggca38
<210>14
<211>21
<212>dna
<213>人工序列
<400>14
gcgagctctaggaattcttac21
<210>15
<211>39
<212>dna
<213>人工序列
<400>15
ttaatacgactcactataggagtctcagggtagatggca39
<210>16
<211>39
<212>dna
<213>人工序列
<400>16
ttaatacgactcactatagaagagatcctgccctactgg39
<210>17
<211>39
<212>dna
<213>人工序列
<400>17
ttaatacgactcactatagaaggatctagatggcaataa39
<210>18
<211>20
<212>dna
<213>人工序列
<400>18
aaaagcaccgactcggtgcc20
<210>19
<211>28
<212>dna
<213>人工序列
<400>19
ccagggatattggtagatgaaatcaatc28
<210>20
<211>30
<212>dna
<213>人工序列
<400>20
tctttgaaaatttaggatggagtttcaatg30
<210>21
<211>30
<212>dna
<213>人工序列
<400>21
tagctcctaggatagataaagtagtgtctg30
<210>22
<211>30
<212>dna
<213>人工序列
<400>22
catctcctactaagtctttctctgtacaac30
<210>23
<211>30
<212>dna
<213>人工序列
<400>23
tattttccatctatccttcctagactgtac30
<210>24
<211>29
<212>dna
<213>人工序列
<400>24
ctagcaggctccagattgtatagaaagag29
- 还没有人留言评论。精彩留言会获得点赞!