一种嵌合分子及其制备和应用的制作方法
本发明属于化合物药物领域,具体涉及一种嵌合分子。
背景技术
现代分子生物学从3个基本层次上调控蛋白的表达水平:首先,在dna水平,通过基因敲除,从而使目标蛋白的dna失活;其次,在mrna水平,通过小分子rna,与目标蛋白的mrna结合,从而抑制mrna的翻译及表达;再次,在蛋白水平,通过对翻译后靶蛋白的修饰,例如甲基化、磷酸化、糖基化等,从而调整靶蛋白的量及活性。本专利中涉及的嵌合分子(protac)是基于蛋白水平,调控靶蛋白的表达,用于治疗疾病。本专利中的brd4嵌合分子具有异源双功能分子,由目标蛋白(brd4)、e3泛素连接酶识别基团、连接基团构成;耦合目标的目的是为了与在该分子的配体brd4结合;e3泛素连接酶识别基团的目的是与靶蛋白结合后,导致靶蛋白泛素化,最终使靶蛋白被蛋白酶体降解.
从基因水平的功能基因的敲除,再到mrna水平小分子rna的干扰,较多的生化技术已被用来研究蛋白质表达调控;嵌合分子则在不影响dna及mrna的表达的情况下,在蛋白水平上直接调控蛋白表达,因此在伦理学上更容易接受。同时,嵌合分子作为一种新的蛋白调控方法,具有其他方法所不具有的优势,有可能成为基因治疗的一种替代方案。嵌合分子靶向降解功能蛋白,有可能研制成药物,成为新的治疗方法。
技术实现要素:
本发明的目的在于提供一种嵌合分子及其制备和应用。
本发明首先提供了式(ⅰ)所示的化合物、或其立体异构体、或其药学上可接受的盐、或其溶剂合物:
m-l-n(i)
其中,l是连接单元,m和n上的一个原子分别被连接基团l的一端所取代;
单元m如式(a)或(c)所示:
单元n如式(b)所示:
其中,r1、r2中一个选自卤素、-nh-so2-r7、氢、氰基、硝基、烷基、烯基、炔基、环烷基、杂环烷基、芳基、杂环芳基,其中所述的烷基、烯基、炔基、环烷基、杂环烷基、芳基或杂环芳基分别独立地任选进一步被一个或多个选自氘原子、卤素、氰基、硝基、氧代基、烷基、卤代烷基、羟烷基、烯基、炔基、环烷基、杂环烷基、芳基、杂环芳基的取代基所取代;
其中,r7选自氢、氰基、硝基、烷基、环烷基、杂环烷基、芳基、杂环芳基;
r1、r2中另一个选自-a-的结构,其中a选自-o-、-cox-或-xco-、-nh-、-hnconh-、-nh-so2-r7、-so2-或-ch2-,x选自-ch2-、-nh-、-so2-、-o-、酰氨基、酯基或羰基,a与连接单元l相连;
r3、r4、r6分别独立地选自氢、卤素、氰基、硝基、烷基、烯基、炔基、环烷基、杂环烷基、芳基、杂环芳基,其中所述的烷基、烯基、炔基、环烷基、杂环烷基、芳基或杂环芳基分别独立地任选进一步被一个或多个选自氘原子、卤素、氰基、硝基、氧代基、烷基、卤代烷基、羟烷基、烯基、炔基、环烷基、杂环烷基、芳基、杂环芳基的取代基所取代;
r5选自烷基、烷氧基、氨基、酰氨基、酯基、羰基以及上述基团的任意组合。
进一步地,r1、r2中一个选自卤素、-nh-so2-r7、、氢,r1、r2中另一个选自-a-的结构,其中a选自-o-、-cox-或-xco-,x选自-ch2-、-nh-、-so2-、-o-、酰氨基、酯基或羰基,r7选自氢、氰基、硝基、烷基、环烷基、杂环烷基、芳基、杂环芳基。
进一步地,所述x选自-ch2-、-nh-、-o-、酯基或羰基。
进一步地,所述m结构为式(a1)或式(a2)所示:
其中,a1选自-cox-或-xco-,x选自-ch2-、-nh-、-o-、酯基或羰基;
r3、r6分别独立地选自氢、卤素、氰基、硝基、烷基、烯基、炔基、环烷基、杂环烷基、芳基、杂环芳基,其中所述的烷基、烯基、炔基、环烷基、杂环烷基、芳基或杂环芳基分别独立地任选进一步被一个或多个选自氘原子、卤素、氰基、硝基、氧代基、烷基、卤代烷基、羟烷基、烯基、炔基、环烷基、杂环烷基、芳基、杂环芳基的取代基所取代;
r7选自氢、氰基、硝基、烷基、环烷基、杂环烷基、芳基、杂环芳基。
进一步地,所述r6选自c1~c4烷基;优选地,所述r6选自甲基。
进一步地,所述r7选自c1~c4烷基;优选地,所述r7为乙基。
进一步地,所述m结构为式(a3)或式(a4)所示:
其中,a1选自-cox-或-xco-,x选自-ch2-、-nh-、-o-、酯基或羰基;
r3选自氢、卤素、氰基、硝基、烷基、烯基、炔基、环烷基、杂环烷基、芳基、杂环芳基,其中所述的烷基、烯基、炔基、环烷基、杂环烷基、芳基或杂环芳基分别独立地任选进一步被一个或多个选自氘原子、卤素、氰基、硝基、氧代基、烷基、卤代烷基、羟烷基、烯基、炔基、环烷基、杂环烷基、芳基、杂环芳基的取代基所取代。
进一步地,r3选自氢、卤素、烷基。
进一步地,所述m结构为(a5)或式(a6)所示:
其中,a1选自-cox-或-xco-;x选自-ch2-、-nh-、-o-、酯基或羰基。
进一步地,所述x选自-nh-或-o-。
进一步地,所述m结构为:
进一步地,所述l选自-(ch2ch2och2)n-co-、-(ch2ch2o)n-ch2co-、-(ch2och2ch2ch2o)n-ch2co-、-(ch2och2)n-co-、-(ch2och2ch2)n-ch2co-或-(ch2ch2och2)n-ch2co-,其中n为0~20的整数。
进一步地,n为1~3的整数。
进一步地,r4选自h或者ch3(s或r)。
进一步地,所述r5选自烷基或氨基。
进一步地,所述n结构为
其中,r4选自h或者ch3(s或r)。
进一步地,所述n结构为(b1)、(b2)或(b3)所示;
进一步地,所述化合物的结构如式(ⅱ)所示:
l如权利要求12或13所定义。
进一步地,所述化合物的结构如式(ⅲ)所示:
l如权利要求12或13所定义。
进一步地,所述化合物的结构如式(ⅳ)所示:
l如权利要求12或13所定义。
进一步地,所述化合物的结构如式(ⅴ)所示:
l如权利要求12或13所定义。
进一步地,所述化合物的结构如式(ⅵ)所示:
l如权利要求12或13所定义。
进一步地,所述化合物的结构如式(ⅶ)所示:
l如权利要求12或13所定义。
进一步地,所述化合物的结构如式(ⅷ)所示:
l如权利要求12或13所定义。
进一步地,所述化合物的结构如式(ⅸ)所示:
l如权利要求12或13所定义。
进一步地,所述化合物的结构如式(ⅹ)所示:
l如权利要求12或13所定义。
进一步地,所述化合物的结构如式(ⅹⅰ)所示:
l如权利要求12或13所定义。
进一步地,所述化合物的结构如式(ⅹⅱ)所示:
l如权利要求12或13所定义。
进一步地,所述化合物的结构如式(ⅹⅲ)所示:
l如权利要求12或13所定义。
进一步地,所述化合物为如下化合物之一:
本发明还提供了该化合物、或其立体异构体、或其药学上可接受的盐、或其溶剂合物在制备brd4抑制剂类或蛋白降解剂类药物上的用途。
进一步地,所述药物是治疗癌症或冠状动脉疾病的药物。
进一步地,所述癌症是前列腺癌、非小细胞肺癌、乳腺癌、黑色素瘤、白血病或直肠癌。
本发明还提供了一种药物组合物,它是以前述的化合物或其立体异构体、或其药学上可接受的盐、或其溶剂合物为活性成分,加上药学上可接受的辅料制备而成的制剂。
关于本发明的使用术语的定义:除非另有说明,本文中基团或者术语提供的初始定义适用于整篇说明书的该基团或者术语;对于本文没有具体定义的术语,应该根据公开内容和上下文,给出本领域技术人员能够给予它们的含义。
“取代”是指分子中的氢原子被其它不同的原子或分子所替换。
碳氢基团中碳原子含量的最小值和最大值通过前缀表示,例如,前缀(ca~cb)烷基表明任何含“a”至“b”个碳原子的烷基。因此,例如,(c1~c6)烷基是指包含1~6个碳原子的烷基。
所述c1~c4烷基是指c1、c2、c3、c4的烷基,即具有1~4个碳原子的直链或支链的烷基,例如甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、仲丁基等等。
所述环烷基是指环状烷基,例如环丙基、环丁基、环戊基、环己基等等。
所述卤素是指氟原子、溴原子、氯原子、碘原子。
术语“药学上可接受的”是指某载体、运载物、稀释剂、辅料,和/或所形成的盐通常在化学上或物理上与构成某药物剂型的其它成分相兼容,并在生理上与受体相兼容。
术语“盐”和“可药用的盐”是指上述化合物或其立体异构体,与无机和/或有机酸和碱形成的酸式和/或碱式盐,也包括两性离子盐(内盐),还包括季铵盐,例如烷基铵盐。这些盐可以是在化合物的最后分离和纯化中直接得到。也可以是通过将上述化合物,或其立体异构体,与一定数量的酸或碱适当(例如等当量)进行混合而得到。这些盐可能在溶液中形成沉淀而以过滤方法收集,或在溶剂蒸发后回收而得到,或在水介质中反应后冷冻干燥制得。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
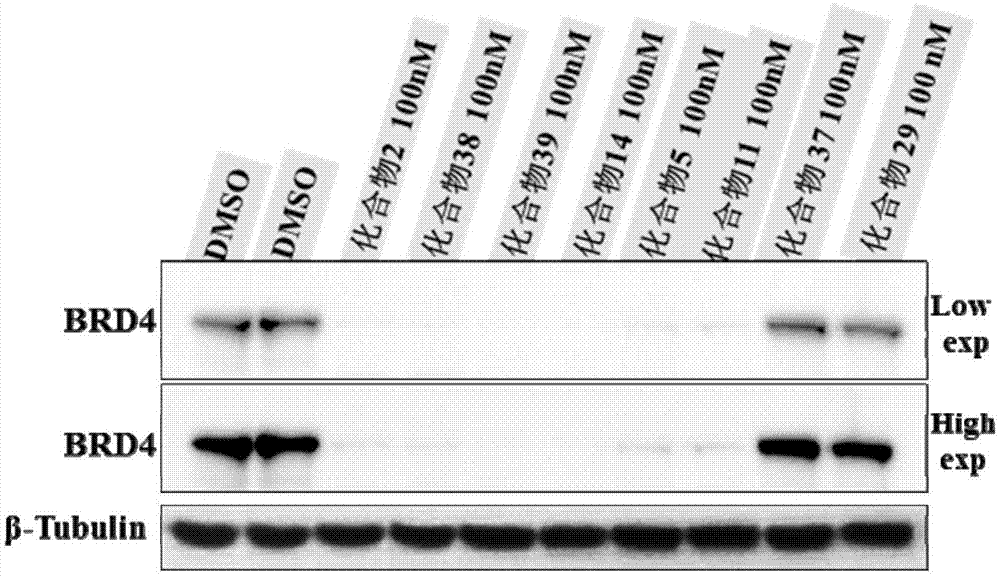
图1为本发明化合物对brd4蛋白的电泳图谱。
具体实施方式
实施例1、化合物1(2s,4r)-1-((s)-13-叔丁基-1-(4-(2,4-二氟苯氧)-3-(6-甲基-7-氧代-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4-yl)苯基)-1,11-二氧代-5,9-二氧-2,12-二氮十四烷基-14-羰基)-4-羟基-n-(4-(4-甲基噻唑-5-yl)苯基)四氢吡咯-2-酰胺(1)的合成
(1)中间体1(e)-2-(5-溴-2-甲氧基-3-硝基吡啶-4-基)-n,n-二甲基乙胺的合成
向装有n,n-二甲基甲酰胺(4l)的10l的反应瓶中加入5-溴-2-甲氧基-4-甲基-3-硝基吡啶(200g,0.8mol),n,n-二甲基甲酰胺二甲基缩醛(571.2g,4.8mol),甲醇锂(0.9g,0.024mol),加热到110℃搅拌反应3个小时。待反应液冷却至室温后,将其倒入冰水(12l)中,充分析出固体后,抽滤,水(1l)洗,烘干。得棕红色固体粉末中间体1(240g),收率98%。
(2)中间体24-溴-7-甲氧基-1h-吡咯并[2,3-c]吡啶的合成
向10l的反应瓶中加入溶剂乙酸乙酯(5l),还原铁粉(223g,3.97mol),乙酸(2.3l,39.7mol),升温至80℃后,加入中间体化合物1(240g,0.79mol)。加完后继续于该温度下反应30分钟。冷却,抽滤,旋干,用乙醇(1l)和水(1l)的混合溶剂打浆。抽滤烘干后得中间体化合物2(140g),收率78%。
(3)中间体34-溴-7-甲氧基-1-对甲苯磺酰基-1h-吡咯并[2,3-c]吡啶的合成
向5l的反应瓶中加入n,n-二甲基甲酰胺(2l),中间体化合物2(140g,0.62mol)。溶清后,冰水浴下冷却至0℃,并向反应液中加入nah(40g,60%,0.99mol),控制反应升温不超过10℃。加完nah停止冒出气泡后,加入对甲苯磺酰氯(177g,0.93mol),室温下搅拌过夜。反应完全后,将反应液倒入6l水中,析出固体,抽滤,固体用200ml乙酸乙酯溶解,加入600ml正己烷,析出固体,抽滤后得中间体化合物3(188g),收率80%。
(4)中间体44-溴-1-甲苯磺酰基-1h-吡咯并[2,3-c]吡啶-7(6h)-酮的合成
向5l的反应瓶中加入1,4-二氧六环2l,甲醇(78g,2.45mol)。室温下,向反应瓶中加入乙酰氯(154g,1.96mol)。加入完毕后,继续搅拌1个小时。加入中间体化合物3(188g,0.49mol),并升温至80℃,搅拌过夜。反应完全后,旋干,用300ml甲基叔丁基醚打浆,抽滤后得中间体化合物4(139g),收率77%。
(5)中间体54-溴-6-甲基-1-甲苯磺酰基-1h-吡咯并[2,3-c]吡啶-7(6h)-酮的合成
向5l的反应瓶中加入1,4-二氧六环2l,中间体化合物4(79g,0.21mol)、碳酸铯(118g,0.32mol)、碘甲烷(92g,0.64mol)室温下,搅拌过夜。反应完全后,过滤,旋干,得中间体化合物5(75g),收率94%。
(6)中间体66-甲基-4-(4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷-2-基)-1-甲苯磺酰基-1h-吡咯并[2,3-c]吡啶-7(6h)-酮的合成
向2l的反应瓶中加入800ml的1,4-二氧六环,中间体化合物5(40g,0.1mol)、联硼酸频哪醇酯(105g,0.4mol)、醋酸钾(20.4g,0.2mol),氮气置换三次后加入四三苯基磷钯(12g,0.01mol),氮气置换三次,升温至110℃,搅拌过夜。反应完全后,过滤,柱层析得中间体化合物6(40g),收率93%。
(7)中间体83-溴-4-(2,4-二氟苯氧基)苯甲酸甲酯的合成
向250ml的反应瓶中加入中间体化合物7(5g,21.5mmol),2,4-二氟苯酚(4.2g,32.3mmol),碳酸铯(12.5g,38.3mmol)以及150mldmso,升温至110度,搅拌过夜。反应完全后,加水200ml,乙酸乙酯萃取,无水硫酸钠干燥,柱层析得中间体化合物8(6.2g,收率84%)。
(8)中间体9(2,4-二氟苯氧基)-3-(6-甲基-7-氧代-1-甲苯磺酰基-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4-基)苯甲酸甲酯的合成
向100ml的反应瓶中加入中间体化合物8(500mg,1.46mmol),中间体化合物6(750mg,1.75mmol),四三苯基磷钯(168mg,0.146mmol),碳酸钾(400mg,2.9mmol)以及50mln,n-二甲基甲酰胺和1-2滴水,氮气置换三次,升温至90℃,搅拌过夜。反应完全后,加入50ml水,乙酸乙酯萃取,无水硫酸钠干燥,柱层析得中间体化合物9(370mg,收率45%)。
(9)中间体10(2,4-二氟苯氧基)-3-(6-甲基-7-氧代-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4-基)苯甲酸的合成:
向50ml的反应瓶中加入中间体化合物9(350mg,0.62mmol),5nkoh,5ml四氢呋喃,升温至80℃,搅拌4小时。反应完全后,浓缩除去四氢呋喃,加2n盐酸调ph<3,过滤,水洗涤,固体干燥得中间体化合物10(185mg,75%)。
(10)中间体12((2-(烯丙氧基)乙氧基)甲基)苯的合成
向250ml的反应瓶中加入中间体化合物11(10g,66mmol),100ml四氢呋喃,冰浴下,加入氢化钠(1.89g,79mmol),搅拌半小时,加入溴丙烯(8g,66mmol),升温至40℃,搅拌30分钟,硅藻土过滤,乙酸乙酯洗涤,滤液浓缩得中间体化合物12(7.6g,60%)。
(11)中间体133-(2-(苄氧基)乙氧基)丙-1-醇的合成
向250ml的反应瓶中加入中间体化合物12(2.5g,13mmol),25ml四氢呋喃,冰浴下,加入硼烷的四氢呋喃溶液(20ml,1mol/l),升温至25度,搅拌2小时,加入饱和醋酸钠水溶液7ml,30%双氧水6ml,继续搅拌1小时。反应完毕后,加入乙酸乙酯萃取,无水硫酸钠干燥,柱层析得中间体化合物13(1g,收率37%)。
(12)中间体142-(3-(2-(苄氧基)乙氧基)丙氧基)乙酸乙酯的合成
向250ml的反应瓶中加入中间体化合物13(1.6g,7.7mmol),15ml二氯甲烷,冰浴下加入重氮乙酸乙酯(0.9g,7.7mmol),加入0.1ml三氟化硼乙醚溶液,搅拌30分钟,反应完毕后,加入10ml水,有机层无水硫酸钠干燥,柱层析得到中间体化合物14(1.36g,收率60%)。
(13)中间体152-(3-(2-羟基乙氧基)丙氧基)乙酸乙酯的合成
向100ml反应瓶中加入中间体化合物14(1.3g),0.25ml醋酸,0.2g钯炭,10ml甲醇,氢气置换三次,室温下搅拌5小时。反应完毕后,过滤,浓缩,柱层析得到中间体化合物15(0.77g,收率82%)。
(14)中间体162-(3-(2-((甲基磺酰基)氧基)乙氧基)丙氧基)乙酸乙酯的合成
向100ml反应瓶中加入中间体化合物15(0.77g,3.7mmol),三乙胺(560mg,5.55mmol),10ml二氯甲烷,冰浴下加入甲烷磺酰氯(500mg,4.44mol),室温下搅拌2小时,反应完毕后,加入1nhcl调ph<5,二氯甲烷萃取,无水硫酸钠干燥,浓缩,得中间体化合物16直接用于下一步。
(15)中间体172-(3-(2-(1,3-二氧代异吲哚啉-2-基)乙氧基)丙氧基)乙酸乙酯的合成
向100ml反应瓶中加入中间体化合物16,邻苯丁二酰亚胺(0.4g),碳酸钾(0.5g),以及10mln,n-二甲基甲酰胺,升温至95度,搅拌3小时。反应完毕后,加10ml水,乙酸乙酯萃取,无水硫酸钠干燥,柱层析得中间体化合物17(0.7g,两步收率61%)。
(16)中间体182-(3-(2-氨基乙氧基)丙氧基)乙酸乙酯的合成
向100ml的反应瓶中加入中间体化合物17(0.7g,2mmol),0.3g水合肼,10ml甲醇,升温至70度,搅拌1小时,反应完毕后,浓缩,加水,乙酸乙酯萃取,无水硫酸钠干燥,柱层析得中间体化合物18(0.36g,收率84%)。
(17)中间体192-(3-(2-(4-(2,4-二氟苯氧基)-3-(6-甲基-7-氧代-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4-基)苯甲酰氨基)乙氧基)丙氧基)乙酸乙酯的合成
向100ml的反应瓶中加入中间体化合物10(200mg,0.5mmol),中间体化合物18(104mg,0.5mmol),2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯hatu(300mg,0.8mmol),n,n-二异丙基乙胺dipea(208mg,1.6mmol),20mldmf,室温下搅拌过夜,加入10ml水,乙酸乙酯萃取,无水硫酸钠干燥,浓缩,柱层析,得到中间体化合物19(180mg,收率61%)。
(18)中间体202-(3-(2-(4-(2,4-二氟苯氧基)-3-(6-甲基-7-氧代-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4-苯甲酰氨基)乙氧基)丙氧基)乙酸的合成
向50ml的反应瓶中加入中间体化合物19(180mg,0.3mmol),2n氢氧化锂水溶液(1ml),甲醇2ml,升温至60度,反应完毕后,加2nhcl调ph<4,过滤,得中间体化合物20(150mg,收率88%)。
(19)化合物2的合成:化合物2(2s,4r)-1-((s)-13-叔丁基-1-(4-(2,4-二氟苯氧)-3-(6-甲基-7-氧代-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4-yl)苯基)-1,11-二氧代-5,9-二氧-2,12-二氮十四烷基-14-羰基)-4-羟基-n-((s)-1-4-(4-甲基噻唑-5-yl)苯基)乙基)四氢吡咯-2-酰胺的制备
向50ml的反应瓶中加中间体化合物20(100mg,0.18mmol),中间体化合物21(根据us20170327469合成)(84mg,0.18mmol),2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯hatu(76mg,0.2mmol),n,n-二异丙基乙胺dipea(52mg,0.4mmol),10mldmf,室温下搅拌过夜,加入10ml水,乙酸乙酯萃取,无水硫酸钠干燥,浓缩,柱层析,得到98mg化合物2,淡黄色固体,收率为56%,质谱:质谱982(m+h+)。1hnmr(400mhz,dmso)δ11.98(s,1h),8.95(s,1h),8.45-8.44(m,1h),8.34-8.33(m,1h),7.85-7.84(m,1h),7.63-7.62(m,1h),7.47-7.36(m,8h),7.07–6.95(m,2h),6.9-6.89(m,1h),6.25(s,1h),5.16(s,1h),4.97–4.85(m,1h),4.53-4.51(m,1h),4.46-4.42(m,1h),4.24(s,1h),,4.01–3.83(m,2h),3.66-3.60(m,10h),3.55(s,3h),2.43(s,3h),2.07–1.97(m,1h),1.92–1.85(m,2h),1.82–1.75(m,1h),1.44-1.38(m,3h),0.91(s,9h).
实施例2、化合物5(2s,4r)-1-((s)-12-叔丁基-1-(4-(2,4-二氟苯氧)-3-(6-甲基-7-氧代-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4-yl)苯基)-1,10-二氧代-5,8-二氧-2,11-二氮十三烷基-13-羰基)-4-羟基-n-((s)-1-4-(4-甲基噻唑-5-yl)苯基)乙基)四氢吡咯-2-酰胺的制备
同实施例1相同,向50ml的反应瓶中加入中间体化合物22(根据中间体化合物20的合成方法,其中步骤(12)由乙二醇替代中间体化合物13合成)(100mg,0.18mmol),中间体化合物21(根据us20170327469合成)(84mg,0.18mmol),2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯hatu(76mg,0.2mmol),n,n-二异丙基乙胺dipea(52mg,0.4mmol),10mldmf,室温下搅拌过夜,加入10ml水,乙酸乙酯萃取,无水硫酸钠干燥,浓缩,柱层析,得到95mg化合物5,淡黄色固体,收率为55%,质谱968(m+h+)。1hnmr(400mhz,dmso)δ12.03(s,1h),8.97(s,1h),8.45-8.41(m,1h),8.34-8.32(m,1h),7.86-7.84(m,1h),7.65-7.63(m,1h),7.48-7.35(m,8h),7.06–6.93(m,2h),6.91-6.89(m,1h),6.27(s,1h),5.17(s,1h),4.98–4.87(m,1h),4.55-4.52(m,1h),4.47-4.45(m,1h),4.25(s,1h),,4.02–3.87(m,2h),3.68-3.63(m,10h),3.53(s,3h),2.41(s,3h),2.06–1.99(m,1h),1.85–1.77(m,1h),1.45-1.39(m,3h),0.93(s,9h).
实施例3、化合物8(2s,4r)-1-((s)-15-叔丁基-1-(4-(2,4-二氟苯氧)-3-(6-甲基-7-氧代-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4-yl)苯基)-1,13-二氧代-5,8,11-三氧-2,14-二氮十六烷基-16-羰基)-4-羟基-n-((s)-1-4-(4-甲基噻唑-5-yl)苯基)乙基)四氢吡咯-2-酰胺的制备
同实施例1相同,向50ml的反应瓶中加入中间体化合物23(根据中间体化合物20的合成方法,其中步骤(12)由二乙二醇替代中间体化合物13为原料合成)(100mg,0.18mmol),中间体化合物21(根据us20170327469合成)(84mg,0.18mmol),2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯hatu(76mg,0.2mmol),n,n-二异丙基乙胺dipea(52mg,0.4mmol),10mldmf,室温下搅拌过夜,加入10ml水,乙酸乙酯萃取,无水硫酸钠干燥,浓缩,柱层析,得到100mg产物8,淡黄色固体,收率为56%,质谱1012(m+h+)。1hnmr(400mhz,dmso)δ12.01(s,1h),8.99(s,1h),8.43-8.40(m,1h),8.36-8.33(m,1h),7.88-7.85(m,1h),7.66-7.64(m,1h),7.46-7.37(m,8h),7.05–6.98(m,2h),6.93-6.88(m,1h),6.25(s,1h),5.15(s,1h),4.97–4.89(m,1h),4.57-4.53(m,1h),4.48-4.46(m,1h),4.23(s,1h),4.01–3.89(m,2h),3.69-3.65(m,14h),3.51(s,3h),2.47(s,3h),2.08–1.97(m,1h),1.88–1.79(m,1h),1.47-1.37(m,3h),0.96(s,9h).
实施例4、化合物11(2s,4r)-1-((s)-2-(2-(3-(2-((4-(2,4-二氟苯氧)-3-(6-甲基-7-氧代-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4-yl)苯基)氨基)-2-氧代乙氧基)丙烷)乙酰胺基)-叔丁基)-4-羟基-n-((s)-1-4-(4-甲基噻唑-5-yl)苯基)乙基)四氢吡咯-2-酰胺的制备
(1)中间体242-溴-1-(2,4-二氟苯氧基)-4-硝基苯的合成
向250ml反应瓶中加入3-溴-4-氟硝基苯(5.5g,25mmol),2,4-二氟苯酚(5g,38mmol),碳酸铯(12.5g,50mmol)和100mldmso,升温至110度,搅拌4小时。反应完毕后,加入200ml水,过滤,干燥得中间体化合物24(5.1g),收率62%。
(2)中间体253-溴-4-(2,4-二氟苯氧基)苯胺的合成
向250ml反应瓶中加入中间体化合物24(2g,6mmol),铁粉(1.8g,32mmol),20ml四氢呋喃,20ml乙醇和10ml水,升温至100度,搅拌4小时。反应完毕后,乙酸乙酯萃取,无水硫酸钠干燥,柱层析得中间体化合物25(1.1g,收率62%)。
(3)中间体264-(5-氨基-2-(2,4-二氟苯氧基)苯基)-6-甲基-1-对甲苯磺酰-1,6-二氢-7h-吡咯并[2,3-c]吡啶-7-酮的合成
向100ml的反应瓶中加入中间体化合物25(500mg,1.6mmol),中间体化合物6(750mg,1.75mmol),四三苯基磷钯(168mg,0.146mmol),碳酸钾(400mg,2.9mmol)以及50mln,n-二甲基甲酰胺和1-2滴水,氮气置换三次,升温至90℃,搅拌过夜。反应完全后,加入50ml水,乙酸乙酯萃取,无水硫酸钠干燥,柱层析得中间体化合物26(450mg,收率51.7%)。
(4)中间体274-(5-氨基-2-(2,4-二氟苯氧基)苯基)-6-甲基-1,6-二氢-7h-吡咯并[2,3-c]吡啶-7-酮的合成
向50ml的反应瓶中加入中间体化合物26(450mg,0.86mmol),5nkoh,5ml四氢呋喃,升温至80℃,搅拌4小时。反应完全后,浓缩除去四氢呋喃,加2n盐酸调ph<3,过滤,水洗涤,固体干燥得中间体化合物27(225mg,71.2%)。
(5)中间体282-(3-羟基丙氧基)乙酸乙酯的合成
向250ml的反应瓶中加入丙二醇(10g,131mmol),100ml二氯甲烷,冰浴下加入重氮乙酸乙酯(3g,26mmol),加入三滴三氟化硼乙醚溶液,搅拌30分钟,反应完毕后,加入100ml水,有机层无水硫酸钠干燥,柱层析得到中间体化合物28(1.3g,收率30%)。
(6)中间体292-(3-(2-乙氧基-2-氧代乙氧基)丙氧基)乙酸叔丁酯的合成
向250ml的反应瓶中加入中间体化合物28(1.2g,7.4mmol),50ml二氯甲烷,冰浴下加入重氮乙酸乙酯(1.2g,8.4mmol),加入三滴三氟化硼乙醚溶液,搅拌30分钟,反应完毕后,加入50ml水,有机层无水硫酸钠干燥,柱层析得到中间体化合物29(1.1g,收率55%)。
(7)中间体302-(3-(2-(叔丁氧基)-2-氧代乙氧基)丙氧基)乙酸的合成
向100ml的反应瓶中加入中间体化合物29(1.1g,4mmol),4n氢氧化钾,10ml水和10ml四氢呋喃,室温搅拌30分钟,反应完毕后,用2nhcl调ph<4,乙酸乙酯萃取,有机层无水硫酸钠干燥,柱层析得到中间体化合物30(800mg,收率71%)。
(8)中间体31(3-(2-((4-(2,4-二氟苯氧基)-3-(6-甲基-7-氧代-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4-基)苯基)氨基)-2-氧代乙氧基)丙氧基)乙酸乙酯的合成
向50ml的反应瓶中加入中间体化合物27(240mg,0.8mmol),中间体化合物28(240mg,0.96mmol),2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯hatu(480mg,1.26mmol),n,n-二异丙基乙胺dipea(164mg,1.26mmol),10mldmf,室温下搅拌过夜,加入10ml水,乙酸乙酯萃取,无水硫酸钠干燥,浓缩,柱层析,得到中间体化合物31(170mg,收率为40%)。
(9)中间体322-(3-(2-((4-(2,4-二氟苯氧基)-3-(6-甲基-7-氧代-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4--基)苯基)氨基)-2-氧代乙氧基)丙氧基)乙酸的合成
向50ml的反应瓶中加入中间体化合物31(170mg,0.28mmol),10ml甲酸,升温至40度,搅拌过夜。反应完毕后,浓缩,柱层析得到中间体化合物32(130mg,收率85%)。
(10)化合物11的合成
向50ml的反应瓶中加入中间体化合物32(100mg,0.18mmol),中间体化合物21(根据us20170327469合成)(84mg,0.18mmol),2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯hatu(76mg,0.2mmol),n,n-二异丙基乙胺dipea(52mg,0.4mmol),10mldmf,室温下搅拌过夜,加入10ml水,乙酸乙酯萃取,无水硫酸钠干燥,浓缩,柱层析,得到101mg化合物11,淡黄色固体,收率为58%,质谱968(m+h+)。1hnmr(400mhz,dmso)δ12.02(s,1h),9.79(s,1h),8.98(s,1h),8.44-8.42(m,1h),7.84-7.83(m,1h),7.62-7.61(m,1h),7.49-7.34(m,8h),7.08–6.93(m,2h),6.91-6.9(m,1h),6.28(s,1h),5.14(s,1h),4.95–4.80(m,1h),4.55-4.53(m,1h),4.44-4.43(m,1h),4.28(s,1h),4.06(s,2h),4.01–3.86(m,2h),3.65-3.61(m,6h),3.53(s,3h),2.45(s,3h),2.09–1.99(m,1h),1.94–1.82(m,2h),1.81–1.70(m,1h),1.4-1.36(m,3h),0.89(s,9h).
实施例5、化合物14(2s,4r)-1-((s)-2-(2-(2-(2-((4-(2,4-二氟苯氧)-3-(6-甲基-7-氧代-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4-yl)苯基)氨基)-2-氧代乙氧基)丙烷)乙酰胺基)-叔丁基)-4-羟基-n-((s)-1-4-(4-甲基噻唑-5-yl)苯基)乙基)四氢吡咯-2-酰胺的制备
向50ml的反应瓶中加入中间体化合物33(根据中间体化合物32的合成方法由乙二醇替代丙二醇为原料合成(100mg,0.18mmol),中间体化合物21(根据us20170327469合成)(84mg,0.18mmol),2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯hatu(76mg,0.2mmol),n,n-二异丙基乙胺dipea(52mg,0.4mmol),10mldmf,室温下搅拌过夜,加入10ml水,乙酸乙酯萃取,无水硫酸钠干燥,浓缩,柱层析,得到95mg化合物14,淡黄色固体,收率为54%,质谱955(m+h+)。1hnmr(400mhz,dmso)δ12.03(s,1h),9.77(s,1h),8.96(s,1h),8.45-8.41(m,1h),7.86-7.85(m,1h),7.63-7.62(m,1h),7.48-7.33(m,8h),7.07–6.95(m,2h),6.93-6.91(m,1h),6.25(s,1h),5.11(s,1h),4.91–4.85(m,1h),4.57-4.51(m,1h),4.46-4.42(m,1h),4.27(s,1h),4.05(s,2h),4.01–3.88(m,2h),3.69-3.62(m,6h),3.51(s,3h),2.47(s,3h),2.05–1.97(m,1h),1.80–1.75(m,1h),1.42-1.38(m,3h),0.92(s,9h).
实施例6、化合物17(2s,4r)-1-((s)-2-叔丁基-14-((4-(2,4-二氟苯氧)-3-(6-甲基-7-氧代-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4-yl)苯基)氨基)-4,14-二氧代-6,9,12-三氧-3-氮十三烷基-1-羰基)-4-羟基-n-((s)-1-4-(4-甲基噻唑-5-yl)苯基)乙基)四氢吡咯-2-酰胺的制备
向50ml的反应瓶中加入中间体化合物34(根据中间体化合物32的合成方法由二乙二醇替代丙二醇为原料合成(100mg,0.18mmol),中间体化合物21(根据us20170327469合成)(84mg,0.18mmol),2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯hatu(76mg,0.2mmol),n,n-二异丙基乙胺dipea(52mg,0.4mmol),10mldmf,室温下搅拌过夜,加入10ml水,乙酸乙酯萃取,无水硫酸钠干燥,浓缩,柱层析,得到93mg化合物17,淡黄色固体,收率为55%,质谱999(m+h+)。1hnmr(400mhz,dmso)δ11.98(s,1h),9.79(s,1h),8.91(s,1h),8.47-8.43(m,1h),7.87-7.83(m,1h),7.65-7.61(m,1h),7.49-7.37(m,8h),7.09–6.99(m,2h),6.95-6.92(m,1h),6.26(s,1h),5.13(s,1h),4.93–4.87(m,1h),4.59-4.53(m,1h),4.47-4.45(m,1h),4.29(s,1h),4.07(s,2h),4.03–3.89(m,2h),3.67-3.61(m,10h),3.53(s,3h),2.48(s,3h),2.07–1.99(m,1h),1.83–1.79(m,1h),1.44-1.37(m,3h),0.9(s,9h).
实施例7、化合物29(2s,4r)-1-((s)-2-(2-(3-(2-(4-(4-(乙硫酰胺)-2-(6-甲基-7-氧代-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4-yl)苯氧基)-3-氟苯氧基)乙氧基)丙烷)乙酰胺)-3,3-二甲基丁基氧代)-4-羟基-n-((s)-1-4-(4-甲基噻唑-5-yl)苯基)乙基)四氢吡咯-2-酰胺的制备
(1)中间体36n-(4-(2-氟-4-甲氧基苯氧基)-3-(6-甲基-7-氧代-1-对甲苯磺酰-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4-基)苯基)乙磺酰胺的合成
向50ml的反应瓶中加入中间体化合物35(根据中间体化合物26的合成方法由2-氟-4-甲氧基苯酚替代2,4-二氟苯酚为原料合成(1g,1.87mmol),三乙胺(283mg,2.8mmol)和20ml二氯甲烷,冰浴下,加入乙基磺酰氯(360mg,2.8mmol)。反应完毕后,加20ml水,二氯甲烷萃取,无水硫酸钠干燥,柱层析后得到中间体化合物36(0.95g,收率84%)。
(2)中间体37n-(4-(2-氟-4-甲氧基苯氧基)-3-(6-甲基-7-氧代-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4-基)苯基)乙磺酰胺的合成
向50ml的反应瓶中加入中间体化合物36(0.9g,1.43mmol),5nkoh,5ml四氢呋喃,升温至80℃,搅拌4小时。反应完全后,浓缩除去四氢呋喃,加2n盐酸调ph<3,过滤,水洗涤,固体干燥得中间体化合物37(600mg,88%)。
(3)中间体38n-(4-(2-氟-4-羟基苯氧基)-3-(6-甲基-7-氧代-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4-基)苯基)乙磺酰胺的合成
向50ml的反应瓶中加入中间体化合物37(0.6g,1.27mmol),hbr水溶液10ml,10ml四氢呋喃,升温至80℃,搅拌4小时。反应完全后,乙酸乙酯萃取,无水硫酸钠干燥,柱层析得中间体化合物38(480mg,82.7%)。
(4)中间体392-(3-(2-(4-(4-(乙基磺酰氨基)-2-(6-甲基-7-氧代-6,7-二氢-1h-吡咯并[2,3-c]苯氧基)-3-氟苯氧基)乙氧基)丙氧基)乙酸乙酯的合成
向50ml的反应瓶中加入中间体化合物38(400mg,0.87mmol),中间体化合物15(180mg,0.87mmol),三苯基磷(262mg,1mmol),冰浴下加入偶氮二甲酸二异丙酯(220mg,1.1mmol),搅拌4小时。反应完全后,乙酸乙酯萃取,无水硫酸钠干燥,柱层析得中间体化合物39(220mg,41%)。
(5)中间体402-(3-(2-(4-(4-(乙基磺酰胺基)-2-(6-甲基-7-氧代-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4-基)苯氧基)-3-氟苯氧基)乙氧基)丙氧基)乙酸的合成
向50ml的反应瓶中加入中间体化合物39(220mg,0.34mmol),5nkoh,5ml四氢呋喃,升温至80℃,搅拌4小时。反应完全后,浓缩除去四氢呋喃,加2n盐酸调ph<3,过滤,水洗涤,固体干燥得中间体化合物40(150mg,71%)。
(6)化合物29的合成
向50ml的反应瓶中加入中间体化合物40(100mg,0.18mmol),中间体化合物21(根据us20170327469合成)(84mg,0.18mmol),2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯hatu(76mg,0.2mmol),n,n-二异丙基乙胺dipea(52mg,0.4mmol),10mldmf,室温下搅拌过夜,加入10ml水,乙酸乙酯萃取,无水硫酸钠干燥,浓缩,柱层析,得到89mg产物29,淡黄色固体,收率为51%,质谱1045(m+h+)。1hnmr(400mhz,dmso)δ12.02(s,1h),9.58(s,1h),8.98(s,1h),8.44-8.42(m,1h),7.84-7.83(m,1h),7.62-7.61(m,1h),7.49-7.34(m,8h),7.08–6.93(m,2h),6.91-6.9(m,1h),6.28(s,1h),5.14(s,1h),4.95–4.80(m,1h),4.55-4.53(m,1h),4.44-4.43(m,1h),4.28(s,1h),4.06(s,2h),4.01–3.86(m,2h),3.65-3.61(m,8h),3.53(s,3h),3.07-3.04(m,2h),2.45(s,3h),2.09–1.99(m,1h),1.94–1.82(m,2h),1.81–1.70(m,1h),1.4-1.36(m,3h),1.25-1.23(m,3h),0.89(s,9h).
实施例8、化合物37(2s,4r)-1-s)-13-(叔丁基)-1-4-(2,4-二氟苯氧基)-3-(6-甲基-7-氧代-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4-基)苯基)氨基)-1,11二氧代-5,9-二氧杂-2,12-二氮十四烷-14酰基)-4-羟基n-((s)-1-(4-(4-甲基噻唑-5-基)苯基)乙基)吡咯烷-2-甲酰胺的制备
(1)中间体412-(3-(2-(3-(4-(2,4-二氟苯氧基)-3-(6-甲基-7-氧代-1-甲苯磺酰基-6,7-二氢-1h-吡咯并[2,3-3-c]吡啶-4-基)苯基)脲基)乙氧基)丙氧基)乙酸乙酯的合成
向50ml的反应瓶中加入三光气(88mg,0.296mmol),5ml四氢呋喃,冰浴下加入中间体化合物18(220mg,1.07mmol)和三乙胺(60mg,0.6mmol)的5ml四氢呋喃溶液,搅拌30分钟,加入中间体化合物26(100mg,0.19mmol),搅拌1小时。反应完全后,乙酸乙酯萃取,无水硫酸钠干燥,柱层析后得中间体化合物41(56mg,38.9%)。
(2)中间体422-(3-(2-(3-(4-(2,4-二氟苯氧基)-3-(6-甲基-7-氧代-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4-基)苯基)脲基)乙氧基)丙氧基)乙酸的合成
向50ml的反应瓶中加入中间体化合物41(56mg,0.074mmol),5nkoh,5ml四氢呋喃,升温至80℃,搅拌4小时。反应完全后,浓缩除去四氢呋喃,加2n盐酸调ph<3,过滤,水洗涤,固体干燥得中间体化合物42(35mg,83%)。
(3)化合物37的合成
向50ml的反应瓶中加入中间体化合物42(42mg,0.074mmol),中间体化合物21(根据us20170327469合成)(36mg,0.074mmol),2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯hatu(38mg,0.1mmol),n,n-二异丙基乙胺dipea(26mg,0.2mmol),10mldmf,室温下搅拌过夜,加入10ml水,乙酸乙酯萃取,无水硫酸钠干燥,浓缩,柱层析,得到32mg产物37,淡黄色固体,收率为44%,质谱997(m+h+)。1hnmr(400mhz,dmso)δ12.00(s,1h),9.45(s,1h),8.98(s,1h),8.49-8.48(m,1h),7.65-7.64(m,1h),7.46–7.16(m,8h),7.02-7.01(m,1h),6.93-6.92(m,3h),6.86-6.84(m,2h),6.26(s,1h),4.96–4.83(m,1h),4.54-4.53(m,1h),4.46-4.45(m,2h),4.28(s,2h),4.00–3.84(m,2h),3.66–3.47(m,13h),2.45(s,3h),2.1-2.08(m,1h),1.84–1.71(m,1h),1.36-1.33(m,3h),0.90(s,9h).
实施例9、化合物38(2s,4r)-1-((s)-2-(2-(3-(2-(n-(4-(2,4-二氟苯氧基)-3-(6-甲基-7-氧代-6-1,7-二氢-1h-吡咯并[2,3-c]吡啶-4-基)苯基)乙基磺酰氨基)乙氧基)丙氧基)乙酰氨基)-3,3-二甲基丁酰基)-4-羟基-n-((s)-1-(4-(4-甲基噻唑-5-基)苯基)乙基)吡咯烷-2-甲酰胺的制备
(1)中间体43n-(4-(2,4-二氟苯氧基)-3-(6-甲基-7-氧代-1-对甲苯磺酰-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4-基)苯基)乙磺酰胺的合成
向50ml的反应瓶中加入中间体化合物26(1g,1.92mmol),三乙胺(283mg,2.8mmol)和20ml二氯甲烷,冰浴下,加入乙基磺酰氯(360mg,2.8mmol)。反应完毕后,加20ml水,二氯甲烷萃取,无水硫酸钠干燥,柱层析后得到中间体化合物43(0.9g,收率77%)。
(2)中间体442-(3-(2-(n-(4-(2,4-二氟苯氧基)-3-(6-甲基-7-氧代-1-甲苯磺酰基-6,7-二氢-1h-吡咯并[2,3-3-c]吡啶-4-基)苯基)乙基磺酰氨基)乙氧基)丙氧基)乙酸乙酯的合成
向50ml的反应瓶中加入中间体化合物43(150mg,0.244mmol),中间体化合物16(70mg,0.244mmol),碳酸铯(163mg,0.5mmo),10mg碘化钾和20mldmso,10ml水,升温至100度,搅拌过夜。反应完毕后,加20ml水,乙酸乙酯萃取,无水硫酸钠干燥,柱层析后得到中间体化合物44(110mg,收率57%)。
(3)中间体452-(3-(2-(n-(4-(2,4-二氟苯氧基)-3-(6-甲基-7-氧代-6,7-二氢-1h-吡咯并[2,3-c]吡啶-4-基)苯基)乙基磺酰氨基)乙氧基)丙氧基)乙酸的合成
向50ml的反应瓶中加入中间体化合物44(110mg,0.137mmol),5nkoh,5ml四氢呋喃,升温至80℃,搅拌4小时。反应完全后,浓缩除去四氢呋喃,加2n盐酸调ph<3,过滤,水洗涤,固体干燥得中间体化合物45(46mg,54%)。
(4)化合物38的合成
向50ml的反应瓶中加入中间体化合物45(46mg,0.074mmol),中间体化合物21(根据us20170327469合成)(36mg,0.074mmol),2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯hatu(38mg,0.1mmol),n,n-二异丙基乙胺dipea(26mg,0.2mmol),10mldmf,室温下搅拌过夜,加入10ml水,乙酸乙酯萃取,无水硫酸钠干燥,浓缩,柱层析,得到23mg产物37,淡黄色固体,收率为29.6%,质谱1046(m+h+)。1hnmr(400mhz,dmso)δ11.98(s,1h),8.91(s,1h),8.42-8.4(m,1h),7.81-7.8(m,1h),7.65-7.63(m,1h),7.45-7.31(m,8h),7.02–6.91(m,2h),6.93-6.91(m,1h),6.24(s,1h),5.19(s,1h),4.91–4.81(m,1h),4.59-4.55(m,1h),4.47-4.45(m,1h),4.24(s,1h),4.01(s,2h),4.0–3.89(m,2h),3.67-3.62(m,8h),3.55(s,3h),3.09-3.01(m,2h),2.47(s,3h),2.05–1.93(m,1h),1.97–1.89(m,2h),1.85–1.73(m,1h),1.45-1.39(m,3h),1.29-1.25(m,3h),0.93(s,9h).
实施例10、化合物39(2s,4r)-1-((s)-13-(叔丁基)-1-(4-氟-3-(6-甲基-7-氧代-6,7-二氢-1h-吡咯并[2,1,3-c]吡啶-4-基)苯基)-1,11二氧代-5,9-二氧杂-2,12-二氮十四烷-14酰基)-4-羟基-n-((s)-1-(4-(4-甲基噻唑-5-基)苯基)乙基)吡咯烷-2-甲酰胺的合成
向50ml的反应瓶中加入中间体化合物46(根据中间体化合物20的合成方法由3-溴-4-氟苯甲酸甲酯替代中间体化合物8为原料合成)(78mg,0.18mmol),中间体化合物21(根据us20170327469合成)(84mg,0.18mmol),2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯hatu(76mg,0.2mmol),n,n-二异丙基乙胺dipea(52mg,0.4mmol),10mldmf,室温下搅拌过夜,加入10ml水,乙酸乙酯萃取,无水硫酸钠干燥,浓缩,柱层析,得到58mg产物39,淡黄色固体,收率为37.5%,质谱858(m+h+)。1hnmr(400mhz,dmso)δ12.14(s,1h),8.98(s,1h),8.60-8.58(m,1h),8.44-8.43(m,1h),8.02-8.01(m,1h),7.95–7.85(m,1h),7.49–7.26(m,10h),6.16(s,1h),5.14-5.13(m,1h),4.95–4.80(m,1h),4.53-4.52(m,1h),4.44-4.42(m,1h),4.28(s,1h),3.89-3.88(m,2h),3.59(s,3h),3.55–3.43(m,9h),2.45(s,4h),2.04-2.03(m,1h),1.85–1.69(m,1h),1.36-1.34(m,3h),0.92(s,9h).
以下通过试验例来说明本发明的有益效果。
试验例1、本发明化合物对cwr22rv1细胞增殖抑制作用的生物学测定
(1)实验材料:
cwr22rv1细胞(中国科学院细胞库,tchu100)
fbs(gibco,cat.no.10099-141)
0.01mpbs(biosharp,cat.no.162262)
ripm1640(hyclone,cat.no.308090.01)
青霉素-链霉素溶液(hyclone,cat.no.sv30010)
cellcountingkit-8(signalwayantibody,cat.no.cp002)
dmso(sigma,cat.no.d5879)
离心管,15ml(excellbio,cat.no.cs015-0001)
培养皿,(excellbio,cat.no.cs016-0128)
96-well细胞培养簇(corning,cat.no.3599)
(2)实验方法
a.缓冲液配制
b.实验步骤
①cwr22rv1细胞用细胞培养液传代培养,取生长状态良好的细胞接种于96孔板,每孔80μl,每孔细胞数为1500,于37℃,5%co2细胞孵育箱中培养过夜。
②将药物用二甲基亚砜(dmso)配置成30mm的储存液。临用前再用dmso稀释3倍,再按3倍梯度稀释,得到9个浓度梯度,再用培养液将各浓度的化合物稀释200倍(以此保证培养体系中dmso浓度为0.1%),每个浓度做2个孔重复。取20μl稀释好的化合物加到细胞培养孔(终浓度为10μm,3.3μm,1.1μm…),轻轻振荡混匀。另外设置3个只加细胞的阴性对照孔和3个只加培养液的空白对照孔(6孔各加20μl培养液稀释200倍的dmso)。
(3)结果检测
①培养6天后,每孔加10μlcck-8,于37℃,5%co2细胞孵育箱中继续培养2.5小时。
②用多功能酶标仪在450nm处测定吸光度(od值)。
③数据用软件graphpadprism6中dose-response-inhibition方程分析,得出ic50值。
本发明化合物对cwr22rv1的活性抑制的ic50(nm),结果如表1所示。
表1化合物对cwr22rv1的活性抑制的ic50
试验例2、本发明化合物brd4(bromodomaincontainingprotein4)蛋白表达生物学测定
(1)实验材料
cwr22rv1细胞(中国科学院细胞库,tchu100)
fbs(gibco,cat.no.10099-141)
0.01mpbs(biosharp,cat.no.162262)
ripm1640(hyclone,cat.no.308090.01)
青霉素-链霉素溶液(hyclone,cat.no.sv30010)
dmso(sigma,cat.no.d5879)
离心管,15ml(excellbio,cat.no.cs015-0001)
培养皿,(excellbio,cat.no.cs016-0128)
6-well细胞培养簇(corning,cat.no.3516)
ripa裂解液缓冲液(beyotime,cat.no.p0013b)
蛋白质缓冲缓冲液(beyotime,cat.no.p0015l)
bca蛋白质定量检测试剂盒(beyotime,cat.no.p0012)
sds-page凝胶制备试剂盒(成都佰和科技有限公司,cat.no.pg112)
抗β-微管蛋白小鼠单克隆抗体(zenbioscience,cat.no.200608)
anti-brd4(e2a7x)兔单克隆抗体(cst,cat.no.13440)
peroxidaseaffinipure(hrp)山羊抗小鼠igg(zenbioscience,cat.no.511103)
peroxidaseaffinipure(hrp)山羊抗小鼠igg(zenbioscience,cat.no.511203)
tbst(biosharp,cat.no.bl601a)
ecl化学发光试剂盒(beyotime,cat.no.p0018)
(2)实验方法
a.缓冲液配制
b.实验步骤
①cwr22rv1细胞用细胞培养液传代培养后,取生长状态良好的细胞接种于6孔板,每孔2ml,每孔细胞数为100万,于37℃,5%co2细胞孵育箱中培养过夜。
②将药物用二甲基亚砜(dmso)配置成30mm的储存液。临用前再用dmso稀释3倍,取2μl稀释好的化合物加到细胞培养孔(以此保证培养体系中dmso浓度为0.1%),每个浓度做2个孔重复,轻轻振荡混匀。另外设置阴性对照孔(加等量dmso)和阳性对照孔。
③培养24小时后,用ripa细胞裂解液裂解细胞,提取蛋白,用bca试剂盒测蛋白浓度。加5倍浓缩的蛋白上样缓冲液,100℃加热5分钟后样品放-20℃保存。
④每孔蛋白量为30μg的蛋白量上样到聚丙烯酰胺凝胶,进行电泳。
⑤蛋白质从聚丙烯酰胺凝胶转移到pvdf膜上,加5%脱脂牛奶室温封闭1小时,一抗(anti-brd4(e2a7x)rabbitmab和anti-β-tubulinmousemab)4℃孵育过夜,tbst溶液洗膜三次每次10分钟,二抗(辣根过氧化物酶标记羊抗小鼠igg)室温孵育2小时,再用tbst溶液洗膜三次每次10分钟。
(3)结果检测
最后加ecl显色液显色,用自动化学发光仪拍照,收集图片,分析。本发明化合物对brd4蛋白的降解,结果如图1所示。
从图1可以看出,本发明提供的化合物对22rv1细胞增殖具有很好的抑制作用,抑制效果尤其好,说明本发明化合物可以制备成为抗肿瘤药物,特别是治疗前列腺癌的药物。
综上,本发明提供了一种嵌合分子,该分子由目标蛋白的小分子化合物单元、e3泛素连接酶结合单元和连接单元组成,能够与brd蛋白进行结合,促使brd蛋白更易被蛋白酶降解,从而起到抑制细胞增殖的作用,可以作为brd蛋白降解的药物,用于治疗癌症或冠状动脉疾病。
- 还没有人留言评论。精彩留言会获得点赞!