一种利用抗CD3McAb与CTC相结合高效诱导DC-CIK的方法与流程
本发明涉及一种利用抗cd3mcab与ctc相结合高效诱导dc-cik的方法。
背景技术
恶性肿瘤之所以成为世界性难治愈的疾病,主要是疾病自身的复杂性和治疗技术的局限性。目前临床中治疗肿瘤的疗法大多是传统的“老三样”:手术治疗、放射治疗、化学疗法。传统疗法对人体危害大,而且无法彻底杀死恶性肿瘤细胞、阻止不了恶性肿瘤细胞扩散;患者自身免疫力低下无法得到提升。从而造成恶性肿瘤无法有效治疗,而且对患者自身带来较大的毒副作用。
肿瘤细胞生物免疫治疗技术利用自体外周血中的肿瘤细胞制成抗原并诱导自身外周血单个核细胞经体外诱导培养而制备的杀伤肿瘤的细胞。dc细胞,即树突状细胞,当负载有肿瘤抗原信息的dc细胞输入人体后,将肿瘤信息传递给肿瘤细胞,使其具有识别能力,充分调动,有效杀灭肿瘤细胞而不损伤任何正常组织,特别擅长清除残留、转移微小病灶,防止癌细胞扩散和复发,同时能够提升机体免疫力的一种新型生物细胞疗法。
肿瘤细胞生物免疫治疗技术优势:①cik细胞增殖速度快,细胞数量大,细胞活性强。②cik细胞具有识别肿瘤的机制,对正常的细胞无毒性作用。不破坏机体整体免疫系统功能。③cik细胞能够激发全身性的抗癌效应,对多发病灶或转移的恶性肿瘤同样有效。④dc-cik肿瘤细胞生物免疫治疗技术是典型的个性化生物治疗模式。将dc细胞回输后,还能使机体免疫能力提高,产生特异的抗病毒作用,从而对肿瘤治疗施以双重的作用。⑤由于cik细胞是活化的自体细胞,应用起来非常安全。dc-cik肿瘤免疫疗法,它是治疗肿瘤的绿色疗法,可以减轻放化疗带来的毒副作用,实现长期带瘤生存,延长患者的生存期。
通常业内使用方法是将抗cd3mcab加入培养基中,用于诱导dc-cik细胞。该方法不仅需要相对较多的抗cd3mcab,同时由于液体体积较大、液面距离培养瓶底部距离相对较长,导致细胞沉积至瓶壁的时间相对较长。再者由于肿瘤细胞浮力密度相对较低,其沉降速度更加缓慢。影响dc-cik细胞的增值,众所周知,原代肿瘤细胞贴壁比较困难,常常需要采用预先包被胶原蛋白、多聚赖氨酸或者其它物质来帮助原代肿瘤细胞的贴壁。
技术实现要素:
本发明的目的是为了提高诱导dc-cik细胞方法的细胞扩增能力及抗原递呈能力,提供了一种利用抗cd3mcab与ctc相结合高效诱导dc-cik的方法。
本发明一种利用抗cd3mcab与ctc相结合高效诱导dc-cik的方法为:一、用抗cd3mcab对用于dc-cik培养的器皿进行预处理:用无菌生理盐水配制浓度为15-25μg/ml的抗cd3mcab溶液,然后过滤除菌,保存于-80℃;取抗cd3mcab溶液涂覆细胞培养瓶内表面,4℃过夜;再用无菌生理盐水洗涤,得到预处理后的培养瓶a和b;二、分离外周血单个核细胞;三、另取外周血,利用试剂盒捕获ctc细胞,然后进行原位培养3-5d;四、取步骤二分离的单个核细胞(1-3)×107个加入到预处理后的培养瓶a中,然后用含自体血浆的dc-cik培养液补至45-50ml,放置培养箱中孵育2-3d,然后将培养瓶a中的培养液转移至另一预处理后的培养瓶b中,培养11d;再用含自体血浆的dc-cik培养液补至45-50ml,培养8d,即完成利用抗cd3mcab与ctc相结合高效诱导dc-cik的方法;其中培养瓶a培养第3-5天时,补充il-4、gm-csf,培养第6天补充步骤三培养的ctc细胞,培养第7天补充tnf-α;培养瓶b培养第1一天,补充ifn-r,培养第2、3、4、6和10天补充il-2、il-1α。
本发明利用患者外周血ctc细胞携带了肿瘤的全部基因、蛋白这一特点和抗cd3mcab促进细胞增值作用相结合,设计了一种利用抗cd3mcab与ctc相结合高效诱导dc-cik的方法。采用将抗cd3mcab预先包被用于培养dc-cik细胞的培养瓶,去除并反复洗涤后,再加入分离获得的单个核细胞,并且使用极少的培养液用于早期培养。这样可以大大提高ctc细胞于单个核细胞的接触几率,提高dc细胞对肿瘤的抗原递呈能力。另外,本发明借助试剂盒进行高效特异性捕获ctc。将已捕获细胞进行原位培养进一步提高了ctc的纯度。解决了由于ctc的数量过少,而降低dc细胞对肿瘤细胞的抗原递呈能力。
实验结果表明该方法应用于dc-cik细胞的培养,可以极大的提高了dc-cik细胞的肿瘤抗原递呈能力。体内外实验证明利用该方法培养的dc-cik细胞,对肿瘤细胞的特异性杀伤(ctl)活性和nk活性得到明显提高,ctl活性提高了30%,nk活性提高了25%。使经过该方法培养所获得的dc-cik细胞可以更加精准和有效地应用于抗肿瘤治疗。
同时,该方法所培养的细胞制剂,外源性的蛋白残余量会更少。可更大的提高dc-cik细胞应用于肿瘤患者治疗的安全性。
附图说明
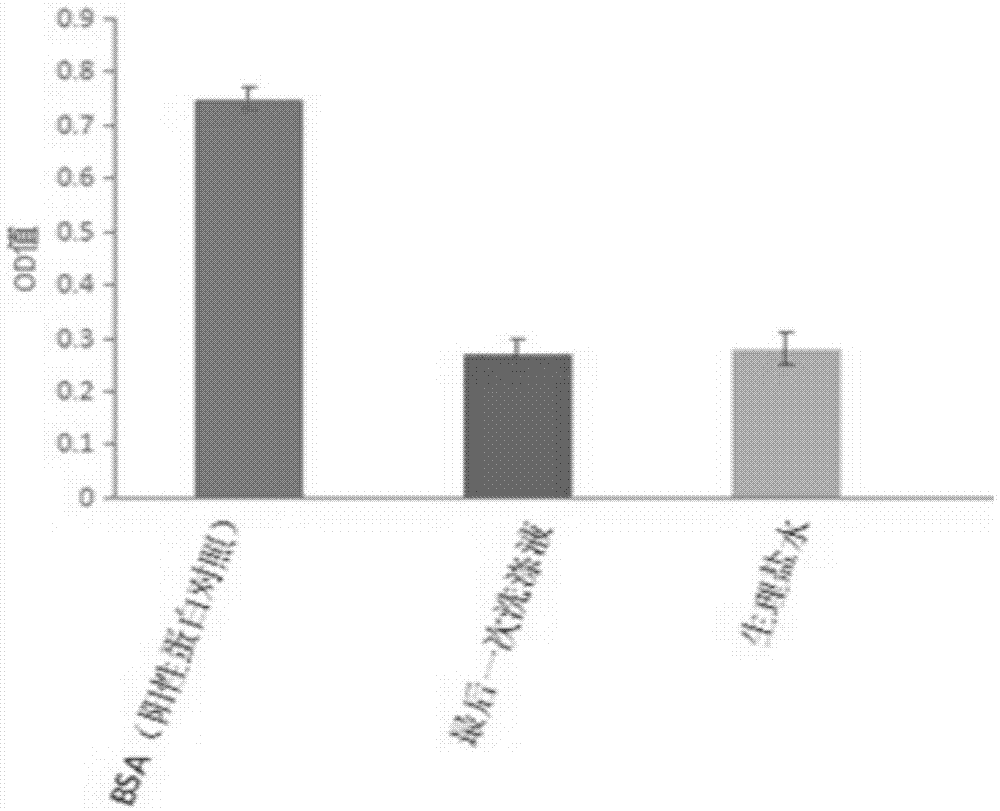
图1为实施例一最后一次去除的残余液体和生理盐水与考马斯亮蓝g250的od值;
图2为实施例一抗cd3mcab预处理不同时间细胞增殖变化图;
图3为实施例一未处理不同时间细胞增殖变化图;
图4为实施例一和对照诱导培养的dc-cik细胞培养7天nk活性变化;其中a为实施例一诱导培养,b为对照诱导培养;
图5为实施例一和对照诱导培养的dc-cik细胞培养培养7天ctl活性变化;其中a为实施例一诱导培养,b为对照诱导培养。
具体实施方式
具体实施方式一:本实施方式一种利用抗cd3mcab与ctc相结合高效诱导dc-cik的方法为:一、用抗cd3mcab对用于dc-cik培养的器皿进行预处理:用无菌生理盐水配制浓度为15-25μg/ml的抗cd3mcab溶液,然后过滤除菌,保存于-80℃;取抗cd3mcab溶液涂覆细胞培养瓶内表面,4℃过夜;再用无菌生理盐水洗涤,得到预处理后的培养瓶a和b;二、分离外周血单个核细胞;三、另取外周血,利用试剂盒捕获ctc细胞,然后进行原位培养3-5d;四、取步骤二分离的单个核细胞(1-3)×107个加入到预处理后的培养瓶a中,然后用含自体血浆的dc-cik培养液补至45-50ml,放置培养箱中孵育2-3d,然后将培养瓶a中的培养液转移至另一预处理后的培养瓶b中,培养11d;再用含自体血浆的dc-cik培养液补至45-50ml,培养8d,即完成利用抗cd3mcab与ctc相结合高效诱导dc-cik的方法;其中培养瓶a培养第3-5天时,补充il-4、gm-csf,培养第6天补充步骤三培养的ctc细胞,培养第7天补充tnf-α;培养瓶b培养第1一天,补充ifn-r,培养第2、3、4、6和10天补充il-2、il-1α。
本实施方式利用患者外周血ctc细胞携带了肿瘤的全部基因、蛋白这一特点和抗cd3mcab促进细胞增值作用相结合,设计了一种利用抗cd3mcab与ctc相结合高效诱导dc-cik的方法。采用将抗cd3mcab预先包被用于培养dc-cik细胞的培养瓶,去除并反复洗涤后,再加入分离获得的单个核细胞,并且使用极少的培养液用于早期培养。这样可以大大提高ctc细胞于单个核细胞的接触几率,提高dc细胞对肿瘤的抗原递呈能力。另外,本发明借助试剂盒进行高效特异性捕获ctc。将已捕获细胞进行原位培养进一步提高了ctc的纯度。解决了由于ctc的数量过少,而降低dc细胞对肿瘤细胞的抗原递呈能力。
实验结果表明该方法应用于dc-cik细胞的培养,可以极大的提高了dc-cik细胞的肿瘤抗原递呈能力。体内外实验证明利用该方法培养的dc-cik细胞,对肿瘤细胞的特异性杀伤(ctl)活性和nk活性得到明显提高,ctl活性提高了30%,nk活性提高了25%。使经过该方法培养所获得的dc-cik细胞可以更加精准和有效地应用于抗肿瘤治疗。
同时,该方法所培养的细胞制剂,外源性的蛋白残余量会更少。可更大的提高dc-cik细胞应用于肿瘤患者治疗的安全性。
具体实施方式二:本实施方式与具体实施方式一不同的是:步骤一用无菌生理盐水配制浓度为20μg/ml的抗cd3mcab溶液。其他与具体实施方式一或二相同。
具体实施方式三:本实施方式与具体实施方式一或二不同的是:步骤一中用无菌生理盐水洗涤至洗涤后的生理盐水与考马斯亮蓝g250无颜色反应。与具体实施方式一或二相同。
具体实施方式四:本实施方式与具体实施方式一至三之一不同的是:步骤二分离外周血单个核细胞的方法为:(1)、将采集的外周血2000rpm离心沉淀8-10分钟,收集上层血浆25ml加入500mlrpmi-1640中备用;将血球沉淀物,加生理盐水混悬至50ml,得到悬液;(2)、将悬液用吸管沿管壁加到已预先加入3ml淋巴细胞分层液的离心管中;其中悬液加入量为6-8ml;然后置水平离心机2000rpm离心15-20min,再用巴氏吸管吸出单个核细胞层,转移至离心管中,加生理盐水,充分混匀细胞,2000rpm离心3-5min反复洗涤3次;将洗涤后的淋巴细胞加含自体血浆的dc-cik培养液,制成细胞悬液,即完成。其他与具体实施方式一至三之一相同。
具体实施方式五:本实施方式与具体实施方式一至四之一不同的是:取一滴细胞悬液加入血球计数板,使其充满计数室,然后按白细胞计数法计数4个大方格的细胞数;细胞个数=4个大方格细胞总数/4×104×2×体积数;其中2为稀释倍数,体积数的单位为毫升。其他与具体实施方式一至四之一相同。
具体实施方式六:本实施方式与具体实施方式一至五之一不同的是:步骤四中取单个核细胞2×107个加入到预处理后的培养瓶a中。其他与具体实施方式一至五之一相同。
具体实施方式七:本实施方式与具体实施方式一至六之一不同的是:il-4补充量为400-700u/ml,gm-csf补充量为800-1200u/ml,ctc细胞加入量为1000-3000个,tnf-α补充量为400-700iu/ml。其他与具体实施方式一至六之一相同。
具体实施方式八:本实施方式本实施方式与具体实施方式一至七之一不同的是:ifn-r补充量为0.8-1.5μl/ml,il-2补充量为800-1200iu/ml,il-1α补充量为400-700iu/ml。其他与具体实施方式一至七之一相同。
具体实施方式九:本实施方式本实施方式与具体实施方式一至八之一不同的是:il-4补充量为550u/ml,gm-csf补充量为1100u/ml,ctc细胞加入量为2000个,tnf-α补充量为550iu/ml。其他与具体实施方式一至八之一相同。
具体实施方式十:本实施方式本实施方式与具体实施方式一至九之一不同的是:ifn-r补充量为1.1μl/ml,il-2补充量为1100iu/ml,il-1α补充量为550iu/ml。其他与具体实施方式一至九之一相同。
实施例一、一种利用抗cd3mcab与ctc相结合高效诱导dc-cik的方法为:一、用抗cd3mcab对用于dc-cik培养的器皿进行预处理:用无菌生理盐水配制浓度为15-25μg/ml的抗cd3mcab溶液,然后过滤除菌,保存于-80℃;取抗cd3mcab溶液涂覆细胞培养瓶内表面,4℃过夜;再用无菌生理盐水洗涤,得到预处理后的培养瓶a和b;二、分离外周血单个核细胞;三、另取外周血,利用试剂盒捕获ctc细胞,然后进行原位培养4d;四、取步骤二分离的单个核细胞1×107个加入到预处理后的培养瓶a中,然后用含自体血浆的dc-cik培养液补至50ml,放置培养箱中孵育2-3d,然后将培养瓶a中的培养液转移至另一预处理后的培养瓶b中,培养11d;再用含自体血浆的dc-cik培养液补至50ml,培养8d,即完成利用抗cd3mcab与ctc相结合高效诱导dc-cik的方法;其中培养瓶a培养第5天时,补充il-4、gm-csf,培养第6天补充步骤三培养的ctc细胞,培养第7天补充tnf-α,第8天收获dc细胞;培养瓶b培养第1一天,补充ifn-r,培养第2、3、4、6和10天补充il-2、il-1α,第11天收获cik细胞。
分别取步骤一最后一次去除的残余液体100μl和生理盐水100μl,均加入100μl的考马斯亮蓝g250,显色;测od570值。结果:最后一次去除的残余液体和生理盐水与考马斯亮蓝g250均无颜色反应(结果见图1),培养瓶中无游离蛋白残留。
本实施例采用纳奥生物的第三代nextctc循环活细胞捕获仪及配套试剂盒捕获ctc细胞。
本实施例分离外周血单个核细胞的方法为:1、将临床采集的自愿者外周血及时转移至50ml离心管,2000rpm离心沉淀8-10分钟;2、收集上层血浆约25ml加入500mlrpmi-1640中备用;收集血球沉淀物,加生理盐水混悬至50ml,得到悬液;3、将悬液用吸管沿管壁缓慢地加到已预先加入3ml淋巴细胞分层液的15ml一次性无菌塑料离心管中,使加入的血液重叠于分层液上,形成明显的分界面(注意不要摇动);4、置水平离心机2000rpm离心15-20min,小心取出;5、用一次性无菌塑料巴氏吸管轻轻插入离心管中,吸出白色云雾状的单个核细胞层,转移至50ml离心管中,加生理盐水至50ml,充分混匀细胞,2000rpm离心3-5min反复洗涤3次;6、细胞计数:将洗涤后的淋巴细胞加4ml含4%自体血浆的dc-cik培养液,制成细胞悬液;7、取一滴细胞悬液用于计数(一般取细胞悬液50μl加50μl白细胞稀释液稀释)。加入血球计数板,使其刚好充满计数室,然后按白细胞计数法计数4个大方格的细胞数;8、细胞个数=(4个大方格细胞总数/4)×104×2(稀释倍数)×体积数(ml)。
对照诱导培养的dc-cik的方法为:dc细胞培养过程,其中培养第3-5天时,补充il-4(500u/ml)、gm-csf(1000u/ml)。培养第六天补充肿瘤特异性抗原(50微克/ml),培养第七天补充tnf-α(500iu/ml)。第8天收获dc细胞。cik细胞培养过程,其中培养第一天,按因子倍数添加ifn-r。培养第2、3、4、6和10天补充il-2(1000iu/ml)、il-1α(500iu/ml)、cd3mcab(375ng/ml);第11天收获cik细胞。
于不同时间段分别收集步骤四培养后的细胞悬液计数。
细胞增殖比较(结果见图2、3),由图2和图3可知,用抗cd3mcab预处理的75cm2细胞培养瓶较未处理的75cm2细胞培养瓶,细胞增殖速度更快。培养7天,预处理后的细胞培养瓶内细胞个数为11.8×107个,对比培养瓶内细胞个数为8.9×107个,具有显著差异(ttests分析,p<0.05)。
dc-cik细胞nk活性检测
方法:分别于培养收集本实施例和对照诱导培养的dc-cik细胞。苔盼兰染色计数,调细胞浓度为2×106个/ml,作为效应细胞;分别取处于对数生长期k562细胞苔盼兰染色计数,调细胞浓度为4×104个/ml作为靶细胞;将已经调整好浓度的靶细胞加入96孔细胞培养板中,每孔100μl。同时作效应细胞对照(不同诱导方法的诱导培养的效应细胞100μl、营养液100μl)和靶细胞对照(靶细胞100μl、营养液100μl)。均作三复孔;37℃、5%co2孵育,18-20小时。于培养结束前6小时,加入cck810μl;培养结束,测定od570值;按下式计算:
结果:本实施例和对照诱导培养的dc-cik细胞相比,本实施例诱导培养的dc-cik细胞的nk活性明显提高(结果见图4),nk活性提高了25%具有显著差异(ttests分析,p<0.05)。因此,用抗cd3mcab预处理细胞培养瓶,可以提高dc-cik细胞的nk活性。
dc-cik细胞ctl活性检测
方法:首先制备人肝癌细胞(smmc-7721)裂解液;分别向本实施例和对照诱导培养的dc-cik细胞中加入含1μg/ml的smmc-7721细胞裂解液共培养7天;收集不同诱导方法的诱导培养的dc-cik细胞。苔盼兰染色计数,调细胞浓度为2×106个/ml。作为效应细胞。分别取处于对数生长期人肝癌细胞(smmc-7721)常规消化,计数,调细胞浓度为2×104个/ml。作为靶细胞。将已经调整好浓度的和靶细胞,分别加入96孔细胞培养板中,每孔100μl。同时作效应细胞对照(不同诱导方法的诱导培养的效应细胞100μl、营养液100μl)和靶细胞对照(靶细胞100μl、营养液100μl)。均作三复孔;37℃、5%co2孵育,18-20小时。于培养结束前6小时,加入cck810μl;培养结束,测定od570值;按下式计算:
结果:本实施例和对照诱导培养的dc-cik细胞相比,本实施例诱导培养的dc-cik细胞的ctl活性明显提高(结果见图5),ctl活性提高了30%具有显著差异(ttests分析,p<0.05)。因此,用抗cd3mcab预处理细胞培养瓶,可以提高dc-cik细胞的ctl活性。
本实施例利用患者外周血ctc细胞携带了肿瘤的全部基因、蛋白这一特点和抗cd3mcab促进细胞增值作用相结合,设计了一种利用抗cd3mcab与ctc相结合高效诱导dc-cik的方法。采用将抗cd3mcab预先包被用于培养dc-cik细胞的培养瓶,去除并反复洗涤后,再加入分离获得的单个核细胞,并且使用极少的培养液用于早期培养。这样可以大大提高ctc细胞于单个核细胞的接触几率,提高dc细胞对肿瘤的抗原递呈能力。另外,本实施例借助试剂盒进行高效特异性捕获ctc。将已捕获细胞进行原位培养进一步提高了ctc的纯度。解决了由于ctc的数量过少,而降低dc细胞对肿瘤细胞的抗原递呈能力。
- 还没有人留言评论。精彩留言会获得点赞!