一种表达c-Kit的人主动脉血管壁干细胞的分离、筛选、培养及功能鉴定方法与流程
本发明属于干细胞与组织工程技术领域,尤其涉及一种表达c-kit的人主动脉血管壁干细胞的分离、筛选、培养及功能鉴定方法。
背景技术
成体干细胞是一类存在于成年动物或人体内已分化组织中的未分化细胞,这种细胞具有不断增殖及自我更新的能力,能够分化成为所处组织特定种类的细胞,从而及时补充该组织中受损的成熟细胞,维持组织器官生长和衰老,损伤和修复的动态平衡。近年来,大量研究表明,在小鼠和人的动脉及静脉血管壁外膜驻留着一群成体干细胞,在正常生理情况下,它们维持着血管稳态,及时补充更新衰老凋亡的血管壁细胞。而在病理状态下,例如在内皮损伤及血管壁病变中,这些干细胞可被活性氧、趋化因子、细胞因子、生长因子、金属蛋白酶等多种因子激活,通过增殖、迁移、分化等方式,及时补充损伤的内皮细胞或平滑肌细胞,参与血管损伤后修复或血管重塑过程中。目前,在许多研究中,血管壁干细胞已经在小鼠主动脉,移植血管等多种血管上分离得到,并在体外成功培养,应用于多种小鼠血管疾病模型病理生理学机制的研究。然而,随着近年来血管壁干细胞研究的不断深入,如果能从人体血管组织分离获得血管壁干细胞,不但能直接对人体多种血管疾病的病理生理学机制做出深入的研究,更为将来在临床建立正常及多种疾病血管壁干细胞库,从而应用于组织工程学及临床干细胞治疗提供了充足的资源。
目前,对于人血管壁干细胞的研究,部分文献只是通过免疫组织化学染色的方法证明在正常及不同疾病组的人主动脉组织血管切片上存在具有表达干细胞标记分子的细胞,而并未进行细胞分离与体外培养。另有部分文献虽已报道在正常人主动脉血管分离出的细胞表达间充质干细胞标记分子,但在分离过程中并未进行干细胞标记分子的筛选,导致最终实际获得的干细胞纯度并不高。
c-kit属于酪氨酸激酶受体蛋白家族成员之一,作为干细胞因子受体,它可与干细胞因子相结合,从而启动相应信号通路,调控干细胞的增殖、分化等多种生物学功能。c-kit是一种鉴定骨髓造血干细胞特定分型的重要标记分子,c-kit的检测可用于临床上急性白血病的分类诊断和分型诊断。
技术实现要素:
本发明的一个目的是提供一种获得人主动脉血管壁干细胞的试剂盒。
本发明提供的试剂盒,包括结合c-kit阳性细胞的物质。
上述试剂盒中,所述结合c-kit阳性细胞的物质包括c-kit抗体;
和/或,所述c-kit抗体具体为c-kit免疫磁珠抗体。
上述试剂盒中,所述试剂盒还包括用于裂解红细胞的红细胞裂解液。
所述试剂盒还包括分离缓冲液和分离柱。
所述分离缓冲液为含0.5%bsa及2mmedta的无菌pbs溶液。
上述试剂盒还包括培养c-kit阳性细胞的培养基,
所述培养基由如下组分组成:dmem-f12+glutamax-1基础培养基、体积百分含量为20%的fbs、100u/ml青链霉素、10ng/mlhumanlif、0.1mmβ-巯基乙醇和20ng/mlhumanbfgf组成。
上述试剂盒还包括记载分离方法的模块或比对卡;
所述分离方法包括如下步骤:
1)从离体人主动脉组织上分离血管外膜,再将所述血管外膜消化成细胞;
2)将所述细胞用上述的试剂盒中的结合c-kit阳性细胞的物质通过与c-kit阳性细胞上的c-kit相结合,分离出c-kit阳性细胞,即获得人主动脉血管壁干细胞。
在步骤1)和2)之间,还包括如下步骤:将消化后的细胞经细胞筛过滤,收集滤液,再离心获得所述滤液中的细胞沉淀;最后去除所述细胞沉淀中的红细胞。
c-kit在作为获得人主动脉血管壁干细胞标志物中的应用也是本发明保护的范围。
上述的试剂盒在制备获得人主动脉血管壁干细胞产品中的应用也是本发明保护的范围;
或,上述的试剂盒在获得人主动脉血管壁干细胞中的应用也是本发明保护的范围。
或,上述结合c-kit阳性细胞的物质在制备获得人主动脉血管壁干细胞产品中的应用也是本发明保护的范围;
或,上述结合c-kit阳性细胞的物质在获得人主动脉血管壁干细胞中的应用也是本发明保护的范围;
或,上述试剂盒在制备获得人主动脉血管壁干细胞产品中的应用也是本发明保护的范围;
或,上述试剂盒在获得人主动脉血管壁干细胞中的应用也是本发明保护的范围;
或,上述培养基在培育c-kit阳性细胞中的应用也是本发明保护的范围。
本发明第二个目的是提供一种获得人主动脉血管壁干细胞的方法。
本发明提供的方法,包括如下步骤:以c-kit作为主动脉血管壁干细胞标志物,进行主动脉血管壁干细胞的分离。
上述方法中,所述分离步骤如下:
1)从离体人主动脉组织上分离血管外膜,再将所述血管外膜消化成细胞;
2)将所述细胞用上述的试剂盒中的结合c-kit阳性细胞的物质通过与c-kit阳性细胞上的c-kit相结合,分离出c-kit阳性细胞,即获得人主动脉血管壁干细胞。
所述将血管外膜消化成细胞采用胶原酶消化;
所述结合c-kit阳性细胞的物质为如c-kit的抗体等,具体为c-kit免疫磁珠抗体;
所述步骤1)和步骤2)之间还包括如下步骤:将所述细胞经细胞筛过滤,收集滤液,再离心获得所述滤液中的细胞沉淀;最后去除所述细胞沉淀中的红细胞。
上述方法还包括如下步骤:将所述c-kit阳性细胞在上述培养c-kit阳性细胞的培养基中培养。
本发明第3个目的是提供一种培养c-kit阳性细胞的培养基。
本发明提供的培养基,为上述的试剂盒中的培养基。
本发明从人主动脉组织上分离血管外膜,用胶原酶消化,通过细胞筛过滤获得细胞悬液,通过c-kit免疫磁珠抗体筛选获得c-kit阳性血管壁干细胞,该类干细胞具有良好的体外增殖与迁移能力,很少有凋亡,不但具有间充质干细胞的分化潜能(可分化为脂肪细胞、成骨细胞、软骨细胞),还具有血管壁干细胞能够分化为血管平滑肌细胞的组织特异性分化能力;总之,本发明的方法克服了以往的分离方法中因缺乏特定干细胞标志物筛选,导致分离的干细胞纯度低,生长慢的问题,提供了一种能够明显提高人主动脉血管壁干细胞纯度及细胞活性的新的分离培养方法。
附图说明
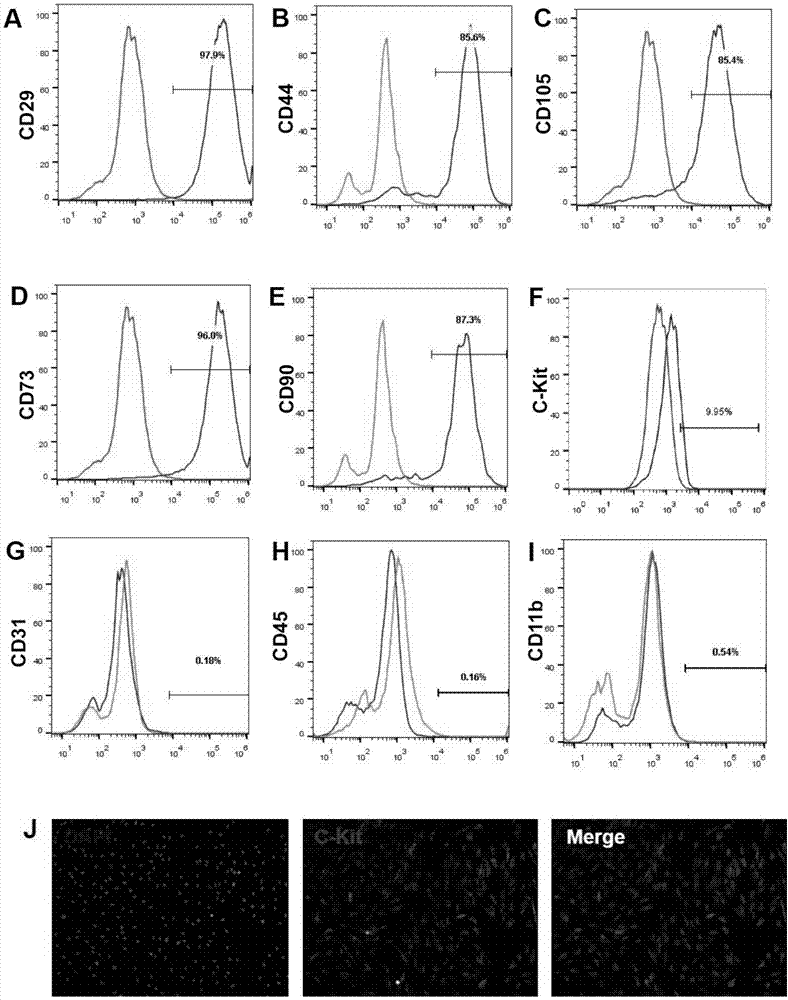
图1为流式细胞术鉴定干细胞标记分子表达水平和免疫荧光染色法标记的c-kit阳性的细胞结果图;
其中,a-i是从人主动脉血管壁外膜组织中分离得到的细胞,在c-kit免疫磁珠筛选前,经流式细胞术鉴定干细胞标记分子表达水平;j是经c-kit免疫磁珠抗体筛选后,用免疫荧光染色法标记的c-kit阳性的细胞。
图2为培养24小时后正常捐献者及主动脉置换术患者的c-kit阳性血管壁干细胞的增殖细胞相关核抗原ki67表达水平。
图3为培养72小时后正常捐献者及主动脉置换术患者c-kit阳性血管壁干细胞凋亡水平的鉴定;(a)annexinv/pi检测法,(b)tunel染色法。
图4为对正常捐献者及主动脉置换术患者c-kit阳性血管壁干细胞迁移6-8小时的水平检测;a为transwell迁移实验,(b)为划痕实验。
图5为正常捐献者及主动脉置换术患者c-kit阳性血管壁干细胞分化为脂肪细胞、成骨细胞、软骨细胞及平滑肌细胞的水平检测。
图6为正常捐献者及主动脉置换术患者c-kit阳性血管壁干细胞分化为血管平滑肌细胞的水平检测。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1、人主动脉血管壁干细胞的分离、筛选和培养
一、人主动脉血管壁干细胞的分离和筛选
1、人主动脉血管壁干细胞的分离
1)分离血管外膜
取正常器官捐献供体或接受主动脉置换术的患者主动脉组织(患者、供体或供体家属知情),面积约为2×5cm2,立即放入20ml冰冷的无菌组织保存液中(含1mgedta-na2及3%fbs的无菌pbs溶液)。在超净台中用无菌镊子从组织保存液中取出血管组织,用含1mgedta-na2的无菌pbs溶液多次漂洗血管组织,去除残留血迹,直至漂洗液澄清无肉眼可见血色。用两把无菌镊子将血管外膜与中膜轻轻分离,保留外膜组织,得到血管外膜,并再次漂洗三次,尽量吸尽液体后,用无菌剪刀将外膜剪成2-3mm的小碎片。
2)胶原酶消化
将组织碎片放入约4ml的37℃预热的含0.25mg/ml胶原酶(liberasetmtlresearchgrade,5401020001,roche)的无血清dmem/f12培养基中(0.1mg胶原酶:1cm2主动脉组织)在37℃孵箱中,摇床上震荡3-4小时。
当消化悬液浑浊成乳糜样,并无明显组织块时,即可停止消化。用移液管反复吹打消化液,尽量分散组织细胞团块。再依次用孔径为100μm和70μm的无菌细胞筛过滤组织悬液,并用全培养基冲洗每个滤网两三次。收集过滤液以1000rpm离心5分钟,弃上清,收集细胞沉淀。
2、c-kit阳性人主动脉血管壁干细胞的筛选
对1所获得的人主动脉血管壁干细胞进行c-kit标记分子的筛选,方法具体如下:
1)、裂解红细胞
为避免组织细胞悬液中大量残余红细胞非特异性结合磁珠引起的分离柱堵塞的情况,在用分离柱筛选c-kit阳性细胞前,先在一得到的细胞沉淀中加入5ml红细胞裂解液(碧云天,c3702)(加入细胞量的5倍红细胞裂解液)重悬细胞,室温孵育10分钟,加入20mlpbs混匀后,1000rpm离心5分钟,弃上清,直至无明显红色沉淀,得到去除红细胞的细胞沉淀。
2)、c-kit抗体(cd117microbeadkit,human,miltenyibiotec,130-091-332)结合细胞
向上述1)得到的去除红细胞的细胞沉淀(约为1x107个细胞)中加入预冷的300μl分离缓冲液(由体积百分含量0.5%bsa、2mmedta和无菌pbs溶液组成),细胞计数板计数,细胞数量低于108个细胞时(记作筛选前的总细胞数),同时加入100μlfcr封闭液(cd117microbeadkit中提供)和100μlc-kit免疫磁珠偶联抗体(cd117microbeadkit),充分混匀,在4℃冰箱孵育15分钟,得到孵育后细胞悬液。
3)、磁珠吸附
取出上述2)得到的孵育后细胞悬液,加入2ml分离缓冲液,300g离心10分钟,完全吸尽上清,弃去。
在细胞离心同时,将分离柱固定在macs分离器上,加入500μl分离缓冲液,润洗柱子,避免混入气泡,堵塞柱子。
在离心后的细胞沉淀中加入500μl分离缓冲液,移液枪吹打混匀,将细胞悬液缓缓加入分离柱(mscolumns,miltenyibiotec,130-042-201)。此时,被c-kit免疫磁珠抗体标记的阳性细胞利用磁性被吸附在分离柱里,而未被c-kit标记的阴性细胞则随液体流出分离柱。
当细胞悬液滴尽后,再次加入500μl分离缓冲液冲洗残留在分离柱内的阴性细胞,重复两次,得到的阳性细胞吸附在分离柱内。
4)、c-kit阳性细胞分离
将上述3)得到的吸附细胞后分离柱轻轻移出macs分离器,置于一个新的15ml无菌离心管上,在分离柱内加入1ml分离缓冲液,并用配套的活塞将分离柱内细胞悬液迅速打入下方的离心管内,收集c-kit阳性细胞悬液即为c-kit阳性的人血管壁干细胞(来源于正常器官捐献供体或接受主动脉置换术的患者的主动脉组织)。
细胞计数板计数收集到的c-kit阳性细胞,通过与筛选前的总细胞数(c-kit免疫磁珠偶联抗体结合前细胞数)相比,计算c-kit阳性细胞的百分比。
人血管壁干细胞(来源于正常器官捐献供体)的百分比约为10%;
人血管壁干细胞(来源于接受主动脉置换术的患者主动脉组织)的百分比约为5%-12%。
二、人主动脉血管壁干细胞的培养
将上述一得到的人主动脉血管壁干细胞按照如下方法培养:
向上述一得到的人血管壁干细胞中加入3ml完全培养基,细胞混匀后加入铺有0.04%b型牛皮胶原的直径为35mm的培养皿,放入37℃,5%co2孵箱中。24小时后,观察细胞,90%以上细胞已贴壁,细胞呈梭形或纺锤形。更换新的培养基,去除未贴壁的细胞。3天更换培养基一次,3-7天后,当细胞长至90%,用0.05%胰蛋白酶edta消化,即可按1:3比例进行传代。
上述完全培养基由如下组分组成:dmem-f12+glutamax-1基础培养基(gibcotm,10565018),20%(体积百分含量)fbs,100u/ml青链霉素,10ng/mlhumanlif,0.1mmβ-巯基乙醇和20ng/mlhumanbfgf组成。
三、人主动脉血管壁干细胞的功能验证
1、人主动脉血管壁干细胞分离纯度鉴定
应用流式细胞术对从上述一的1得到胶原酶消化后细胞的多种分子标记物进行鉴定:分别用不同分子抗体及其相应igg在冰上避光孵育细胞1小时,1500rpm离心5分钟后,pbs洗一遍,pbs重悬,立刻通过流式细胞仪检测各抗体表达水平;包括干细胞标记分子cd29,cd73,cd105,cd44,cd90和c-kit,内皮细胞标记分子cd31,白细胞标记分子cd45,巨噬细胞标记分子cd11b。
结果如图1a-i所示,可以看出,本发明上述一的1得到细胞沉淀表达大量干细胞标记分子,约10%为c-kit阳性细胞,几乎不表达内皮、白细胞、巨噬细胞标记分子,说明通过本分离方法提取得到的干细胞纯度高,极少混入其它组织及血液细胞。
免疫荧光染色法检测上述一的2得到的c-kit阳性细胞悬液细胞,细胞爬片用4%多聚甲醛固定10分钟,驴血清室温封闭60分钟,加兔抗c-kit一抗,4℃孵育过夜,加驴抗兔二抗,室温孵育1小时,pbs洗三次,dapi染色5分钟,封片,荧光显微镜观察结果,结果如图1j所示,可见90%以上细胞表达c-kit蛋白,说明通过本提取及筛选方法得到的c-kit干细胞纯度很高。
2、人主动脉血管壁干细胞增殖能力鉴定
为鉴定c-kit阳性人主动脉血管壁干细胞的增殖能力,从上述二的人血管壁干细胞传代第四代细胞消化后种于4孔玻璃板,通过对细胞核相关抗原ki67免疫荧光染色,在细胞培养24小时后,4%福尔马林固定5分钟,驴血清室温封闭1小时,ki67抗体4℃孵育过夜,pbs洗三次,室温孵育相应的二抗1个小时,pbs洗三次,dapi染色5分钟,封片,荧光显微镜观察结果。
结果如图2所示,从正常捐献供体和主动脉置换术患者分离提取的人血管壁干细胞(c-kit阳性)均具有明显的细胞增殖能力。
3、人主动脉血管壁干细胞凋亡水平鉴定
为鉴定c-kit阳性人主动脉血管壁干细胞的凋亡水平,细胞在体外按照二的方法培养72小时后,通过annexinv/pi凋亡试剂盒和tunel染色,分别利用流式细胞术及荧光显微镜检测凋亡细胞数量(annexinv/pi试剂盒,碧云天,c1063;tunel试剂盒,碧云天,c1088)(以上方法均按照相应试剂盒说明书操作)。
结果如图3所示,从正常捐献供体和主动脉置换术患者分离提取的人血管壁干细胞(c-kit阳性)在本发明提供的培养条件下极少量细胞处于凋亡及坏死水平,只有不到4%的细胞凋亡或死亡,说明通过本发明提取及筛选方法得到的c-kit干细胞活性也很高。
4、人主动脉血管壁干细胞迁移能力鉴定
为鉴定c-kit阳性人主动脉血管壁干细胞的迁移能力,分别通过transwell迁移实验和划痕实验,在6-8小时后计数迁移至transwell小室下底面及划痕以内区域的细胞。
结果如图4所示,从正常捐献供体和主动脉置换术患者分离提取的人血管壁干细胞(c-kit阳性)均具有较强的细胞迁移能力。
5、阳性人主动脉血管壁干细胞分化能力鉴定
为鉴定c-kit阳性人主动脉血管壁干细胞的分化能力,利用常规成脂肪、成骨、成软骨细胞培养液中进行刺激分化(分化实验使用的是humanmesenchymalstemcellfunctionalidentificationkit,r&dsc006),(方法步骤按照说明书操作)。
免疫荧光染色结果如图5所示,分化14天后,脂肪细胞标记分子表达水平升高。21天后,成软骨细胞和成骨细胞标记分子表达水平升高。
此外,根据图6实验结果表明,在特定平滑肌细胞分化培养液(dmem-f12+glutamax-1培养基中加入1%fbs,10ng/mltgf-β1)中刺激分化7天后,通过qpcr分析,平滑肌细胞标记分子calponinmrna水平均较分化前明显升高,而免疫荧光染色进一步发现calponin蛋白表达水平也明显升高。
以上所述的具体实施例,对本发明的目的、技术方案和有益效果进行了进一步详细说明,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
- 还没有人留言评论。精彩留言会获得点赞!