一种合成β-突厥烯酮的方法与流程
本发明属于精细化工香料技术领域,具体涉及一种合成β-突厥烯酮的方法,合成过程中还可以同步生产香料α-突厥酮。
背景技术
β-突厥烯酮(β-damascenone),又叫β-大马烯酮,化学名为4-(2,6,6-三甲基-1,3-环己二烯)-2-丁烯-4-酮,为淡黄色至黄色液体,cas:23696-85-7。因其具有诱人的玫瑰香气,兼有覆盆子样的果香和扩散力,成为珍贵的香原料。该原料首先由ohloff在保加利亚突厥玫瑰油中发现其微量存在,且是关键性的香气成份。近年来随着香料工业的发展、合成工艺技术改进等,其价格亦有所下调,使用量也逐年增加。β-突厥烯酮类香料不仅在配制高级香水和调配化妆品香精中用作珍贵香原料,而且已被应用到食品香精中,同时,还可在烟草中改善香烟的韵味,使烟味变得更为柔和舒适。
β-突厥烯酮的合成路线有很多,国外报道较多,常见有一定价值的合成方法如下:
1.文献helv.chim.acta.1970,53(3),541报道了以柠檬醛为原料经β-环柠檬醛,丙烯溴格式加成,氧化,溴代消除得到,具体反应式如下:
反应a柠檬醛环化需要用到高毒的苯胺,会产生大量的胺氮废水,反应b烯丙基溴没有商品化,需要自制,自制工艺也很麻烦,反应c氧化需要用到二氧化锰或者含铬试剂,最后反应d溴代用到nbs,总之该工艺会产生大量的三废,工艺复杂难操作,很难工业化生产。
2.snowden等人(helv.chim.acta.1987,70,1858)报道了以藏红花酸甲酯为原料合成,与两分子丙烯氯格氏试剂加成,而后在kh/hmpa的条件下得到β-突厥烯酮的方法,具体反应式如下所述:
原料藏红花酸甲酯合成工艺较复杂,不易获得,反应f用到了kh/hmpa,很危险,其工业化易燃易爆的风险非常大。
3.文献(j.c.s.perkin1,1975,1727-1736)报道了diels-alder合成路线,溴代异丙叉丙酮与1,3-戊二烯环加成,再消除溴化氢,与乙醛aldol缩合脱水得到β-突厥烯酮,具体如下:
该工艺原料溴代异丙叉丙酮难得,反应j用到了n-甲基苯胺溴化镁,会产生大量的胺氮废水。
4.日本专利jp74-7556和美国专利us4250332报道了三甲基环己烯酮与甲基丙炔醇在锂氨存在下进行加成反应,制得二醇,然后将此二醇与80%甲酸回流1/2小时,得到β-突厥烯酮。
该工艺原料2,6,6-三甲基环己烯酮不易获得,氨基锂工艺操作风险较大。
5.ohloff等人(helv.chim.acta,1973,56,310-320)报道bǜchi-vederas重排反应路线制备β-突厥烯酮,利用β-紫罗兰酮为原料,先肟化,再制成异噁唑、环氧化后再开环,最后用酸处理制得β-突厥烯酮。
该工艺反应p还原用到金属钠和液氨,安全风险较大。
鉴于以上工艺的种种弊端,还需要开发一些更适合工业化生产的β-突厥烯酮合成路线。
技术实现要素:
本发明的目的在于克服现有技术的不足之处,提供了一种条件温和、便于操作、成本低、原料易得的合成β-突厥烯酮的方法,本工艺经过香料α-突厥酮作为中间体,可以同时合成α-突厥酮及β-突厥烯酮。
本发明解决其技术问题所采用的技术方案是:
一种合成β-突厥烯酮的方法,包括:
1)α-环香叶酸的合成:
步骤1:往反应容器中加入柠檬醛、还原剂、第一溶剂和磷酸二氢钠水溶液,温度10~40℃下往其中滴加亚氯酸钠溶液;滴加完毕后,室温下搅拌反应16~24h;分出有机相,水相用第一萃取剂萃取,合并有机相,除去其中的第一溶剂和第一萃取剂;然后加第一种碱中和,搅拌0.2~1h,分液,水相用第一萃取剂萃取,弃去有机相,萃取后的水相用第一种酸调节ph值至1.8~2.2,分出有机相,水相用第一萃取剂萃取,合并有机相,浓缩得粗品;
步骤2:往反应容器中加入步骤1得到的粗品,加入第二溶剂,加热至100~115℃,往其中滴加第二种酸,保温搅拌6~12h;往其中加入水,搅拌,分出有机相,水相用第二萃取剂萃取,合并有机相,浓缩得粗品,重结晶若干次,得α-环香叶酸;
2)α-突厥酮的合成:
步骤3:反应容器中加入步骤2得到的α-环香叶酸和第三溶剂,往其中滴加氯代试剂,回流反应2~4h,除去氯代试剂和部分第三溶剂;降至室温,保护气氛下,往其中滴加第二种碱,滴加完毕后,升温至140~160℃,回流进行消除反应5~8h;降至室温,除去析出的固体,滤液浓缩,得环香叶烯酮;
步骤4:反应容器中加入镁屑和第四溶剂;保护气氛下,将卤代烃溶于第四溶剂中,将其向反应容器中加入少许引发后,滴加剩余溶液至反应容器中,维持温度不超过42℃,滴加完毕后,室温下搅拌0.5~2h,得到格式试剂;格氏试剂降温至-5~5℃,往其中滴加步骤3得到的环香叶烯酮,控制温度不超过25℃,滴加完毕后,搅拌0.5~2h进行格氏加成;滴加淬灭剂淬灭至悬浊沙状固体,固液分离,异构化溶剂洗涤固体,滤液浓缩得粗品,往其中加入异构化溶剂和第三种酸,保护气氛下,加热回流反应10~18h,加第三种碱中和洗涤至弱碱性,分液,水相用异构化溶剂萃取,合并有机相,浓缩得α-突厥酮;
3)β-突厥烯酮的合成:
步骤5:反应容器中加入步骤4得到的α-突厥酮、盐、第五溶剂,搅拌下,冷却至8~12℃;滴加环氧化试剂,温度不超过25℃,滴加完毕后,升至常温,继续搅拌过夜进行环氧化反应;加入水,搅拌分层,水相用第三萃取剂萃取,合并有机相,用淬灭还原剂洗涤,分液,有机相浓缩,得环氧突厥酮;
步骤6:反应容器中加入第四种碱、步骤5得到的环氧突厥酮、第六溶剂,保护气氛下,加热回流5~6h,反应完全后,加水,除去第六溶剂,分液,水相用第四萃取剂萃取,合并有机相,加入干燥剂干燥,过滤,浓缩得羟基突厥酮;
步骤7:反应容器中,加入第四种酸、第七溶剂、步骤6得到的羟基突厥酮,保护气体保护下,加热至回流11~13h,反应完毕后,加入第五种碱至弱碱性,分出有机相;除去第七溶剂,浓缩得β-突厥烯酮。
所述步骤1中,柠檬醛和还原剂的摩尔比为1:4~10,优选1:4.5~5.5;柠檬醛和亚氯酸钠摩尔比为1:1~2,优选1:1.2~1.3;柠檬醛、还原剂、亚氯酸钠、磷酸二氢钠、第一溶剂的摩尔比为1:4.5~5.5:1.2~1.3:1.45~1.5:9.9~10;还原剂为双戊烯、异戊烯、dmso中的一种,优选双戊烯;第一溶剂为叔丁醇、乙醇、异丙醇中的一种,优选叔丁醇;反应温度为15~35℃;反应时间为16~18h;第一萃取剂为苯、甲苯、二氯甲烷、乙醚、石油醚中的一种,优选甲苯;第一种碱为氢氧化钠或氢氧化钾,优选氢氧化钠,例如9~11%的氢氧化钠溶液;第一种酸为硫酸、盐酸、磷酸、醋酸中的一种,优选硫酸,例如30~32%的硫酸。
所述步骤2中,第二溶剂为甲苯、石油醚、苯中的一种,优选甲苯;第二种酸为浓磷酸、浓硫酸、甲酸中的一种,优选浓磷酸,例如84~86%磷酸;第二种酸为84~86%磷酸时,香叶酸和84~86%磷酸质量比为1:0.1~0.2,优选1:0.16~0.18;第二种酸为84~86%磷酸、第二溶剂为甲苯时,香叶酸、84~86%磷酸、甲苯质量比为1:0.16~0.18:1.6~1.8;反应温度为100~105℃;反应时间为7~9h;第二萃取剂为甲苯、环己烷、苯、石油醚中的一种,优选甲苯;采用甲苯、环己烷、苯、石油醚中的一种进行重结晶,优选环己烷。
所述步骤3中,α-环香叶酸和氯代试剂的摩尔比为1:2~3,优选1:2.4~2.5;α-环香叶酸和第二种碱摩尔比为1:1~2,优选1:1.20~1.21;第三溶剂为甲苯、石油醚、环己烷、苯中的一种,优选甲苯;第三溶剂为甲苯时,甲苯质量是α-香叶酸的6.3~6.4倍;氯代试剂为氯化亚砜或草酰氯,优选氯化亚砜;第二种碱为三乙胺、二异丙基乙基胺、三丙胺、三丁胺、三辛胺中的一种,优选三乙胺;消除反应温度为145~150℃;消除反应时间为5.5~6.5h。
所述步骤4中,环香叶烯酮和卤代烃的摩尔比为1:2~2.5,优选1:2.1~2.2;环香叶烯酮和第三种酸摩尔比为1:0.05~0.1,优选1:0.05~0.06;环香叶烯酮、卤代烃、镁屑、第三种酸摩尔比为1:2.1~2.2:2.3~2.4:0.05~0.06;第四溶剂为thf、乙醚、甲基四氢呋喃中的一种,优选thf;第四溶剂为thf时,其质量是环香叶烯酮的8.7~8.9倍;卤代烃为烯丙基氯或烯丙基溴,优选烯丙基氯;格氏加成温度为0~25℃;淬灭剂为氯化铵溶液或者氯化镁溶液,优选氯化铵溶液,例如饱和氯化铵溶液;格氏加成后直接用氯化铵淬灭至悬浊沙状固体过滤洗涤即可,无需分液萃取;异构化溶剂为乙酸乙酯、四氢呋喃、石油醚、环己烷中的一种,优选乙酸乙酯;异构化溶剂为乙酸乙酯时,其质量是thf的0.8~0.9倍;第三种酸为对甲苯磺酸、盐酸、硫酸中的一种,优选对甲苯磺酸;加热回流反应时间为11~13h;第三种碱用碳酸钠或碳酸钾,优选碳酸钠,例如18~22%的碳酸钠溶液。
所述步骤5中,α-突厥酮和环氧化试剂摩尔比为1:1.1~3,优选1:2.1~2.2;α-突厥酮、盐、环氧化试剂摩尔比为1:2.1~2.2:2.1~2.2;盐为乙酸钠、乙酸钾、碳酸钠、碳酸钾中的一种,优选乙酸钠;第五溶剂为二氯甲烷、甲苯、苯、环己烷、石油醚中的一种,优选二氯甲烷;第五溶剂为二氯甲烷时,质量为α-突厥酮的6.2~6.3倍;环氧化试剂为过氧乙酸、m-cpba、双氧水中的一种,优选过氧乙酸,例如18~22%过氧乙酸水溶液;第三萃取剂为二氯甲烷、甲苯、苯、石油醚、环己烷中的一种,优选二氯甲烷;淬灭还原剂为硫代硫酸钠或亚硫酸钠,优选硫代硫酸钠,例如9~11%的硫代硫酸钠溶液;环氧化反应温度为0~35℃,优选10~25℃。
所述步骤6中,环氧突厥酮和第四种碱摩尔比为1:0.1~1,优选1:0.5~0.6;第四种碱为碳酸钾、碳酸钠、乙醇钠、氢氧化钠、氢氧化钾中的一种,优选碳酸钾;第六溶剂为无水甲醇或无水乙醇,优选无水甲醇;第六溶剂为无水甲醇时,其质量是环氧突厥酮的4.5~5.5倍;第四萃取剂为乙酸乙酯、乙酸丁酯、甲苯、苯、石油醚中的一种,优选乙酸乙酯;所述干燥剂为元明粉。
所述步骤7中,羟基突厥酮和第四种酸的摩尔比为1:0.1~0.5,优选1:0.2~0.3;第七溶剂采用二氯甲烷、石油醚、环己烷、甲苯、苯中的一种,优选二氯甲烷;第七溶剂为二氯甲烷时,其质量是羟基突厥酮的7.0~7.1倍;第四种酸为对甲苯磺酸、盐酸、硫酸、甲酸中的一种,优选对甲苯磺酸;第五种碱采用碳酸氢钠、碳酸钠、氢氧化钠、氢氧化钾中的一种,优选碳酸氢钠,例如饱和碳酸氢钠。
本发明合成β-突厥烯酮的反应式如下:
本技术方案与背景技术相比,它具有如下优点:
本发明采用柠檬醛为原料,经过改进的pinnick氧化、浓磷酸环化得到α-环香叶酸;α-环香叶酸经氯化亚砜氯代,三乙胺碱性消除得到环香叶烯酮中间体,再与烯丙基氯格氏试剂加成,双键异构得到香料α-突厥酮;α-突厥酮再经环内双键选择性环氧化,碱性开环,酸性消除最终得到β-突厥烯酮。该工艺操作简便,反应条件温和,原料来源方便易获取,成本低,在合成β-突厥烯酮的同时可以同步合成另一种香料α-突厥酮,实现一种工艺合成两种香料的目的,尤其适合工业化放大生产。
附图说明
下面结合附图和实施例对本发明作进一步说明。
图1为本发明实施例得到的α-突厥酮的gc谱图。
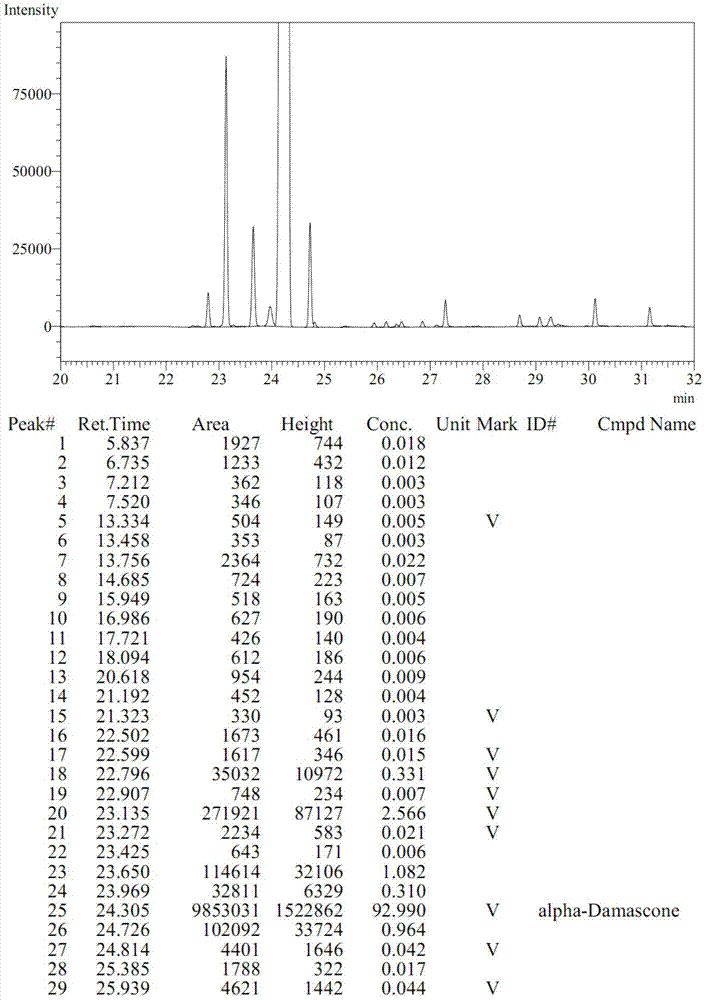
图2为本发明实施例得到的β-突厥烯酮的gc谱图。
具体实施方式
下面通过实施例具体说明本发明的内容:
1)α-环香叶酸的合成:
步骤1:以柠檬醛为原料,经过改进过的pinnick氧化反应得到香叶酸中间体。具体地:
往5l的三颈瓶中加入柠檬醛(100g)、双戊烯(446g)、叔丁醇(486g),加入902g的16.8%的磷酸二氢钠水溶液,15℃下往其中缓慢滴加20%亚氯酸钠溶液379.6g,温度不高于35℃;滴加完毕后,室温下搅拌反应16h;待原料反应完全,分液,分出上层有机相,下层水相用甲苯萃取(2x100ml),合并有机相,旋蒸,除去其中的叔丁醇和甲苯;然后10%的氢氧化钠溶液400g,搅拌0.5h,分液,水相用甲苯萃取(2x100ml),弃去有机相,萃取后的水相用31%的硫酸调节ph值至2.0,分出有机相,水相用甲苯萃取(2x50ml),合并有机相,旋蒸,得粗品117.8g,为香叶酸,含量77.4%(两个异构体之和),直接投入下一步反应;
步骤2:香叶酸采用85%的磷酸,加热至100℃环化,结晶得到α-环香叶酸。具体地:
往反应瓶中加入117g步骤1得到的香叶酸粗品,加入甲苯200g,加热至100℃,往其中滴加85%的磷酸20g,保温搅拌8h;往其中加入水200g,搅拌,分出有机相,水相用甲苯萃取(2x100ml),合并有机相,旋蒸浓缩得粗品106g,加入环己烷多次重结晶,得α-环香叶酸,两步收率70%;
2)α-突厥酮的合成:
步骤3:环香叶酸在氯化亚砜的条件下,制备酰氯,浓缩除去多余的氯化亚砜和甲苯,直接加入三乙胺作碱,加热消除,蒸馏得到中间体环香叶烯酮。具体地:
1l三口瓶中,加入47g步骤2得到的α-环香叶酸,甲苯300g,装好回流冷凝管,干燥管,尾气碱液吸收装置。往反应瓶中滴加氯化亚砜82.2g,回流反应2~4h,常压蒸馏蒸出残留的氯化亚砜和部分甲苯;降至室温,氮气氛下,往其中滴加三乙胺34g,滴加完毕后,升温至145~150℃,回流进行消除反应6h;降至室温,析出大量固体,抽滤除去析出的固体盐,滤液减压蒸馏,得环香叶烯酮21.4g,收率51%;
步骤4:烯丙基氯格氏试剂制备好后,往其中滴加环香叶烯酮,控制好温度,反应完毕后,饱和氯化铵淬灭反应,抽滤,浓缩,加入乙酸乙酯、催化量对甲苯磺酸异构化,浓缩蒸馏,得到α-突厥酮。具体地:
往150ml的反应瓶中加入镁屑3.4g,thf30g;置换氮气,将烯丙基氯10.1g溶于thf50g中,将其向反应瓶中加入少许引发后,缓慢滴加剩余溶液至反应瓶中,维持温度不超过42℃,滴加完毕后,室温下搅拌1h,得到格式试剂;
格氏试剂降温至冰浴,往其中滴加步骤3得到的环香叶烯酮9g,控制温度不超过25℃,滴加完毕后,搅拌1h进行格氏加成;滴加饱和氯化铵溶液(19.3g)淬灭至悬浊沙状固体,抽滤,乙酸乙酯洗涤固体,滤液浓缩得12.9g粗品,往粗品中加入乙酸乙酯70g、对甲苯磺酸0.6g,氮气氛下,加热回流反应12h,加20%的碳酸钠溶液20g洗涤至弱碱性(ph值约8.0),分液,水相用乙酸乙酯萃取(2x15g),合并有机相,减压浓缩,蒸馏得α-突厥酮8.2g,收率71%;
3)β-突厥烯酮的合成:
步骤5:α-突厥酮在乙酸钠的二氯甲烷溶液中,滴加20%的过氧乙酸溶液,反应完毕后,用硫代硫酸钠淬灭反应,浓缩,减压蒸馏得环氧突厥酮。具体地:
往5l的三口烧瓶中,加入步骤4得到的α-突厥酮225g,乙酸钠192g,二氯甲烷1400g,搅拌下,冰浴下冷却至10℃;滴加20%过氧乙酸水溶液946g,温度不超过25℃,滴加完毕后,升至常温,继续搅拌过夜进行环氧化反应;加入水450g,搅拌分层,水相(上层)用二氯甲烷萃取2次(2x150g),合并有机相,用10%的硫代硫酸钠溶液(375g)洗涤,分液,有机相浓缩,得粗品282.8g,减压蒸馏得产品环氧突厥酮217.8g,收率89%;
步骤6:环氧突厥酮在碳酸钾/甲醇溶液中加热回流开环,反应完毕减压旋去甲醇,乙酸乙酯萃取,浓缩,得到羟基突厥酮粗品,无需纯化可直接投入下一步反应。具体地:
往2l的单口瓶中,加入72g碳酸钾、217g步骤5得到的环氧突厥酮、1085g无水甲醇,氮气氛下,加热回流5.5h,反应完全后,加水500ml,旋蒸除去甲醇,分液,水相用乙酸乙酯萃取(2x150ml),合并有机相,加入元明粉干燥,过滤,旋蒸浓缩,得羟基突厥酮粗品228g,直接投入下一步反应;
步骤7:羟基突厥酮在二氯甲烷溶剂中,对甲苯磺酸做催化剂,加热回流,反应完毕后,饱和碳酸氢钠洗涤,浓缩,蒸馏得到最终产品β-突厥烯酮。具体地:
3l的三口烧瓶中,加入41.7g对甲苯磺酸、1.6kg的二氯甲烷,228g步骤6得到的羟基突厥酮,氮气保护下,加热至回流12h,反应完毕后,加入500ml的饱和碳酸氢钠洗涤至弱碱性(ph值约8.0),分出有机相;旋蒸除去二氯甲烷,得粗品218g,减压蒸馏,得β-突厥烯酮126.8g,两步收率64%。
以上所述,仅为本发明较佳实施例而已,故不能依此限定本发明实施的范围,即依本发明专利范围及说明书内容所作的等效变化与修饰,皆应仍属本发明涵盖的范围内。
- 还没有人留言评论。精彩留言会获得点赞!