携带CEACAM8突变抗原基因的重组腺相关病毒载体及其构建方法与应用与流程
本发明涉及生物领域中的载体及其应用,特别是涉及一种携带CEACAM8突变基因的重组腺相关病毒载体及其构建方法以及其在制备抗CEACAM8阳性的肿瘤药物中的应用。
背景技术:
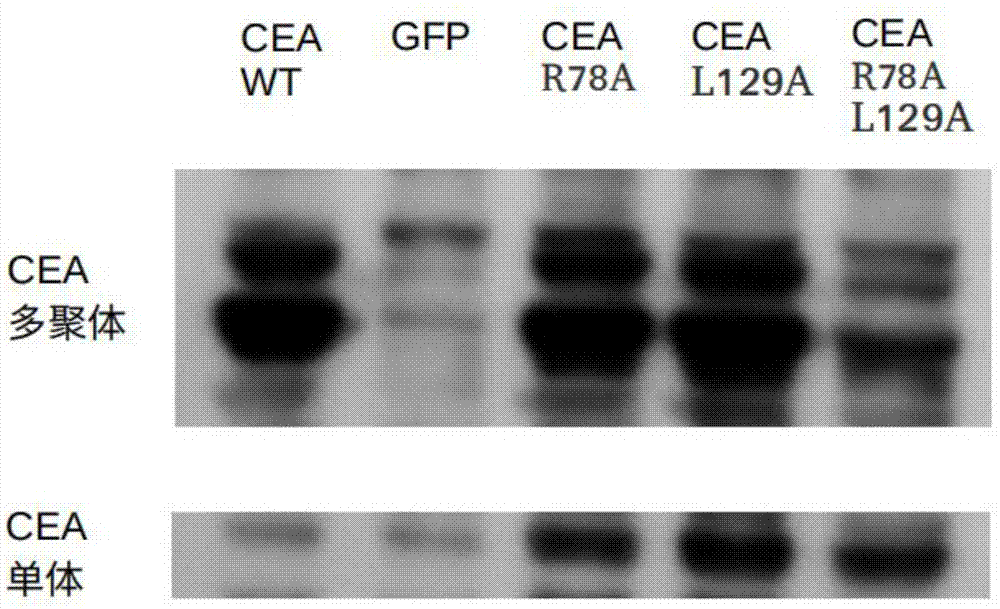
:腺相关病毒(adeno-associatedvirus,AAV)的基因结构已经被鉴定。1983年,Samulski等人描述了AAV的末端重复片段LTR(上游5’端片段,下游3’端片段)。1984年,Hermonat等人描述了AAV的低感染颗粒(lip)基因和包膜(cap)基因。1986年,Labow等人鉴定了位于上游5’端片段和rep基因之间的p5启动子。1984年,美国PaulL.Hermonat证明AAV载体可用于人类疾病的基因治疗。目前,主要是欧美国家在进行以AAV为基础的基因治疗人类疾病的临床试验。据美国粮食和药品管理局统计,现有十余项以AAV为基础的基因治疗临床试验正在进行,主要是将携带治疗基因的AAV病毒注入患者体内,使其在体内表达治疗基因,从而达到治疗疾病的目的。主要针对治疗的疾病是帕金森氏综合症、风湿性关节炎、血友病、心力衰竭、进行性肌萎缩和奥兹海默综合症等非肿瘤性疾病。2012年11月2日欧盟批准UniQure公司的Glybera产品在欧盟27个成员国使用,这是西方国家第一个获批准的基因治疗药物,它是利用腺相关病毒I型(AAV-I)携带外源基因用于治疗脂蛋白脂酶缺乏遗传病(LPLD)的基因药物。AAV是一种非致病性的缺陷性病毒,需要其它病毒(如腺病毒)的基因产物辅助,才能装配成为具有感染性的病毒颗粒。目前AAV可分为12种血清型(AAV-1~AAV-12)。其中,2型腺相关病毒载体(AAV-2)因具有无致病性、宿主范围广、目的基因长期表达等优点而成为当前基因治疗中最有潜力的病毒载体之一。AAV-2基因组全长约4700碱基对(bp),两端为重复末端片段(TR)。如何构建各种新的可用于制备治疗疾病的药物的重组腺相关病毒及其相关产品是本领域技术人员努力的方向。技术实现要素:本发明所要解决的技术问题是:提出一种安全性高、携带突变癌胚抗原细胞黏附分子8(CEACAM8)的重组腺相关病毒(recombinantadeno-associatedvirus,rAAV)载体及其构建方法与应用。本发明的技术问题通过以下的技术方案予以解决:本发明提供了一种携带CEACAM8R78AL129A突变抗原基因的重组腺相关病毒载体,其特征在于:将腺相关病毒载体中的腺相关病毒的结构基因替换为CEACAM8R78AL129A突变抗原基因得到的重组腺相关病毒载体。本发明通过将CEACAM8与CEACAM6相互作用的关键位点突变,R78A(CGA突变为GGA)和L129A(CTT突变为GAT),使其失去与CEACAM6相互作用的致癌能力,但保留了原来的免疫源性。最后将其嵌入腺相关病毒载体中包装成可诱导树突细胞免疫反应且不具有致癌性的CEACAM8疫苗。已知的腺相关病毒载体具有巨噬细胞病毒(CMV)启动子,为提高目的基因的转录水平,还可进一步将CEACAM8突变抗原基因插入后成功构建的质粒的启动子替换为p5启动子、β-肌动蛋白启动子、SV40早期启动子中的任意一种。本发明还提供一种携带CEACAM8突变抗原基因的重组腺相关病毒载体的构建方法:在腺相关病毒载体中,将腺相关病毒的结构基因剔除,在剔除的位置上插入CEACAM8突变抗原基因,得到重组腺相关病毒载体。本发明所提供的构建方法,是使用基因重组的方法,使用限制性内切酶先将AAV载体骨架DNA切断,再运用DNA连接技术,将特异抗原基因CEACAM8与被切断的AAV载体DNA进行连接,再通过PCR点突变,得到携带CEACAM8突变抗原基因的重组腺相关病毒载体。该rAAV载体的启动子为p5启动子或者下述启动子中的一种:β-肌动蛋白启动子、SV40早期启动子。本发明还提供了一种携带CEACAM8突变抗原基因的重组腺相关病毒载体的产品,包括CEACAM8R78AL129A重组腺相关病毒的质粒载体、CEACAM8R78AL129A重组腺相关病毒的病毒载体、被所述CEACAM8R78AL129A重组腺相关病毒的病毒载体感染或转染的细胞系,所述CEACAM8R78AL129A重组腺相关病毒的质粒载体由上述携带CEACAM8R78AL129A突变抗原基因的重组腺相关病毒载体或者上述构建方法制得的携带CEACAM8R78AL129A突变抗原基因的重组腺相关病毒载体制得;所述CEACAM8R78AL129A重组腺相关病毒的病毒载体由所述CEACAM8R78AL129A重组腺相关病毒的质粒载体进行细胞培养得到。本发明还提供了一种携带CEACAM8突变抗原基因的重组腺相关病毒载体的产品的制备方法,CEACAM8R78AL129A重组腺相关病毒的质粒载体的制备:将如上述携带CEACAM8R78AL129A突变抗原基因的重组腺相关病毒载体或者上述构建方法制得的携带CEACAM8R78AL129A突变抗原基因的重组腺相关病毒载体导入基因工程大肠杆菌DH5α感受态细胞,用含100μg/mL氨苄青霉素的LB平板进行抗性筛选,挑取白色单菌落,提取质粒并纯化,得到CEACAM8重组腺相关病毒的质粒载体;CEACAM8重组腺相关病毒的病毒载体的制备:以所述CEACAM8R78AL129A重组腺相关病毒的质粒载体和pHelper质粒共转染AAVp细胞得到CEACAM8R78AL129A重组腺相关病毒的病毒载体;CEACAM8R78AL129A重组腺相关病毒感染或转染的细胞系的制备:用所述CEACAM8R78AL129A重组腺相关病毒的病毒载体感染或转染单核细胞、树突状细胞或T淋巴细胞得到,所述细胞系包括单核细胞-树突状细胞系、T淋巴细胞系。一种如上所述的携带CEACAM8突变抗原基因的重组腺相关病毒载体或者如上所述的产品在制备抗CEACAM8突变抗原阳性的癌症药物中的应用。药物可采用溶剂或粉剂等剂型。所述溶剂的选择是多种多样的,如细胞培养液(基)、生理盐水或磷酸盐缓冲液等均可。需要的时候,在上述药物中还可以加入一种或多种药学上可接受的载体。所述载体包括药学领域常规的稀释剂、吸收促进剂和表面活性剂等。用药方式可为先分离出肿瘤患者体内的单核细胞,再将AAV/CEACAM8R78AL129A的病毒载体感染或转染患者的单核细胞。或将转化有CEACAM8的成熟的树突状细胞所刺激产生的细胞毒性T淋巴细胞回输肿瘤患者。上述药物的用量一般为100μl/5×106个单核细胞/每次,每月2次,疗程通常为6个月。剂量和疗程都可根据实际情况调整。为提高疗效,本发明的药物还可以与抗生素、免疫刺激剂和肿瘤靶向药物等进行组合治疗。本发明与现有技术对比的有益效果是:本发明提供了一种稳定性高、携带外源性基因(CEACAM8)的重组腺相关病毒(rAAV)载体。在本发明的重组腺相关病毒(AAV/CEACAM8)载体可将其携带的CEACAM8突变抗原基因输送入单核细胞-树突状细胞系中,存在CEACAM8突变抗原基因的细胞被用于刺激免疫系统的效应细胞(不局限于T淋巴细胞和B淋巴细胞)。实验证明,被本发明的rAAV感染的树突状细胞和所诱导的细胞毒性T淋巴细胞在体外和患者体内可有效地抑制相关恶性肿瘤细胞的生长或者杀灭肿瘤细胞,因而,本发明的携带CEACAM8R78AL129A突变抗原基因的重组腺相关病毒载体或与本发明重组腺相关病毒载体相关的产品可被用于制备抗CEACAM8抗原阳性的恶性肿瘤的细胞免疫治疗。本发明在恶性肿瘤的临床治疗和应用中具有重要的理论和实际意义,应用前景广阔。【附图说明】图1:CEA野生型和三种突变体R78A,L129A和L/RA质粒转染HEK293细胞电泳测试结果【具体实施方式】下面结合具体实施方式对本发明做进一步详细说明。实施例1:构建CEACAM8R78AL129A重组载体1)改建AAV2型pAAV-GFP质粒:使用限制性内切酶BsaBI和XbaI将AAV2型pAAV-GFP质粒中的病毒包装识别区域内基因切除,保留原本的CMV启动子,得到pAAV-GFP酶切片段;2)逆转录PCR后,用引物1:ATGGGGCCCATCTCAGCCCCTTC和引物2:CTAGAGGCCAGGAGAACTTCCTTGTACTAAAGC扩增得到CEACAM8核心致癌cDNA;3)将步骤2)中CEACAM8cDNA进行酶切反应,之后和步骤1)产物pAAV-GFP酶切片段进行DNA连接反应,得到携带CMV启动子和CEACAM8基因的重组腺相关病毒载体;4)使用引物3:CAGTGGATGCCAACCGTgGAATTATAGGATATGTAATATC和引物4:CAAGTCATAAAGCTAAATgaTATGAGTGAAGAAGTAACTGGC进行点突变PCR,将CEACAM8基因突变为CEACAM8R78AL129A突变抗原基因;5)将CMV启动子用酶切连接的方法替换为p5启动子。实施例2构建CEACAM8R78A重组载体根据实施例1的方法制备CEACAM8R78A重组载体,区别在于步骤4)中仅对R78A进行PCR点突变,得到相应的载体。实施例3构建CEACAM8L129A重组载体根据实施例1的方法制备CEACAM8L129A重组质粒,区别在于步骤4)中仅对L129A进行PCR点突变,得到相应的载体。实施例4细胞杀伤实验AAV/CEACAM8R78AL129A系统可以在动物细胞培养基中被供体的树突细胞吞噬,进而经由免疫递呈活化供体的T细胞,并诱发对携带有CEACAM8抗原的癌症细胞系U266/70的免疫反应治疗有效性可通过对携带CEACAM8的U266/70细胞的体外杀伤实验证实。通过CTL细胞杀伤实验测试实施例1制备得到重组载体的效果。具体地,包括以下步骤:1)抽取供体50ml血液,分离其中的单核细胞与T细胞前体细胞;2)细胞计数后,用单核细胞:AAV/CEACAM8R78AL129A=1:1000的比例加入6孔板一孔中,并加入适当细胞因子的2ml1640培养基培养7天,观察细胞状态及时更换培养基。单核细胞经过刺激成为识别了CEACAM8的成熟树突细胞。同时用AAVGFP诱导产生不识别CEACAM8的树突细胞做对照。3)T细胞前体细胞,加入适当细胞因子的2ml1640培养基培养7天,观察细胞状态及时更换培养基。4)按照1:1000的比例混合2)和3)的产物细胞。再用加入适当细胞因子的1640培养基培养7天,得到成熟的CD4+T细胞。5)以40:1的比例用分别诱导的CD4+T细胞对对携带CEACAM8的U266/70细胞进行杀伤实验;6)细胞杀伤6小时后,加入MTS试剂检测细胞活性。MTS试剂作用4小时后,将细胞培养板放入酶标仪,在波长490nm处测定吸光度,记录测定结果。细胞杀伤测试结果如表1,表1U266细胞杀伤试验测试结果空白组U266AAVGFPAAVCEAGFP+U266CEA+U266149236593611043047229115322148651056308921191432548928106631112103细胞杀伤率计算公式为:杀伤率=1-(效应细胞CEACAM8+靶细胞U266/70-混合细胞CEACAM8和U266/70)/(效应细胞CEACAM8+靶细胞U266/70)。经换算,CEACAM8的CTL杀伤实验结果见表2:表2:细胞杀伤试验结果空白组AAV-GFP组CEACAM8组细胞杀伤率——1.84%35.88%根据表2所示,试验结果表明CEACAM8R78AL129A突变抗原基因的重组腺相关病毒载体通过树突细胞诱导的杀伤率为35.88%,远高于对照组GFP杀伤U266的1.84%。实施例5突变后致癌性风险测试1)体外培养HEK293;2)以1:100比例稀释腺相关病毒GFP,CEACAM8WT,和三种突变体R78A,L129A和L/RA(病毒滴度每毫升5×1010)加入上述细胞,培养3天;3)收集细胞后,立即加入含磷酸酶抑制剂的裂解液,破碎细胞收集蛋白质;4)使用锰离子磷酸化western(AAL-107FUJIFILM)测试CEACAM8磷酸化能力的变化,结果如附图1所示。根据试验结果,与CEA野生型相比三种突变体R78A,L129A和L/RA多聚化明显减少(单体比例高),特别是CEACAM8的L/RA。由于多聚化CEA是活化致癌能力的关键,因此突变体的致癌风险更低,可以用于腺相关病毒免疫治疗。以上内容是结合具体的优选实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属
技术领域:
的普通技术人员来说,在不脱离本发明构思的前提下做出若干替代或明显变型,而且性能或用途相同,都应当视为属于本发明的保护范围。序列表<110>北京安斯晨睿生物科技有限公司<120>携带CEACAM8突变抗原基因的重组腺相关病毒载体及其构建方法与应用<130>1<160>1<170>SIPOSequenceListing1.0<210>1<211>1050<212>DNA<213>CEACAM8R78AL129A突变抗原基因(carcinoembryonicantigenrelatedcelladhesionmolecule8)<400>1atggggcccatctcagccccttcctgcagatggcgcatcccctggcaggggctcctgctc60acagcctcacttttcaccttctggaacccgcccaccactgctcagctcactattgaagct120gtgccatccaatgctgcagaggggaaggaggttcttctacttgtccacaatctgccccag180gaccctcgtggctacaactggtacaaaggggaaacagtggatgccaaccgtcgaattata240ggatatgtaatatcaaatcaacagattaccccagggcctgcatacagcaatcgagagaca300atataccccaatgcatccctgctgatgcggaacgtcaccagaaatgacacaggatcctac360accctacaagtcataaagctaaatcttatgagtgaagaagtaactggccagttcagcgta420catccggagactcccaagccctccatctccagcaacaactccaaccccgtggaggacaag480gatgctgtggccttcacctgtgaacctgagactcagaacacaacctacctgtggtgggta540aatggtcagagtctcccggtcagtcccaggctgcagctgtccaatggcaacaggaccctc600actctactcagtgtcacaaggaatgacgtaggaccctatgaatgtgaaatacagaaccca660gcgagtgcaaacttcagtgacccagtcaccctgaatgtcctctatggcccagatgccccc720accatttccccttcagacacctattaccatgcaggggtaaatctcaacctctcctgccat780gcggcctctaatccaccctcacagtattcttggtctgtcaatggcacattccagcaatac840acacaaaagctctttatccccaacatcactacaaagaacagcggatcctatgcctgccac900accactaactcagccactggccgcaacaggaccacagtcaggatgatcacagtctctgat960gctttagtacaaggaagttctcctggcctctcagctagagccactgtcagcatcatgatt1020ggagtactggccagggtggctctgatatag1050当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1