合成气或其他气态碳源和甲醇转化为1,3-丁二醇的方法和有机体与流程
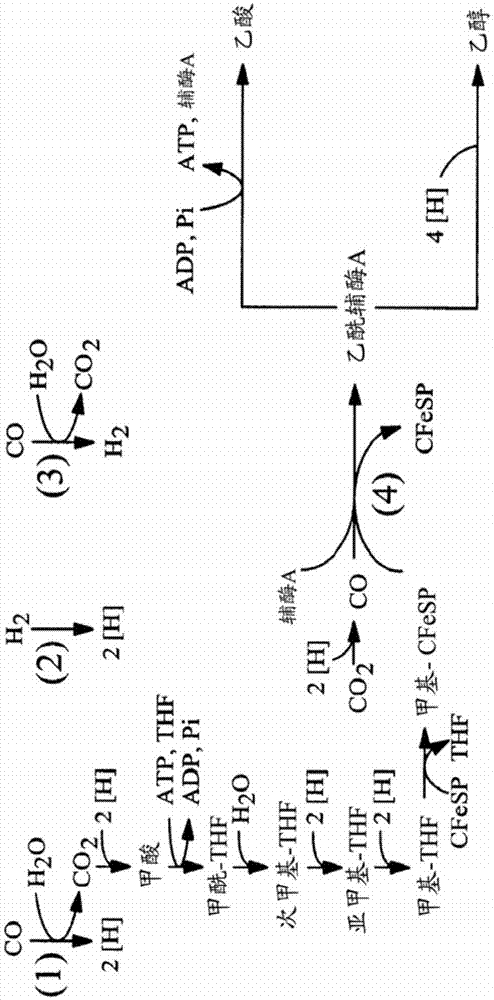
本申请要求2009年12月10日提交的美国临时申请no.61/285,312的优先权,将其全部内容引用作为参考。发明背景本发明一般涉及生物合成方法,更具体地涉及在日常化学制品的生产中能够利用碳水化合物、甲醇、合成气体和其他气态碳源的有机体。1,3-丁二醇(1,3-bdo)是一种由乙炔经水合产生的四碳二元醇。得到的乙醛再转化为3-羟基丁醛,随后还原成1,3-bdo。近几年中,乙炔已被较廉价的乙烯取代用作乙醛的来源。1,3-bdo通常用作食物调味剂的有机溶剂。它也是聚氨酯和聚酯类树脂的共聚单体,且广泛地用作降血糖剂。光学活性的1,3-bdo是有用的生物活性化合物和液晶合成的原材料。1,3-丁二醇的另一用途是它的脱水产生1,3-丁二烯(ichikawa等人,j.molecularcatalysisa-chemical,231:181-189(2005);ichikawa等人,j.molecularcatalysisa-chemical,256:106-112(2006)),一种用于生产合成橡胶(例如轮胎)、乳胶和树脂的化学制品。合成气(syngas)是一种主要为h2和co的混合物,其可以通过任何有机原料的气化法获得,例如煤、石油、天然气、生物质、或废弃有机物质。已经开发了很多气化方法,最多的设计是基于部分氧化,限制氧以避免有机物质在高温(500-1500℃)下的完全氧化,从而提供0.5:1-3:1h2/co混合物的合成气。有时增加蒸汽以增加氢含量,典型地伴随水煤气转换反应增加的co2生产量。工业上最常通过催化合成气组分,co和h2生产甲醇。当今,煤是工业生产合成气的主要材料,其在传统上用于取暖和电力,以及作为甲醇和液态烃类的fischer-tropsch合成的原料。许多大的化学制品和能源公司大范围的采用煤气化法,但在工业上用该技术是昂贵的。此外,事实上在世界任何地方,存在来自过剩的其他材料如生物质、废料、聚合物等的合成气的成本有效的生产技术。使用合成气的好处包括灵活性,因为合成气可以从大多数有机物包括生物质中生产得到。另一个好处是合成气的廉价。此外,我们有已知的在有机体如clostridiumspp.中有效地利用合成气的途径。尽管在利用合成气有机体的利用率方面,一般的已知有机体不足以具有该特征且不适合商业化发展。例如,clostridium及其相关细菌是严格厌气菌,其对高浓度的某些产物如丁醇不耐受,从而限制了效价和商业化潜力。clostridium还产生多种产物,要获得想要的产物时存在分离问题。最后,容易操作梭状芽胞杆菌基因的遗传工具的开发正处于起步阶段;因此,它们不能迅速地顺应基因工程以改善所需产物的产率或生产特征。增加廉价和容易利用的原料的灵活性,同时使化学产物的环境影响最小化是可持续化工的两个目标。原料的灵活性依赖于大范围的材料进入并作为化学制品生产的初始原料利用。无论乙炔还是乙烯,对以石油为基础的原料的依赖保证了基于可再生原料的1,3-丁二醇和丁二烯的合成路线的开发。因此,现在需要开发微生物和它们利用碳水化合物、甲醇、合成气或其他气态碳源生产1,3-丁二醇的方法。本发明满足该需求,还提供相关优点。发明概要在某些方面,本文公开的实施方式涉及一种具有1,3-丁二醇(1,3-bdo)途径的非天然存在的微生物有机体,所述途径包括至少一个编码足量表达以生产1,3-bdo的1,3-bdo途径酶或蛋白的外源性核酸。该1,3-bdo途径包括甲醇甲基转移酶(mtab)、类咕啉蛋白(mtac)、甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa)、甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse)、类咕啉铁-硫蛋白(acsd)、镍-蛋白装配蛋白(acsf&cooc)、铁氧化还原蛋白(orf7)、乙酰辅酶a合酶(acsb&acsc)、一氧化碳脱氢酶(acsa)、氢化酶(hyd)、乙酰乙酰辅酶a硫解酶(atob)、乙酰乙酰辅酶a还原酶(辅酶a依赖,乙醛形成)、3-氧代丁醛还原酶(酮还原)、3-羟基丁醛还原酶、乙酰乙酰辅酶a还原酶(辅酶a依赖,醇形成)、3-氧代丁醛还原酶(醛还原)、4-羟基,2-丁酮还原酶、乙酰乙酰辅酶a还原酶(酮还原)、3-羟基丁酰辅酶a还原酶(乙醛形成)、3-羟基丁酰辅酶a还原酶(醇形成)、3-羟基丁酰辅酶a转移酶、3-羟基丁酰辅酶a水解酶、3-羟基丁酰辅酶a合成酶、3-羟基丁酸脱氢酶、3-羟基丁酸还原酶、乙酰乙酰辅酶a转移酶、乙酰乙酰辅酶a水解酶、乙酰乙酰辅酶a合成酶或乙酰乙酸还原酶。在某些方面,本文公开的实施方式涉及一种具有1,3-丁二醇(1,3-bdo)途径的非天然存在的微生物有机体,所述途径包括至少一个编码足量表达以生产1,3-bdo的1,3-bdo途径酶或蛋白的外源性核酸。该1,3-bdo途径包括甲酸脱氢酶、甲酰四氢叶酸合成酶、次甲基四氢叶酸酯环水解酶、亚甲基四氢叶酸脱氢酶、亚甲基四氢叶酸还原酶、甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse)类咕啉铁-硫蛋白(acsd)、镍-蛋白装配蛋白(acsf&cooc)、铁氧化还原蛋白(orf7)、乙酰辅酶a合酶(acsb&acsc)、一氧化碳脱氢酶(acsa)、氢化酶(hyd)、乙酰乙酰辅酶a硫解酶(atob)、乙酰乙酰辅酶a还原酶(辅酶a依赖,醛形成)、3-氧代丁醛还原酶(酮还原)、3-羟基丁醛还原酶、乙酰乙酰辅酶a还原酶(辅酶a依赖,醇形成)、3-氧代丁醛还原酶(醛还原)、4-羟基,2-丁酮还原酶、乙酰乙酰辅酶a还原酶(酮还原)、3-羟基丁酰辅酶a还原酶(醛形成)、3-羟基丁酰辅酶a还原酶(醇形成)、3-羟基丁酰辅酶a转移酶、3-羟基丁酰辅酶a水解酶、3-羟基丁酰辅酶a合成酶、3-羟基丁酸脱氢酶、3-羟基丁酸还原酶、乙酰乙酰辅酶a转移酶、乙酰乙酰辅酶a水解酶、乙酰乙酰辅酶a合成酶或乙酰乙酸还原酶。在某些方面,本文公开的实施方式涉及一种用于生产1,3-bdo的方法,其包括在条件和足够的时间下培养上述非天然存在微生物有机体以生产1,3-bdo。附图简要说明附图1显示了一个描述wood-ljungdahl途径以及乙酸和乙醇的形成途径的图表。能够在合成气中生长的有机体的特征性转化是1)co脱氢酶,2)氢化酶,3)能量转化氢化酶(ech),和4)双功能co脱氢酶/乙酰辅酶a合酶。附图2显示了完整的wood-ljungdahl途径,其能够使气体包括co、co2和/或h2转换至乙酰辅酶a,其随后转换至细胞群和产物例如乙醇或乙酸。缩写:10fthf:10-甲酰四氢叶酸,5mthf:5-甲基四氢叶酸,,actp:乙酰磷酸,cfesp:类咕啉铁硫蛋白,for:甲酸,meoh:甲醇,methf:甲基四氢叶酸,mlthf:次甲基四氢叶酸,thf:四氢叶酸。附图3描述了从乙酰乙酰辅酶a至1,3-丁二醇的途径。酶的步骤是:a)乙酰乙酰辅酶a还原酶(辅酶a依赖,醛形成),b)3-氧代丁醛还原酶(酮还原),c)3-羟基丁醛还原酶,d)乙酰乙酰辅酶a还原酶(辅酶a依赖,醇形成),e)3-氧代丁醛还原酶(醛还原),f)4-羟基,2-丁酮还原酶,g)乙酰乙酰辅酶a还原酶(酮还原),h)3-羟基丁酰辅酶a还原酶(醛形成),i)3-羟基丁酰辅酶a还原酶(醇形成),j)3-羟基丁酰辅酶a转移酶、水解酶或合成酶,k)3-羟基丁酸脱氢酶,l)3-羟基丁酸还原酶,m)乙酰乙酰辅酶a转移酶、水解酶或合成酶,n)乙酰乙酸还原酶。附图4显示了碳水化合物例如葡萄糖,包括co、co2和/或h2的气体以及甲醇到乙酰辅酶a并进一步到1,3-丁二醇的生物合成代谢途径。加工到生产宿主中的特定酶转化编号并显示在该附图中。缩写:10fthf:10-甲酰四氢叶酸,5mthf:5-甲基四氢叶酸,actp:乙酰磷酸,cfesp:类咕啉铁硫蛋白,for:甲酸,meoh:甲醇,methf:甲基四氢叶酸,mlthf:次甲基四氢叶酸,thf:四氢叶酸。附图5显示了碳水化合物例如葡萄糖、包括co,co2和/或h2的气体以及甲醇到乙酰辅酶a并进一步到1,3-丁二醇的生物合成代谢途径。加工到产物宿主中的具体酶的转化被编号并显示在该附图中。缩写:10fthf:10-甲酰四氢叶酸,5mthf:5-甲基四氢叶酸,actp:乙酰磷酸,cfesp:类咕啉铁硫蛋白,for:甲酸,meoh:甲醇,methf:甲基四氢叶酸,mlthf:次甲基四氢叶酸,thf:四氢叶酸。附图6显示了10mg下述物质的蛋白质印迹:acs90(泳道1),acs91(泳道2),mta98/99(泳道3和4)标准大小的细胞提取物(泳道5)和热醋穆尔氏菌codh(moth_1202/1203)或mtr(moth_1197)蛋白(50、150、250、350、450、500、750、900和1000ng)的对照。附图7显示了在甲基紫精分析中使用的比色皿。右边是空白对照,左边是含还原的甲基紫精的比色皿。注,每个比色皿顶部的塞子和真空油酯用来维持反应是缺氧的。附图8显示了acs90细胞提取物的光谱图,为了分析ch3从加入的ch3-thf到纯的热醋穆尔氏菌类咕啉蛋白的转移。附图9从左到右显示了在空载体、acs90和acs91三种情况下,重组大肠杆菌mg1655在37℃下在n2和co中厌氧生长36小时。附图10显示了通过采用wood-ljungdahl途径酶结合1,3-丁二醇生物合成途径,在葡萄糖中可生产1.09mol/mol产率的1,3-丁二醇的示例性流量分布。附图11显示了通过采用可共同利用甲醇作为底物的酶,在葡萄糖中可生产1.2mol/mol产率的1,3-丁二醇的示例性流量分布。发明详述本发明涉及开发和使用有机体,所述有机体能够利用碳水化合物、甲醇、合成气和/或其他气态碳源生产1,3-丁二醇。本发明进一步涉及扩展利用合成气的微生物的产品范围和产生能够利用合成气生产1,3-丁二醇的重组有机体,并优化它们的产率、效价和生产能力。重组有机体的开发为可再生化学制品和染料制造提供成本优势的方法,所述重组有机体例如大肠杆菌(escherichiacoli)或其他适合商业化规模的有机体,其可以有效地利用合成气作为底物来生长和化学制品生产。有机体可以得到优化且快速测定并在合理的成本内。合成气作为原料的潜力在于它能够有效率地且成本有效地转化成化学制品和燃料的利益。合成气转化的两个主要技术是fischer-tropsch方法和发酵方法。fischer-tropsch(f-t)技术自第二次世界大战就已被开发,并且包含无机和金属的催化剂,从而能够有效地生产甲醇或混合烃类作为燃料。f-t方法的缺点是:1)缺少产物选择性,其导致分离想要的产物的难度;2)催化剂敏感性中毒;3)由于高温和压力要求导致的高能量成本;和4)商业竞争成本上的可用的产品范围有限。至于发酵方法,合成气已表现出能给许多厌氧微生物充当碳和能源,其中厌氧微生物可以把这材料转化成产物如乙醇、乙酸和氢。合成气发酵转化的主要优点是有机体生产单一产物的选择性,对合成气杂质更强的耐受性,温度和压力的较低操作要求,以及潜在的来自合成气的大型组合的产物。发酵方法的主要缺点是已知有机体只能把合成气转化成有限范围的化学制品,如乙醇和乙酸,而不能有效生产其他化学制品,有机体缺少既定的工具用于遗传操作,且有机体对高浓度的最终产物敏感。本发明涉及微生物的产生,其能有效地从合成气或其他气态碳源中生产1,3-丁二醇。与传统的基于石油的产品和直接衍生自葡萄糖、蔗糖或木质纤维糖的相比,本发明的有机体和方法在1,3-丁二醇的生产成本上有显著的优势。在一个实施方式中,本发明提供一种非天然存在的微生物,其能够利用合成气或其他气态碳源生产1,3-丁二醇,其亲本微生物没有利用合成气的本能,如附图4和5所示。在这些微生物中,一个或多个蛋白或酶在微生物中表达,从而赋予一个利用合成气或其他气态碳源生产想要产物的途径。在另一实施方式中,本发明提供一种非天然存在的微生物,其在遗传上已被改良,例如,通过表达一个或多个外源性基因或酶而赋予一种增加的生产1,3-丁二醇的能力,其亲本微生物具有利用合成气或其他气态碳源生产想要产品的能力。因此,本发明涉及产生一种具有新的利用合成气的代谢途径能力的微生物,以及产生一种利用合成气或其他气态碳源生产1,3-丁二醇的效率提高的微生物。本发明还提供了非天然存在的微生物,其表达这样的基因,所述基因编码与mtaabc型甲基转移酶系统相连的wood-ljungdahl途径中的羰基分支相关的催化反应的酶。该有机体能够将甲醇和包含co、co2、和/或h2的气体转化到乙酰辅酶a、细胞量和产物中,其中甲醇是一种可以来自合成气的相对廉价的有机原料。本发明进一步提供可以使碳水化合物原料中的1,3-丁二醇产率增加并超过天然预期的产率的途径,大约1mol1,3-丁二醇/mol葡萄糖,通过提供高效的机制将外源提供或内源产生的甲醇或二氧化碳中的碳装配到乙酰辅酶a中。大肠杆菌是一种工业上大量使用的有机体,具有无与伦比的遗传工具适用性。为了加工将co2、co和/或h2转化至乙酰辅酶a的能力,作为所有细胞量组分和多种有用产物来源的中心代谢物进入外源宿主例如大肠杆菌可以通过下述的外源性基因的表达来实现,其中的外源性基因编码wood-ljungdahl途径的多种蛋白。该途径在产乙酸有机体例如热醋穆尔氏菌(moorellathermoacetica,以前称为clostridiumthermoaceticum)中是高度活跃的,其中热醋穆尔氏菌自从1942年分离得到就成为解释wood-ljungdahl途径的模型有机体(fontaine等人,jbacteriol.43:701-715(1942))。wood-ljungdahl途径包括2个分支:东向或甲基分支,和西向或羰基分支,前者能将co2转化成甲基四氢叶酸(me-thf),后者能将甲基-thf、co和辅酶a转化至乙酰辅酶a(参见附图1和2)。正如本文所公开的,本发明提供一种非天然存在的微生物,其表达催化wood-ljungdahl途径的两个分支的基因,以及用于生产1,3-丁二醇的基因。该有机体能够将包含co、co2和/或h2的气体转化至乙酰辅酶a、1,3-丁二醇、细胞量和产物。该有机体还能够以化学当量的最佳产率从碳水化合物生产1,3-丁二醇。例如,与任一乙酰辅酶a至1,3-丁二醇途径结合,wood-ljungdahl酶能使每11摩尔的葡萄糖产生12摩尔1,3-丁二醇,这与缺少wood-ljungdahl途径酶下可得到1mol1,3-丁二醇/1mol葡萄糖不同。本发明还提供了一种非天然存在的微生物,其表达这样的基因,所述基因编码催化与mtaabc型甲基转移酶系统相连的wood-ljungdahl途径的羰基分支的酶,以及生产1,3-丁二醇的基因。该有机体能够将甲醇和包含co、co2、和/或h2的气体转化至乙酰辅酶a、1,3-丁二醇、细胞量和产物,其中甲醇是来自合成气的相对廉价的有机底物。除气体底物以外,有机体可以单独地利用甲醇或与碳水化合物如葡萄糖组合的甲醇来高产率的生产1,3-丁二醇。合成气也称为syngas或水煤气,是煤和含碳材料如生物质材料,包括农作物和残渣气化的主要产物。合成气是主要为h2和co的混合物,可以从任何有机原料包括但不限于煤、石油、天然气、生物质和废弃有机物质的气化而得到。气化通常在高的燃料对氧气比率下发生。除了大量的h2和co,合成气还可包括较少量的co2和其他气体。因此,合成气提供了气态碳如co和co2的成本有效来源。正如本文所公开的,气态碳源如包含co和/或co2的合成气可以被本发明的非天然存在的微生物利用以生产1,3-丁二醇。尽管本文通常以合成气来举例说明,但可以理解地,任何来源的包含co和/或co2的气态碳都可以被本发明的非天然存在的微生物利用。因此,本发明涉及非天然存在的微生物,其能够利用co和/或co2作为碳源。wood-ljungdahl途径催化co和h2转化至乙酰辅酶a和其他产物如乙酸。能够利用co和合成气的有机体通常也能够通过wood-ljungdahl途径包含的酶和转化的基本设置来利用co2和co2/h2的混合物。早在揭露co也能够被相同的有机体利用并涉及相同的途径之前,微生物的co2至乙酸的h2依赖转化已得到公认。已经证明,许多产乙酸菌在存在co2和产物化合物如乙酸的情况下生长,只要存在氢以供应必需的还原当量(例如参见drake,acetogenesis,pp.3-60chapman和hall,newyork,(1994))。这可以用以下的公式概括:2co2+4h2+nadp+npi→ch3cooh+2h2o+natp因此,具有wood-ljungdahl途径的非天然存在的微生物也可以利用co2和h2的混合物用于生产乙酰辅酶a和其他想要产物,例如1,3-丁二醇。wood-ljungdahl途径是现有技术已知的,由可分成两个分支的12个反应组成:(1)甲基分支和(2)羰基分支。甲基分支将合成气转化为甲基四氢叶酸(甲基-thf),而羰基分支将甲基-thf转化为乙酰辅酶a。甲基分支的反应依次被以下酶或蛋白催化:铁氧化还原蛋白氧化还原酶、甲酸脱氢酶、甲酰四氢叶酸合成酶、次甲基四氢叶酸酯环化脱水酶、亚甲基四氢叶酸脱氢酶和亚甲基四氢叶酸还原酶。羰基分支的反应依次被以下酶或蛋白催化:甲基四氢叶酸:类咕啉蛋白甲基转移酶(例如acse)、类咕啉铁硫蛋白、镍蛋白装配蛋白(例如acsf)、铁氧化还原蛋白、乙酰辅酶a合酶、一氧化碳脱氢酶和镍蛋白装配蛋白(例如cooc)。根据本文提供的引入足量的编码核酸来产生乙酰辅酶a途径的教导和指导,本领域技术人员可以理解,为了引入至少编码宿主有机体缺少的wood-ljungdahl酶或蛋白的基因,也可以进行相同的加工设计。因此,将一个或多个编码核酸引入到本发明的微生物中,这样,改良的有机体包含一个分支或完整的wood-ljungdah途径,将赋予合成气利用能力。因此,本发明的非天然存在的微生物可以使用合成气或其他提供co和/或co2的气态碳源来生产1,3-丁二醇。关于co2,其他的来源包括,但不限于,氨和氢工厂里作为副产物的co2的产生,其中甲烷转化成co2;木材和矿物燃料的燃烧;作为啤酒、威士忌和其他酒精饮料酿造中糖发酵或其他发酵过程的副产物,co2的产生;在生产石灰cao过程中石灰石caco3的高温分解;作为磷酸钠生产中的副产物的co2的产生;以及直接来自天然二氧化碳泉,其由石灰石或白云石与酸化水的反应产生。产乙酸菌例如热醋穆尔氏菌、c.ljungdahlii和c.carboxidivorans可以在许多碳源中生长,其中碳源的范围从己糖到一氧化碳。己糖如葡萄糖首先经embden-meyerhof-parnas(emp)糖降解代谢为丙酮酸,其然后经丙酮酸:铁氧化还原蛋白氧化还原酶(pfor)转化为乙酰辅酶a。乙酰辅酶a可用于修建生物质前体,或可转换为乙酸,其经乙酸激酶和磷酸乙酸转移酶产生能量。葡萄糖至乙酸的全部转换、能量和还原当量是c6h12o6+4adp+4pi→2ch3cooh+2co2+4atp+8[h]产乙酸菌甚至在葡萄糖至乙酸的转化中得到更多的能量,同时还通过wood-ljungdahl途径将释放的co2进一步转化为乙酸来维持氧化还原反应平衡:2co2+8[h]+nadp+npi→ch3cooh+natp上述公式中的系数n表示该转化是产生能量的,许多产乙酸菌可以通过wood-ljungdahl途径在有co2的情况下生长,甚至不存在葡萄糖,只要存在氢以供应必需的还原当量。2co2+4h2+nadp+npi→ch3cooh+2h2o+natp如附图1所描述的wood-ljungdahl途径与na+或h+离子梯度的建立相偶联,其可以经na+或h+依赖atp合酶产生atp,各自在产乙酸菌中mullerv.能量守恒。applenvironmicrobiol69:6345-6353(2003)。基于这些已知的转化,产乙酸菌还能够利用co作为唯一的碳和能量来源。特别地,co可以被氧化产生还原当量和co2,或直接同化到乙酰辅酶a中,其随后转化为生物质或乙酸。4co+2h2o→ch3cooh+2co2但是,当存在足够的氢以满足还原当量的需求量,甚至可以达到更高的乙酸产率。2co+2h2→ch3cooh根据图1,经乙酰辅酶的乙酸生产生成1个atp分子,而从乙酰辅酶a的乙醇生产不生成atp且需要2个还原当量。因此,可以得出结论,在没有乙酸产生时,从合成气中生产乙醇不会产生足够的能量用于细胞生长。但是,在某些条件下,clostridiumljungdahlii主要从合成气中生产乙醇(klasson等人,fuel72.12:1673-1678(1993)),这表明一些相结合的途径确实产生足够的能量来支持细胞生长。2co2+6h2→ch3ch2oh+3h2o6co+3h2o→ch3ch2oh+4co22co+4h2→ch3ch2oh+h2o产氢细菌如深红红螺菌也可以在co和水转化为氢的过程中产生能量(参见附图1)(simpma等人,criticalreviewsinbiotechnology,26.1:41-65(2006))。中心机制是能量转换氢化酶(ech)和co脱氢酶的协调活动。co脱氢酶提供来自co的电子,然后电子被ech用于将质子还原成h2,它们的活动与能量产生的质子转为相偶联。最终的结果是通过水煤气变换反应产生的能量。本文公开的用于从合成气中生物合成生产1,3-bdo的方法包含可持续生产实践,其利用可再生原料,降低能量强度和减低温室气体排放。此外,生物基-1,3-bdo的脱水是在小型终端使用的设备中生产丁醇的可再生途径,其中不需要可燃的和活性化学品的运输。如本文所用的,提到本发明的微生物有机体或微生物时使用的术语“非天然存在”意指微生物有机体有至少一个的遗传改变,其在相关物种的天然存在菌株(包括相关物种的野生型菌株)中通常找不到。遗传改变包括,例如,引入编码代谢性多肽的可表达核酸的修饰、其他核酸添加、核酸删除和/或微生物的遗传物质的其他功能破坏。这样的修饰包括,例如,它的编码区域和功能性片段,对于相关物种的异源、同源或既有异源又有同源的多肽。其他修饰包括,例如,非编码调节区域,其中修饰改变基因或操纵子的表达。示例性的代谢性多肽包括1,3-丁二醇生物合成途径在内的酶或蛋白。代谢性修饰是指一种生化反应,其改变它的天然存在状态。因此,非天然存在微生物可以具有对其编码代谢性多肽的核酸或功能片段的遗传修饰。本文公开了示例性的代谢性修饰。如本文所用的,提到微生物有机体时使用的术语“分离”意指一个有机体,其至少缺少自然界中找到的相关微生物有机体的一个组分。该术语包括这样的微生物,其删除了自然环境中找到的这种微生物中一些或所有组分。该术语还包括这样的微生物有机体,其删除了非天然存在的环境中找到的这种微生物中一些或所有组分。因此,分离的微生物是部分或完全地与那些在自然界或那些生长、储藏或生存在非天然存在的环境中找到的其他物质相分离。分离的微生物的具体例子包括部分纯的微生物、基本上纯的微生物和培养在非天然存在的培养基中的微生物。如本文所用的,术语“微生物(microbial)”、“微生物有机体(microbialorganism)”或“微生物(microorganism)”意指任何以显微细胞存在的有机体,其包括在古细菌、细菌或真核的范围内。因此,该术语包含具有显微大小的原核或真核细胞或有机体,并且包括细菌、古细菌和真细菌的所有物种,以及真核微生物如酵母和真菌。该术语还包括细胞培养的任何物种,其可以培养用于生物化学品的生产。如本文所用的,术语“coa”或“辅酶a”意指一种有机辅因子或辅基(酶的非蛋白部分),它的存在是许多酶(脱辅基酶)的活性所必需的,以形成活化的酶系统。在某些缩合酶中,辅酶a在乙酰或其他酰基转移以及脂肪酸合成和氧化、丙酮酸氧化以及其他乙酰化中发挥作用。如本文所用的,提到培养或生长条件时使用的术语“基本上厌氧”意指液体培养基中的溶解氧的量少于约10%的饱和度。这个术语也包括液体或固体培养的密封室中维持少于约1%氧的大气压。本文所用的“外源”意指相关分子或相关活性引入到宿主微生物中。可以引入分子,例如,将编码核酸引入到宿主遗传物质中,如通过整合到宿主染色体或非染色体遗传物质如质粒中。因此,提到编码核酸的表达时使用的该术语是指编码核酸以可表达形式引入到微生物中。在提到生物合成活性时使用,该术语是指一种引入到宿主相关有机体中的活性。来源可以是,例如,同源或异源的编码核酸,其在被引入到宿主微生物后表达相关活性。因此,术语“内源”是指存在在宿主中的相关分子或活性。类似地,当在提到表达编码核酸时使用时,该术语是指微生物内含的编码核酸的表达。术语“异源”是指分子或活性来自除相关物种以外的来源,而“同源”是指分子或活性来自宿主微生物。相应地,本发明的编码核酸的外源性表达可以利用异源或同源编码核酸的任一个或两者。可以理解地,当微生物中包含超过一个外源核酸时,该超过一个外源核酸是指如上文详述的相关编码核酸或生物合成活性。进一步可以理解地,正如本文所述的,这种超过一个的外源核酸可以在分离核酸分子、多顺反子核酸分子或其结合上被引入到宿主微生物,并仍被认为是超过一个的外源核酸。例如,如本文所描述的,一个微生物可以被加工成表达两个或更多的编码期望途径的酶或蛋白的外源核酸。在两个编码期望活性的外源核酸引入到宿主微生物的情况下,我们可以理解这两个外源核酸可作为单个核酸引入,例如,在一个单个质粒上,或在分离的质粒上,可以整合到宿主染色体的单个位置或多个位置,并仍被认为是两个外源核酸。类似地,我们可以理解超过两个外源核酸可以任何期望的组合引入到宿主微生物中,例如,在单个质粒上,在分离的质粒上,可整合到宿主染色体的单个位置或多个位置,并仍被认为是超过两个外源核酸,例如三个外源核酸。因此,相关外源核酸或生物合成活性的数量是指编码核酸的数量或生物合成活性的数量,而不是引入到宿主微生物中的分离核酸的数量。本发明的非天然存在的微生物可包括稳定的遗传改变,其是指微生物可培养超过5代而不丢失该改变。通常,稳定的遗传改变包括维持超过10代的修饰,特别地,稳定的修饰可维持超过约25代,更特别地,稳定的遗传修饰可以超过50代,包括无限期。本领域技术人员可以理解,包括本文示例性的代谢修饰的遗传改变的描述是与下列有机体相关,合适的宿主有机体例如大肠杆菌e.coli和它们相关的代谢反应或者作为期望遗传物质如期望代谢途径的基因的合适来源的有机体。但是,由于品种多样的有机体的完整的基因组序列和基因组领域的高水平,本领域技术人员能够很容易把本文所提供的教导和指导应用到基本上所有的其他有机体上。例如,本文示例性的大肠杆菌e.coli代谢改变可以容易地应用到其他物种中,通过掺合来自引用物种以外的物种的相同或相似的编码核酸。这样的遗传改变包括,例如,物种同源性的遗传改变,一般地,以及特别地,同源、旁系或非同源的基因替换。同源体是不同的有机体中以垂直族系(verticaldescent)相关联且具有基本上相同或同一功能的基因。例如,因为环氧化物的水解酶的生物学功能,鼠环氧化物水解酶和人环氧化物水解酶可以被认为是同源体。当例如基因共有足量的序列相似性以表明它们是同源的时候,基因以垂直族系相关联;或者基因以进化自共同的祖先相关联。基因也可以被认为是同源,如果它们共享三维结构但不必要序列相似性,有足够的量以表明它们自共同祖先进化至基础序列相似性不同的程度。同源的基因可以编码序列相似性约25%至100%氨基酸序列同一性的蛋白。编码共享氨基酸相似性少于25%的蛋白的基因也可以被认为是由垂直族系产生的,如果它们的三维结构也表现出相似性。酶的丝氨酸蛋白酶家族的成员,包括组织型纤溶酶原激活物和弹性蛋白酶,被认为是由共同祖先的垂直族系产生的。同源体包括基因或它们编码的基因产物,其经过,例如进化,在结构或全部的活性上已有差异。例如,一个物种编码一种显示两个功能的基因产物且该功能在第二种物种中已经分成不同的基因,那么这3种基因和它们的相关产物被认为是同源体。关于生物化学的产物的生产,本领域技术人员可以理解,选择引入或是破坏含代谢活性的同源基因是为了非天然存在的微生物的构建。同源体显示可分离活性的一个例子是在两个或更多物种之间或在单个物种内,不同的活性已被分成不同的基因产物。一个具体的例子是弹性蛋白酶蛋白酶解和纤维蛋白溶酶原蛋白酶解的分离,丝氨酸蛋白酶的两种类型,成为纤溶酶原激活物和弹性蛋白酶这两种不同的分子。第二个例子是支原体5’-3’核酸外切酶和果蝇drosophiladna聚合酶iii活性。来自第一个物种的dna聚合酶可被认为是来自第二个物种的核酸外切酶或聚合酶中的一个或两者的同源体,反之亦然。相反地,旁系体是这样的同源体,其与例如进化趋异后的复制有关,具有相似或共同但不完全相同的功能。旁系体可以起源于或衍生自例如相同的物种或来自不同的物种。例如,微粒体的环氧化物水解酶(环氧化物水解i)和可溶性环氧化物水解酶(环氧化物水解酶ii)可被认为是旁系体,因为它们表示两种不同的酶,共同进化自共同的祖先,它们催化不同的反应并在相同物种中具有不同的功能。旁系体是这样的蛋白,其来自相同物种且彼此之间具有显著的序列相似性以表明它们是同源,或通过共同进化自共同的祖先而相关联。旁系蛋白家族的成员包括hipa同源体、荧光素酶基因、肽酶和其他。非同源基因替换是来自一种物种的非同源基因能替换为不同物种中的相关功能基因。替换包括,例如,相比于所述不同物种中的相关功能,能够执行基本上相同或相似的功能的起源物种。尽管通常地,非同源基因替换可以鉴别为与编码相关功能的已知基因结构上相关,然而较低的结构相关性但是功能相似的基因及其对应的基因产物将仍落入本文所用的该术语的含义之内。功能相似性要求,例如,在非同源基因产物的活性位点或结合区域上至少一些结构相似性,相比于编码要替换的功能的基因。因此,非同源基因包括,例如,旁系或不相关基因。因此,在鉴别和构建本发明的具有1,3-丁二醇生物合成能力的非天然存在的微生物时,本领域技术人员可以理解将本文提供的教导和指导应用于具体的物种,其中代谢修饰的鉴别可包括同源体的确认和包含或失活。就存在于编码催化相似或基本上相似代谢反应的酶的相关微生物中的旁系和/或非同源基因替换而言,本领域技术人员还可以利用这些进化相关基因。同源、旁系和非同源基因替换可以用本领域技术人员已知的方法来测定。例如,两个多肽的核酸或氨基酸序列的检测将显示比较序列之间的序列同一性和相似性。基于这些相似性,本领域技术人员可以确定该相似性是否高到足以表明蛋白是通过进化自共同的祖先而相关联的。本领域技术人员已知的算法,如align、blast、clustalw和其他比较并测定未加工序列相似性或同一性,还测定序列中间隙的存在或重要性,其可以指定一个比重或得分。这些算法也是本领域已知的,并类似地用于测定核苷酸序列相似性或同一性。测定相关性的足够相似性的参数基于计算统计学相似性的公知方法来计算,或者在随机多肽中找到相似配对的机会,以及测定配对的显著性。如果需要的话,两个或更多序列的计算机比较还可以通过本领域技术人员肉眼来优化。相关基因产物或蛋白可期望具有高相似性,例如,25%至100%的序列同一性。不相关蛋白可以具有这样的同一性,其基本上与被期望偶然发生的一样(约5%),如果扫描足够大的数据库。5%至24%之间的序列可能或可能不代表足够的同源性来得出比较序列是相关的结论。基于数据库的大小测定这样的配对的显著性的其他统计学分析可以用来测定这些序列的相关性。使用blast算法来确定两个或更多序列的相关性的示例性参数,例如,可以如下设置。简而言之,氨基酸序列比对可以用blastp版本2.0.8(1999年1月5日)和以下参数来进行:矩阵:0blosum62;间隙开放:11;间隙延伸:1;x_dropoff:50;期望:10.0;字长:3;过滤:开。核酸序列比对可以用blastn版本2.0.6(1998年9月16日)和以下参数进行:配对:1;错配:-2;间隙开放:5;间隙延伸:2;x_dropoff:50;期望:10.0;:11;过滤:关。本领域技术人员知道可以对上述参数进行哪些修改以增加或减少例如比较的严紧性,以及确定两个或多个序列的相关性。在一些实施方式中,本发明提供具有1,3-丁二醇(1,3-bdo)途径的非天然存在微生物,其包括至少一个编码足量表达以产生1,3-bdo的1,3-bdo途径酶或蛋白的外源性核酸。1,3-bdo途径包括甲醇甲基转移酶(mtab)、类咕啉蛋白(mtac)、甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa)、甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse)、类咕啉铁-硫蛋白(acsd)、镍-蛋白装配蛋白(acsf&cooc)、铁氧化还原蛋白(orf7)、乙酰辅酶a合酶(acsb&acsc)、一氧化碳脱氢酶(acsa)、氢化酶(hyd)、乙酰乙酰辅酶a硫解酶(atob)、乙酰乙酰辅酶a还原酶(辅酶a依赖,醛形成)、3-氧代丁醛还原酶(酮还原)、3-羟基丁醛还原酶、乙酰乙酰辅酶a还原酶(辅酶a依赖,醇形成)、3-氧代丁醛还原酶(醛还原)、4-羟基,2-丁酮还原酶、乙酰乙酰辅酶a还原酶(酮还原)、3-羟基丁酰辅酶a还原酶(醛形成)、3-羟基丁酰辅酶a还原酶(醇形成)、3-羟基丁酰辅酶a转移酶、3-羟基丁酰辅酶a水解酶、3-羟基丁酰辅酶a合成酶、3-羟基丁酸脱氢酶、3-羟基丁还原酶、乙酰乙酰辅酶a转移酶、乙酰乙酰辅酶a水解酶、乙酰乙酰辅酶a合成酶、或乙酰乙酸还原酶。在一些实施方式中,1,3-bdo途径酶是选自以下的一组酶:a:1)甲醇甲基转移酶(mtab),2)类咕啉蛋白(mtac),3)甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa),4)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),5)类咕啉铁-硫蛋白(acsd),6)镍-蛋白装配蛋白(acsf&cooc),7)铁氧化还原蛋白(orf7),8)乙酰辅酶a合酶(acsb&acsc),9)一氧化碳脱氢酶(acsa),10)氢化酶,11)乙酰乙酰辅酶a硫解酶(atob),12)乙酰乙酰辅酶a还原酶(辅酶a依赖,醛形成),13)3-氧代丁醛还原酶(醛还原),和14)4-羟基,2-丁酮还原酶;b:1)甲醇甲基转移酶(mtab),2)类咕啉蛋白(mtac),3)甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa),4)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),5)类咕啉铁-硫蛋白(acsd),6)镍-蛋白装配蛋白(acsf&cooc),7)铁氧化还原蛋白(orf7),8)乙酰辅酶a合酶(acsb&acsc),9)一氧化碳脱氢酶(acsa),10)氢化酶,11)乙酰乙酰辅酶a硫解酶(atob),12)乙酰乙酰辅酶a还原酶(辅酶a依赖,醛形成),13)3-氧代丁醛还原酶(酮还原),和14)3-羟基丁醛还原酶;c:1)甲醇甲基转移酶(mtab),2)类咕啉蛋白(mtac),3)甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa),4)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),5)类咕啉铁-硫蛋白(acsd),6)镍-蛋白装配蛋白(acsf&cooc),7)铁氧化还原蛋白(orf7),8)乙酰辅酶a合酶(acsb&acsc),9)一氧化碳脱氢酶(acsa),10)氢化酶,11)乙酰乙酰辅酶a硫解酶(atob),12)乙酰乙酰辅酶a还原酶(酮还原),13)3-羟基丁酰辅酶a还原酶(醛形成),和14)3-羟基丁醛还原酶;d:1)甲醇甲基转移酶(mtab),2)类咕啉蛋白(mtac),3)甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa),4)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),5)类咕啉铁-硫蛋白(acsd),6)镍-蛋白装配蛋白(acsf&cooc),7)铁氧化还原蛋白(orf7),8)乙酰辅酶a合酶(acsb&acsc),9)一氧化碳脱氢酶(acsa),10)氢化酶,11)乙酰乙酰辅酶a硫解酶(atob),12)乙酰乙酰辅酶a还原酶(酮还原),和13)3-羟基丁酰辅酶a还原酶(醇形成);e:1)甲醇甲基转移酶(mtab),2)类咕啉蛋白(mtac),3)甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa),4)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),5)类咕啉铁-硫蛋白(acsd),6)镍-蛋白装配蛋白(acsf&cooc),7)铁氧化还原蛋白(orf7),8)乙酰辅酶a合酶(acsb&acsc),9)一氧化碳脱氢酶(acsa),10)氢化酶,11)乙酰乙酰辅酶a硫解酶(atob),12)乙酰乙酰辅酶a还原酶(辅酶a依赖,醇形成),和14)4-羟基,2-丁酮还原酶;f:1)甲醇甲基转移酶(mtab),2)类咕啉蛋白(mtac),3)甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa),4)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),5)类咕啉铁-硫蛋白(acsd),6)镍-蛋白装配蛋白(acsf&cooc),7)铁氧化还原蛋白(orf7),8)乙酰辅酶a合酶(acsb&acsc),9)一氧化碳脱氢酶(acsa),10)氢化酶,11)乙酰乙酰辅酶a硫解酶(atob),12)乙酰乙酰辅酶a转移酶、水解酶或合成酶,13)乙酰乙酸还原酶,14)3-氧代丁醛还原酶(酮还原),和15)3-羟基丁醛还原酶;g:1)甲醇甲基转移酶(mtab),2)类咕啉蛋白(mtac),3)甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa),4)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),5)类咕啉铁-硫蛋白(acsd),6)镍-蛋白装配蛋白(acsf&cooc),7)铁氧化还原蛋白(orf7),8)乙酰辅酶a合酶(acsb&acsc),9)一氧化碳脱氢酶(acsa),10)氢化酶,11)乙酰乙酰辅酶a硫解酶(atob),12)乙酰乙酰辅酶a转移酶、水解酶或合成酶,13)乙酰乙酸还原酶,14)3-氧代丁醛还原酶(醛还原),和15)4-羟基,2-丁酮还原酶;h:1)甲醇甲基转移酶(mtab),2)类咕啉蛋白(mtac),3)甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa),4)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),5)类咕啉铁-硫蛋白(acsd),6)镍-蛋白装配蛋白(acsf&cooc),7)铁氧化还原蛋白(orf7),8)乙酰辅酶a合酶(acsb&acsc),9)一氧化碳脱氢酶(acsa),10)氢化酶,11)乙酰乙酰辅酶a硫解酶(atob),12)乙酰乙酰辅酶a还原酶(酮还原),13)3-羟基丁酰辅酶a转移酶、水解酶或合成酶,14)3-羟基丁酸还原酶,和15)3-羟基丁醛还原酶;i:1)甲醇甲基转移酶(mtab),2)类咕啉蛋白(mtac),3)甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa),4)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),5)类咕啉铁-硫蛋白(acsd),6)镍-蛋白装配蛋白(acsf&cooc),7)铁氧化还原蛋白(orf7),8)乙酰辅酶a合酶(acsb&acsc),9)一氧化碳脱氢酶(acsa),10)氢化酶,11)乙酰乙酰辅酶a硫解酶(atob),12)乙酰乙酰辅酶a转移酶、水解酶或合成酶,13)3-羟基丁酸脱氢酶,14)3-羟基丁酸还原酶,和15)3-羟基丁醛还原酶。非天然存在的微生物可以包括2个各自编码一个1,3-bdo途径酶的外源核酸,在一些实施方式中,3个各自编码一个1,3-bdo途径酶的外源核酸,在其他实施方式中,4个各自编码一个1,3-bdo途径酶的外源核酸,在其他实施方式中,5个各自编码一个1,3-bdo途径酶的外源核酸,在其他实施方式中,6个各自编码一个1,3-bdo途径酶的外源核酸,在其他实施方式中,7个各自编码一个1,3-bdo途径酶的外源核酸,在其他实施方式中,8个各自编码一个1,3-bdo途径酶的外源核酸,在其他实施方式中,9个各自编码一个1,3-bdo途径酶的外源核酸,在其他实施方式中,10个各自编码一个1,3-bdo途径酶的外源核酸,在其他实施方式中,11个各自编码一个1,3-bdo途径酶的外源核酸,在其他实施方式中,12个各自编码一个1,3-bdo途径酶的外源核酸,在其他实施方式中,13个各自编码一个1,3-bdo途径酶的外源核酸,在其他实施方式中,14个各自编码一个1,3-bdo途径酶的外源核酸,在其他实施方式中,15个各自编码一个1,3-bdo途径酶的外源核酸,还在其他实施方式中。这些至少一个外源核酸的任一个可以是异源核酸,并且可以构建该非天然存在的微生物用于培养在基本上厌氧培养基中。这样的微生物可以使用选自以下的碳原料:1)甲醇和co,2)甲醇、co2和h2,3)甲醇、co、co2和h2,4)甲醇和包含co和h2的合成气,5)甲醇和包含co、co2和h2的合成气,6)一种或多种碳水化合物,7)甲醇和一种或多种碳水化合物,和8)甲醇。示例性碳水化合物包括,但不局限于,葡萄糖、蔗糖、木糖、阿拉伯糖和甘油。在一些实施方式中,本发明提供一种非天然存在的微生物,包含具有1,3-丁二醇(1,3-bdo)途径的微生物,所述途径包含至少一个编码足量表达以产生1,3-bdo的1,3-bdo途径酶或蛋白的外源性核酸,所述1,3-bdo途径包含甲酸脱氢酶,甲酰四氢叶酸合成酶,次甲基四氢叶酸酯环水解酶,亚甲基四氢叶酸脱氢酶,亚甲基四氢叶酸还原酶,甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),类咕啉铁-硫蛋白(acsd),镍-蛋白装配蛋白(acsf&cooc),铁氧化还原蛋白(orf7),乙酰辅酶a合酶(acsb&acsc),一氧化碳脱氢酶(acsa),氢化酶(hyd),乙酰乙酰辅酶a硫解酶(atob),乙酰乙酰辅酶a还原酶(辅酶a依赖,醛形成),3-氧代丁醛还原酶(酮还原),3-羟基丁醛还原酶,乙酰乙酰辅酶a还原酶(辅酶a依赖,醇形成),3-氧代丁醛还原酶(醛还原),4-羟基,2-丁酮还原酶,乙酰乙酰辅酶a还原酶(酮还原),3-羟基丁酰辅酶a还原酶(醛形成),3-羟基丁酰辅酶a还原酶(醇形成),3-羟基丁酰辅酶a转移酶,3-羟基丁酰辅酶a水解酶,3-羟基丁酰辅酶a合成酶,3-羟基丁酸脱氢酶,3-羟基丁酸还原酶,乙酰乙酰辅酶a转移酶,乙酰乙酰辅酶a水解酶,乙酰乙酰辅酶a合成酶,或乙酰乙酸还原酶。在一些实施方式中,1,3-bdo途径酶选自下列酶的一组:a:1)甲酸脱氢酶,2)甲酰四氢叶酸合成酶,3)次甲基四氢叶酸酯环水解酶,4)亚甲基四氢叶酸脱氢酶,5)亚甲基四氢叶酸还原酶,6)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),7)类咕啉铁-硫蛋白(acsd),8)镍-蛋白装配蛋白(acsf&cooc),9)铁氧化还原蛋白(orf7),10)乙酰辅酶a合酶(acsb&acsc),11)一氧化碳脱氢酶(acsa),12)氢化酶(hyd),13)乙酰乙酰辅酶a硫解酶(atob),14)乙酰乙酰辅酶a还原酶(辅酶a依赖,醛形成),15)3-氧代丁醛还原酶(醛还原),和16)4-羟基,2-丁酮还原酶;b:1)甲酸脱氢酶,2)甲酰四氢叶酸合成酶,3)次甲基四氢叶酸酯环水解酶,4)亚甲基四氢叶酸脱氢酶,5)亚甲基四氢叶酸还原酶,6)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),7)类咕啉铁-硫蛋白(acsd),8)镍-蛋白装配蛋白(acsf&cooc),9)铁氧化还原蛋白(orf7),10)乙酰辅酶a合酶(acsb&acsc),11)一氧化碳脱氢酶(acsa),12)氢化酶(hyd),13)乙酰乙酰辅酶a硫解酶(atob),14)乙酰乙酰辅酶a还原酶(辅酶a依赖,醛形成),15)3-氧代丁醛还原酶(酮还原),和16)3-羟基丁醛还原酶;c:1)甲酸脱氢酶,2)甲酰四氢叶酸合成酶,3)次甲基四氢叶酸酯环水解酶,4)亚甲基四氢叶酸脱氢酶,5)亚甲基四氢叶酸还原酶,6)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),7)类咕啉铁-硫蛋白(acsd),8)镍-蛋白装配蛋白(acsf&cooc),9)铁氧化还原蛋白(orf7),10)乙酰辅酶a合酶(acsb&acsc),11)一氧化碳脱氢酶(acsa),12)氢化酶(hyd),13)乙酰乙酰辅酶a硫解酶(atob),14)乙酰乙酰辅酶a还原酶(酮还原),15)3-羟基丁酰辅酶a还原酶(醛形成),和16)3-羟基丁醛还原酶;d:1)甲酸脱氢酶,2)甲酰四氢叶酸合成酶,3)次甲基四氢叶酸酯环水解酶,4)亚甲基四氢叶酸脱氢酶,5)亚甲基四氢叶酸还原酶,6)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),7)类咕啉铁-硫蛋白(acsd),8)镍-蛋白装配蛋白(acsf&cooc),9)铁氧化还原蛋白(orf7),10)乙酰辅酶a合酶(acsb&acsc),11)一氧化碳脱氢酶(acsa),12)氢化酶(hyd),13)乙酰乙酰辅酶a硫解酶(atob),14)乙酰乙酰辅酶a还原酶(辅酶a依赖,醇形成),和15)4-羟基,2-丁酮还原酶;e:1)甲酸脱氢酶,2)甲酰四氢叶酸合成酶,3)次甲基四氢叶酸酯环水解酶,4)亚甲基四氢叶酸脱氢酶,5)亚甲基四氢叶酸还原酶,6)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),7)类咕啉铁-硫蛋白(acsd),8)镍-蛋白装配蛋白(acsf&cooc),9)铁氧化还原蛋白(orf7),10)乙酰辅酶a合酶(acsb&acsc),11)一氧化碳脱氢酶(acsa),12)氢化酶(hyd),13)乙酰乙酰辅酶a硫解酶(atob),14)乙酰乙酰辅酶a还原酶(酮还原),和15)3-羟基丁酰辅酶a还原酶(醇形成);f:1)甲酸脱氢酶,2)甲酰四氢叶酸合成酶,3)次甲基四氢叶酸酯cyclo水解酶,4)亚甲基四氢叶酸脱氢酶,5)亚甲基四氢叶酸还原酶,6)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),7)类咕啉铁-硫蛋白(acsd),8)镍-蛋白装配蛋白(acsf&cooc),9)铁氧化还原蛋白(orf7),10)乙酰辅酶a合酶(acsb&acsc),11)一氧化碳脱氢酶(acsa),12)氢化酶(hyd),13)乙酰乙酰辅酶a硫解酶(atob),14)乙酰乙酰辅酶a转移酶、水解酶或合成酶,15)乙酰乙酸还原酶,16)3-氧代丁醛还原酶(酮还原),和17)3-羟基丁醛还原酶;g:1)甲酸脱氢酶,2)甲酰四氢叶酸合成酶,3)次甲基四氢叶酸酯环水解酶,4)亚甲基四氢叶酸脱氢酶,5)亚甲基四氢叶酸还原酶,6)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),7)类咕啉铁-硫蛋白(acsd),8)镍-蛋白装配蛋白(acsf&cooc),9)铁氧化还原蛋白(orf7),10)乙酰辅酶a合酶(acsb&acsc),11)一氧化碳脱氢酶(acsa),12)氢化酶(hyd),13)乙酰乙酰辅酶a硫解酶(atob),14)乙酰乙酰辅酶a转移酶、水解酶或合成酶,15)乙酰乙酸还原酶,16)3-氧代丁醛还原酶(醛还原),和17)4-羟基,2-丁酮还原酶;h:1)甲酸脱氢酶,2)甲酰四氢叶酸合成酶,3)次甲基四氢叶酸酯环水解酶,4)亚甲基四氢叶酸脱氢酶,5)亚甲基四氢叶酸还原酶,6)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),7)类咕啉铁-硫蛋白(acsd),8)镍-蛋白装配蛋白(acs&cooc),9)铁氧化还原蛋白(orf7),10)乙酰辅酶a合酶(acsb&acsc),11)一氧化碳脱氢酶(acsa),12)氢化酶(hyd),13)乙酰乙酰辅酶a硫解酶(atob),14)乙酰乙酰辅酶a还原酶(酮还原),15)3-羟基丁酰辅酶a转移酶、水解酶或合成酶,16)3-羟基丁酸还原酶,和17)3-羟基丁醛还原酶;i:1)甲酸脱氢酶,2)甲酰四氢叶酸合成酶,3)次甲基四氢叶酸酯环水解酶,4)亚甲基四氢叶酸脱氢酶,5)亚甲基四氢叶酸还原酶,6)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),7)类咕啉铁-硫蛋白(acsd),8)镍-蛋白装配蛋白(acsf&cooc),9)铁氧化还原蛋白(orf7),10)乙酰辅酶a合酶(acsb&acsc),11)一氧化碳脱氢酶(acsa),12)氢化酶(hyd),13)乙酰乙酰辅酶a硫解酶(atob),14)乙酰乙酰辅酶a转移酶、水解酶或合成酶,15)3-羟基丁酸脱氢酶,16)3-羟基丁酸还原酶,和17)3-羟基丁醛还原酶。非天然存在的微生物可包括2个各自编码一个1,3-bdo途径的外源核酸,在一些实施方式中,3个各自编码一个1,3-bdo途径酶的外源核酸,在其他实施方式中,4个各自编码一个1,3-bdo途径酶的外源核酸,在其他实施方式中,5个各自编码一个1,3-bdo途径酶的外源核酸,在其他实施方式中,6个各自编码一个1,3-bdo途径酶的外源核酸,在其他实施方式中,7个各自编码一个1,3-bdo途径酶的外源核酸,在其他实施方式中,8个各自编码一个1,3-bdo途径酶的外源核酸,在其他实施方式中,9个各自编码一个1,3-bdo途径酶的外源核酸,在其他实施方式中,10个各自编码一个1,3-bdo途径酶的外源核酸,在其他实施方式中,11个各自编码一个1,3-bdo途径酶的外源核酸,在其他实施方式中,12个各自编码一个1,3-bdo途径酶的外源核酸,在其他实施方式中,13个各自编码一个1,3-bdo途径酶的外源核酸,在其他实施方式中,14个各自编码一个1,3-bdo途径酶的外源核酸,在其他实施方式中,15个各自编码一个1,3-bdo途径酶的外源核酸,在其他实施方式中,16个各自编码一个1,3-bdo途径酶的外源核酸,在其他实施方式中,和17个外源核酸,还在其他实施方案中。这些至少一个外源核酸的任一个可以是异源核酸,并且可以构建该非天然存在的微生物用于培养在基本上厌氧培养基中。这样的微生物可以使用选自以下的碳原料:1)co,2)co2和h2,3)co、co2和h2,4)包含co和h2的合成气,5)包含co、co2和h2的合成气,6)一种或多种碳水化合物。示例性碳水化合物包括,但不局限于,葡萄糖、蔗糖、木糖、阿拉伯糖和甘油。在一个其他的实施方式中,本发明提供具有1,3-丁二醇途径的非天然存在的微生物,其中非天然存在的微生物包含至少一个编码酶或蛋白的外源性核酸,其将底物转化成产物,该转化选自以下:二氧化碳到for,for到10fthf,10fthf至methf,methf至mlthf,mlthf至5mthf,甲醇至ch3-mtac,ch3-mtac至5mthf,5mthf至cfesp-ch3,cfesp-ch3至乙酰辅酶a,乙酰辅酶a至乙酰乙酰辅酶a,乙酰乙酰辅酶a至3-羟基丁基辅酶a,3-羟基丁基辅酶a至3-羟基丁醛,3-羟基丁醛至1,3-bdo,3-羟基丁基辅酶a至1,3-bdo,乙酰乙酰辅酶a至4-羟基-2-丁酮,乙酰乙酰辅酶a至3-氧丁醛(3-oxobutryaldehyde),3-氧丁醛至4-羟基-2-丁酮,4-羟基-2-丁酮至1,3-bdo,3-氧丁醛至3-羟基丁醛,乙酰乙酰辅酶a至乙酰乙酸,乙酰乙酸至3-氧代丁醛,乙酰乙酸至3-羟基丁酸,3-羟基丁酰辅酶a至3-羟基丁酸,和3-羟基丁酸至3-羟基丁醛。本领域技术人员可以理解,这些仅仅是示例,且基于本文的教导,本文公开的任何适合生产想要产物的底物-产物对和可用于将底物转化为产物的恰当的活性可以容易地被本领域技术人员所确定。因此,本发明提供包含至少一个编码酶或蛋白的外源性核酸的非天然存在的微生物,其中酶或蛋白转化底物和1,3-丁二醇途径的产物,例如附图4和5显示的那些。当本文通常描述为包含1,3-丁二醇途径的微生物时,可以理解地,本发明还提供包含至少一个外源性核酸的非天然存在的微生物,所述外源性核酸编码足量表达以产生1,3-丁二醇途径的中间产物的1,3-丁二醇途径酶或蛋白。例如,如本文所公开的,1,3-丁二醇途径示例在附图4和5。因此,除了包含产生1,3-丁二醇的1,3-丁二醇途径的微生物外,本发明还提供包含至少一个编码1,3-丁二醇途径酶的外源核酸的非天然存在的微生物,其中微生物产生1,3-丁二醇途径中间产物,例如,乙酰辅酶a,乙酰乙酰辅酶a,乙酰乙酸,3-羟基丁基辅酶a,3-羟基丁酸,3-氧代丁醛,4-羟基-2-丁酮,和3-羟基丁醛。可以理解地,本文公开的任一途径,如实施例和示例性附图中的描述的,包括附图4和5的途径,可以用于产生非天然存在的微生物,其生产任何途径的中间产物或产物,按照期望的。如本文公开的,这样的生产中间产物的微生物可以与其他表达下游途径酶生产想要产物的微生物结合使用。但是,可以理解地,生产1,3-丁二醇途径中间产物的非天然存在的微生物可以用于生产中间产物作为期望的产物。因此,本发明的非天然存在的有机体可以用于生产,例如,乙酰乙酸,3-羟基丁酸,3-氧代丁醛,3-羟基丁醛,或4-羟基-2-丁酮。因此,这些中间产物的任何一个可以利用附图4和5所示的途径在分离的有机体中产生。在一些实施方式中,本文描述的非天然存在的有机体具有如附图4所示的3个能力:1)功能性甲基转移酶系统,提供从甲醇和thf中生产5-甲基-四氢叶酸(me-thf),2)结合co、辅酶a和me-thf的甲基以形成乙酰辅酶a的能力,和3)从乙酰辅酶a合成1,3-丁二醇的能力。后者可以通过碳水化合物经糖酵解产生丙酮酸而得到促进。糖酵解是一个厌氧代谢途径,其可在所有活的有机体细胞的细胞质中找到。这个过程将一分子葡萄糖转化为2分子丙酮酸,同时提供2个净分子atp:葡萄糖+2nad++2pi+2adp→2丙酮酸+2nadh+2atp+2h++2h2o这种非天然存在的有机体可以“固定(fix)”外源性co和/或co2和甲醇的碳以合成乙酰辅酶a、细胞量和产物。值得注意的是,相比于利用全部的wood-ljungdahl途径,执行从甲醇和合成气形成乙酰辅酶a的途径是能量有利的。例如,合成气到乙酸的直接转化是能量中立过程(参见附图1和2)。特别地,由甲酰基-thf合酶形成甲酰基-thf的过程中消耗一个atp分子,而经乙酸激酶生产乙酸的过程产生1个atp分子。本文公开的途径围绕着atp消耗,通过保证甲基分支产物甲基-thf的甲基是从甲醇而不是co2中得到。这保证了乙酸形成有正atp产率,其可以帮助支持细胞生长和维持。被加工成具有这些能力并具有(糖)回补(anapleurosis)能力的宿主微生物(例如大肠杆菌)在存在合适的外部电子受体如硝酸的情况下可以在甲醇和合成气生产的乙酰辅酶a中生长。电子受体用于接受来自经琥珀酸脱氢酶形成的还原醌的电子。添加外部电子受体的另一个好处是,用于细胞生长、维持和产物形成的额外能量可由乙酰辅酶a的呼吸来产生。在一些实施方式中,另一个非天然存在的微生物具有丙酮酸铁氧还原蛋白氧化还原酶(pfor)或其他促进丙酮酸转化到乙酰辅酶a的酶或反之亦然进入菌株以促进生物量母体的合成,在缺少外部电子受体的情况下。该非天然存在的有机体的另一特征是从分子氢中提取还原当量的能力。这能使还原产物例如乙醇、丁醇、异丁醇、异丙醇、1,4-丁二醇、1,3-丁二醇、琥珀酸、富马酸、马来酸、4-羟丁酸、3-羟丙酸、乳酸、己二酸、甲基丙烯酸和丙烯酸具有高的产率。本发明描述的有机体可以从下列物质中生产乙酰辅酶a、细胞量和目标化学制品,更特定地是1,3-bdo,所述物质是:1)甲醇和co,2)甲醇、co2和h2,3)甲醇、co、co2和h2,4)甲醇和包含co和h2的合成气,5)甲醇和包含co、co2和h2的合成气,6)一种或多种碳水化合物,7)甲醇和一种或多种碳水化合物,和8)甲醇。示例性的碳水化合物包括,但不限于,葡萄糖、蔗糖、木糖、阿拉伯糖和甘油。成功地将这些途径加工到一个有机体中包含鉴别一组恰当的酶,克隆它们的相应的基因到生产宿主,优化这些基因的稳定性和表达,优化发酵条件,以及分析发酵后的产物形成。下面描述了催化途径的各步骤的许多酶,所述途径使用合成气和甲醇转化成乙酰辅酶a,以及进一步转化成至1,3-丁二醇。为了加工生产宿主用于合成气和甲醇的利用,一个或多个编码这些途径的酶的外源dna序列可以在微生物中表达。如附图4所示的外来宿主中的改良的wood-ljungdahl途径的表达包含引入一组甲基转移酶来利用甲醇提供的碳和氢以及co和/或co2提供的碳。名称为mtaa、mtab和mtac的这3个甲基转移酶蛋白的复合体执行期望的甲醇甲基转移酶活性(sauer等人,eur.j.biochem.243.3:670-677(1997);naidu和ragsdale,j.bacteriol.183.11:3276-3281(2001);tallant和krzycki,j.biol.chem.276.6:4485-4493(2001);tallant和krzycki,j.bacteriol.179.22:6902-6911(1997);tallant和krzycki,j.bacteriol.178.5:1295-1301(1996);ragsdale,s.w.,crit.rev.biochem.mol.biol.39.3:165-195(2004))。mtab是一种锌蛋白,其催化甲基从甲醇转移到mtac,一种类咕啉蛋白。编码mtab和mtac的示例性基因可以在产甲烷古细菌例如巴氏甲烷八叠球菌(methanosarcinabarkeri)(maeder等人,j.bacteriol.188.22:7922-7931(2006))和醋酸甲烷八叠球菌(methanosarcinaacetivorans)(galagan等人,genomeres.12/4:532-542(2002))以及产乙酸菌热醋穆尔氏菌(das等人,proteins67.1:167-176(2007))中找到。通常地mtab和mtac基因在染色体上彼此靠近,因为它们的活性是紧密地相互依赖。在巴氏甲烷八叠球菌、醋酸甲烷八叠球菌和热醋穆尔氏菌中的各种mtab和mtac的编码基因的蛋白序列可以通过它们下列的genbank登记号来鉴定:来自巴氏甲烷八叠球菌的mtab1和mtac1基因,yp_304299和yp_304298被克隆到大肠杆菌中并测序(sauer等人,eur.j.biochem.243.3:670-677(1997))。甲醇-钴胺素甲基转移酶复合物的晶体结构也是可买到的(hagemeier等人,proc.natl.acad.sci.u.s.a.103.50:18917-18922(2006))。巴氏甲烷八叠球菌中的mtab基因,yp_307082和yp_304612通过与yp_304299的序列同源性来鉴定。通常地,同源性检索是鉴定甲醇甲基转移酶的有效方式,因为mtab编码基因显示几乎没有或没有与甲基转移酶的相似性,所述甲基转移酶在可选底物上发挥作用,例如三甲胺、二甲胺、一甲胺或二甲硫醚。mtac基因,yp_307081和yp_304611是基于它们与mtab基因近似且也与yp_304298同源进行鉴定。来自醋酸甲烷八叠球菌的三组mtab和mtac基因已在遗传上、生理学上、生物化学上被表征(pritchett和metcalf,mol.microbiol.56.5:1183-1194(2005))。缺少上述组中的两组的突变株能在甲醇中生长,而缺少所有的三组mtab和mtac基因组的突变株不能在甲醇中生长。这表明每组基因都在甲醇利用中发挥作用。热醋穆尔氏菌mtab基因的鉴定是基于与产甲烷mtab基因的同源性,还通过它的邻近染色体靠近甲醇感应类咕啉蛋白mtac,所述mtac已被结晶(zhou等人,actacrystallogr.sect.fstruct.biolcryst.commun.61pt.5:537-540(2005))且进一步被northern杂交和western印迹所表征。(das等人proteins67.1:167-76(2007))。mtaa是一种锌蛋白,其催化甲基从mtac转移到产甲烷菌的辅酶m或产乙酸菌的甲基四氢叶酸上。mtaa还可以利用甲基钴胺素作为甲基供体。示例性基因编码mtaa可以在产甲烷古细菌如巴氏甲烷八叠球菌(maeder等人,j.bacteriol.188.227922-7931(2006))和醋酸甲烷八叠球菌(galagan等人,genomeres.12.4:532-542(2002))以及产乙酸菌热醋穆尔氏菌(das等人,proteins67.1:167-176(2007))中找到。通常地,催化ch3-mtac上的甲基转移的mtaa蛋白很难在生物信息学(bioinformatically)上进行鉴定,因为它们与其他类咕啉蛋白甲基转移酶相似,而且在染色体上没有定向的靠近mtab和mtac基因。然而,许多mtaa编码基因已被表征。巴氏甲烷八叠球菌和醋酸甲烷八叠球菌中这些基因的蛋白序列可以通过以下genbank登记号来鉴定:来自巴氏甲烷八叠球菌的mtaa基因,yp_304602被克隆、测序并功能性地过表达在大肠杆菌上(harms和thauer,eur.j.biochem.135.3:653-659(1996))。在醋酸甲烷八叠球菌中,mtaa1的作用是为了在甲醇中生长,而mtaa2不是必要的,即使从甲醇生产的甲烷在mtaa2突变株中被还原(bose等人j.bacteriol.190.11:4017-4026(2008))。此外,在巴氏甲烷八叠球菌和醋酸甲烷八叠球菌中有多重的尚未被表征的mtaa同源体,但其也可以催化类咕啉蛋白甲基转移酶活性。热醋穆尔氏菌中的推定的mtaa编码基因是通过它们与已表征的产甲烷mtaa基因的序列相似性来鉴定。特别地,三个热醋穆尔氏菌基因显示出与来自巴氏甲烷八叠球菌的yp_304602具有高的同源性(>30%的序列同一性)。与天然地催化甲基从ch3-mtac转移到辅酶m的产甲烷mtaa蛋白不同,热醋穆尔氏菌mtaa可以将甲基转移到甲基四氢叶酸,因为产甲烷菌和产乙酸菌中各自的甲基四氢叶酸和辅酶m的作用类似。来自热醋穆尔氏菌的推定mtaa编码基因的蛋白序列可以通过以下genbank登记号来鉴定:蛋白genbankidgi号有机体mtaayp_43093783590928热醋穆尔氏菌mtaayp_43117583591166热醋穆尔氏菌mtaayp_43093583590926热醋穆尔氏菌acs/codh是wood-ljungdahl途径的羰基分支的中心酶。它催化二氧化碳到一氧化氮的可逆还原反应,以及催化从一氧化碳、辅酶a和来自甲基化的类咕啉铁硫蛋白的甲基中合成乙酰辅酶a。类咕啉铁硫蛋白是甲基四氢叶酸经甲基转移酶而甲基化的。acs/codh在外来宿主中的表达包括引入一个或多个以下蛋白:甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),类咕啉铁-硫蛋白(acsd),镍-蛋白装配蛋白(acsf),铁氧化还原蛋白(orf7),乙酰辅酶a合酶(acsb和acsc),一氧化碳脱氢酶(acsa),镍-蛋白装配蛋白(cooc)。用于一氧化碳脱氢酶/乙酰辅酶a合酶活性的基因典型地位于自身基因组的有限区域,其可能是一个延伸的操纵子(ragsdale,s.w.,crit.rev.biochem.mol.biol.39.3:165-195(2004);morton等人,j.biol.chem.266.35:23824-23828(1991);roberts等人,proc.natl.acad.sci.u.s.a.86.1:32-36(1989))。来自产乙酸菌热醋穆尔氏菌的这种操纵子上的每个基因早已被克隆并在大肠杆菌中活跃地表达(morton等人,出处同上(1991);roberts等人,出处同上(1989);lu等人,j.biol.chem.268.8:5605-5614(1993))。这些基因的蛋白序列可以通过以下的genbank登记号来鉴定:蛋白genbankidgi号有机体acseyp_43005483590045热醋穆尔氏菌acsdyp_43005583590046热醋穆尔氏菌acsfyp_43005683590047热醋穆尔氏菌orf7yp_43005783590048热醋穆尔氏菌acscyp_43005883590049热醋穆尔氏菌acsbyp_43005983590050热醋穆尔氏菌acsayp_43006083590051热醋穆尔氏菌coocyp_43006183590052热醋穆尔氏菌产氢菌生氢氧化碳嗜热菌(carboxydothermushydrogenoformans)可以通过乙酰辅酶a合酶利用一氧化碳作为生长底物(wu等人plosgenet.1.5:e65(2005))。在菌株z-2901中,由于移码突变,乙酰辅酶a合酶酶复合物缺少一氧化碳脱氢酶(wu等人plosgenet.1.5:e65(2005));而在菌株dsm6008中,纯化了该蛋白的功能性的未移码全长版本(svetlitchnyi等人,proc.natl.acad.sci.u.s.a.101.2:446-451(2004))。来自菌株z-2901的生氢氧化碳嗜热菌基因的蛋白序列可以通过以下genbank登记号来鉴定:蛋白genbankidgi号有机体acseyp_36006578044202生氢氧化碳嗜热菌acsdyp_36006478042962生氢氧化碳嗜热菌acsfyp_36006378044060生氢氧化碳嗜热菌orf7yp_36006278044449生氢氧化碳嗜热菌acscyp_36006178043584生氢氧化碳嗜热菌acsbyp_36006078042742生氢氧化碳嗜热菌coocyp_36005978044249生氢氧化碳嗜热菌产甲烷古细菌醋酸甲烷八叠球菌还可以在一氧化碳中生长,表现出乙酰辅酶a合酶/一氧化碳脱氢酶活性,并生产乙酸和甲酸(lessner等人,proc.natl.acad.sci.u.s.a.103.47:17921-17926(2006))。该有机体包含两组编码acs/codh活性的基因(rother和metcalf,proc.natl.acad.sci.u.s.a.101.48:16929-16934(2004))。醋酸甲烷八叠球菌的上述两组基因的蛋白序列可以通过以下genbank登记号来鉴定:蛋白genbankidgi号organismacscnp_61873620092661醋酸甲烷八叠球菌acsdnp_61873520092660醋酸甲烷八叠球菌acsf,coocnp_61873420092659醋酸甲烷八叠球菌acsbnp_61873320092658醋酸甲烷八叠球菌acsepsnp_61873220092657醋酸甲烷八叠球菌acsanp_61873120092656醋酸甲烷八叠球菌acscnp_61596120089886醋酸甲烷八叠球菌acsdnp_61596220089887醋酸甲烷八叠球菌acsf,coocnp_61596320089888醋酸甲烷八叠球菌acsbnp_61596420089889醋酸甲烷八叠球菌acsepsnp_61596520089890醋酸甲烷八叠球菌acsanp_61596620089891醋酸甲烷八叠球菌acsc、acsd、acsb、acse和acsa蛋白通常指的是产甲烷的codh/acs的γ、δ、β、ε和α亚基。ε编码基因的同源体在产乙酸菌如热醋穆尔氏菌或产氢菌如生氢氧化碳嗜热菌中不存在。醋酸甲烷八叠球菌中存在两个活性codh/acs操纵子的假说包括催化性能(即,km,vmax,kcat),其有利于一氧化碳营养菌或解乙酸菌生长或分化基因调节促使各种刺激因素以诱导codh/acs表达(rother等人,arch.microbiol.188.5:463-472(2007))。在热醋穆尔氏菌和生氢氧化碳嗜热菌中,其他codh编码基因位于acs/codh操纵子的外面。这些酶提供从一氧化碳到二氧化碳的转化中提取电子(或还原当量)的工具。然后,该还原当量传送到受体如氧化的铁氧化还原蛋白、nadp+、水或过氧化氢以分别形成还原的铁氧化还原蛋白、nadph、h2或水。在一些情况,氢化酶编码基因位于相邻codh。在深红红螺菌(rhodospirillumrubrum)中,编码的codh/氢化酶蛋白形成膜结合酶复合物,其已被标明是从co转化为co2和h2的过程中以质子梯度的形式产生能量的位点(fox等人,j.bacteriol.178.21:6200-6208(1996))。生氢氧化碳嗜热菌的codh-i及其相邻基因建议作用于催化相似功能作用,基于它们与深红红螺菌codh/氢化酶基因组的相似性(wu等人,plosgenet.1.5:e65(2005))。生氢氧化碳嗜热菌codh-i还显示出激烈的co氧化和co2还原活性,当它与电极相连接(parkin等人,j.am.chem.soc.,129.34:10328-10329(2007))。克隆并测序了一种基因,其编码生氢氧化碳嗜热菌codh-ii和coof,一种毗邻蛋白(gonzalez和robb,femsmicrob.lett.191.2:243-247(2000))。得到的复合物是膜结合的,虽然codh-ii的细胞质碎片显示出催化nadph的形成,暗示合成代谢作用(svetlitchnyi等人,j.bacteriol.183.17:5134-5144(2001))。该codh-ii的晶体结构是可买到的(dobbek等人,science293.5533:1281-1285(2001))。示例性codh和氢化酶基因的蛋白序列可以根据以下genbank登记号来鉴定:在没有外部电子受体的情况下,在合成气和甲醇中的厌氧生长被赋予具有mtr和acs/codh活性的宿主有机体,通过允许经丙酮酸铁氧化还原蛋白氧化还原酶(pfor)的丙酮酸合成。这种酶允许丙酮酸到乙酰辅酶a的可逆转化。来自非洲脱硫弧菌(desulfovibrioafricanus)的pfor已被克隆且在大肠杆菌中表达,从而得到一种有效的重组酶,其在存在氧的情况下稳定数天(pieulle等人,,j.bacteriol.179.18:5684-5692(1997))。氧稳定性在pfors中是相对地罕有的,但可以通过在非洲脱硫弧菌酶的多肽链上一个60个残基扩展而得到。热醋穆尔氏菌pfor还被很好地表征(menon和ragsdalebiochemistry36.28:8484-8494(1997))且显示出在自养生长期间丙酮酸合成的方向上有高的活性(furdui和ragsdale,j.biol.chem.275.37:28494-28499(2000))。进一步地,大肠杆菌具有一个未表征的开放阅读框,ydbk,其编码一个与热醋穆尔氏菌pfor具有51%同一性的蛋白。关于丙酮酸氧化还原酶在大肠杆菌中的活性的证据已被描述(blaschkowski等人,eur.j.biochem.123.3:563-569(1982))。这些示例性pfor酶的蛋白序列可以通过以下genbank登记号来鉴定。一些其他pfor酶已在下面的综述中进行了描述(ragsdale,s.w.,chem.rev.103.6:2333-2346(2003)):蛋白genbankidgi号有机体porcaa70873.11770208非洲脱硫弧菌poryp_428946.183588937热醋穆尔氏菌ydbknp_415896.116129339大肠杆菌丙酮酸到乙酰辅酶a的转化可以通过一些其他酶或他们的结合来催化。例如,丙酮酸脱氢酶可以将丙酮酸转化到乙酰辅酶a,同时伴随一分子nad还原成nadh。它是一个多酶复合体,其催化一系列局部反应导致丙酮酸的酰化氧化脱酸作用。该酶由三个亚基组成:丙酮酸脱羧酶(e1)、酰基转移酶(e2)和二氢硫辛酰胺脱氢酶(e3)。这个酶天然地存在于一些有机体中,包括大肠杆菌和酿酒酵母。在大肠杆菌酶中,e1元件中的具体残基负责底物特异性(bisswanger,h.,j.biol.chem.256:815-82(1981);bremer,j.,eur.j.biochem.8:535-540(1969);gong等人,j.biol.chem.275:13645-13653(2000))。酶工程的努力已经改善了缺氧情况下的大肠杆菌pdh酶活性(kim等人,j.bacteriol.190:3851-3858(2008);kim等人,appl.environ.microbiol.73:1766-1771(2007);zhou等人,biotechnol.lett.30:335-342(2008))。不同于大肠杆菌pdh,b.subtilis复合体在缺氧情况的生长中是活跃的且必需的(nakano等人,j.bacteriol.179:6749-6755(1997))。在甘油中生长期间被表征的克雷伯氏肺炎菌pdh在缺氧情况下也是活跃的(menzel等人,j.biotechnol.56:135-142(1997))。来自牛肾的酶复合体的晶体结构(zhou等人,proc.natl.acad.sci.u.s.a.98:14802-14807(2001))和来自棕色固氮菌的e2催化域是可买到的(mattevi等人,science255:1544-1550(1992))。然而,另一个可以催化这个转换的酶是丙酮酸甲酸裂解酶。这个酶催化丙酮酸和辅酶a到乙酰辅酶a和甲酸的转化。丙酮酸甲酸裂解酶是原核生物中的常见酶,其用于帮助调节缺氧的氧化还原反应平衡。示例性酶可以在由pflb编码的大肠杆菌(knappe和sawers,fems.microbiolrev.6:383-398(1990))、乳酸链球菌(melchiorsen等人,applmicrobiolbiotechnol58:338-344(2002))和变形链球菌(takahashi-abbe等人,oral.microbiolimmunol.18:293-297(2003))中找到。大肠杆菌具有另外的由tdce编码的丙酮酸甲酸裂解酶,其催化丙酮酸或2-氧代丁酸各自到乙酰辅酶a或丙酰辅酶a的转化(hesslinger等人,mol.microbiol27:477-492(1998))。来自大肠杆菌的pflb和tdce都需要由pfla编码的丙酮酸甲酸裂解酶激活酶的存在。进一步地,大肠杆菌中的一个由yfid编码的短蛋白可以相关,且恢复氧裂的丙酮酸甲酸裂解酶的活性(vey等人,proc.natl.acad.sci.u.s.a.105:16137-16141(2008)。值得注意地,来自大肠杆菌的pfla和pflb在酿酒酵母中表达,作为一种为了丁醇生产而增加细胞液乙酰辅酶a的方法,如wo/2008/080124。分别由pfl和act编码的另外的丙酮酸甲酸裂解酶和激活酶候选物可巴斯德梭菌在中找到(weidner等人,jbacteriol.178:2440-2444(1996))。进一步地,不同的酶可以联合使用以将丙酮酸转化到乙酰辅酶a中。例如,在酿酒酵母中,乙酰辅酶a在细胞液中是通过以下步骤获得,首先脱羧化丙酮酸以形成乙醛,后者通过乙醛脱氢酶被氧化成乙酸,并随后通过乙酰辅酶a合成酶被活化以形成乙酰辅酶a。乙酰辅酶a合成酶是一些其他有机体中的自身酶,所述有机体包括大肠杆菌(kumari等人,j.bacteriol.177:2878-2886(1995)),肠道沙门菌(starai等人,microbiology151:3793-3801(2005);starai等人,j.biol.chem.280:26200-26205(2005))和热醋穆尔氏菌(已有描述)。可选地,乙酸可以被乙酸激酶和磷酸乙酸转移酶活化以形成乙酰辅酶a。首先,乙酸激酶将乙酸转化到乙酰磷酸中,伴随着一个atp分子的消耗。接下来,乙酰磷酸和辅酶a通过磷酸乙酸转移酶被转化到乙酰辅酶a中,伴随着一个磷酸的释放。乙酸激酶和磷酸乙酸转移酶都是一些梭状芽胞杆菌和嗜热甲烷八叠球菌中的被很好地研究了的酶。然而,将丙酮酸转化为乙酰辅酶a的另一种途径是通过丙酮酸氧化酶。丙酮酸氧化酶将丙酮酸转化到乙酸中,使用泛醌作为电子受体。在大肠杆菌中,这种活性由poxb编码。poxb具有与酿酒酵母和运动发酵单胞菌(zymomonasmobilis)的丙酮酸脱羧酶的相似性。该酶有一个硫胺素焦磷酸酶辅因子(koland和gennis,biochemistry21:4438-4442(1982);o'brien等人,biochemistry16:3105-3109(1977);o'brien和gennis,j.biol.chem.255:3302-3307(1980))和一个黄素腺嘌呤二核苷酸(fad)辅因子。然后,如之前所述,通过乙酰辅酶a合成酶,或通过乙酸激酶和磷酸乙酸转移酶,乙酸被转化到乙酰辅酶a中。这些酶中的一些还可以催化乙酰辅酶a到丙酮酸的逆反应。与co和meoh到乙酰辅酶a或乙酸的氧化还原反应中性的转化不同,从气态底物生产最高的可能产率的更高还原的产物如丁醇、异丁醇、异丙醇、1,4-丁二醇、1,3-丁二醇、琥珀酸、富马酸、苹果酸、4-羟基丁酸、3-羟基丙酸、乳酸、己二酸、甲基丙烯酸和丙烯酸依赖于来自co和h2的额外的还原当量的提取(例如,参见附图4中的醇形成)。特别地,还原当量是通过一氧化碳脱氢酶将co和水转化为co2而获得的,或者直接从氢利用氢化酶的活性中获得,所述氢利用氢化酶将电子从h2转移到接受体例如铁氧化还原蛋白、黄素氧化还原蛋白、fad+、nad+或nadp+。自身的大肠杆菌和其他肠细菌具有编码多达4种氢化酶的多基因(sawers,g.,antonievanleeuwenhoek66.1:57-88(1994);sawers等人,j.bacteriol.168.1:398-404(1986);sawers和boxer,eur.j.biochem.156.2:265-275(1986);sawers等人,j.bacteriol.164.3:1324-1331(1985))。由于酶活性的多样性,大肠杆菌或另一个宿主有机体可提供充足的氢化酶活性以分裂进来的分子氢并还原相应的受体。在大肠杆菌的内源的氢解酶中是氢化酶3和氢化酶4,前者是一种使用铁氧化还原蛋白作为接受体的膜结合酶复合体,后者也是一种使用铁氧化还原蛋白的接受体。氢化酶3和4分别由hyc和hyf基因组编码。大肠杆菌中的氢化酶活性还依赖于hyp基因的表达,所述hyp基因的对应蛋白是包含在氢化酶复合体的组合中(rangarajan等人j.bacteriol.190.4:1447-1458(2008);jacobi等人,arch.microbiol.158.6:444-451(1992))。热醋穆尔氏菌氢化酶是适合的候选物,其允许生产宿主缺少充足的内源的氢化酶活性。热醋穆尔氏菌可以用co2作为唯一碳源进行生长,暗示还原当量提取自h2以激活经wood-ljungdahl途径的乙酰辅酶a合成(drake,h.l.,j.bacteriol.150.2:702-709(1982);kellum和drake,j.bacteriol.160.1:466-469(1984);drake和danielres.microbial.155.10:869-883(2004))(参见附图2)。热醋穆尔氏菌有一些来自大肠杆菌的hyp、hyc和hyf基因的同源体。由这些基因编码的蛋白序列可以通过以下genbank登记号来鉴定。此外,一些基因组编码氢化酶功能性存在于热醋穆尔氏菌中且它们的对应的蛋白序列也在下面提供:蛋白genbankidgi号有机体hypanp_41720616130633大肠杆菌hypbnp_41720716130634大肠杆菌hypcnp_41720816130635大肠杆菌hypdnp_41720916130636大肠杆菌hypenp_417210226524740大肠杆菌hypfnp_41719216130619大肠杆菌热醋穆尔氏菌中的蛋白如下所示,其中它们的基因与大肠杆菌hyp基因是同源的:蛋白genbankidgi号有机体moth_2175yp_43100783590998热醋穆尔氏菌moth_2176yp_43100883590999热醋穆尔氏菌moth_2177yp_43100983591000热醋穆尔氏菌moth_2178yp_43101083591001热醋穆尔氏菌moth_2179yp_43101183591002热醋穆尔氏菌moth_2180yp_43101283591003热醋穆尔氏菌moth_2181yp_43101383591004热醋穆尔氏菌氢化酶3蛋白如下所示:蛋白genbankidgi号有机体hycanp_41720516130632大肠杆菌hycbnp_41720416130631大肠杆菌hyccnp_41720316130630大肠杆菌hycdnp_41720216130629大肠杆菌hycenp_41720116130628大肠杆菌hycfnp_41720016130627大肠杆菌hycgnp_41719916130626大肠杆菌hychnp_41719816130625大肠杆菌hycinp_41719716130624大肠杆菌氢化酶4蛋白如下所示:蛋白genbankidgi号有机体hyfanp_41697690111444大肠杆菌hyfbnp_41697716130407大肠杆菌hyfcnp_41697890111445大肠杆菌hyfdnp_41697916130409大肠杆菌hyfenp_41698016130410大肠杆菌hyffnp_41698116130411大肠杆菌hyfgnp_41698216130412大肠杆菌hyfhnp_41698316130413大肠杆菌hyfinp_41698416130414大肠杆菌hyfjnp_41698590111446大肠杆菌hyfrnp_41698690111447大肠杆菌热醋穆尔氏菌中的蛋白如下所示,其中它们的基因是与大肠杆菌hyc和/或hyf或基因同源的:蛋白genbankidgi号有机体moth_2182yp_43101483591005热醋穆尔氏菌moth_2183yp_43101583591006热醋穆尔氏菌moth_2184yp_43101683591007热醋穆尔氏菌moth_2185yp_43101783591008热醋穆尔氏菌moth_2186yp_43101883591009热醋穆尔氏菌moth_2187yp_43101983591010热醋穆尔氏菌moth_2188yp_43102083591011热醋穆尔氏菌moth_2189yp_43102183591012热醋穆尔氏菌moth_2190yp_43102283591013热醋穆尔氏菌moth_2191yp_43102383591014热醋穆尔氏菌moth_2192yp_43102483591015热醋穆尔氏菌热醋穆尔氏菌中的基因组编码的其他氢化酶如下所示:1,3-丁二醇生产可以在重组大肠杆菌中通过如附图4和附图5所述的各种替代途径而实现。所有途径首先利用硫解酶将两分子乙酰辅酶a转化到一分子乙酰乙酰辅酶a。乙酰乙酰辅酶a硫解酶将两分子乙酰辅酶a转化成各一分子的乙酰乙酰辅酶a和辅酶a。示例性乙酰乙酰辅酶a硫解酶包括来自下列基因的基因产物,所述基因是大肠杆菌的atob(martin等人,nat.biotechnol.21.7:796-802(2003)),来自丙酮丁醇梭菌(c.acetobutylicum)的thla和thlb(hanai等人,appl.environ.microbiol.73.24:7814-7818(2007);winzer等人j.mol.microbiol.biotechnol.2.4:531-541(2000)),和来自酿酒酵母的erg10(hiser等人,j.biol.chem.269.50:31383-31389(1994))。与这些蛋白和基因相关的信息可以用以下信息来找到:蛋白genbankidgi号有机体atobnp_41672816130161大肠杆菌thlanp_349476.115896127丙酮丁醇梭菌thlbnp_149242.115004782丙酮丁醇梭菌erg10np_0152976325229酿酒酵母来自乙酰乙酰辅酶a的一条途径承担通过乙酰乙酰辅酶a还原酶(酮还原)将乙酰乙酰辅酶a还原成3-羟基丁酰辅酶a。随后,3-羟基丁酰辅酶a通过叫做3-羟基丁酰辅酶a还原酶的辅酶a依赖醛还原酶被转化为3-羟基丁醛。最后,3-羟基丁醛可以通过3-羟基丁醛还原酶被还原成产物1,3-bdo。可选地,3-羟基丁酰辅酶a通过醇形成辅酶a依赖3-羟基丁酰辅酶a还原酶直接被还原成1,3-bdo。途径中每个步骤的基因描述在下面。催化乙酰乙酰辅酶a至3-羟基丁酰辅酶a的还原反应的乙酰乙酰辅酶a还原酶(酮还原)在一些梭状芽胞杆菌物种中参与乙酰辅酶a发酵途径至丁酸,并已被详细研究(jones和woods,microbiol.rev.50.4:484-524(1986))。来自丙酮丁醇梭菌由hbd编码的酶已被克隆并在大肠杆菌中功能性表达(youngleson等人,j.bacteriol.171.12:6800-6807(1989))。此外,大肠杆菌中的两个脂肪酸氧化复合体的亚基,由fadb和fadj编码,充当3-羟酰辅酶a脱氢酶的功能(binstock和schulz,methodsenzymol.71pt.c:403-411(1981))。用于示范将乙酰乙酰辅酶a还原成3-羟基丁酰辅酶a的其他基因是来自生枝动胶菌(zoogloearamigera)的phbb(ploux等人,eur.j.biochem.171.1:177-182(1988))和来自类球红细菌(rhodobactersphaeroides)的phab(alber等人,mol.microbiol.61.2:297-309(2006))。前者的基因是nadph依赖性的,它的核苷酸序列已确定(peoples和sinskey,mol.microbiol.3.3:349-357(1989)),且该基因已在大肠杆菌中表达。该基因的底物特异性研究得到这样的结论,除乙酰乙酰辅酶a以外,它可以接受3-氧丙酰辅酶a作为底物(ploux等人,eur.j.biochem.171.1:177-182(1988))。其他基因包括克氏梭菌(clostridiumkluyveri)中的hbd1(c-端结构域)和hbd2(n-端结构域)(hillmer和gottschalk,biochim.biophys.acta3334:12-23(1974))以及牛(bostaurus)中的hsd17b10(wakil等人,j.biol.chem.207.2:631-638(1954))。基因和蛋白信息的概括如下所示:蛋白genbankidgi号有机体fadbp21177.2119811大肠杆菌fadjp77399.13334437大肠杆菌hbd2edk34807.1146348271克氏梭菌hbd1edk32512.1146345976克氏梭菌hbdp52041.2丙酮丁醇梭菌hsd17b10o02691.33183024牛phbbp23238.1130017生枝动胶菌phabyp_353825.177464321类球红细菌许多相似基因已在梭状芽胞杆菌的其他物种和勤奋生金球菌(metallosphaerasedula)中找到(berg等人,science318.5857:1782-1786(2007))如下所示:蛋白genbankidgi号有机体hbdnp_349314.1np_349314.1丙酮丁醇梭菌hbdaam14586.1aam14586.1贝氏梭状芽胞杆菌msed_1423yp_001191505yp_001191505勤奋生金球菌msed_0399yp_001190500yp_001190500勤奋生金球菌msed_0389yp_001190490yp_001190490勤奋生金球菌msed_1993yp_001192057yp_001192057勤奋生金球菌一些酰基辅酶a脱氢酶具有将酰基辅酶a还原成它的对应醛的能力,并可以用于催化3-羟基丁酰辅酶a还原酶(醛形成)活性。编码这些酶的示例性基因包括乙酸钙不动杆菌acr1编码脂肪酰辅酶a还原酶(reiser和somerville,j.bacteriol.179.9:2969-2975(1997)),不动杆菌属m-1脂肪酰辅酶a还原酶(ishige等人appl.environ.microbiol.68.3:192-195(2002)),以及由克氏梭菌中的sucd基因编码的辅酶a和nadp依赖琥珀酸半醛脱氢酶(sohling和gottschalk,j.bacteriol.178.3:871-880(1996);sohling和gottschalkj.bacteriol.178.3:871-880(1996))。p.gingivalis的sucd是另一种琥珀酸半醛脱氢酶(takahashi等人,j.bacteriol.182.17:4704-4710(2000))。假单胞菌属中的酰化乙醛脱氢酶并由bphg编码的酶还是另一种酶,用于示范氧化和酰化乙醛、丙醛、丁醛、异丁醛和甲醛(powlowski等人,j.bacteriol.175.2:377-385(1993))。除了将乙酰辅酶a还原成乙醇外,肠系膜明串珠菌中的由adhe编码的酶已显示出能将支链化合物异丁醛氧化成异丁酰辅酶a(kazahaya等人,j.gen.appl.microbiol.18:43-55(1972);koo等人,biotechnol.lett.27.7:505-510(2005))。丁醛脱氢酶催化相似的反应,丁酰辅酶a至丁醛的转化,在产溶剂性有机体(solventogenicorganisms)如糖乙酸多丁醇梭菌(clostridiumsaccharoperbutylacetonicum)中(kosaka等人,biosci.biotechnol.biochem.71.1:58-68(2007))。关于这些基因和蛋白的信息如下所示:蛋白genbankidgi号有机体acr1yp_047869.150086359乙酸钙不动杆菌acr1aac452171684886acinetobacterbaylyiacr1bab85476.118857901不动杆菌属菌株m-1sucdp38947.1172046062克氏梭菌sucdnp_904963.134540484牙龈卟啉单胞菌bphgbaa03892.1425213假单胞菌属adheaav66076.155818563肠系膜明串珠菌bldaap42563.131075383糖乙酸多丁醇梭菌一个将酰基辅酶a转化成它的对应醛的其他酶类型是丙二酰辅酶a还原酶,其将丙二酰辅酶a转移至丙二酸半醛。丙二酰辅酶a还原酶是热嗜酸性古细菌(thermoacidophilicarchaealbacteria)中经3-羟丙酸循环的自养型碳固定中的关键酶(berg等人,science318.5857:1782-1786(2007);thauer,r.k.,science318.5857:1732-1733)。该酶利用nadph作为辅因子,且在metallosphaera和sulfolobusspp中已被表征(alber等人,j.bacteriol.188.24:8551-8559(2006);hugler等人2404-10)。该酶由勤奋生金球菌中的msed_0709编码((alber等人,j.bacteriol.188.24:8551-8559(2006);(berg等人,science318.5857:1782-1786(2007))。来自sulfolobustokodaii的编码丙二酰辅酶a还原酶的基因被克隆且异源性表达在大肠杆菌中(alber等人,j.bacteriol.188.24:8551-8559(2006);alber等人,mol.microbiol.61.2:297-309(2006))。该酶已显示出能催化甲基丙二酸辅酶a转化为它的对应醛。尽管这些酶的醛脱氢酶功能与来自橙色绿屈挠菌的双功能脱氢酶相似,但是它们几乎没有序列相似性。丙二酰辅酶a还原酶候选酶都与天冬氨酸半醛脱氢酶有高的序列相似性,其中天冬氨酸半醛脱氢酶是一种催化天冬氨酰-4-磷酸至天冬氨酸半醛的还原反应以及并发的脱磷酸化反应。另外的基因可以通过与其他有机体中的蛋白的序列同源性而找到并已被列在下表中,所述其他有机体包括硫磺矿硫化叶菌和sulfolobusacidocaldariu。然而,关于辅酶a酰化的醛脱氢酶的另一个基因是来自贝氏梭状芽胞杆菌的ald基因(toth等人,appl.environ.microbiol.65.11:4973-4980(1999))。已有报道该酶将乙酰辅酶a和丁酰辅酶a还原成它们对应的醛。这个基因与eute非常相似,其中eute编码伤寒沙门菌(salmonellatyphimurium)和大肠杆菌的乙醛脱氢酶(toth等人,appl.environ.microbiol.65.11:4973-4980(1999))。有关基因和蛋白信息的概括如下所示:蛋白genbankidgi号有机体msed_0709yp_001190808.1146303492勤奋生金球菌mcrnp_378167.115922498sulfolobustokodaiiasd-2np_343563.115898958硫磺矿硫化叶菌saci_2370yp_256941.170608071sulfolobusacidocaldariusaldaat664369473535贝氏梭状芽胞杆菌euteaaa80209687645伤寒沙门菌eutep774452498347大肠杆菌显示3-羟基丁醛还原酶活性的酶(ec1.1.1.61)已在真氧产碱杆菌(bravo等人,j.forensicsci.49.2:379-387(2004)),克氏梭菌(wolff和kenealy,proteinexpr.purif.6.2:206-212(1995))和拟南芥(breitkreuz等人,j.biol.chem.278.42:41552-41556(2003))中被表征。然而,另一个基因是来自嗜热脂肪泥土芽孢杆菌的乙醇脱氢酶adhi(jeon等人,j.biotechnol.135.2:127-133(2008))。基因和蛋白信息的概括如下所示:蛋白genbankidgi号有机体4hbdyp_726053.1113867564真氧产碱杆菌h164hbdl21902.1146348486克氏梭菌dsm5554hbdq94b0775249805拟南芥adhiaar91477.140795502嗜热脂肪泥土芽孢杆菌m10exg另一个示例性酶是3-羟基异丁酸脱氢酶,其催化3-羟基异丁酸至甲基丙二酸半醛的可逆反应。这种酶参与缬氨酸、亮氨酸和异亮氨酸降解,并在细菌、真核生物和哺乳动物中已被鉴定。这种由来自thermusthermophilushb8的p84067编码的酶在结构上已被表征(lokanath等人,j.mol.biol.352.4:905-917(2005))。人的羟基异丁酸脱氢酶的可逆性通过使用核素标记的底物来证明(manning和pollitt,biochem.j.231.2:481-484(1985))。编码该酶的其它基因包括智人(hawes等人methodsenzymol.324:218-228(2000))和穴兔(hawes等人methodsenzymol.324:218-228(2000);chowdhury等人,biosci.biotechnol.biochem.60.12:2043-2047(1996))中的3hidh,绿脓假单胞菌中的mmsb,以及恶臭假单胞菌中的dhat(aberhart和hsu,j.chem.soc.(perkin1)6:1404-1406;chowdhury等人,biosci.biotechnol.biochem.60.12:2043-2047(1996));chowdhury等人,biosci.biotechnol.biochem.67.2:438-441(2003))。有关这些基因和蛋白的信息如下所示:蛋白genbankidgi号有机体p84067p8406775345323thermusthermophilusmmsbp28811.1127211绿脓假单胞菌dhatq59477.12842618恶臭假单胞菌3hidhp31937.212643395智人3hidhp32185.1416872穴兔其他编码催化乙醛至乙醇的转化(即,乙醇脱氢酶或相当于醛还原酶)且可以充当3-羟基丁醛还原酶的候选酶的酶的示例性基因包括编码c2-c14的中链乙醇脱氢酶的alra(tani等人,appl.environ.microbiol.66.12:5231-5335(2000)),来自酿酒酵母的adh2(atsumi等人,nature451.7174:86-89(2008)),来自大肠杆菌的优先选择比c3长的分子的yqhd(sulzenbacher等人,j.mol.biol.342.2:489-502(2004)),以及来自丙酮丁醇梭菌的转化丁醛至丁醇的bdhi和bdhii(walter等人,j.bacteriol.174.22:7149;7158(1992))。yqhd的基因产物使用nadph作为辅因子催化乙醛、丙二醇、丙醛、丁醛和丙烯醛的还原反应(perez等人,j.biol.chem.283.12:7346-7353(2008))。来自运动发酵单胞菌的adh1已被证明对包括甲醛、乙醛、丙醛、丁醛和丙烯醛的许多醛有活性(kinoshita等人,appl.microbiol.biotchenol.22:249-254(1985))。如果需要,这些示例性基因产物各自的蛋白序列可以使用以下genbank登记号找到:蛋白genbankidgi号有机体alrabab12273.19967138不动杆菌属菌株m-1adh2np_014032.16323961酿酒酵母yqhdnp_417484.116130909大肠杆菌bdhinp_349892.115896543丙酮丁醇梭菌bdhiinp_349891.115896542丙酮丁醇梭菌adhayp_162971.156552132运动发酵单胞菌醇形成的3-羟基丁酰辅酶a还原酶可通过示例性的两步氧化还原酶来催化,其将酰基辅酶a转化为乙醇。这些包括这样的酶,所述酶转化底物例如乙酰辅酶a至乙醇(例如,大肠杆菌adhe(kessler等人,febslett.281.1-2:59-63(1991))以及丁酰辅酶a至丁醇(例如,丙酮丁醇梭菌adhe2(fontaine等人,j.bacteriol.184.3:821-830(2002))。除了将乙酰辅酶a还原成乙醇以外,这种肠系膜明串珠菌中的由adhe编码的酶已显示能氧化支链化合物异丁醛至异丁酰辅酶a(kazahaya等人,j.gen.app.microbiol.18:43-55(1972);koo等人,biotechnol.lett.27.7:505-510(2005))。这些基因和蛋白的相关信息如下所示:另一个示例性酶可以将丙二酰转化为3-hp。一个具有这种活性的nadph-依赖酶已在橙色绿屈挠菌中被表征,在那里它参与3-羟丙酸循环(hugler等人,j.bacteriol.184.9:2404-2410(2002);strauss和fuchs,eur.j.biochem.215.3:633-643(1993))。这个质量300kda的酶是高度底物特异性的,且与其他已知的氧化还原酶几乎没有序列相似性(hugler等人,j.bacteriol.184.9:2404-2410(2002))。在其他有机体中目前没有酶显示出能催化这个特异性反应,但是有生物信息学上的证据证明其他有机体可以有相似的途径(klatt等人,environ.microbiol.9.8:2067-2078(2007))。包括roseiflexuscastenholzii、赤细菌属nap1和海洋γ变形菌htcc2080(marinegammaproteobacteriumhtcc2080)的其他有机体中的酶候选者通可以通过序列相似性进行推论。有关这些基因和蛋白的信息如下所示:较长链酰基辅酶a分子可以通过酶例如编码醇形成的脂肪酰基辅酶a还原酶的jojoba(simmondsiachinensis)far来还原。它在大肠杆菌中的过表达带来far活性和脂肪醇的蓄积(metz等人,plantphysiol.122.3:635-644(2000))。有关far的信息如下所示:蛋白genbankidgi号有机体faraad38039.15020215simmondsiachinensis从乙酰乙酰辅酶a至1,3-丁二醇的第二个可选通途从经由辅酶a依赖醛形成乙酰乙酰辅酶a还原酶的乙酰乙酰辅酶a至3-氧代丁醛的还原反应开始。接着,3-氧代丁醛由3-氧代丁醛还原酶(酮还原)还原成3-羟基丁醛,最后,中间产物由3-羟基丁醛还原酶还原成1,3-丁二醇。这些步骤中的每个步骤中的酶和编码这些酶的基因列在下面。用于催化乙酰乙酰辅酶a至3-氧代丁醛的转化的乙酰乙酰辅酶a还原酶(辅酶a依赖,醛形成)的示例性候选者与本文之前所描述的那些用于3-羟基丁酰辅酶a还原酶(醛形成)的相同。这里存在一些将酮转化为羟基官能团的示例性乙醇脱氢酶,且可以用于催化3-氧代丁醛还原酶(酮还原)活性。来自大肠杆菌的两种这样的酶是由苹果酸脱氢酶(mdh)和乳酸脱氢酶(ldha)编码。此外,来自真氧产碱杆菌的乳酸脱氢酶已证明对各种链长的底物如乳酸、2-酮丁酸、2-酮戊酸和2-酮戊二酸具有高的活性(steinbuchel和schlegel,eur.j.biochem.130.2:329-334(1983))。羰基功能团至羟基的转化还可以通过2-酮1,3-丁二醇还原酶来催化,据报道,2-酮1,3-丁二醇还原酶是一种在大鼠和人胎盘中找到的酶(suda等人,arch.biochem.biophys.176.2:610-620(1976);suda等人,biochem.biophys.res.commun.342.2:586-591(1977))。所有这些酶可以用作3-氧代丁醛还原酶。用于这个步骤的一个另外的酶是来自人心脏的线粒体3-羟基丁酸脱氢酶(bdh),其已被克隆和表征(marks等人,j.biol.chem.267.22:15459-15463(1992))。这个酶是一个脱氢酶,其作用在3-羟酸上。另一个将丙酮转化为异丙醇的示例性乙醇脱氢酶显示在贝氏梭状芽胞杆菌(ismaiel等人,j.bacteriol.175.16:5097-5105(1993))和布氏热厌氧杆菌(lamed和zeikus,biochem.j.195.1:183-190(1981);peretz和burstein,biochemistry28.16:6549-6555(1989))中。甲基乙基甲酮(mek)还原酶,或者可选地,2-丁醇脱氢酶,催化mek的还原以形成2-丁醇。示例性酶可以在深红红球菌(rhodococcusruber)(kosjek等人,biotechnol.bioeng.86.1:55-62(2004))和强烈炽热球菌(pyrococcusfuriosus)(vanderoost等人,eur.j.biochem.268.10:3062-3068(2001))中找到。有关这些蛋白和基因的信息如下所示:蛋白genbankidgi号有机体mdhaac76268.11789632大肠杆菌ldhanp_415898.116129341大肠杆菌ldhyp_725182.1113866693真氧产碱杆菌bdhaaa58352.1177198智人adhaaa23199.260592974贝氏梭状芽胞杆菌adhp14941.1113443布氏热厌氧杆菌sadhcad3647521615553深红红球菌adha3288810aac25556强烈炽热球菌从乙酰乙酰辅酶a开始的另一途径首先是由辅酶a依赖,醇形成的乙酰乙酰辅酶a还原酶将乙酰乙酰辅酶a还原成4-羟基,2-丁酮。然后,中间产物通过4-羟基丁酮还原酶被还原成1,3-丁二醇。4-羟基丁酮还可以通过醛还原的3-氧代丁醛还原酶由3-氧代丁醛来形成。乙酰乙酰辅酶a还原酶(辅酶a依赖,醇形成)可以利用与那些用于醇形成的3-羟基丁酰辅酶a还原酶相同的酶。4-羟基丁酮还原酶的活性可以从与描述的那些用于3-氧代丁醛还原酶相同的酶中获得。此外,许多有机体可以催化4-羟基,2-丁酮至1,3-丁二醇的还原反应,包括matsuyama等的美国专利no.5,413,922中描述的属于基因芽孢杆菌属,短杆菌属,念珠菌属和克雷白氏杆菌属中的那些。编码催化醛至醇的转化的酶(即,乙醇脱氢酶或相当地醛还原酶)的示例性基因包括编码c2-c14的中链醇脱氢酶的alra(tani等人,app.environ.microbiol.66.12:5231-5235(2000)),来自酿酒酵母的adh2(atsumi等人,nature451.7174:86-89(2008)),来自大肠杆菌的优先选择比c3长的分子的yqhd(sulzenbacher等人,j.mol.biol.342.2:489-502(2004)),以及来自丙酮丁醇梭菌的将丁醛转化为丁醇的bdhi和bdhii(walter等人,j.bacteriol.174.22:7149-7158(1992))。yqhd的基因产物使用nadph作为辅因子催化乙醛、丙二醛、丙醛、丁醛和丙烯醛(perez等人,j.biol.chem.283.12:7346-7353(2008))。所有这些基因可以提供3-氧代丁醛还原酶(醛还原)用于将3-氧代丁醛转化为4-羟基丁酮。来自运动发酵单胞菌的adh1已被证明对许多醛包括甲醛、乙醛、丙醛、丁醛和丙烯醛有活性(kinoshita等人,app.microbiol.biotechnol.22:249-254(1985))。有用地,这些示例性基因产物各自的蛋白序列可以使用以下genbank登记号找到:蛋白genbankidgi号有机体alrabab12273.19967138不动杆菌属菌株m-1adh2np_014032.16323961酿酒酵母yqhdnp_417484.116130909大肠杆菌bdhinp_349892.115896543丙酮丁醇梭菌bdhiinp_349891.115896542丙酮丁醇梭菌adhayp_162971.156552132运动发酵单胞菌乙酰乙酰辅酶a至乙酰乙酸的转化可以通过乙酰乙酰辅酶a转移酶来实现,其中所述乙酰乙酰辅酶a转移酶转移存储在辅酶a-酯键中的能量。以下提供一些具有催化这种转化的能力的示例性转移酶。这些酶或者天然地展现出想要的乙酰乙酰辅酶a转移酶活性或者可以通过定向进化加工它们以增效地接受乙酰乙酰辅酶a作为底物。这种酶,或者天然地或者根据定向进化,还适用于通过转移酶机制催化3-羟基丁酰辅酶a至3-羟基丁酸的转化。乙酰乙酰辅酶a:乙酰辅酶a转移酶天然地将乙酰乙酰辅酶a和乙酸转化为乙酰乙酸和乙酰辅酶a。这种酶还可以接受3-羟基丁酰辅酶a作为底物或可被加工成能做这个。示例性酶包括下列基因的基因产物,所述基因是来自大肠杆菌的atoad(hanai等人,applenvironmicrobiol73:7814-7818(2007)),来自丙酮丁醇梭菌的ctfab(jojima等人,applmicrobiolbiotechnol77:1219-1224(2008)),和来自糖乙酸多丁醇梭菌的ctfab(kosaka等人,biosci.biotechnolbiochem.71:58-68(2007))。有关这些蛋白和基因的信息如下所示:琥珀酰辅酶a:3-酮酸辅酶a转移酶天然地将琥珀酸转化成琥珀酰辅酶a,同时将3-酮酰辅酶a转化成3-酮酸。示例性琥珀酰辅酶a:3-酮酸辅酶a转移酶存在于幽门螺杆菌(corthesy-theulaz等人,j.biol.chem.272:25659-25667(1997)),枯草杆菌(stols等人,蛋白.expr.purif.53:396-403(2007)),和智人(fukao等人,genomics68:144-151(2000);tanaka等人,mol.hum.reprod.8:16-23(2002))。有关这些蛋白和基因的信息如下所示:蛋白genbankidgi号有机体hpag1_0676yp_627417108563101幽门螺杆菌hpag1_0677yp_627418108563102幽门螺杆菌scoanp_39177816080950枯草杆菌scobnp_39177716080949枯草杆菌oxct1np_0004274557817智人oxct2np_07140311545841智人另外的合适的乙酰乙酰辅酶a和3-羟基丁酰辅酶a转移酶是由克氏梭菌的cat1、cat2和cat3的基因产物编码。这些酶已显示出分别具有琥珀酰辅酶a、4-羟基丁酰辅酶a和丁酰辅酶a乙酰转移酶活性(seedorf等人,proc.natl.acad.sci.usa105:2128-2133(2008);sohling和gottschalk,jbacteriol178:871-880(1996))。类似的辅酶a转移酶活性还存在于阴道毛滴虫(vangrinsven等人,j.biol.chem.283:1411-1418(2008))和布氏锥虫(riviere等人,j.biol.chem.279:45337-45346(2004))。而具有想要的转化能力的另一个转移酶是丁酰辅酶a:乙酰乙酸辅酶a转移酶。示例性酶可在核粒梭形杆菌(barker等人,j.bacteriol.152(1):201-7(1982)),梭状芽孢杆菌sb4(barker等人,j.biol.chem.253(4):1219-25(1978)),和丙酮丁醇梭菌(wiesenborn等人,appl.environ.microbiol.55(2):323-9(1989))中找到。尽管关于丁酰辅酶a:乙酰乙酸辅酶a转移酶的特异性基因序列还没有确认,但是基因fn0272和fn0273已被注解为是一个丁酰-乙酰乙酸辅酶a转移酶(kapatral等人,j.bact.184(7)2005-2018(2002))。核粒梭形杆菌中的同源体如fn1857和fn1856可以具有想要的乙酰乙酰辅酶a转移酶活性。fn1857和fn1856的位置是紧靠许多其他参与赖氨酸发酵的基因,并因此完全可以编码一个乙酰乙酸:丁酰辅酶a转移酶(kreimeyer,etal.,j.biol.chem.282(10)7191-7197(2007))。来自牙龈卟啉单胞菌和腾冲嗜热厌氧菌(thermoanaerobactertengcongensis)的另外的基因/基因产物可以相似方式来进行鉴定(kreimeyer,等人,j.biol.chem.282(10)7191-7197(2007))。有关这些蛋白和基因的信息如下所示:蛋白genbankidgi号有机体cat1p38946.1729048克氏梭菌cat2p38942.21705614克氏梭菌cat3edk35586.1146349050克氏梭菌tvag_395550xp_001330176123975034阴道毛滴虫g3tb11.02.0290xp_82835271754875布氏锥虫fn0272np_603179.119703617核粒梭形杆菌fn0273np_603180.119703618核粒梭形杆菌fn1857np_602657.119705162核粒梭形杆菌fn1856np_602656.119705161核粒梭形杆菌pg1066np_905281.134540802牙龈卟啉单胞菌w83pg1075np_905290.134540811牙龈卟啉单胞菌w83tte0720np_622378.120807207腾冲嗜热厌氧菌mb4tte0721np_622379.120807208腾冲嗜热厌氧菌mb4乙酰乙酰辅酶a可以通过乙酰乙酰辅酶a水解酶水解成乙酰乙酸。类似地,3-羟基丁酰辅酶a可以通过3-羟基丁酰辅酶a水解酶水解成3-羟丁酸。许多辅酶a水解酶(ec3.1.2.1)具有宽的底物特异性,并且是用于这些天然地或酶工程的转化的合适的酶。尽管序列没有被报道,但是一些乙酰乙酰辅酶a水解酶在大鼠肝脏的细胞液和线粒体中被鉴定(aragon和lowenstein,j.biol.chem.258(8):4725-4733(1983))。此外,一个来自褐鼠(rattusnorvegicus)脑的酶(robinson等人,biochem.biophys.res.commun.71:959-965(1976))可以与丁酰辅酶a,己酰辅酶a和丙二酰辅酶a反应。来自大鼠肝脏的acot12酶显示出能水解c2至c6酰基辅酶a分子(suematsu等人,eur.j.biochem.268:2700-2709(2001))。尽管它的序列还没有被报道,但是来自豌豆叶的线粒体的酶显示出对乙酰辅酶a、丙酰辅酶a、丁酰辅酶a、棕榈酰辅酶a、油酰辅酶a、琥珀酰辅酶a和巴豆酰辅酶a的活性(zeiher和randall,plant.physiol.94:20-27(1990))。此外,来自发酵氨基酸球菌(acidaminococcusfermentans)的戊稀二酸辅酶a-转移酶通过定点突变被转化成酰基辅酶a水解酶,该水解酶具有对戊二酰辅酶a,乙酰辅酶a和3-丁烯酰辅酶a的活性(mack和buckel,febslett.405:209-212(1997))。这暗示编码琥珀酰辅酶a:3-酮酸辅酶a转移酶和乙酰乙酰辅酶a:乙酰辅酶a转移酶的酶还可以用作具有某些突变以改变它们的功能的水解酶。来自酿酒酵母的乙酰辅酶a水解酶,ach1,代表另一个候选水解酶(buu等人,j.biol.chem.278:17203-17209(2003))。有关这些蛋白和基因的信息如下所示:蛋白genbankidgi号有机体acot12np_570103.118543355褐鼠gctacaa57199559392发酵氨基酸球菌gctbcaa57200559393发酵氨基酸球菌ach1np_0095386319456酿酒酵母另一个水解酶是人二羧酸硫酯酶,acot8,其显示出对戊二酰辅酶a、己二酰辅酶a、环庚基辅酶a、癸二酰辅酶a和十二烷二酰辅酶a的活性(westin等人,j.biol.chem.280:38125-38132(2005)),以及最接近大肠杆菌同源体,tesb,其也可以水解宽范围的辅酶a硫酯(naggert等人,j.biol.chem.266:11044-11050(1991))包括3-羟基丁酰辅酶a(tseng等人,appl.environ.microbiol.75(10):3137-3145(2009))。类似的酶也已在大鼠肝脏中被表征(deana,biochem.int.26:767-773(1992))。其他大肠杆菌硫酯水解酶包括下列基因的基因产物,所述基因是tesa(bonner和bloch,j.biol.chem.247:3123-3133(1972)),ybgc(kuznetsova等人,femsmicrobiol.rev.29:263-279(2005);zhuang等人,febslett.516:161-163(2002)),paai(song等人,j.biol.chem.281:11028-11038(2006)),和ybdb(leduc等人,j.bacteriol.189:7112-7126(2007))。有关这些蛋白和基因的信息如下所示:蛋白genbankidgi号有机体acot8caa155023191970智人tesbnp_41498616128437大肠杆菌acot8np_57011251036669褐鼠tesanp_41502716128478大肠杆菌ybgcnp_41526416128711大肠杆菌paainp_41591416129357大肠杆菌ybdbnp_41512916128580大肠杆菌另外的水解酶包括3-羟基异丁酰辅酶a水解酶,其已被描述成在缬氨酸降解过程中有效地催化3-羟基异丁酰辅酶a转化成3-羟基异丁酸(shimomura等人,j.biol.chem.269:14248-14253(1994))。编码这个酶的基因包括褐鼠(shimomura等人,出处同上(1994);shimomura等人,methodsenzymol.324:229-240(2000))和智人(shimomura等人,出处同上(1994))的hibch。序列同源的候选基因包括酿酒酵母的hibch和蜡样芽胞杆菌的bc_2292。当被加工到大肠杆菌时,作为3-羟基丁酸合成的途径的部分,bc_2292表现出具有3-羟基丁酰辅酶a水解酶活性和功能(lee等人,appl.microbiol.biotechnol.79:633-641(2008))。有关这些蛋白和基因的信息如下所示:一个从乙酰乙酰辅酶a或3-羟基丁酰辅酶a上除去辅酶a部分的可选方法是应用一对酶,例如磷酸转移酰基转移酶和给予乙酰乙酰辅酶a或3-羟基丁酰辅酶a合成酶活性的激酶。如本文所用的,提到的磷酸转乙酰酶和激酶的组合是当做一个“合成酶”。这种活性允许任一分子的辅酶a-酯的纯粹水解,同时存在atp的产生。例如,来自丙酮丁醇梭菌的丁酸激酶(buk)/磷酸转丁酰酶(ptb)系统已成功地被用来除去3-羟基丁酰辅酶a的辅酶a基团,当充当3-羟基丁酸合成途径的部分时的(tseng等人,appl.environ.microbiol.75(10):3137-3145(2009))。特别地,来自丙酮丁醇梭菌的ptb基因编码这样的酶,所述酶能将酰基辅酶a转化成酰基-磷酸酯(walter等人gene134(1):p.107-11(1993));huang等人jmolmicrobiolbiotechnol2(1):p.33-38(2000))。另外的ptb基因可以在产丁酸的细菌l2-50(louis等人j.bacteriol.186:2099-2106(2004))和巨大芽胞杆菌(vazquez等人curr.microbiol42:345-349(2001))中找到。另外的示例性磷酸转移酰基转移酶包括由pta编码的磷酸转乙酰酶。来自大肠杆菌的pta基因编码这样的酶,所述酶可以将乙酰辅酶a转化成乙酰-磷酸,且反之亦然(suzuki,t.biochim.biophys.acta191:559-569(1969))。这种酶还可以在程序中利用丙酰辅酶a代替乙酰辅酶a形成丙酸(hesslinger等人mol.microbiol27:477-492(1998))。有关这些蛋白和基因的信息如下所示:蛋白genbankidgi号有机体ptanp_416800.116130232大肠杆菌ptbnp_34967615896327丙酮丁醇梭菌ptbaar19757.138425288产丁酸细菌l2-50ptbcac07932.110046659巨大芽胞杆菌示例性激酶包括由acka编码的大肠杆菌乙酸激酶(skarstedt和silversteinj.biol.chem.251:6775-6783(1976)),由buk1和buk2编码的丙酮丁醇梭菌丁酸激酶(walter等人gene134(1):107-111(1993);huang等人jmolmicrobiolbiotechnol2(1):33-38(2000)),和由prob编码的大肠杆菌γ-谷氨酰激酶(smith等人j.bacteriol.157:545-551(1984))。这些酶分别磷酸化乙酸、丁酸和谷氨酸。来自大肠杆菌的acka基因产物还磷酸化丙酸(hesslinger等人mol.microbiol27:477-492(1998))。有关这些蛋白和基因的信息如下所示:蛋白genbankidgi号有机体ackanp_416799.116130231大肠杆菌buk1np_34967515896326丙酮丁醇梭菌buk2q97ii120137415丙酮丁醇梭菌probnp_414777.116128228大肠杆菌乙酰乙酰辅酶a或者3-羟基丁酰辅酶a的水解作用可选地可通过展现乙酰乙酰辅酶a或者3-羟基丁酰辅酶a合成酶活性的单个酶或酶复合物来完成。这种活性能够使任一分子的辅酶a-酯纯粹的水解,且在一些情况下,同时产生atp。例如,酿酒酵母的lsc1和lsc2基因以及大肠杆菌的succ和sucd基因的产物天然地形成琥珀酰辅酶a合成酶复合物,其催化从琥珀酸中形成琥珀酰辅酶a,同时伴随着一分子atp的消耗,一个在体内可逆的反应(gruys等人,美国专利no.5,958,745,1999年9月28日)。有关这些蛋白和基因的信息如下所示:蛋白genbankidgi号有机体succnp_415256.116128703大肠杆菌sucdaac73823.11786949大肠杆菌lsc1np_0147856324716酿酒酵母lsc2np_0117606321683酿酒酵母另外的示例性辅酶a-连接酶包括序列还没有被表征的大鼠二羧酸辅酶a连接酶(vamecq等人,biochemicalj.230:683-693(1985)),来自产黄青霉菌的两个已表征的苯乙酸辅酶a连接酶的任一个(lamas-maceiras等人,biochem.j.395:147-155(2005);wang等人,biochembiophyrescommun360(2):453-458(2007)),来自恶臭假单胞菌的苯乙酸辅酶a连接酶(martinez-blanco等人,j.biol.chem.265:7084-7090(1990)),和来自枯草芽孢杆菌的6-羧基己酸辅酶a连接酶(bower等人,j.bacteriol.178(14):4122-4130(1996))。另外的候选酶是来自小家鼠(hasegawa等人,biochim.biophys.acta1779:414-419(2008))和智人(ohgami等人,biochem.pharmacol.65:989-994(2003))的乙酰乙酰辅酶a合成酶,其天然地催化乙酰乙酸至乙酰乙酸辅酶a的atp依赖的转化。4-羟基丁酰辅酶a合成酶活性已被在勤奋生金球菌中证实(berg等人,science318:1782-1786(2007))。这个功能已归属于msed_1422基因。有关这些蛋白和基因的信息如下所示:蛋白genbankidgi号有机体phlcaj15517.177019264产黄青霉菌phlbabs19624.1152002983产黄青霉菌paafaac24333.222711873恶臭假单胞菌biownp_390902.250812281枯草杆菌aacsnp_084486.121313520小家鼠aacsnp_076417.231982927智人msed_1422yp_001191504146304188勤奋生金球菌adp-形成的乙酰辅酶a合成酶(acd,ec6.2.1.13)是一个将酰基辅酶a酯与它们的对应的酸配联系起来并发地合成atp的酶。一些有广泛的底物特异性的酶已描述在文献中。来自archaeoglobusfulgidus的由af1211编码的acdi显示出在各种直链和支链底物包括乙酰辅酶a、丙酰辅酶a、丁酰辅酶a、乙酸、丙酸、丁酸、异丁酸、异戊酸、琥珀酸、延胡索酸、苯乙酸、吲哚乙酸上操作(musfeldt等人,j.bacteriol.184:636-644(2002))。来自死海盐盒菌(haloarculamarismortui)的酶(注解为一个琥珀酰辅酶a合成酶)接受丙酸、丁酸和支链酸(异戊酸和异丁酸)作为底物,并且显示出操作正向和逆向反应(brasen等人,arch.microbiol.182:277-287(2004))。来自超嗜热泉古菌pyrobaculumaerophilum的由pae3250编码的acd显示了所有表征的acd中的最宽底物范围,与乙酰辅酶a、异丁酰辅酶a(优选的底物)和苯乙酰辅酶a反应(brasen等人,出处同上(2004))。来自a.fulgidus、死海盐盒菌和p.aerophilum的酶都已在大肠杆菌中克隆、功能性表达和表征(musfeldt等人,出处同上;brasen等人,出处同上(2004))。有关这些蛋白和基因的信息如下所述:蛋白genbankidgi号有机体af1211np_070039.111498810archaeoglobusfulgidusdsm4304scsyp_135572.155377722死海盐盒菌atcc43049pae3250np_560604.118313937pyrobaculumaerophilum菌株im23-羟基丁酸至3-羟基丁醛的转化可以由3-羟基丁酸还原酶来执行。类似地,乙酰乙酸至乙酰乙醛的转化可以由乙酰乙酸还原酶来执行。用于这些转化的适合的酶是来自nocardiaiowensis的芳基-醛脱氢酶,或相当地羧酸还原酶。羧酸还原酶催化羧酸的镁、atp和nadph-依赖的还原反应成为它们对应的醛(venkitasubramanian等人,j.biol.chem.282:478-485(2007))。这种由car编码的酶已在大肠杆菌中克隆和功能性表达(venkitasubramanian等人,j.biol.chem.282:478-485(2007))。npt基因产物的表达经由转录后修饰提高酶的活性。npt基因编码特异性磷酸泛酰巯基乙胺转移酶(pptase),该转移酶将无活性的脱辅酶转化为活化的全酶。这种酶的天然底物是香草酸,并且这种酶展现出对芳香族和脂肪族底物有宽的接受能力(venkitasubramanian等人,inbiocatalysisinthepharmaceuticalandbiotechnologyindustires,ed.r.n.patel,chapter15,pp.425-440,crcpressllc,bocaraton,fl.(2006))。有关这些蛋白和基因的信息如下所示:另外的car和npt基因可以基于序列同源性进行鉴定。在灰色链霉菌中找到的另外一种候选酶是由gric和grid基因编码的。人们相信这种酶将3-氨基-4-羟基苯甲酸转化成3-氨基-4羟基苯甲醛,因为gric或grid的缺失导致胞外3-乙酰氨基-4-羟基苯甲酸的蓄积,其中3-乙酰氨基-4-羟基苯甲酸是3-氨基-羟基苯甲酸代谢的支路产物(suzuki,等人,j.antibiot.60(6):380-387(2007))。gric和grid与sgr_665的共同表达可以是有益的,其中sgr_665是一种序列上与nocardiaiowensisnpt相似的酶。有关这些蛋白和基因的信息如下所示:具有相似特征的酶,α-氨基己二酸还原酶(aar,ec1.2.1.31),在一些真菌物种中参与赖氨酸生物合成途径。这种酶天然地将α-氨基己二酸还原成α-氨基己二酸半醛。羧基首先通过atp依赖的腺苷酸形成反应被活化,然后被nad(p)h还原以产生醛和amp。同car,这种酶利用镁且需要由pptase活化。用于aar和它对应的pptase的候选酶在酿酒酵母(morris等人,gene98:141-145(1991))、白色念珠菌(guo等人,mol.genet.genomics269:271-279(2003))和粟酒裂殖酵母菌(schizosaccharomycespombe)(ford等人,curr.genet.28:131-137(1995))中找到。来自粟酒裂殖酵母菌的aar在大肠杆菌中表达时展现出显著的活性(guo等人,yeast21:1279-1288(2004))。来自产黄青霉菌的aar接受s-羧甲基-l-半胱氨酸作为可选底物,但不与己二酸、l-谷氨酸或二氨基庚二酸反应(hijarrubia等人,j.biol.chem.278:8250-8256(2003))。编码产黄青霉菌pptase的基因还没有被鉴定。有关这些蛋白和基因的信息如下所示:蛋白gi号genbankid有机体lys2171867aaa34747.1酿酒酵母lys51708896p50113.1酿酒酵母lys22853226aac02241.1白色念珠菌lys528136195aao26020.1白色念珠菌lys1p13124791p40976.3粟酒裂殖酵母菌lys7p1723561q10474.1粟酒裂殖酵母菌lys23282044caa74300.1产黄青霉菌基本上,这些car或car样酶中的任何一种可以显示3-羟基丁酸或乙酰乙酸还原酶活性,或者可以被加工成具有该活性。必需的3-羟基丁酸脱氢酶催化乙酰乙酸的还原反应以形成3-羟基丁酸。示例性酶可以在深红红球菌(kosjek等人,biotechnolbioeng.86:55-62(2004))和强烈炽热球菌(vander等人,eur.j.biochem.268:3062-3068(2001))中找到。另外的具有这种转换能力的次要的醇脱氢酶包括来自贝氏梭状芽胞杆菌的adh(hanai等人,applenvironmicrobiol73:7814-7818(2007);jojima等人,applmicrobiolbiotechnol77:1219-1224(2008))和来自布氏热厌氧杆菌的adh(hanai等人,applenvironmicrobiol73:7814-7818(2007);peretz等人,anaerobe3:259-270(1997))。bdha基因从苜蓿中华根瘤菌到大肠杆菌的克隆给予了利用3-羟基丁酸作为碳源的能力(aneja和charles,j.bacteriol.181(3):849-857(1999))。另外的3-羟基丁酸脱氢酶可在莓实假单胞菌(pseudomonasfragi)(ito等人,j.mol.biol.355(4)722-733(2006))和皮氏罗尔斯顿菌(ralstoniapickettii)(takanashi等人,antonievanleeuwenoek,95(3):249-262(2009))中找到。有关这些蛋白和基因的信息如下所示:为了加工co2、co和/或h2至乙酰辅酶a的转化能力,作为所有细胞量组分和多种有用产物来源的中心代谢物进入外源宿主如大肠杆菌可以通过外源性基因的表达来实现,其中的外源性基因编码wood-ljungdahl途径的多种蛋白。该途径在产乙酸有机体例如热醋穆尔氏菌(以前称为clostridiumthermoaceticum)中是高度活跃的,其中热醋穆尔氏菌自从1942年分离得到就成为解释wood-ljungdahl途径的模型有机体(fontaine等人,j.bacteriol.43.6:701-715(1942))。wood-ljungdahl途径由两个分支组成:东向(或甲基)分支,和西向(或羰基)分支,前者能将co2转化成甲基四氢叶酸(me-thf),后者能将甲基-thf、co和辅酶a转化至乙酰辅酶a(附图5)。因此,我们描述了一种非天然存在的微生物,其表达编码催化wood-ljungdahl途径的甲基和羰基分支的酶的基因。这样的有机体能够将co、co2和/或h2转化至乙酰辅酶a、细胞量和产物中。在一些实施方式中,利用附图5所述的途径的非天然存在的有机体具有三种能力:1)一个wood-ljungdahl途径的功能性甲基分支,其能够将thf和co2转化成5-甲基-四氢叶酸,2)结合co、辅酶a和me-thf的甲基形成乙酰辅酶a的能力,以及3)从乙酰辅酶a合成1,3-丁二醇的能力。这种非天然存在的有机体可以“固定(fix)”外源性co和/或外源性或内生co2的碳以合成乙酰辅酶a、细胞量和产物。被加工成具有这些能力并天然地具有(糖)回补能力的宿主有机体(例如大肠杆菌)在存在合适的外部电子受体如硝酸的情况下可以在syngas生产的乙酰辅酶a中生长。电子受体用于接受来自经琥珀酸脱氢酶形成的还原醌的电子。添加外部电子受体的另一个好处是,用于细胞生长、维持和产物形成的额外能量可由乙酰辅酶a的呼吸来产生。可选方案包括将一个丙酮酸铁氧化还原蛋白氧还原酶(pfor)或其他将丙酮酸转化至乙酰辅酶a的酶加工到菌株中,使在缺少外部电子受体的情况下能够合成生物量。加工的有机体的另一个特征是从分子氢中提取还原当量的能力。这使还原产物例如丁醇、异丁醇、异丙醇、1,4-丁二醇、1,3-丁二醇、琥珀酸、富马酸、苹果酸、4-羟基丁酸、3-羟基丙酸、乳酸、己二酸、甲基丙烯酸和丙烯酸有高的产率。非天然存在的有机体可以从下列物质中生产乙酰辅酶a、细胞量和目标化合物,更具体的是1,3-丁二醇,所述物质为:1)co,2)co2和h2,3)co、co2和h2,4)包含co和h2的合成气,5)包含co、co2和h2的合成气,以及6)一种或多种碳水化合物。示例性的碳水化合物包括,但不限于,葡萄糖、蔗糖、木糖、阿拉伯糖和甘油。用于co、co2和/或h2至乙酰辅酶a的转化的酶如附图5所示。为了加工一个利用co、co2和/或h2的生产宿主用于,编码这些酶的一个或多个外源性dna序列可以在微生物中表达。现在参考附图5,下面描述那些可以被整合以利用co、co2和/或h2的酶。甲酸脱氢酶是一种两个亚基的含硒代胱氨酸的蛋白,其催化在热醋穆尔氏菌中co2整合到甲酸中(andreesen和ljungdahl,j.bacteriol.116.2:867-873(1973);li等人,j.bacteriol.92.2:405-412(1966);yamamoto等人.j.biol.chem.258.3:1826-1832(1983))。位点moth_2312和moth_2313实际上是一个基因,其负责编码甲酸脱氢酶的α亚基,而β亚基是由moth_2314编码(pierce等人environ.microbiol.10:2550-2573(2008))。另一个编码甲酸脱氢酶活性且具有co2还原倾向的基因组是由syntrophobacterfumaroxidans中的穿过sfum_2706的sfum_2703编码(reda等人,proc.natl.acad.sci.u.s.a.105.31:10654-10658(2008);debok等人,eur.j.biochem.270.11:2476-2485(2003))。与它们的热醋穆尔氏菌复本类似,sfum_2705和sfum_2706实际上是一个基因。推测用于执行相同功能的一个类似的基因组是由生氢氧化碳嗜热菌中的chy_0731、chy_0732和chy_0733编码(wu等人,plosgenet.1.5:e65(2005))。相关基因和蛋白的信息可从如下所示的信息中获得:蛋白genbankidgi号有机体moth_2312yp_431142148283121热醋穆尔氏菌moth_2313yp_431143热醋穆尔氏菌moth_2314yp_43114483591135热醋穆尔氏菌sfum_2703yp_846816.1116750129syntrophobacterfumaroxidanssfum_2704yp_846817.1116750130syntrophobacterfumaroxidanssfum_2705yp_846818.1116750131syntrophobacterfumaroxidanssfum_2706yp_846819.1116750132syntrophobacterfumaroxidanschy_0731yp_359585.178044572生氢氧化碳嗜热菌chy_0732yp_359586.178044500生氢氧化碳嗜热菌chy_0733yp_359587.178044647生氢氧化碳嗜热菌甲酰四氢叶酸合成酶在消耗一个atp下将甲酸结合到四氢叶酸上。该反应由下述基因的基因产物催化,其中所述基因是热醋穆尔氏菌中的moth_0109(o'brien等人,experientiasuppl.26:249-262(1976);lovell等人,arch.microbiol.149.4:280-285(1988);lovell等人,biochemistry29.24:5687-5694(1990)),尿酸梭菌(clostridiumacidurici)中的fhs(whitehead和rabinowitz,j.bacteriol.167.1:205-209(1986);whitehead和rabinowitz,j.bacteriol.170.7:3255-3261(1988)),和生氢氧化碳嗜热菌中的chy_2385(wu等人,plosgenet.1.5:e65(2005))。相关基因和蛋白的信息可从如下所示的信息中获得:蛋白genbankidgi号有机体moth_0109yp_428991.183588982热醋穆尔氏菌chy_2385yp_361182.178045024生氢氧化碳嗜热菌fhsp13419.1120562尿酸梭菌在热醋穆尔氏菌、大肠杆菌和生氢氧化碳嗜热菌中,次甲基四氢叶酸酯环水解酶和亚甲基四氢叶酸脱氢酶分别由moth_1516、fold和chy_1878的双功能基因产物来执行(pierce等人environ.microbiol.10:2550-2573(2008);(wu等人,plosgenet.1.5:e65(2005);d'ari和rabinowitz,j.biol.chem.266.35:23953-23958(1991))。相关基因和蛋白的信息可从如下所示的信息中获得:蛋白genbankidgi号有机体moth_1516yp_430368.183590359热醋穆尔氏菌foldnp_415062.116128513大肠杆菌chy_1878yp_360698.178044829生氢氧化碳嗜热菌在热醋穆尔氏菌、大肠杆菌和生氢氧化碳嗜热菌中,次甲基四氢叶酸酯环水解酶和亚甲基四氢叶酸脱氢酶分别由moth_1516、fold和chy_1878的双功能基因产物来执行(pierce等人environ.microbiol.10:2550-2573(2008);(wu等人,plosgenet.1.5:e65(2005);d'ari和rabinowitz,j.biol.chem.266.35:23953-23958(1991))。相关基因和蛋白的信息可从如下所示的信息中获得:蛋白genbankidgi号有机体moth_1516yp_430368.183590359热醋穆尔氏菌foldnp_415062.116128513大肠杆菌chy_1878yp_360698.178044829生氢氧化碳嗜热菌wood-ljungdahl途径的甲基分支的最后的步骤是由亚甲基四氢叶酸还原酶催化的在热醋穆尔氏菌中,这个酶是氧敏感的且包含一个铁硫簇(clark和ljungdahl,j.biol.chem.259.17:10845-10849(1984))。这个酶是由大肠杆菌中的metf(sheppard等人,j.bacteriol.181.3:718-725(1999))和生氢氧化碳嗜热菌中的chy_1233(wu等人,plosgenet.1.5:e65(2005))编码的。热醋穆尔氏菌基因以及它的生氢氧化碳嗜热菌复本位于codh/acs基因簇的附近,被推定氢化酶和异二硫还原酶基因隔开。蛋白genbankidgi号有机体moth_1191yp_430048.183590039热醋穆尔氏菌metfnp_418376.116131779大肠杆菌chy_1233yp_360071.178044792生氢氧化碳嗜热菌虽然大肠杆菌天然地拥有一些必需的转化能力(即,次甲基四氢叶酸酯环水解酶,亚甲基四氢叶酸脱氢酶,亚甲基四氢叶酸还原酶),但是与来自非产乙酸菌的那些相比,来自产乙酸菌的甲基分支酶具有显著地更高(50-100x)的特异活性(morton等人,geneticsandmolecularbiologyofanaerobicbacteria,ed.m.sebald,newyork:springerverlag(1992)pages389-406)。甲酸脱氢酶可专门用于缺氧条件(ljungdahl和andreesen,febslett.54.2:279-282(1975))(1975)。因此,这些酶各自的各种非天然版本可以在具有甲醇和co2、co和/或h2的利用能力的大肠杆菌菌株中表达。特别地,这些基因可以克隆并结合到表达型载体中,该载体如设定的那样被设计来表达它们。最初,可以选择高或中等拷贝数的载体(使用cole1或p15a复制子)。示例性启动子是强的构成性启动子,例如lambdapl,或者pl-laco的iptg可诱导版本(lutz和bujard,nucleicacidsres.25.6:1203-1210(1997))。为了制造人工操纵子,一个5’端启动子置于基因集合的上游,每个基因接受一个共有的rbs元件。基因顺序基于可能的天然顺序。最后,基因被整合进入大肠杆菌基因组。酶分析如下描述来进行:(ljungdahl和andreesen,methodsenzymol.53:360-372(1978);yamamoto等人.j.biol.chem.258.3:1826-1832(1983);lovell等人,arch.microbiol.149.4:280-285(1988);demata和rabinowitz,j.biol.chem.255.6:2569-2577(1980);d'ari和rabinowitz,j.biol.chem.266.35:23953-23958(1991);clark和ljungdahl,259.17:10845-10849(1984);clark和ljungdahl,methodsenzymol.122:392-399(1986))。表达wood-ljungdahl途径的羰基和甲基分支的大肠杆菌菌株构建成后,分析他们利用co2、co和/或h2整合到乙酰辅酶a、细胞量、1,3-丁二醇的能力。初始条件严格地采用厌氧生长细胞,提供外源性葡萄糖。将葡萄糖或其他碳水化合物代谢成乙酰辅酶a提供一个co2的潜在来源,其可以通过wood-ljungdahl途径得以装配。可选地,或者除葡萄糖以外,硝酸可以加到发酵液中以充当电子受体和生长的引发剂。大肠杆菌在脂肪酸中的厌氧生长已经证明了硝酸的存在,其中脂肪酸最终代谢成乙酰辅酶(campbell等人,mol.microbiol.47.3:793-805(2003))。还可以提供氧,只要氧的细胞内水平维持在加工的酶的抑制阈值以下。适用于这些实验的组合物的“合成的合成气”也可以被采用。将13c标记的co和/或co2提供给细胞,并且采用分析质谱法来测定标记碳至乙酸、1,3-丁二醇和细胞量(例如,蛋白氨基酸)的整合。合成气发酵过程的考虑因素包括高的生物量浓度和良好的气液质量转移(bredwell等人,biotechnol.prog.15.5:834-844(1999))。co在水中的溶解度稍微少于氧的溶解度。连续地喷气发酵可以在控制的发酵罐里进行,同时不断地用质谱法分析废气以及定期的液体取样并用gc和hplc分析。液相在批样中起作用。发酵产物如醇、有机酸和残留葡萄糖连同残留甲醇一起用hplc来定量(shimadzu,columbiamd),例如,使用一个系列的hplc柱(例如,hpx-87系列)(biorad,herculesca),对于葡萄糖和醇使用折射率检测器,而对于有机酸使用uv检测器。生长速率通过使用分光光度计(600nm)测定光密度而得以确定。这些系统中的所用配管是玻璃或金属的以维持缺氧条件。气体喷射可用玻璃釉料来进行,以减少气泡大小并提高质量转移。测试了各种喷射速率,从约0.1至1vvm(气体体积每分钟)的范围。为了获得精确的气体摄取速率的测量结果,进行定期的检查,其中气流暂时停止,并且检测气相成分作为一个时间的函数。为了达到全部的目标生产率,可以采用细胞保留或再循环的方法。一种增加微生物浓度的方法是从测流通过切线流过滤膜再循环细胞。重复的分批培养物也可以被使用,如前述的通过moorella的乙酸生产(sakai等人,j.biosci.bioeng.99.3:252-258(2005))。也可以使用各种其他的方法(bredwell等人,biotechnol.prog.15.5:834-844(1999);datar等人,biotechnol.bioeng.86.5:587-594(2004))。可以试验另外的优化法,例如1.5atm的超压以提高质量转移(najafpour和younesi,enzymeandmicrobialtechnology38:223-228(2006))。一旦使用纯的h2/co作为投料达到满意的表现,可以产生合成气混合物,其包含商品化合成气中可能存在的抑制剂。例如,一个典型的杂质分布是4.5%ch4、0.1%c2h2、0.35%c2h6、1.4%c2h4和150ppm一氧化氮(datar等人,biotechnol.bioeng.86.5:587-594(2004))。以化合物例如苯、甲苯、乙苯、对-二甲苯、邻-二甲苯和萘为代表的焦油以ppm水平加入,用于测试对生产的任何影响。例如,已被证明40ppm的no对c.carboxidivorans有抑制(ahmed和lewis,biotechnol.bioeng.97.5:1080-1086(2007))。在移至发酵罐之前,可以在摇瓶培养中试验培养物。并且,可以对这些潜在的抑制化合物的不同水平进行试验,从而将它们对细胞生长的影响定量化。这知识用于开发合成气纯度的规格,其用于放大研究和生产。如果发现任何特定组分很难从用于放大的合成气中减少或移除,则利用适应性进化步骤以使细胞耐受一种或多种杂质。本文描述的发明广泛地提高代谢反应、反应物或其产物,或者特别地提高一种或多种核酸或基因,所述核酸或基因编码与提到的代谢反应、反应物或产物相关或者催化提到的代谢反应、反应物或产物的酶,或者编码与提到的代谢反应、反应物或产物相关的蛋白。除非本文另有特别说明,本领域技术人员可以理解,提到反应也构成提到反应物和反应产物。类似地,除非本文另有特别说明,提到反应物或产物也就提到反应,以及提到这些代谢组分的任一个也就提到基因或者编码催化引用的反应、反应物或产物的酶或者包含在引用的反应、反应物或产物中的蛋白的基因。同样地,根据代谢生物化学的公知领域,酶学和基因学,本文提到基因或编码核酸也构成提到相应的编码酶和它催化的反应,或与反应以及反应的反应物和产物有关的蛋白。本发明的非天然存在的微生物可以通过引入可表达的核酸来生产,所述核酸编码参与一个或多个1,3-丁二醇生物合成途径的一种或多种酶或蛋白。依赖于选定的用于生物合成的宿主微生物,用于一个特定1,3-丁二醇生物合成途径的一些或所有的核酸可得到表达。例如,如果一个选定的宿主缺少用于想要的生物合成途径的一种或多种酶或蛋白,那么用于该缺少的酶或蛋白的可表达核酸被引入到宿主中,用于随后的外源性表达。可选地,如果选定的宿主表现出一些途径基因的外源性表达,但缺少其他的,那么需要用于编码缺少的酶或蛋白的核酸以完成1,3-丁二醇生物合成。因此,本发明的非天然存在的微生物可以通过引入外源性酶或蛋白活性以获得想要的生物合成途径而产生,或者想要的生物合成途径可以通过引入一种或多种外源性酶或蛋白活性,其与一种或多种外源性酶或蛋白一起生产想要的产物例如1,3-丁二醇。宿主微生物可以选自,以及在其中产生非天然存在的微生物,例如细菌、酵母、真菌、藻类、蓝藻细菌、或者适用于发酵方法的许多其他微生物中的任一种。示例性细菌包括选自的下列的物种:大肠杆菌、产酸克雷伯氏菌、产琥珀酸厌氧螺菌、琥珀酸放线菌、曼海姆琥珀酸产生菌、豆根瘤菌、枯草杆菌、谷氨酸棒状杆菌、氧化葡萄糖酸菌、运动发酵单胞菌、乳酸链球菌、胚牙乳杆菌、天蓝色链霉菌、丙酮丁醇梭菌、荧光假单胞菌和恶臭假单胞菌。示例性酵母或真菌包括选自下列的物种:酿酒酵母、粟酒裂殖酵母菌、乳酸克鲁维酵母、马克思克鲁维酵母、土曲霉、黑曲霉、巴斯德毕赤酵母、无根根霉菌、rhizobusoryzae等等。示例性蓝藻细菌包括海滨蓝藻菌mbic11017、鱼腥藻属pcc7120、多变鱼腥藻atcc29413、阿格门氏藻、绿硫细菌tls、蓝杆藻atcc51142、无类囊体蓝藻pcc7421、铜绿微囊藻nies-843、点状念珠藻atcc29133、原绿球藻med4、原绿球藻mit9313、原绿球藻ss120、原绿球藻str.as9601、原绿球藻str.mit9211、原绿球藻str.mit9215、原绿球藻str.mit9301、原绿球藻str.mit9303、原绿球藻str.mit9312、原绿球藻str.mit9515、原绿球藻str.natl1a、原绿球藻str.natl2a、沼泽红假单胞菌cga009、细长聚球藻pcc6301、细长聚球藻pcc7942、聚球藻cc9311、聚球藻cc9605、聚球藻cc9902、聚球藻ja-2-3b\'a(2-13)、聚球藻ja-3-3ab、聚球藻pcc7002、聚球藻rcc307、聚球藻wh7803、聚球藻wh8102、集胞藻pcc6803、细长热聚球藻bp-1、红海束毛藻ims101。示例性藻类包括布朗葡萄藻、莱茵衣藻、小球藻、隐甲藻、筒柱藻、杜氏盐藻、等鞭金藻、单肠藻、微小绿藻、微拟球藻、富油新绿藻、菱形藻、三角褐指藻、裂殖壶藻、tetraselmissueica。大肠杆菌是一种特别有用的宿主有机体,因为它是一个被良好表征的适合基因工程的有机体。其他特别有用的宿主有机体包括酵母,例如酿酒酵母。可以理解地,任何合适的微生物宿主有机体可以用于引入代谢和/或基因修饰以生产想要的产物。依赖于所选的宿主微生物的1,3-丁二醇生物合成组分,本发明的非天然存在的微生物可以包括至少一个外源性表达的1,3-bdo途径-编码核酸以及一直到用于一个或多个1,3-丁二醇生物合成途径的所有编码核酸。例如,1,3-丁二醇生物合成可以在缺少途径酶或蛋白的宿主中通过相应地编码核酸的外源性表达而建立。在缺少1,3-丁二醇途径的所有酶或蛋白的宿主中,途径中的所有酶或蛋白的外源性表达都被包括,尽管可以理解即使宿主包含至少一个途径酶或蛋白,途径的所有酶或蛋白也可以表达。例如,生产1,3-丁二醇的途径中的所有酶或蛋白外源性表达可以包括,例如1)甲醇甲基转移酶(mtab),2)类咕啉蛋白(mtac),3)甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa),4)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),5)类咕啉铁-硫蛋白(acsd),6)镍-蛋白装配蛋白(acsf&cooc),7)铁氧化还原蛋白(orf7),8)乙酰辅酶a合酶(acsb&acsc),9)一氧化碳脱氢酶(acsa),10)氢化酶,11)乙酰乙酰辅酶a硫解酶(atob),12)乙酰乙酰辅酶a还原酶(辅酶a依赖,醇形成),13)3-氧代丁醛还原酶(醛还原),14)4-羟基,2-丁酮还原酶,15)乙酰乙酰辅酶a还原酶(辅酶a依赖,醛形成),16)3-氧代丁醛还原酶(酮还原),17)3-羟基丁醛还原酶,18)乙酰乙酰辅酶a还原酶(酮还原),19)3-羟基丁酰辅酶a还原酶(醛形成),20)3-羟基丁酰辅酶a还原酶(醇形成),21)乙酰乙酰辅酶a转移酶,水解酶,或合成酶,22)乙酰乙酸还原酶,23)3-羟基丁酰辅酶a转移酶,水解酶,或合成酶,24)3-羟基丁酸还原酶,和25)3-羟基丁酸脱氢酶,如附图4所示。可选地,生产1,3-丁二醇的途径红的所有酶或蛋白的外源性表达,如附图5所示,可以包括,例如1)甲酸脱氢酶,2)甲酰四氢叶酸合成酶,3)次甲基四氢叶酸酯环水解酶,4)亚甲基四氢叶酸脱氢酶,5)亚甲基四氢叶酸还原酶,6)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),7)类咕啉铁-硫蛋白(acsd),8)镍-蛋白装配蛋白(acsf&cooc),9)铁氧化还原蛋白(orf7),10)乙酰辅酶a合酶(acsb&acsc),11)一氧化碳脱氢酶(acsa),12)氢化酶(hyd),13)乙酰乙酰辅酶a硫解酶(atob),14)乙酰乙酰辅酶a还原酶(辅酶a依赖,醇形成),15)3-氧代丁醛还原酶(醛还原),16)4-羟基,2-丁酮还原酶,17)乙酰乙酰辅酶a还原酶(辅酶a依赖,醛形成),18)3-氧代丁醛还原酶(酮还原),19)3-羟基丁醛还原酶,20)乙酰乙酰辅酶a还原酶(酮还原),21)3-羟基丁酰辅酶a还原酶(醛形成),22)3-羟基丁酰辅酶a还原酶(醇形成),23)乙酰乙酰辅酶a转移酶,水解酶或合成酶,24)乙酰乙酸还原酶,25)3-羟基丁酰辅酶a转移酶,水解酶,或合成酶,26)3-羟基丁酸还原酶,和27)3-羟基丁酸脱氢酶。鉴于本文的教导和指导,本领域技术人员可以理解以可表达形式引入的编码核酸的数目至少与所选宿主微生物的1,3-丁二醇途径缺少相匹配。因此,本发明的非天然存在的微生物可以具有1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个,一直到编码构成一条本文公开的1,3-丁二醇生物合成途径的酶或蛋白的所有核酸,如附图4和5所示。在一些实施方式中,非天然存在的微生物还可以包括其他基因修饰,其促进或优化1,3-丁二醇生物合成,或其给予宿主微生物其他有用的功能。一个这样的其他功能可以包括,例如,一个或多个1,3-丁二醇途径母体如乙酰辅酶a、乙酰乙酰辅酶a、乙酰乙酸、3-羟基丁酰辅酶a、3-羟基丁酸、4-羟基-2-丁酮、3-氧代丁醛或3-羟基丁醛的合成的增加。通常地,选择这样的宿主微生物,它生产1,3-丁二醇途径的母体,作为天然生产的分子或者作为加工的产物,所述加工的产物提供想要母体的从头生产或者增加由宿主微生物天然地生产的母体的生产。例如,乙酰辅酶a在有机体例如大肠杆菌中天然地生产得到。宿主有机体可以被加工以增加母体的生产,如本文所述。此外,加工成产生想要母体的微生物可以用作宿主有机体,且进一步加工成表达1,3-丁二醇途径的酶或蛋白。在一些实施方式中,本发明的非天然存在的微生物是由包含合成1,3-丁二醇的酶能力的宿主产生的。在一个具体实施方式中,它可以用于增加1,3-丁二醇途径产物的合成或累积以例如推进1,3-丁二醇途径反应向1,3-丁二醇生产。增加的合成或累积可以通过例如编码一种或多种上述1,3-丁二醇途径酶或蛋白的核酸的过表达而完成。过表达1,3-丁二醇途径的酶或酶和/或蛋白或蛋白的发生可例如通过外源性基因的外源性表达或通过异源性基因的外源性表达而实现。因此,天然存在的有机体可以容易地变成本发明的非天然存在的微生物,例如,生产1,3-丁二醇,通过1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个,一直到编码构成一条本文公开的1,3-丁二醇生物合成途径的酶或蛋白的所有核酸,如附图4和5所示。此外,非天然存在的有机体可以通过外源性基因的的诱变而产生,这导致1,3-丁二醇生物合成途径中的一种酶的活性的增加。在一个特别有用的实施方式中,采用编码核酸的外源性表达。外源性表达赋予这样的能力:定制表达和/或调控元件到宿主中以及定制应用以达到由使用者控制的想要的表达水平。但是,外源性表达也可以在其他实施方式中使用,例如通过移除一个负调控效应物或基因启动子的诱导,当与诱导性启动子或其他调控元件相连时。因此,具有天然存在的可诱导启动子的外源性基因可以通过提供合适的诱导剂而得到正调节,或者外源性基因的调节区域可以整合入一个可诱导调控元件而得到加工,从而在想要的时间允许外源性基因的增加的表达的调节。类似地,可诱导启动子可作为调控元件而包含在内,为了将外源性基因引入到非天然存在的微生物中。可以理解地,在本发明的方法中,任何一种或多种外源性核酸可以引入到微生物中以产生本发明的非天然存在的微生物。核酸的引入可以是为了例如在微生物中赋予1,3-丁二醇生物合成途径。可选地,可以引入编码核酸以产生中间微生物,其具有生物合成能力以催化一些必需反应而赋予1,3-丁二醇生物合成能力。例如,具有1,3-丁二醇生物合成途径的非天然存在的微生物可以包含至少2个编码想要的酶或蛋白的外源性基因。因此,可以理解地,生物合成途径的2个或多个酶或蛋白的任意组合可以包括在本发明的非天然存在的微生物中。类似地,可以理解地,生物合成途径的3个或多个酶或蛋白的任意组合可以包括在本发明的非天然存在的微生物中。类似地,可以理解地,根据需要,生物合成途径的4个或多个酶或蛋白的任意组合可以包括在本发明的非天然存在的微生物中,只要想要的生物合成途径的酶和/或蛋白的组合得到生产相应的想要产物的结果。同样地,根据需要,如本文所述的生物合成途径的5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个酶或蛋白的任意组合可以包括在本发明的非天然存在的微生物中,只要想要的生物合成途径的酶和/或蛋白的组合得到生产相应的想要产物的结果。如本文公开的,包含在本发明的非天然存在的微生物中的生物合成途径的17个外源性酶或蛋白的示例性组合包括:a:1)甲酸脱氢酶,2)甲酰四氢叶酸合成酶,3)次甲基四氢叶酸酯环水解酶,4)亚甲基四氢叶酸脱氢酶,5)亚甲基四氢叶酸还原酶,6)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),7)类咕啉铁-硫蛋白(acsd),8)镍-蛋白装配蛋白(acsf&cooc),9)铁氧化还原蛋白(orf7),10)乙酰辅酶a合酶(acsb&acsc),11)一氧化碳脱氢酶(acsa),12)氢化酶(hyd),13)乙酰乙酰辅酶a硫解酶(atob),14)乙酰乙酰辅酶a转移酶,水解酶,或合成酶,15)乙酰乙酸还原酶,16)3-氧代丁醛还原酶(酮还原),17)3-羟基丁醛还原酶;b:1)甲酸脱氢酶,2)甲酰四氢叶酸合成酶,3)次甲基四氢叶酸酯环水解酶,4)亚甲基四氢叶酸脱氢酶,5)亚甲基四氢叶酸还原酶,6)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),7)类咕啉铁-硫蛋白(acsd),8)镍-蛋白装配蛋白(acsf&cooc),9)铁氧化还原蛋白(orf7),10)乙酰辅酶a合酶(acsb&acsc),11)一氧化碳脱氢酶(acsa),12)氢化酶(hyd),13)乙酰乙酰辅酶a硫解酶(atob),14)乙酰乙酰辅酶a转移酶,水解酶,或合成酶,15)乙酰乙酸还原酶,16)3-氧代丁醛还原酶(醛还原),17)4-羟基,2-丁酮还原酶;c:1)甲酸脱氢酶,2)甲酰四氢叶酸合成酶,3)次甲基四氢叶酸酯环水解酶,4)亚甲基四氢叶酸脱氢酶,5)亚甲基四氢叶酸还原酶,6)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),7)类咕啉铁-硫蛋白(acsd),8)镍-蛋白装配蛋白(acsf&cooc),9)铁氧化还原蛋白(orf7),10)乙酰辅酶a合酶(acsb&acsc),11)一氧化碳脱氢酶(acsa),12)氢化酶(hyd),13)乙酰乙酰辅酶a硫解酶(atob),14)乙酰乙酰辅酶a还原酶(酮还原),15)3-羟基丁酰辅酶a转移酶,水解酶,或合成酶,16)3-羟基丁酸还原酶,17)3-羟基丁醛还原酶;d:1)甲酸脱氢酶,2)甲酰四氢叶酸合成酶,3)次甲基四氢叶酸酯环水解酶,4)亚甲基四氢叶酸脱氢酶,5)亚甲基四氢叶酸还原酶,6)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),7)类咕啉铁-硫蛋白(acsd),8)镍-蛋白装配蛋白(acsf&cooc),9)铁氧化还原蛋白(orf7),10)乙酰辅酶a合酶(acsb&acsc),11)一氧化碳脱氢酶(acsa),12)氢化酶(hyd),13)乙酰乙酰辅酶a硫解酶(atob),14)乙酰乙酰辅酶a转移酶,水解酶,或合成酶,15)3-羟基丁酸脱氢酶,16)3-羟基丁酸还原酶,17)3-羟基丁醛还原酶。如本文公开的,包含在本发明的非天然存在的微生物中的生物合成途径的16个外源性酶或蛋白的示例性组合包括上述a-d公开的17个酶中的16个的任意组合或:e:1)甲酸脱氢酶,2)甲酰四氢叶酸合成酶,3)次甲基四氢叶酸酯环水解酶,4)亚甲基四氢叶酸脱氢酶,5)亚甲基四氢叶酸还原酶,6)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),7)类咕啉铁-硫蛋白(acsd),8)镍-蛋白装配蛋白(acsf&cooc),9)铁氧化还原蛋白(orf7),10)乙酰辅酶a合酶(acsb&acsc),11)一氧化碳脱氢酶(acsa),12)氢化酶(hyd),13)乙酰乙酰辅酶a硫解酶(atob),14)乙酰乙酰辅酶a还原酶(辅酶a依赖,醛形成),15)3-氧代丁醛还原酶(醛还原),和16)4-羟基,2-丁酮还原酶。f:1)甲酸脱氢酶,2)甲酰四氢叶酸合成酶,3)次甲基四氢叶酸酯环水解酶,4)亚甲基四氢叶酸脱氢酶,5)亚甲基四氢叶酸还原酶,6)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),7)类咕啉铁-硫蛋白(acsd),8)镍-蛋白装配蛋白(acsf&cooc),9)铁氧化还原蛋白(orf7),10)乙酰辅酶a合酶(acsb&acsc),11)一氧化碳脱氢酶(acsa),12)氢化酶(hyd),13)乙酰乙酰辅酶a硫解酶(atob),14)乙酰乙酰辅酶a还原酶(辅酶a依赖,醛形成),15)3-氧代丁醛还原酶(酮还原),和16)3-羟基丁醛还原酶。g:1)甲酸脱氢酶,2)甲酰四氢叶酸合成酶,3)次甲基四氢叶酸酯环水解酶,4)亚甲基四氢叶酸脱氢酶,5)亚甲基四氢叶酸还原酶,6)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),7)类咕啉铁-硫蛋白(acsd),8)镍-蛋白装配蛋白(acsf&cooc),9)铁氧化还原蛋白(orf7),10)乙酰辅酶a合酶(acsb&acsc),11)一氧化碳脱氢酶(acsa),12)氢化酶(hyd),13)乙酰乙酰辅酶a硫解酶(atob),14)乙酰乙酰辅酶a还原酶(酮还原),15)3-羟基丁酰辅酶a还原酶(醛形成),和16)3-羟基丁醛还原酶。如本文公开的,包含在本发明的非天然存在的微生物中的生物合成途径的15个外源性酶或蛋白的示例性组合包括上述a-g公开的酶中的15个的任意组合或:h:1)甲酸脱氢酶,2)甲酰四氢叶酸合成酶,3)次甲基四氢叶酸酯环水解酶,4)亚甲基四氢叶酸脱氢酶,5)亚甲基四氢叶酸还原酶,6)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),7)类咕啉铁-硫蛋白(acsd),8)镍-蛋白装配蛋白(acsf&cooc),9)铁氧化还原蛋白(orf7),10)乙酰辅酶a合酶(acsb&acsc),11)一氧化碳脱氢酶(acsa),12)氢化酶(hyd),13)乙酰乙酰辅酶a硫解酶(atob),14)乙酰乙酰辅酶a还原酶(辅酶a依赖,醇形成),和15)4-羟基,2-丁酮还原酶。i:1)甲酸脱氢酶,2)甲酰四氢叶酸合成酶,3)次甲基四氢叶酸酯环水解酶,4)亚甲基四氢叶酸脱氢酶,5)亚甲基四氢叶酸还原酶,6)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),7)类咕啉铁-硫蛋白(acsd),8)镍-蛋白装配蛋白(acsf&cooc),9)铁氧化还原蛋白(orf7),10)乙酰辅酶a合酶(acsb&acsc),11)一氧化碳脱氢酶(acsa),12)氢化酶(hyd),13)乙酰乙酰辅酶a硫解酶(atob),14)乙酰乙酰辅酶a还原酶(酮还原),和15)3-羟基丁酰辅酶a还原酶(醇形成)。j:1)甲醇甲基转移酶(mtab),2)类咕啉蛋白(mtac),3)甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa),4)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),5)类咕啉铁-硫蛋白(acsd),6)镍-蛋白装配蛋白(acsf&cooc),7)铁氧化还原蛋白(orf7),8)乙酰辅酶a合酶(acsb&acsc),9)一氧化碳脱氢酶(acsa),10)氢化酶,11)乙酰乙酰辅酶a硫解酶(atob),12)乙酰乙酰辅酶a转移酶,水解酶,或合成酶,13)乙酰乙酸还原酶,14)3-氧代丁醛还原酶(酮还原),15)3-羟基丁醛还原酶;k:1)甲醇甲基转移酶(mtab),2)类咕啉蛋白(mtac),3)甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa),4)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),5)类咕啉铁-硫蛋白(acsd),6)镍-蛋白装配蛋白(acsf&cooc),7)铁氧化还原蛋白(orf7),8)乙酰辅酶a合酶(acsb&acsc),9)一氧化碳脱氢酶(acsa),10)氢化酶,11)乙酰乙酰辅酶a硫解酶(atob),12)乙酰乙酰辅酶a转移酶,水解酶,或合成酶,13)乙酰乙酸还原酶,14)3-氧代丁醛还原酶(醛还原),15)4-羟基,2-丁酮还原酶;l:1)甲醇甲基转移酶(mtab),2)类咕啉蛋白(mtac),3)甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa),4)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),5)类咕啉铁-硫蛋白(acsd),6)镍-蛋白装配蛋白(acsf&cooc),7)铁氧化还原蛋白(orf7),8)乙酰辅酶a合酶(acsb&acsc),9)一氧化碳脱氢酶(acsa),10)氢化酶,11)乙酰乙酰辅酶a硫解酶(atob),12)乙酰乙酰辅酶a还原酶(酮还原),13)3-羟基丁酰辅酶a转移酶,水解酶,或合成酶,14)3-羟基丁酸还原酶,15)3-羟基丁醛还原酶;m:1)甲醇甲基转移酶(mtab),2)类咕啉蛋白(mtac),3)甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa),4)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),5)类咕啉铁-硫蛋白(acsd),6)镍-蛋白装配蛋白(acsf&cooc),7)铁氧化还原蛋白(orf7),8)乙酰辅酶a合酶(acsb&acsc),9)一氧化碳脱氢酶(acsa),10)氢化酶,11)乙酰乙酰辅酶a硫解酶(atob),12)乙酰乙酰辅酶a转移酶,水解酶,或合成酶,13)3-羟基丁酸脱氢酶,14)3-羟基丁酸还原酶,15)3-羟基丁醛还原酶。如本文公开的,包含在本发明的非天然存在的微生物中的生物合成途径的14个外源性酶或蛋白的示例性组合包括上述a-m公开的酶中的14个的任意组合或:n:1)甲醇甲基转移酶(mtab),2)类咕啉蛋白(mtac),3)甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa),4)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),5)类咕啉铁-硫蛋白(acsd),6)镍-蛋白装配蛋白(acsf&cooc),7)铁氧化还原蛋白(orf7),8)乙酰辅酶a合酶(acsb&acsc),9)一氧化碳脱氢酶(acsa),10)氢化酶,11)乙酰乙酰辅酶a硫解酶(atob),12)乙酰乙酰辅酶a还原酶(辅酶a依赖,醛形成)13)3-氧代丁醛还原酶(醛还原),和14)4-羟基,2-丁酮还原酶。o:1)甲醇甲基转移酶(mtab),2)类咕啉蛋白(mtac),3)甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa),4)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),5)类咕啉铁-硫蛋白(acsd),6)镍-蛋白装配蛋白(acsf&cooc),7)铁氧化还原蛋白(orf7),8)乙酰辅酶a合酶(acsb&acsc),9)一氧化碳脱氢酶(acsa),10)氢化酶,11)乙酰乙酰辅酶a硫解酶(atob),12)乙酰乙酰辅酶a还原酶(辅酶a依赖,醛形成),13)3-氧代丁醛还原酶(酮还原),和14)3-羟基丁醛还原酶。p:1)甲醇甲基转移酶(mtab),2)类咕啉蛋白(mtac),3)甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa),4)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),5)类咕啉铁-硫蛋白(acsd),6)镍-蛋白装配蛋白(acsf&cooc),7)铁氧化还原蛋白(orf7),8)乙酰辅酶a合酶(acsb&acsc),9)一氧化碳脱氢酶(acsa),10)氢化酶,11)乙酰乙酰辅酶a硫解酶(atob),12)乙酰乙酰辅酶a还原酶(酮还原),13)3-羟基丁酰辅酶a还原酶(醛形成),和14)3-羟基丁醛还原酶。如本文公开的,包含在本发明的非天然存在的微生物中的生物合成途径的13个外源性酶或蛋白的示例性组合包括上述a-p公开的酶中的13个的任意组合或:q:1)甲醇甲基转移酶(mtab),2)类咕啉蛋白(mtac),3)甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa),4)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),5)类咕啉铁-硫蛋白(acsd),6)镍-蛋白装配蛋白(acsf&cooc),7)铁氧化还原蛋白(orf7),8)乙酰辅酶a合酶(acsb&acsc),9)一氧化碳脱氢酶(acsa),10)氢化酶,11)乙酰乙酰辅酶a硫解酶(atob),12)乙酰乙酰辅酶a还原酶(酮还原),和13)3-羟基丁酰辅酶a还原酶(醇形成),r:1)甲醇甲基转移酶(mtab),2)类咕啉蛋白(mtac),3)甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa),4)甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),5)类咕啉铁-硫蛋白(acsd),6)镍-蛋白装配蛋白(acsf&cooc),7)铁氧化还原蛋白(orf7),8)乙酰辅酶a合酶(acsb&acsc),9)一氧化碳脱氢酶(acsa),10)氢化酶,11)乙酰乙酰辅酶a硫解酶(atob),12)乙酰乙酰辅酶a还原酶(辅酶a依赖,醇形成),和13)4-羟基,2-丁酮还原酶。如本文公开的,包含在本发明的非天然存在的微生物中的生物合成途径的12个外源性酶或蛋白的示例性组合包括上述a-r公开的酶中的12个的任意组合。如本文公开的,包含在本发明的非天然存在的微生物中的生物合成途径的11个外源性酶或蛋白的示例性组合包括上述a-r公开的酶中的10个的任意组合。如本文公开的,包含在本发明的非天然存在的微生物中的生物合成途径的9个外源性酶或蛋白的示例性组合包括上述a-r公开的酶中的8个的任意组合。如本文公开的,包含在本发明的非天然存在的微生物中的生物合成途径的7个外源性酶或蛋白的示例性组合包括上述a-r公开的酶中的6个的任意组合,并且这样一直下至上述a-r公开的酶中的2个的任意组合。除了本文所述的1,3-丁二醇的生物合成以外,本发明的非天然存在的微生物和方法还可以用于相互之间各种组合,以及与本领域公职的其他微生物和方法的各种组合以达到通过其他途径得到产物的生物合成。例如,除使用1,3-丁二醇发生器以外的一个生产1,3-丁二醇的替代是通过其他的具有将1,3-丁二醇途径中间体转化成1,3-丁二醇的能力的微生物的添加。一个这样的步骤包括,例如,微生物的发酵,其产生1,3-丁二醇途径中间体。1,3-丁二醇途径中间体然后可以用作第二种微生物的底物,所述第二种微生物将1,3-丁二醇途径中间体转化为1,3-丁二醇。1,3-丁二醇途径中间体可以直接添加到另一个的第二种有机体培养中,或者1,3-丁二醇途径中间体发生器的原始培养物中可以通过例如细胞分离而去除这些有机体,随后可以将第二种有机体加入到发酵液以生产最终产物,而没有中间体纯化步骤。在其他的实施方式中,本发明的非天然存在的微生物和方法可以在各种各样的亚途径中组合,以达到例如1,3-丁二醇的生物合成。在这些实施方式中,本发明的想要的产物的生物合成途径可以分配到不同的微生物中,并且不同的微生物可以共同培养以产生最终产物。在这样的生物合成线路图中,一种微生物的产物是第二种微生物的底物,直到最终产物合成得到。例如,1,3-丁二醇的生物合成可以通过构建一个微生物而完成,所述微生物包含一个途径中间体转化成另一个途径中间体或产物的生物合成途径。可选地,1,3-丁二醇还可以从微生物中生物合成得到,通过使用两种有机体在同一个容器中共培养或共发酵,其中第一种微生物产生1,3-丁二醇中间体以及第二种微生物将该中间体转化为1,3-丁二醇。鉴于本文提供的教导和指导,本领域技术人员可以理解,本发明的非天然存在的微生物和方法与其他微生物、与具有亚途径的其他非天然存在的微生物的共培养以及与本领域公知的产生1,3-丁二醇的其他化学和/或生物学方法的组合一起存在各种各样的组合和排列。用于1,3-丁二醇途径的酶或蛋白的编码核酸的来源可以包括,例如,任何物种,所述物种中的基因编码的产物能够催化涉及的反应。这样的物种包括原核生物和真核生物,包括,但不限于,包括古细菌和真细菌的细菌,以及包括酵母、植物、藻类、昆虫、动物和哺乳动物的真核生物,包括人。这样来源的示例类型物种包括,例如,大肠杆菌,以及本文公开的或可用作相应基因的来源有机体的其他示例性物种。但是,目前可用的具有完整的基因组序列的物种超过550种(超出在公开数据库如ncbi中可用的这些的一半),包括395种微生物基因组和许多种酵母、真菌、植物和哺乳动物基因组;对于相关或疏远的物种中的一种或多种基因进行编码必需的1,3-丁二醇生物合成活性的基因的鉴定,包括例如,已知基因的同系、同源、旁系同源和非同源的基因替换,以及有机体之间的遗传改变的互换都是本领域的常识和公知。相应地,关于特别的有机体例如大肠杆菌,本文所述的获得1,3-丁二醇生物合成的代谢改变可以容易地应用于其他微生物中,同样地包括原核生物和真核生物。鉴于本文的教导和指导,本领域技术人员可以理解在一个有机体中示例的代谢改变同样可以适用于其他有机体中。在一些实例中,例如当可选的1,3-丁二醇生物途径存在于不相关的物种中时,1,3-丁二醇生物合成可以通过,例如,来自不相关物种的旁系同源的外源性表达而被赋予到宿主物种中,所述不相关的物种催化类似而非全同的代谢反应以代替涉及的反应。因为代谢网络中的某些差异存在于不同有机体之间,所以本领域技术人员可以理解不同有机体之间的实际的基因用法可能不同。但是,鉴于本文提供的教导和指导,本领域技术人员还可以理解本发明的教导和方法可以应用于所有微生物中,对本文示例的那些微生物使用同源代谢改变以在感兴趣物种中构建一种能够合成1,3-丁二醇的微生物。用于构建和测试非天然存在的1,3-丁二醇生产宿主的表达水平的方法可以例如通过本领域公知的重组和检测方法来进行。这样的方法可以在下述描述中找到:例如,sambrook等人,molecularcloning:alaboratorymanual,thirded.,coldspringharborlaboratory,newyork(2001);和ausubel等人,currentprotocolsinmolecularbiology,johnwiley和sons,baltimore,md(1999)。包含在用于生产1,3-丁二醇的途径中的外源性核酸序列可以使用本领域公知的技术稳定地或短暂地引入到宿主细胞,包括,但不限于,接合、电穿孔、化学转化、转导、转染和超声转化。为了在大肠杆菌或其他原核细胞中外源性表达,一些真核核酸的基因或cdna中的核酸序列可以编码导向信号例如n-端线粒体或其他导向信号,其可以在转化到原核宿主细胞之前被移除,如果需要的话。例如,线粒体引导序列的除去导致增加的大肠杆菌中的表达(hoffmeister等人,j.biol.chem.280:4329-4338(2005))。为了在酵母或其他真核细胞中外源性表达,基因可以表达在细胞液中且不用引导序列,或者可以定向到线粒体或其他细胞器,或定向用于分泌,通过添加合适的前导序列例如适用于宿主细胞的线粒体定向或分泌信号。因此,可以理解,对核酸序列的恰当的修饰以除去或包含前导序列可以整合到外源核酸序列中以获得期望的性能。进一步地,使用本领域公知的技术,基因可以受到密码子优化以达到蛋白的最优化表达。可以构建表达载体,其包含一个或多个如本文示例的1,3-丁二醇生物合成途径编码核酸,可操作地与宿主有机体中的表达控制序列功能的相关联。可用于本发明的微生物宿主有机体的表达载体包括,例如,质粒、噬菌体载体、病毒载体、游离基因和人工染色体,包括可操作的用于稳定整合进入宿主染色体的载体和选择序列或标记。此外,表达载体可以包括一个或多个可选的标记基因和合适的表达控制序列。还可以包括可选的标记基因,例如,其提供对抗生素或毒素的抵抗力,补充营养缺陷不足,或供给培养基中没有的关键营养物。表达控制序列可以包括构成的和可诱导的启动子、转录增强子、转录终止子,以及本领域公知的这些。当2个或更多外源性编码核酸共同表达时,核酸都可以例如插入到单个表达载体或插入到分开的表达载体。对于单个载体表达,编码核酸可以工作地与一个共同的表达控制序列相关联,或者与不同的表达控制序列相关联,例如一个可诱导启动子和一个构成的启动子。包含在代谢或合成途径中的外源性核酸的转化可以使用本领域公知的方法而得到。这样的方法包括,例如,核酸分析例如mrna的northern印迹法或聚合酶链反应(pcr)扩增,或者用于基因产物的表达的免疫印迹法,或者其他合适的分析方法来测试引入核酸序列或它的相应的基因产物的表达。本领域技术人员可以理解地,外源性核酸足量表达生产想要的产物,并且可以进一步地理解,可以使用本领域公知的方法以及如本文所述的方法来优化表达水平以获得充足的表达。在一些实施方式中,本发明提供一种生产1,3-bdo的方法,其包括培养一种具有1,3-bdo途径的非天然存在的微生物,所述途径具有至少一个编码足量表达以生产1,3-bdo的1,3-bdo途径酶或蛋白的外源性核酸,所述微生物在一定条件下培养充足的一段时间以生产1,3-bdo。在一些实施方式中,该1,3-bdo途径包括甲醇甲基转移酶(mtab),类咕啉蛋白(mtac),甲基四氢叶酸:类咕啉蛋白甲基转移酶(mtaa),甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),类咕啉铁-硫蛋白(acsd),镍-蛋白装配蛋白(acsf&cooc),铁氧化还原蛋白(orf7),乙酰辅酶a合酶(acsb&acsc),一氧化碳脱氢酶(acsa),氢化酶(hyd),乙酰乙酰辅酶a硫解酶(atob),乙酰乙酰辅酶a还原酶(辅酶a依赖,醛形成),3-氧代丁醛还原酶(酮还原),3-羟基丁醛还原酶,乙酰乙酰辅酶a还原酶(辅酶a依赖,醇形成),3-氧代丁醛还原酶(醛还原),4-羟基,2-丁酮还原酶,乙酰乙酰辅酶a还原酶(酮还原),3-羟基丁酰辅酶a还原酶(醛形成),3-羟基丁酰辅酶a还原酶(醇形成),3-羟基丁酰辅酶a转移酶,3-羟基丁酰辅酶a水解酶,3-羟基丁酰辅酶a合成酶,3-羟基丁酸脱氢酶,3-羟基丁酸还原酶,乙酰乙酰辅酶a转移酶,乙酰乙酰辅酶a水解酶,乙酰乙酰辅酶a合成酶,或乙酰乙酸还原酶。在其他实施方式中个,本发明提供一种生产1,3-bdo的方法,其包括培养一种具有1,3-bdo途径的非天然存在的微生物,所述途径具有至少一个编码足量表达以生产1,3-bdo的1,3-bdo途径酶或蛋白的外源性核酸,所述微生物在一定条件下培养充足的一段时间以生产1,3-bdo。1,3-bdo途径包括甲酸脱氢酶,甲酰四氢叶酸合成酶,次甲基四氢叶酸酯环水解酶,亚甲基四氢叶酸脱氢酶,亚甲基四氢叶酸还原酶,甲基四氢叶酸:类咕啉蛋白甲基转移酶(acse),类咕啉铁-硫蛋白(acsd),镍-蛋白装配蛋白(acsf&cooc),铁氧化还原蛋白(orf7),乙酰辅酶a合酶(acsb&acsc),一氧化碳脱氢酶(acsa),氢化酶(hyd),乙酰乙酰辅酶a硫解酶(atob),乙酰乙酰辅酶a还原酶(辅酶a依赖,醛形成),3-氧代丁醛还原酶(酮还原),3-羟基丁醛还原酶,乙酰乙酰辅酶a还原酶(辅酶a依赖,乙醇),3-氧代丁醛还原酶(醛还原),4-羟基,2-丁酮还原酶,乙酰乙酰辅酶a还原酶(酮还原),3-羟基丁酰辅酶a还原酶(醛形成),3-羟基丁酰辅酶a还原酶(醇形成),3-羟基丁酰辅酶a转移酶,3-羟基丁酰辅酶a水解酶,3-羟基丁酰辅酶a合成酶,3-羟基丁酸脱氢酶,3-羟基丁酸还原酶,乙酰乙酰辅酶a转移酶,乙酰乙酰辅酶a水解酶,乙酰乙酰辅酶a合成酶,或乙酰乙酸还原酶。在一些实施方式中,培养该非天然存在的微生物包括在一定条件下培养足够长的一段时间以生产1,3-bdo。在一些实施方式中,培养是在基本上厌氧的培养基中进行的。在一些实施方式中,微生物的至少一个外源性核酸是异源性核酸。如上所述,培养的非天然存在的微生物在1,3-bdo途径中可以具有任意数目的外源性核酸,包括1,2,3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,其一直到编码1,3-bdo途径的所有核酸。本发明的非天然存在的微生物可以利用选自下列物质的碳原料:1)甲醇和co,2)乙醇、co2和h2,3)乙醇、co、co2和h2,4)甲醇和包含co和h2的合成气,5)甲醇和包含co、co2和h2的合成气,6)一种或多种碳水化合物,7)甲醇和一种或多种碳水化合物,和8)乙醇,在一些实施方式中或者碳原料选自:1)co,2)co2和h2,3)co、co2和h2,4)包含co和h2的合成气,5)包含co、co2和h2的合成气,和6)一种或多种碳水化合物,在其他实施方式中。为了测试1,3-丁二醇的生产,合适的纯化和/或分析可以使用公知的方法来进行。合适的重复例如平行三份的培养可以用于每种加工的待测试菌株的生长。例如,加工的生产宿主中的产物和副产物形成可以得到监测。最终产物和中间体以及其他有机化合物可以用以下方法进行分析:hplc(高效液相色谱法),gc-ms(气相色谱-质谱法)和lc-ms(液相色谱-质谱法)或者本领域公知的其他合适的常规分析方法。发酵液中的产物的释放也可用培养上清液来测试。副产物和残留葡萄糖可用hplc来定量,例如对于葡萄糖和乙醇使用示差折光率检测器,以及对于有机酸使用uv检测器(lin等人,biotechnol.bioeng.90:775-779(2005)),或本领域公知的其他合适的分析和检测方法。来自外源性dna序列的独特的酶或蛋白活性也可以用本领域公知的方法进行分析。通过使用各种本领域公知的方法,1,3-丁二醇可以与培养物中的其他组分分离。这样的分离方法包括,例如,提取过程以及方法,包括连续液液提取、汽化法、膜过滤、膜分离、反向渗透法、电渗析法、蒸馏、结晶、离心、过滤萃取、离子交换色谱、体积排阻色谱、吸附色谱和超滤。上述的所有方法都是本领域公知的。本文所述的任何的非天然存在的微生物都可以得到培养以生产或分泌本发明的生物合成产物。例如,1,3-丁二醇发生器可以得到培养用于1,3-丁二醇的生物合成生产。为了1,3-丁二醇的生产,重组菌株与碳源和其他必需营养物一起在培养基中培养。我们高度地期望维持发酵中的厌氧条件以减少全部过程的花费。这样的条件可以通过例如下述方法获得:首先用氮气喷射培养基,然后用一个密封螺旋盖将培养瓶密封。对于那些缺氧下不生长的菌株,可以通过在隔膜上打小孔来有限的通风从而获得有氧条件。示例性缺氧条件先前已有描述,且是本领域公知的。示例性的有氧和缺氧条件在例如2007年8月10日的美国专利申请no.11/891,602中发酵可以在有描述。发酵可以如本文所述的批量、分批补料或连续方式来操作。如果需要的话,通过添加碱例如naoh或其他碱,或者酸可让培养基的ph维持在想要的ph,特别是中性ph,例如约7的ph,根据需要维持培养基在一个想要的ph。生长速率可以通过用分光光度计(600nm)测量光密度来确定,而葡萄糖摄入速率通过监测随着时间推移碳源的消耗来确定。相应地,鉴于本文提供的教导和指导,本领域技术人员可以理解,可以产生非天然存在的微生物,其分泌本发明的生物合成化合物,当它们在碳源例如合成气、甲醇或者co、co2、氢的组合等等中生长时。这样的化合物包括,例如,1,3-丁二醇以及1,3-丁二醇途径中的任意的中间代谢物。所有这一切都需要加工一种或多种所需的酶或蛋白活性以获得想要的化合物或中间产物的生物合成,其包括,例如,包括1,3-丁二醇生物合成途径的部分或所有在内。本发明的非天然存在的微生物可以用本领域公知的方法来构建,如同本文示例的外源性表达至少一个编码足够量生产1,3-丁二醇的1,3-丁二醇途径酶或蛋白的核酸。可以理解地,本发明的微生物充足地在一定条件下培养来产生1,3-丁二醇。按照本文提供的教导和指导,本发明的非天然发生的微生物可以达到细胞内浓度大约0.1-200mm或更多的1,3-丁二醇的生物合成。通常地,1,3-丁二醇的细胞内浓度大约3-150mm之间,特别地大约5-125mm之间,以及更特别地大约8-100mm之间,包括大约10mm、20mm、50mm、80mm、或者更多。细胞内浓度在这些示例性范围之间或高于这些示例性范围也可以从本发明的非天然存在的微生物中得到。在一些实施方式中,培养条件包括厌氧或基本上厌氧生长或者养护条件。示例性厌氧条件先前已有描述且是本领域公知的。发酵过程的示例性厌氧条件在本文中有描述,且在例如2007年8月10日的美国专利申请2009/0047719中有描述。这些条件中的任何一个可以应用于非天然发生的微生物以及本领域公知的其他厌氧条件。在这样的厌氧条件下,1,3-丁二醇发生器可以合成细胞内浓度5-10mm或更多以及本文所有的其他示例性浓度的1,3-丁二醇。可以理解地,即使以上描述是指细胞内浓度,但是1,3-丁二醇产生微生物可以细胞内产生1,3-丁二醇和/或将产物分泌到培养基中。除了本文公开的培养和发酵条件以外,取得1,3-丁二醇的生物合成的生长条件可以包括培养条件中渗透保护剂的添加。在某些实施方式中,本发明的非天然存在的微生物可以在有渗透保护剂的情况下如本文所述的存活、培养或发酵。简单地说,渗透保护剂是指一种作为渗透剂的化合物,且帮助本文所述的微生物在渗透胁迫下存活。渗透保护剂包括,但不限于,甜菜碱、氨基酸和海藻糖。这样的物质的非限制性实例是甘氨酸甜菜碱、脯氨酸甜菜碱、二甲基噻亭、二甲基巯基丙酸、3-二甲基巯基-2-甲基丙酸、哌啶酸、二甲基巯基乙酸、胆碱、l-卡尼汀和四氢嘧啶。一个方面,渗透保护剂是甘氨酸甜菜碱。本领域技术人员可以理解适合于保护本文所述的微生物的渗透保护剂的量和类型依赖于所用的微生物。培养条件中的渗透保护剂的量可以,例如,不超过约0.1mm、不超过约0.5mm、不超过约1.0mm、不超过约1.5mm、不超过约2.0mm、不超过约2.5mm、不超过约3.0mm、不超过约5.0mm、不超过约7.0mm、不超过约10mm、不超过约50mm、不超过约100mm,或者不超过约500mm。培养条件包括,例如,液体培养过程以及发酵和其他大规模培养过程。如本文所述,本发明的生物合成产物的特别令人满意的产率可以从厌氧或者基本上厌氧的培养条件中获得。如本文所述,为了达到1,3-丁二醇的生物合成,一个示例性生长条件包括厌氧的培养或者发酵条件。在某些实施方式中,本发明的非天然存在的微生物可以在厌氧或基本上厌氧的条件下存活、培养或者发酵。简单地说,厌氧条件是指一个没有氧的环境。基本上厌氧的条件包括,例如,培养基中溶解的氧浓度保持在0至10%的饱和度的培养、批发酵或连续发酵。基本上厌氧的条件还包括在维持少于1%的氧的气氛的密封室中的液体培养基或固体琼脂上生长或休眠细胞。氧的百分比的维持可以,例如通过用n2/co2混合物或其他合适的非氧气体喷射培养物。本文描述的培养条件可以规模化并连续生长用于生产1,3-丁二醇。示例性的生长过程包括,例如,分批补料发酵和批分离;分批补料发酵和连续分离,或者连续发酵和连续分离。所有的这些方法都是本领域公知的。发酵过程对商业化数量的1,3-丁二醇的生物合成生产特别有用。通常地,像用非连续培养方法一样,1,3-丁二醇的连续和/或近连续生产包括在充足的营养物和培养中培养本文的非天然存在的1,3-丁二醇生产有机体以维持和/或几乎维持指数生长。这样的条件下的连续培养可以包括,例如,生长1天、2、3、4、5、6或7天或更长。此外,连续培养可以包括较长的一段时间:1周、2、3、4、或者5或者更多周直至数月。可选地,本发明的有机体可以培养数小时,如果适合用于特定应用。可以理解地,连续和/或近连续培养条件还包括在这些示例性时期之间的所有时间间隔。进一步可以理解,为了想要的目的,培养本发明的微生物的时间是足够长的一段时间以产生足量的产物。发酵方法是本领域公知的。简单地说,用于1,3-丁二醇的生物合成生产的发酵可以用于,例如,分批补料发酵和批分离;分批补料发酵和连续分离,或者连续发酵和连续分离。分批和连续发酵方法的实例是本领域公知的。除了上述使用本发明的1,3-丁二醇发生器用于大量1,3-丁二醇的连续性生产的发酵方法以外,1,3-丁二醇发生器还可以,例如同时接受化学合成步骤以将产物转化为其他化合物,或者如果需要,产物可以从发酵培养物中分离,继而接受化学转化以将产物转化为其他化合物。为了产生更好的发生器,可以利用代谢建模来优化生长条件。建模可以用于设计基因敲除,其额外地优化途径的利用(参见,例如,美国专利申请us2002/0012939、us2003/0224363、us2004/0029149、us2004/0072723、us2003/0059792、us2002/0168654和us2004/0009466,以及美国专利no.7,127,379)。建模分析可以可靠地预测朝向更有效的1,3-丁二醇生产的代谢改变对细胞生长的影响。一种用于鉴定和设计有利于期望产物的生物合成的代谢改变的计算方法是optknock计算构架(burgard等人,biotechnol.bioeng.84:647-657(2003))。optknock是一个代谢建模和模拟程序,其启示基因删除或破坏策略从而产生遗传稳定的微生物,所述微生物过度生产目标产物。特别地,为了启示强迫期望的生物化学品成为细胞的必然产物的基因操作,该构架检查微生物的完整的代谢和/或生物化学网络。通过战略性地放置基因删除或其他功能性基因破坏让生物化学生产与细胞生长相偶联,生物反应器中生长选择压力施加于加工的菌株上一段长的时间后导致性能的提高,其作为强制生长偶联的生物化合生产的一个结果。最后,当构建基因删除时,设计的菌株恢复到它们的野生型的可能性可以忽略,因为由optknock选择的基因是完全地从基因组中移除了的。因此,这种计算方法学可以用于鉴定导致想要产物的生物合成的可选途径,或者用于非天然存在的微生物之间的连接以进一步优化想要产物的生物合成。简而言之,本文所用的术语optknock是指一种用于构建细胞代谢模型的计算方法和系统。optknock程序涉及一种模型和方法的框架,其并入特别的限制到通量平衡分析(fba)模型中。这些限制包括,例如,定性动力学信息、定性调控信息和/或dna微阵列实验数据。optknock还计算各种代谢问题的解决方案,通过,例如,收紧通过通量平衡分析模型得出的通量边界,随后用探针探测在存在基因添加或删除情况下的代谢网络的性能限制。optknock计算框架允许模型公式化的构建使代谢网络的性能限制得到有效的查询,并且提供解决由此产生的混合的整数线性规划问题的方法。如本文的optknock的这种代谢建模和模拟法在,例如,2002年1月10日的美国专利公开号2002/0168654,2002年1月10日的国际专利号pct/us02/00660,以及2007年8月10日的美国专利公开号2009/0047719中有描述。另一个用于鉴定和设计有利于想要产物的生物合成的代谢改变的计算方法是一个叫做的代谢建模和模拟系统。这个计算方法和系统在,例如2002年6月14日的美国专利公开号2003/0233218,以及2003年6月13日的国际专利申请号pct/us03/18838中有描述。是一个可以用于制造一个电子(insilico)网络模型并模拟物质、能量或电荷的通量的计算系统,其通过生物系统的化学反应来定义系统中包含化学反应的任一和所有可能的功能性的解空间,从而为生物系统确定一个允许的活性范围。这种方法被称为基于限制的建模,因为解空间是由限制例如已知的内含反应以及与通过反应的最大通量有关的反应热力学的和能力的限制的化学计量学来确定的。可以询问由这些限制确定的空间来确定生物系统或者其生物化学元件的表型的能力和行为。这些计算方法符合生物学现实,因为生物系统是灵活的且可以以许多不同的方式达到相同的结果。生物系统通过进化机制来设计,所述进化机制被所有有生命的系统都必须面对的基本限制所约束。因此,基于限制的建模策略包含这些普遍现实。进一步地,通过限制的收紧来将进一步的限制连续强加给网络模型的能力导致解空间的大小的减小,从而提高生物学性能或表型的可预见的精度。鉴于本文提供的教导和指导,本领域技术人员能够应用各种计算框架用于代谢建模和模拟以设计和实现想要化合物在宿主微生物中的生物合成。这样的代谢建模和模拟方法包括,例如,以上示例的计算系统如和optknock。为了说明本发明,本文描述了关于optknock计算框架用于建模和模拟的一些方法。本领域技术人员知道如何使用optknock来将代谢改变的鉴定、设计和执行应用到任意的本领域公知的其他代谢建模和模拟计算框架和方法中。以上描述的方法将提供一组代谢反应的破坏。组内各反应的消除或代谢修饰可以导致在有机体的生长期间期望的产物成为强制性产物。因为反应是已知的,双相optknock问题的解决方法还将提供关联的基因,所述基因编码一种或多种催化反应组内的各反应的酶。反应组和它们相应的编码参与各反应的酶的基因的鉴定通常是一个自动化过程,通过反应与具有酶和编码基因之间的关系的反应数据库的相关性来实现。一旦经鉴定,为了实现期望产物的生产,通过至少一个编码组内各代谢反应的基因的功能性破坏而将破坏的反应组应用于靶细胞或有机体中。一个实现反应组的功能性破坏的特别有用的方法是通过各编码基因的删除。但是,在某些情况下,通过其他遗传变异来破坏反应可以是有益的,包括,例如,突变、调节区例如启动子或用于调节因子的顺式结合位点的删除,或者通过许多位点中的任何一个位点上的编码序列的截断。这些近来的少于基因集的整体删除的畸变可以是有用的,例如,当期望一个产物的结合的快速评估时或者当遗传回复不太可能发生时。为了确定上述的双相optknock问题的其它有效解决方案,其导致更多的反应组的破坏或代谢修饰进而可以导致生物合成,包括想要产物的生物偶联的生物合成,可以应用一个称为整数切割(integercuts)的优化方法。这个方法从用一个另外限制的并入来迭代地解决上述示例的optknock问题开始,所述限制指的是每次迭代的整数切割。整数切割限制有效地阻止了解决程序选择与经鉴定的先前任一迭代完全一样的反应组,所述迭代必须让产物生物合成与生长相偶联。例如,如果先前鉴定的生物偶联的代谢修饰指定反应1、2和3用于破坏,然后接下去的限制阻止相同的反应同时地被考虑在随后的解决中。整数切割方法是本领域公知的,且可以在以下的描述中找到,例如burgard等人,biotechnol.prog.17:791-797(2001)。与本文描述的所有方法关于它们与optknock计算框架相结合用于代谢建模和模拟一样,在迭代计算分析中的减少冗余的整数切割方法也可以与其他本领域公知的其他计算框架一起使用,例如本文示例的方法允许细胞和有机体的构建,其生物合成生产期望的产物,包括靶生物化学产物的生产与加工成包含经鉴定的遗传改变的细胞或有机体的生长强制性的偶联。因此,本文描述的计算方法允许代谢修饰的鉴定和实现,其由选择或在电子(insilico)方法来鉴定。代谢修饰集合可以包括,例如,一个或多个生物合成途径酶的添加和/或一个或多个代谢反应的功能性破坏,例如,基因删除的破坏。如上述讨论的,optknock方法学的开发的前提是,当接受长时间的生长选择时,突变型微生物网络可以向它们计算地预想的最大生长表型进化。换言之,该方法利用有机体在选择压力下的自我优化能力。optknock框架允许基于网络化学计量学的强迫生物化学生产和细胞生长之间的偶联的基因删除组合的穷尽枚举。优化的基因/反应敲除的鉴定要求双相优化问题的解决,其选择一组活性反应使得用于所得网络的优化的生长溶液有兴趣过度生产生物化学品(burgard等人,biotechnol.bioeng.84:647-657(2003))。一个大肠杆菌代谢的电子(insilico)化学计量学模型可以用于鉴定先前示例的代谢途径的必要基因,且被描述在,例如,美国专利公开号us2002/0012939、us2003/0224363、us2004/0029149、us2004/0072723、us2003/0059792、us2002/0168654和us2004/0009466,以及在美国专利no.7,127,379中。如本文所公开的,optknock的数学框架可以用于精确地找到导致生长偶联的想要产物的生产的基因删除。进一步地,双相optknock问题的解决只提供一组的删除。为了列举所有有意义的解决方案,即导致生长偶联的生产形成的所有组,我们可以应用一种被称为整数切割的优化技术。这需要用一个另外限制的并入来迭代地解决optknock问题,所述限制指的是每次迭代的整数切割,如上面所讨论的。如本文所公开的,编码1,3-丁二醇途径的期望活性的核酸可以引入到宿主有机体中。在某些情况下,我们想要修饰1,3-丁二醇途径酶或蛋白的活性来增加1,3-丁二醇的生产量。例如,增加蛋白或酶的活性的已知突变可以引入到编码核酸分子。此外,优化方法可以用于增加酶或蛋白的活性和/或降低抑制活性,例如,降低负调控子的活性。一种这样的优化方法是定向进化。定向进化是一个有力的方案,其使突变的引入靶向特定的基因以改善和/或改变酶的性能。改善的和/或改变的酶可以通过允许许多酶变异的自动筛选的敏感的高通量筛选分析的发展和执行来鉴定(例如,>104)。诱变和筛选的迭代轮的执行典型地是为了提供最优化性能的酶。有助于鉴定诱变的基因区域的计算算法也已经得到发展并且可以现住地减少酶变异的数量,其需要产生和筛选。很多定性进化技术已得到开发(综述,参见hibbert等人,biomol.eng22:11-19(2005);huisman和lalonde,inbiocatalysisinthepharmaceuticalandbiotechnologyindustriespgs.717-742(2007),patel(ed.),crcpress;otten和quax.biomol.eng22:1-9(2005).;和sen等人,applbiochem.biotechnol143:212-223(2007)),其有效的用于建立多元化的变种库,并且这些方法已经成功地用于许多酶类的大量性能的改善。通过定向进化技术而得以改善和/或改变的酶的特性包括,例如,选择性/特异性,用于非天然底物的转化;温度稳定性,用于强大的高温处理;ph稳定性,用于较低或较高ph条件下的生物处理;底物或产物的耐受性,以便可以达到高的产物滴度;结合(km),包括扩大底物结合包含的非天然底物;抑制(ki),以移除产物、底物或关键中间产物的抑制作用;活性(kcat),以增加酶促反应以达到想要的通量;表达水平,以增加蛋白产率和全部的途径通量;氧稳定性,为了有氧条件下的空气敏感性酶的操作;以及厌氧活性,用于缺少氧的情况下的需氧酶的操作。为了特定酶的期望性能,许多示例性方法已被开发用于基因的诱变和多样化。这样的方法对于本领域技术人员来说是公知的。它们中的任一个可以用于改变和/或优化1,3-丁二醇途径酶或蛋白的活性。这样的方法包括,但不限于:eppcr,其通过在pcr反应中减少dna聚合酶的保真度来引入随机点突变(pritchard等人,jtheor.biol.234:497-509(2005));易错滚环扩增法(eprca),其与eppcr类似,除了整个环状质粒用作模板,以及随机6聚体以外切核酸酶抗性硫代磷酸连接至最后2个核苷酸上用于扩增质粒,随后转化进细胞,其中质粒是以连续重复重新环化(fujii等人,nucleicacidsres.32:e145(2004);和fujii等人,nat.protoc.1:2493-2497(2006));dna或家族改组,典型地涉及用核酸酶例如dnasei或endov消化两个或更多的变异基因以产生随机片段池,其通过存在dna聚合酶下的退火和延伸的循环而重新集合以建立嵌合基因文库(stemmer,procnatlacadsciusa91:10747-10751(1994);和stemmer,nature370:389-391(1994));交错延伸(step),其需要模板启动,随后是变性和很短时间(短至5秒)的退火/延伸的2步pcr的重复循环(zhao等人,nat.biotechnol.16:258-261(1998));随机引导重组(rpr),其中随机序列引物用于产生许多与模板的不同段互补的短dna片段(shao等人,nucleicacidsres26:681-683(1998))。另外的方法包括异源双链重组,其中线形化的质粒dna用于形成异源双链体,其通过错配来制备(volkovetal,nucleicacidsres.27:e18(1999);和volkov等人,methodsenzymol.328:456-463(2000));过渡模板随机嵌合(rachitt),其使用单链dna(ssdna)的dnasei片段化和大小分离(coco等人,nat.biotechnol.19:354-359(2001));截短模板重组延伸(rett),其中在用作模板池的单向ssdna片段的存在下使用单向生长链的模板转换(lee等人,j.molec.catalysis26:119-129(2003));退化寡核苷酸基因转移(dogs),其中退化引物用于控制分子间的重组;(bergquist和gibbs,methodsmol.biol352:191-204(2007);bergquist等人,biomol.eng22:63-72(2005);gibbs等人,gene271:13-20(2001));用于建立杂合酶的增长截短(itchy),其建立具有感兴趣的基因或基因片段的1个碱基对缺失的组合文库(ostermeier等人,proc.natl.acad.sci.usa96:3562-3567(1999);和ostermeier等人,nat.biotechnol.17:1205-1209(1999));用于建立杂合酶的硫代增长截短(thio-itchy),其类似于itchy,除了硫代磷酸酯dnt用于产生截短(lutz等人,nucleicacidsres29:e16(2001));scratchy,其组合重组基因的两种方法,itchy和dna改组(lutz等人,proc.natl.acad.sci.usa98:11248-11253(2001));随机漂变(rndm),其中经eppcr造成突变后筛选/选择保留有用活性的那些(bergquist等人,biomol.eng.22:63-72(2005));序列饱和突变(sesam),这是一种随机突变方法,其通过硫代磷酸酯核苷酸的随机整合和切断而产生随机长度片段池,被用作模板以在“通用”碱基例如肌苷存在下延伸,并且含肌苷互补物的复制导致随机碱基整合并从而突变(wong等人,biotechnol.j.3:74-82(2008);wong等人,nucleicacidsres.32:e26(2004);和wong等人,anal.biochem.341:187-189(2005);合成改组,其利用设计为编码“靶标中所有遗传多样性”的重叠寡核苷酸并允许改组后代的非常高的多样性(ness等人,nat.biotechnol.20:1251-1255(2002));核苷酸交换和切除技术next,其利用dutp整合的组合随后用尿嘧啶dna糖苷酶处理然后哌啶以进行终点dna片段化(muller等人,nucleicacidsres.33:e117(2005))。进一步的方法包括不依赖序列同源性的蛋白重组(shiprec),其中用一个接头以利于两个远距离相关或不相关基因的融合,而这两个基因之间产生一个范围的嵌合体,导致产生单-杂交杂合体文库(sieber等人,nat.biotechnol.19:456-460(2001));基因位点饱和突变(genesitesaturationmutagenesistm,gssmtm),其中起始材料包括超螺旋双链dna(dsdna)质粒,包含插入片段和两个引物,后者在突变的需要位点退化(kretz等人,methodsenzymol.388:3-11(2004));组合盒式诱变(ccm),其中涉及用短寡核苷酸盒以大量可能的氨基酸序列改变取代有限的区域(reidhaar-olson等人methodsenzymol.208:564-586(1991);和reidhaar-olson等人science241:53-57(1988));组合多盒式诱变(cmcm),其基本上类似于ccm并利用eppcr以高突变率鉴别热点和热点区域并然后通过cmcm延伸以覆盖蛋白序列空间的确定区域(reetz等人,angew.chem.int.edengl.40:3589-3591(2001));突变株技术,其中条件性ts突变子质粒以允许在选择时随机增加20至4000-x和天然突变率并在不需要选择时封闭缺失突变的积累,其中所述质粒使用mutd5基因,其编码dna聚合酶iii的变异亚基。(selifonova等人,appl.environ.microbiol.67:3645-3649(2001));low等人,j.mol.biol.260:359-3680(1996))。其他示例性方法包括透视突变(ltm),这是一种多二维突变方法,其评估并优化选择氨基酸的组合突变(rajpal等人,proc.natl.acad.sci.usa102:8466-8471(2005));基因拼装,这是一种dna改组方法,可以用于同时多个基因或建立单一基因的嵌合体(多突变)的大型文库(tunablegenereassemblytm(tgrtm)technologysuppliedbyvereniumcorporation),电子(insilico)自动蛋白设计(pda),这是一种优化算法,其锚定具有特定折叠的结构确定的蛋白骨架,并搜索能稳定所述折叠和整个蛋白的能量的氨基酸取代的序列空间,并通常最有效地用于已知三维结构的蛋白(hayes等人,proc.natl.acad.sci.usa99:15926-15931(2002));和迭代保护突变(ism),其设计用结构/功能的知识来选择酶改进的类似位点,在选定位点用突变方法例如stratagenequikchange(stratagene;sandiegoca)进行饱和突变,筛选/选择期望的性能,并用改进的克隆,在另一个位点开始以继续重复直到达到期望的活性(reetz等人,nat.protoc.2:891-903(2007);和reetz等人,angew.chem.int.edengl.45:7745-7751(2006))。任何前文提及的突变方法可以单独或以任何组合使用。另外,定向进化方法的任何一个或组合可以用于与适应性进化技术结合,如本文所述。应当理解基本上不影响本发明的各种实施方式的活性的修饰也包括在本文提供的本发明的定义之内。从而,下述实施例仅用于示意而不限制本发明。实施例i利用甲醇、co和/或co2作为碳源生产1,3-bdo该实施例展示了天然存在的有机体如何被构建为能够从甲醇、co和/或co2作为碳源生产1,3-bdo。克隆和表达过程的第一步是在大肠杆菌中表达从甲醇生产me-thf所需要的最小基因集(例如,mtaa、mtab和mtac)。这些甲基转移酶活性需要辅酶b12(钴胺素)作为辅因子。在热醋穆尔氏菌中,甲基转移酶蛋白的级联介导了将源自甲醇的甲基基团整合进入乙酰辅酶a合酶途径。近来的工作(das等人,proteins67.1:167-176(2007))表明mtaabc由moth_1208-09和moth_2346编码。这些基因通过校对pcr来克隆并连接在一起以在高拷贝数载体例如pze22-s中在可抑制启动子pa1-laco1的控制之下表达。克隆的基因通过pcr和/或限制性酶图谱来鉴定以验证所述3-基因集构建和插入至表达载体中。进行假定克隆的dna测序以确认每个基因的期望序列。一旦确认后,最终的构建体在大肠杆菌k-12(mg1655)细胞中通过加入0.05至1mm之间的终浓度的iptg诱导剂来表达。克隆的基因的表达用全细胞提取物的sds-page来监控。为了最优化可溶vs.颗粒(可能来源于包涵体)蛋白的水平,检测这些水平下的启动子的滴度的影响。如果未获得可接受的表达,测试更高或更低拷贝数目的载体或启动子强度的变体。为了确定来自热醋穆尔氏菌的mtaabc蛋白的表达在大肠杆菌中是否保留了将来自甲醇的甲基基团转移至四氢叶酸(thf)的能力,转化株在各种浓度下加料甲醇。甲基转移酶系统的活性在厌氧条件下进行分析,如前所述在热醋穆尔氏菌中以香子兰酸作为甲基来源(naidu和ragsdale,j.bacteriol.183.11:3276-3281(2001))或用于巴氏甲烷八叠球菌甲醇甲基转移酶(sauer等人,eur.j.biochem.243.3:670-677(1997);tallant等人,j.biol.chem.276.6:4485-4493(2001);tallant和krzycki,j.bacteriol.179.22:6902-6911(1997);tallant和krzycki,j.bacteriol.178.5:1295-1301(1996))。对于阳性对照,平行培养热醋穆尔氏菌细胞并厌氧分析以确认内源性甲基转移酶活性。对外源性加入的辅酶b12的依赖的证据确认了大肠杆菌中甲醇:类咕啉甲基转移酶的活性。一旦实现甲基转移酶的表达,进行进一步的工作以优化表达。滴定表达载体中的启动子使得能够测试表达水平的范围。从而这被用作在单一拷贝中所需的表达的标引,或者允许确定单一拷贝的这些基因是否允许足够的表达。如果这样,甲基转移酶基因被整合进入染色体作为单一的合成性操纵子。这可以使用基于recet的“重组工程(recombineering)”来完成靶向整合(angrand等人,nucleicacidsres.27.17:e16(1999);muyrers等人,nucleicacidsres.27.6:1555-1557(1999);zhang等人,nat.genet.20.2:123-128(1998))。基于recet的级联整合和以frt或loxp为边界的通过flp或cre的选择标记的潜在问题是在每个整合位点产生重组痕迹。虽然由此引起的问题可以通过多种方法来最小化,但不留下遗传痕迹的其它方法也可以使用。标准选择是用整合性“自杀”质粒来引入需要的基因,所述质粒涉及反向选择例如由bacillussacb基因所提供(link等人,j.bacteriol.179.20:6228-6237(1997));这样,在大肠杆菌染色体中的任何位点的无标记和无痕迹的插入都可以产生。最终目的是大肠杆菌k-12,其在可诱导启动子下以单拷贝(染色特整合)表达甲醇:类咕啉甲基转移酶活性。通过标准pcr方法,整个acs/codh操纵子被组装进入低或中等拷贝数目在载体例如pza33-s(基于p15a)或pzs13-s(基于psc101)。正如对甲基转移酶基因的描述,确认了克隆的基因的结构和序列。表达通过在提供必需金属(ni、zn、fe)和辅酶b12的严格厌氧条件下生长的全细胞溶解物的蛋白凝胶电泳来监控。如果需要,基因簇修饰为适合大肠杆菌表达,通过鉴别和移除任何明显的终止子和引入选自已知在大肠杆菌中有效的位点的一致性核糖体结合位点(barrick等人,nucleicacidsres.22.7:1287-1295(1994);ringquist等人mol.microbiol.6.9:1219-1229)。然而,每个基因簇以平行于其自身结构和表达的方式来克隆和表达。这有助于确保各种基因产物之间的化学计量——哪个最多的相互之间作用。一旦达到codh/acs基因簇在厌氧条件下的满意表达,分析细胞表达这些基因以固定co和/或co2进入细胞内碳的能力。初始条件使用严格的厌氧生长细胞,提供异源葡萄糖通过底物水平的磷酸化或厌氧呼吸以硝酸盐作为电子受体而作为碳源和能量来源。另外,可以向培养基加入外源性提供的ch3-thf。在也表达甲醇甲基转移酶系统的细胞中克隆和表达acs/codh基因。这可以通过将表达acs/codh的兼容性质粒引入表达mtr的细胞而实现。为了加入长期稳定性,acs/codh和mtr基因可也以整合进入染色体中。在制作能够利用甲醇生产me-thf和表达活性acs/codh基因的大肠杆菌菌株之后,分析其利用甲醇和合成气两者整合进入乙酰辅酶a,乙酸和细胞量的能力。初始条件使用严格厌氧生长的细胞并提供外源性葡萄糖作为碳源和能量来源。可选地,或作为葡萄糖的补充,可以向发酵液加入硝酸盐以作为电子受体和生长起始子。大肠杆菌在脂肪酸上的厌氧生长,已经在存在硝酸盐下得到证实,其中脂肪酸被最终代谢进入乙酰辅酶a(campbell等人,mol.microbiol.47.3:793-805(2003))。也可以提供氧气,如果细胞内水平保持在工程酶的抑制临界值之下。向细胞提供13c-标记的甲醇,13c-标记的碳酸氢盐或13c-标记的co并使用质谱分析以测量标记的碳整合进乙酸和细胞量(例如,蛋白氨基酸)。一个用于加工甲醇甲基转移酶系统的可选或补充方案包含加工wood-ljungdahl途径的甲基分支以给acs/codh提供甲基。大肠杆菌具有编码能够执行一些必需活性的酶的基因(fdh、metf、fold),它已表明来自产乙酸菌的甲基分支酶可能局域显著地更高(50–100x)特异性活性,与来自非产乙酸菌的那些相比(morton等人,geneticsandmolecularbiologyofanaerobicbacteriaspringerverlag,newyork)。热醋穆尔氏菌版本包括甲酸脱氢酶(fdha,moth_2312–moth_2313alpha,moth_2314beta),甲酰-四氢叶酸(thf)合成酶(moth_0109),次甲基-thf环水解酶/亚甲基-thf脱氢酶(fold,moth_1516),亚甲基-thf还原酶(metf,moth_1191),和甲基转移酶(acse,moth_1197)。除了将被克隆作为codh/acs簇的一部分的甲基转移酶(acse,moth_1197)以外,这些基因被克隆并结合到一个设计用于表达这些作为一套的表达性载体中。将如上所述地进行甲基分支基因的克隆和表达。最初,将选择高或中等拷贝数的载体(使用cole1或p15a复制子)。这些基因也可以整合到大肠杆菌染色体中。来自热醋穆尔氏菌、非洲脱硫弧菌和大肠杆菌的丙酮酸铁氧化还原蛋白氧还原酶基因可以在菌株中克隆并表达,展现acs/codh活性。条件、启动子等如上所述。鉴于pfor基因的大尺寸和相应的酶的氧敏感性,可以使用低或单拷贝质粒载体或者单拷贝染色体整合来进行试验。参考文献(furdui和ragsdale,j.biol.chem.275.37:28494-28499(2000))中描述的活性分析可以用于证明活性。此外,在缺少外源性电子接受体的情况下,在气态碳源中的生长的论证将提供更多关于体内pfor活性的证据。宿主有机体的内源性氢利用的氢化酶活性可以通过在存在和缺少氢的条件下如上所述的生长细胞来试验。如果观察到在发酵期间剧烈地移向更多还原产物形成的方向(例如,乙醇增加,与乙酸相反),这表明内源性氢化酶活性是足够活跃的。在这种情况下,没有异源性氢化酶被克隆和表达。如果自身的酶没有足够的活性或者减少需要的受体,那么编码单个氢化酶复合体的基因可以在菌株中克隆和表达,展现acs/codh活性。条件、启动子等如上所述。1,3-丁二醇合成需要的非自身的基因在表达型质粒上克隆,如前所述。宿主菌株也表达甲醇甲基转移酶活性、codh/acs活性,以及可能地pfor和氢化酶活性。在这一点上,这些(codh/acs等)基因可以整合到基因组中,并且可以用构成性的或用诱导剂的启动子来表达(即,pa1-laco1在含laci的细胞中是可诱导的,否则是构成性的)。一旦表达和1,3-bdo的产率得到优化,基础菌株可以通过这些基因在天然位点的单拷贝整合而得到进一步修饰。鉴于相对有限数量的酶(最少3,且最多4),人们可以构建编码所需基因的人工操纵子。这个操纵子可以用整合质粒引入,且与反向选择方法偶联,例如由bacillussacb基因提供的(link等人,j.bacteriol.179.20:6228-6237(1997))。在这种方式中,可以产生在大肠杆菌染色体的任何位点的无标记和无痕迹插入。优化涉及改变基因顺序以及核糖体结合位点和启动子。为了过表达任何的自身基因,例如,大肠杆菌的自身atob(b2224)基因,其可以充当1,3-丁二醇生产所需的丙酮丁醇梭菌乙酰辅酶a[coa]乙酰转移酶的替代物,基于recet的方法用于整合更强的上游启动子。在atob的情况中,该基因是操纵子中的最后一个,而下一个下游基因(yfap)既是非必需的又是在相反方向。因此,极性应当不是问题。含选择标记例如壮观霉素抗性或氯霉素抗性侧邻于frt或loxp位点的盒被用于筛选强的构成性启动子(例如,pl)的引入。一旦获得正确的克隆并用qrt-pcr验证,flp或cre表达被用于筛选以frt或loxp为边界的标记的移除。实施例ii热醋穆尔氏菌acs/codh编码基因的克隆和表达该实施例描述了构建表达热醋穆尔氏菌acs/codh操纵子基因的大肠杆菌质粒,所述基因包括用于codh,acs,甲基转移酶,和类咕啉铁-硫蛋白。该实施例进一步描述了这些在大肠杆菌中的表达导致可观察的co氧化活性,甲基转移酶活性,和类咕啉铁-硫蛋白活性。最终,该实施例证实了大肠杆菌耐受高co浓度,并可能在来自热醋穆尔氏菌的co利用基因被表达的时候甚至消耗co。表达载体选自集合,其描述于lutz和bujard(lutz和bujard,nucleicacidsres.25.6:1203-1210(1997));它们具有竞争性复制子并保有一定范围的拷贝数目。另外,每个包含pra1-laco1;该t7早期基因启动子可以通过iptg诱导并能在iptg存在下导致非常高水平的转录而在其它条件下被抑制。acs/codh编码操纵子克隆自moth_1204(cooc)至moth_1197;也构建了第二版本,其包含仅moth_1203至moth_1197。这两个片段(10-11kbp)通过dna序列分析来确认。它们均构建于基于p15a和co1e1的载体,其具有中等到高拷贝数目。为了评估重组蛋白的最终浓度,用于co氧化,acs,甲基转移酶,和类咕啉fe-s分析的相同细胞提取物进行了sds-page随后是蛋白质印迹分析。所用的抗血清是多克隆抗体以纯化热醋穆尔氏菌acs/codh和mtr蛋白,并用碱性磷酸酶连结的山羊抗兔第二抗体显示。蛋白质印迹展示于图6。acs90和acs91中codh的量以50ng通过与对照条带对比而评价。一氧化碳氧化分析(seravalli等人,biochemistry43.13:3944-3955(2004))用于测试是否实现了来自热醋穆尔氏菌的codh编码基因的功能性表达。包含空载体或者表达“acs90”或“acs91”的载体的大肠杆菌mg1655培养物在极品肉汤中在厌氧条件下生长(补充氰钴胺,二价铁,和还原试剂)直到培养基达到高密度,这时候加入iptg至终浓度0.2mm以诱导启动子。在37℃下生长3.5小时后,收获细胞并旋转沉淀之后用溶菌酶和弱洗涤剂溶解。有一个热醋穆尔氏菌codh特殊活性的基准图,55℃下500u或25℃下约60u。该分析采用co存在下的甲基苄基紫精的还原。在有塞厌氧玻璃比色皿中在578nm下测量。codh的co氧化反应阳性造成深紫色(参见附图7)。蛋白质印迹评价约0.5%的细胞蛋白是codh;因此,表1中的数据是比纯的热醋穆尔氏菌codh的500u/mg活性少大约50x。无论如何,该实验清楚地证明了重组大肠杆菌中的co氧化活性,而在阴性对照中仅有少得多的量。阴性对照中观察到的少量co氧化(ch3苄基紫精的还原)表明大肠杆菌可能具有有限的降解ch3苄基紫精的能力。表1.粗提取物co氧化活性该分析是一个体外反应,其使用acs/codh、甲基转移酶和cfesp从甲基四氢叶酸、co和辅酶a合成乙酰辅酶a(raybuck等人,biochemistry27.20:7698-7702(1988))。通过添加或者删去涉及的每个酶,该分析可用于大范围的实验,从测试一个或多个纯化的酶或细胞提取物的活性,到测定各种条件下或者含限定量的底物或酶时该反应的动力学。在不同时间取的反应样品用1mhcl淬灭,其将乙酸从乙酰辅酶a终产物中释放出来。用dowex柱纯化后,乙酸可以用色谱法、质谱法或者用放射性测量来分析。确切的方法可以由反应中所用的特定底物来确定。为了确定在大肠杆菌中表达的acs/codh操纵子是否表达fe-s类咕啉蛋白活性,进行该分析。因此,14c-标记的甲基-thf用作标记底物,根据并入分离的乙酸样品中的放射性来测量乙酸合成。试验了6个不同的条件:1.作为阳性对照的纯化的acs/codh、metr和cfesp,2.纯化的acs/codh与acs90细胞提取物3.纯化的acs/codh与acs91细胞提取物4.纯化的acs/codh、metr与acs90细胞提取物5.纯化的acs/codh、metr与acs91细胞提取物6.纯化的acs/codh、metr与尽可能多的acs91细胞提取物(去除mes缓冲液)该反应装配在厌氧培养室中的充满co的检测瓶中。与瓶体积相比,总反应体积很小,在充满co前用气密的hamilton注射器加入试剂,并且试剂保持缺氧。反应(总共~60ul)由细胞提取物(除了#1之外)、辅酶a、钛(iii)柠檬酸盐、mes(除了#6之外)、纯化的acs/codh、14c-甲基-四氢叶酸、甲基紫精和铁氧化还原蛋白组成。此外,纯化的metr加入到#1、#4-6中,以及纯化的cfesp加入到#1中。该反应在厌氧培养室中的55°的沙浴中进行。最后加入的试剂是14c-甲基-四氢叶酸,其启动该反应(t=0s)。开始的样品马上取样,随后在30分、1小时和2小时取样。这些时间点不是精确的,因为6个条件是同时进行的(由于这实验是基本上定性的实验)。15μl样品加入到闪烁瓶中的15μl1mhcl中。计数反应混合物后,测得acs90提取物中的类咕啉fe-s蛋白具有总活力接近大约阳性对照的1/5的活性。在acs/codh操纵子内部是编码必需的甲基转移酶活性,其催化来自甲基-四氢叶酸的ch3转移到acs复合体中作为乙酰辅酶a的合成的一部分(即,这是甲基和羰基路径结合在一起的步骤)。在热醋穆尔氏菌的操纵子内部,mtr编码基因是moth_1197,并且在主要codh和acs亚基之后出现。因此,mtr活性将构成间接的证据,证明更多的近端基因可以得到表达。mtr活性用光谱学进行分析。特别地,甲基化的cfesp,含co(iii),在~450nm具有小的吸收峰,而非-甲基化的cfesp,含co(i),在~390nm具有大峰。该光谱是由于钴和铁硫簇生色团。此外,应当注意到,cfesp可以自发地氧化成co(ii),其产生~470nm处的宽的吸收峰(seravalli等人,biochemistry38.18:5728-5735(1999))。参见附图8,关于来自含acs90的大肠杆菌细胞的结果。为了测试是否大肠杆菌能在存在饱和量的co下厌氧地生长,我们制作了厌氧条件下的含50ml极品肉汤培养基(加上nicl2、fe(ii)nh4so4和氰钴胺)的120ml血清瓶。这些瓶中的一半用氮气平衡30分钟,而另一半用co气体平衡30分钟。一个空载体(pza33)被用作对照,并且它和acs90和acs91都用no和co测试。所有在摇床(250rpm)中37℃下生长36小时。在36小时的终点,瓶的检查显示在所有中都高度生长(附图9)。所观察到的生长的大部分发生在一夜之间,具有一定(低但是可见)密度的长的滞后。接种量是~0.5ml来自大肠杆菌原种。结果如表2所示。不管菌株在有co或没有co下培养,生长达到相似的水平(通过肉眼观察)。而且,阴性对照的最终co浓度是930微摩尔,相对地,acs/codh操纵子表达菌株是688和728微摩尔。显然,鉴于大的标准偏差,这些测量的误差是高的。然而,这个测试提供两个暂定的结论:1)大肠杆菌在缺氧条件下可以耐受接触co,和2)表达acs/codh操纵子的大肠杆菌细胞可能代谢一些co。第二个结论显著地没有第一个肯定。表2.一氧化碳浓度,36小时实施例iii用wood-ljungdahl途径酶增加糖的1,3-丁二醇产率在本实施例中,我们描述了非天然存在的微生物,其表达编码催化wood-ljungdahl途径的羰基分支的酶的基因。wood-ljungdahl途径酶将甲酸、co和/或co2形式的碳同化成乙酰辅酶a,其随后可以转化成有用的化学产物例如1,3-丁二醇。在其他底物例如葡萄糖中生长的期间,wood-ljungdahl途径还可以充当第二碳同化途径。特别地,1摩尔葡萄糖至2摩尔乙酰辅酶的转化生成还原当量和co2。wl途径酶可以利用还原当量以将co2和/或甲酸转化成额外的乙酰辅酶a,其可以进一步用于1,3-丁二醇形成。1,3-丁二醇可以通过本申请中先前描述的一些可选途径从乙酰辅酶a合成得到,且如附图4和5所示。源自葡萄糖的这些途径中的任意一个最大可达到1,3-丁二醇的产率是,例如,1mol/mol(0.5g/g),在缺少wood-ljungdahl途径酶的情况下。经wood-ljungdahl途径的co2额外的同化进一步提高产率到化学计量的理论最高限度1.09mol/mol(0.545g/g)。为了达到最大理论产率,预见的通量分布如附图10所示。此外,甲醇与碳水化合物例如葡萄糖共同补料以增加1,3-丁二醇的产率。例如,使用1.0:0.4比例的葡萄糖和甲醇使1mol1,3-丁二醇/mol葡萄糖(0.5g/g)增加到1.2mol1,3-丁二醇/mol葡萄糖。为了达到该增加的产率,预见的通量分布如附图11所示。实施例iv加工钴胺素合成进入有机体wood-ljungdahl途径的关键酶,acs/codh,需要钴胺素(维生素b12)起作用。b12在一些有机体中是从头合成的,但是对于其他有机体必须外源性提供。然而,其他有机体例如酿酒酵母缺乏有效摄取b12的能力。本实施例描述了一种加工从头合成b12的能力到有机体中的策略。b12生物合成途径已在一些有机体中被表征,所述有机体包括鼠伤寒沙门杆菌lt2(roth等人,j.bacteriol.175:3303-3316)、lactobacillusreutericrl1098(harms和thauer,eur.j.biochem.235:653-659(1996))和巨大芽胞杆菌(brey等人,j.bacteriol.167:623-630(1986))。细菌的b12生物合成途径涉及20-30基因一起簇生在一个或多个操纵子中。2条钴胺素生物合成途径:晚插入(late-insertion)(只能有氧的)和早插入(early-insertion)(厌氧的)已有描述(scott,a.i.,j.org.chem.68:2529-2539(2003))。维生素b12的生物合成的总产物是5’-腺苷谷氨酸(辅酶b12)和甲基钴胺素(mecbl)。维生素b12被确定为氰钴胺(cncbl),其是工业上通常制备得到的形式。在本实施例中,b12指的是三个类似分子的全部。厌氧钴胺素生物合成途径已在鼠伤寒沙门杆菌lt2中被很好的表征(roth等人,j.bacteriol.175:3303-3316)。途径基因簇生在一个称为cob操纵子的大操纵子上。含下列来自cob操纵子(par8827)的20个基因的质粒被转换到大肠杆菌中,并且赋予从头合成钴胺素的能力(raux等人,j.bacteriol.178:753-767(1996))。为了进一步提供钴啉胺酸母体的产率,作者移除已知的调控元件cbia并且改变rbs。基因和相关的genbank鉴定标记符和gi号如下所列。一些不能从头合成b12的有机体能够催化途径的某些步骤。例如,大肠杆菌不能合成钴啉环结构,但是编码催化途径中的某些反应的蛋白(raux等人j.bacteriol.178:753-767(1996))。cysg基因编码功能性cysg,一种将尿卟啉原iii转化成前咕啉-2的多功能酶(hugler等人,j.bacteriol.184:2404-2410(2002);ishige等人,appl.environ.microbiol.68:1192-1195(2002))。由cobtsu编码的蛋白将钴啉醇酰胺转化成钴胺素并且引入5’-脱氧腺苷基团(raux等人,出处同上(1996))。cobtnp_416495.116129932大肠杆菌k12sp.mg1655cobsnp_416496.116129933大肠杆菌k12sp.mg1655cobunp_416497.116129934大肠杆菌k12sp.mg1655cysgnp_417827.116131246大肠杆菌k12sp.mg1655酿酒酵母是不能从头合成b12的,也不能摄取可检测水平的维生素。但是,酿酒酵母基因组编码2个蛋白,met1p和met8p,其催化一些b12途径反应。met1p与鼠伤寒沙门杆菌的尿卟啉原iii甲基转移酶类似,其催化从尿卟啉原iii生物合成b12的第一步(raux等人,biochem.j.338(pt.3):701-708(1999))。met8p蛋白是具有尿卟啉原iii甲基转移酶活性和钴螯合酶(cobaltochelatase)活性的双功能蛋白,类似于巨大芽孢杆菌的cysg(raux等人,出处同上(1999))。met1pnp_012995.16322922酿酒酵母met8pnp_009772.16319690酿酒酵母这些基因的任一个或全部可以引入到缺少一个或多个钴胺素合成元件的有机体中以能够或者增加钴胺素合成的效率。实施例v加工有机体中的增强的钴胺素摄取能力本实施例描述加工b12摄取能力至宿主有机体中。b12摄取要求特殊的转运系统(sennett等人,annu.rev.biochem.50:1053-1086(1981))。大肠杆菌的b12转运系统已被广泛地研究。穿过外膜的高亲和力的转运是钙依赖的,且由一个66kda外膜孔蛋白,btub介导(heller等人,j.bacteriol.161:896-903(1985))。btub与tonb能量转导系统(tonb-exbb-exbd)相互作用,促进能量依赖的迁移以及结合到胞质结合蛋白btuf(wo/2007/141208;atsumi等人,nature451:86-89(2008))。穿过内膜的转运由btuf、btud(atp结合元件)和btuc(通透酶)组成的abc型摄取系统来推进(binstock等人,meth.enzymol.71(pt.c):403-411(1981))。btucdf复合体的晶体结构是有用的(atsumi等人,出处同上(2008);binstock等人,出处同上(1981))。一个另外的蛋白,btue,共表达在btuced操纵子中,但是这个蛋白不需要b12转运,且它的功能是未知的(rioux等人,mol.gen.genet.217:301-308(1989))。btuced操纵子是构成性的表达的。与b12转运有关的基因的genbank鉴定标记符和gi号如下所列。btubnp_418401.116131804大肠杆菌k12sp.mg1655btucnp_416226.116129667大肠杆菌k12sp.mg1655btudnp_416224.116129665大肠杆菌k12sp.mg1655btufnp_414700.116128151大肠杆菌k12sp.mg1655tonbnp_415768.116129213大肠杆菌k12sp.mg1655exbbnp_417479.116130904大肠杆菌k12sp.mg1655exbdnp_417478.116130903大肠杆菌k12sp.mg1655有机体的b12摄取能力可以进一步通过编码必需转运蛋白的基因的过表达并且减少或消除负调控控制而得到提高。过表达btubcdf基因导致增加了的b12对膜的结合,且增加了的摄取进入细胞的速率。另一个策略是移除调控控制。btubmrna翻译直接地被b12在5’utr上抑制(nahvi等人,chem.biol.9:1043(2002))。该相互作用可能诱导mrna折叠以阻挡核糖体进入翻译起点。b12结合位点的突变或消除移除了抑制并提高了b12摄取的效率(美国专利no.6,432,686,bulthuis等人)。这些策略成功地用于提高1,3-pdo生产微生物中的b12摄取能力(wo/1999/058686)和(美国专利no.6,432,686,bulthuis等人)。一项最近的专利描述了通过删除负调控蛋白例如c.glutamicumbtur2以提高摄取的效率(wo/2008/152016)。鼠伤寒沙门杆菌同时具有高和低的亲和力的b12转运蛋白。高亲和力转运蛋白是由btub编码的(rioux等人,j.bacteriol.171:2986-2993(1989))。像大肠杆菌,穿过胞质膜的转运预计是同abc转运系统发生的,尽管这迄今为止还没有被表征。b12结合蛋白是由btud和btue编码的,而btuc推定是编码通透酶。btubaaa27031.1153891鼠伤寒沙门杆菌lt2btucnp_460306.116764691鼠伤寒沙门杆菌lt2btudnp_460308.116764693鼠伤寒沙门杆菌lt2btueaal20266.116419860鼠伤寒沙门杆菌lt2这些基因中的任一个或所有可以引入到缺少一种或多种钴胺素摄取元件的有机体中,以增加缺少的钴胺素摄取。在培养基中定量b12的方法。为了在培养基中定量b12的量,在hplc上跑无细胞的样品。钴胺素的定量通过以下操作来实现:在278nm和361nm下用标准品比较峰面积比,然后将峰面积应用于钴胺素的标准曲线中。贯穿本申请,各种出版物被引用在括弧中。为了更加充分地描述本发明的技术水平,这些出版物公开的全部内容被本文引用并作为本申请的参考。尽管已经用公开的实施方式描述了本发明,但是本领域技术人员将容易地理解上述的这些具体实施例和研究仅仅是用作本发明的说明。应当理解到,可以进行各种不脱离本发明的精神的修饰。相应地,本发明仅由下列权利要求来限制。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1