一种提高γ-聚谷氨酸产量的方法与流程
本发明属于发酵工程领域,具体涉及一种在发酵过程中提高γ-聚谷氨酸产量的方法。
背景技术:
γ-聚谷氨酸(γ-pga),是自然界中微生物发酵产生的水溶性多聚氨基酸,其结构为谷氨酸单元通过α-氨基和γ-羧基形成肽键的高分子聚合物,分子量分布在100kda到10000kda之间。具有优良的水溶性、超强的吸附性和生物可降解性,降解产物为无公害的谷氨酸,是一种优良的环保型高分子材料,可作为保水剂、重金属离子吸附剂、絮凝剂、缓释剂以及药物载体等。γ-聚谷氨酸(γ-pga)是一种微生物生产的安全、可降解高分子材料,具有优良的成膜性、粘结性和极强的吸水性和保水性,在医药、化妆品、农业、环保等领域有广泛的应用前景。干旱缺水是制约我国农业发展和导致土壤沙漠化的重要原因。聚谷氨酸可以改善土壤团聚结构、土壤持水能力,提高土壤形成水稳定性团聚体能力,有利于沙漠化土壤的改善。γ-聚谷氨酸能增加土壤透气性,可以提高植物根系对氮肥的利用率,增强肥料在根系的作用效果。同时,将一定浓度γ-聚谷氨酸溶液与农药混合喷洒到农作物表面,可以起到延长药物在植株叶面的停留、作用时间,增强药效。因此,该产品在各个领域有着巨大的潜在市场。
γ-pga的结构独特,很难通过化学方法合成;酶转化法虽然工艺路线简单、周期短,但合成的γ-pga相对分子质量较小,制约了该方法的实际生产应用;提取法制备γ-pga的含量不稳定且副产物多、成本也较高,不利于大规模生产,因此目前获得γ-pga最有效的途径是通过微生物发酵。目前多采用以芽孢杆菌属为生产菌,发酵产γ-pga。目前γ-聚谷氨酸的发酵研究集中于如何达到高效表达,可以通过筛选优良菌株、优化培养及发酵控制条件等方法来实现。
技术实现要素:
本申请的发明目的主要是针对优化发酵控制条件,提供一种在发酵过程中提高γ-聚谷氨酸产量的发酵条件控制方法。该方法通过地衣芽孢杆菌发酵产γ-聚谷氨酸,对菌龄、装液量、转速、接种量、ph值等影响γ-聚谷氨酸产量的因素进行优化,达到提高γ-聚谷氨酸产量的目的。
为了实现上述目的,本发明的具体技术方案为:
一种提高γ-聚谷氨酸产量的方法,该方法包括以下步骤:
1.1以产γ-聚谷氨酸的地衣芽孢杆菌为发酵菌株,挑取一环接种在lb斜面培养基上,恒温37℃,培养24h,进行活化和复壮;
1.2从培养好的新鲜斜面挑取一环接入一级种子液培养基,培养温度37℃、摇床转速220r/min,培养时间20h;
1.3将培养好的一级种子液,按10%接种量接入二级种子培养基中,培养温度37℃、摇床转速220r/min,培养时间20h。
采用的一级种子液培养基、二级种子培养基同lb培养基。
1.4将培养好的二级种子液按10%的接种量接入10l发酵罐中,装液量为6.5l,控制发酵起始转速220r/min,待发酵20h后上调转速至250r/min,并控制风量10l/min,当发酵过程中ph从初始ph7.4降低到6.0时,开始缓慢流加20%vol浓度氨水上调发酵液ph值至7.5,一直维持到发酵结束,γ-聚谷氨酸产量由未优化控制条件前的9g/l左右提高到22g/l,产量提升了150%。
本发明的积极效果体现在:
该发酵控制方法大大提高了γ-聚谷氨酸的产量,使γ-聚谷氨酸产量由未优化控制条件前的9g/l左右提高到22g/l,产量提升了150%。
附图说明
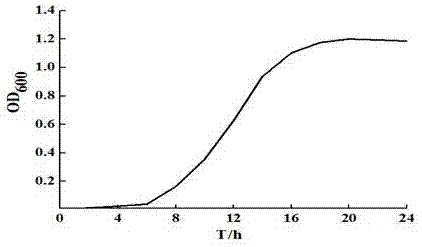
图1为培养时间对菌体浓度的影响曲线图。
图2为装液量对γ-pga产量的影响的柱状图。
图3为接种量对γ-pga产量的影响的柱状图。
具体实施方式
为了使本发明的发明目的、技术方案及优点更加清楚明白,下面结合具体实施方式对本发明作进一步的详细描述,但不应将此理解为本发明上述主题的范围仅限于下述实施例。
本申请中所采用的地衣芽孢杆菌均为四川省微生物资源平台菌种保藏中心购买的菌种,其菌种编号为sicc1.1024、sicc1.1023、sicc1.1009、sicc1.1008中的任意一个。
实施例1:
1.1从四川菌种保藏中心购买的一株产γ-聚谷氨酸的地衣芽孢杆菌,其菌种编号为sicc1.1024,以该菌株为发酵菌株,挑取一环接种在lb斜面培养基上,恒温37℃,培养24h,进行活化和复壮。
1.2从培养好的新鲜斜面挑取一环接入一级种子液培养基(lb培养基),培养温度37℃、摇床转速220r/min,培养时间20h。
1.3培养好的一级种子液,按10%接种量接入二级种子培养基中(lb培养基),培养温度37℃、摇床转速220r/min,培养时间20h。
1.4.将培养好的二级种子液按10%的接种量接入10l发酵罐中(装有6.5l发酵培养基),开始发酵。
1.510l发酵罐发酵过程中,发酵起始转速220r/min(发酵20h后上调转速250r/min)、风量10l/min、发酵过程中ph从初始ph7.4降低到6.0时,开始缓慢流加20%浓度氨水上调发酵液ph至7.5,一直维持到发酵结束,(发酵培养基为现有技术)。
1.6发酵过程中每隔12h取样一次,镜检,使用茚三酮法测定发酵液ph及γ-聚谷氨酸含量。
测定结果为:发酵结束,γ-聚谷氨酸产量为22g/l。
实施例2:
1.1从四川菌种保藏中心购买的一株产γ-聚谷氨酸的地衣芽孢杆菌,其菌种编号为sicc1.1023,以该菌株为发酵菌株,挑取一环接种在lb斜面培养基上,恒温37℃,培养24h,进行活化和复壮。
1.2从培养好的新鲜斜面挑取一环接入一级种子液培养基(lb培养基),培养温度37℃、摇床转速220r/min,培养时间20h。
1.3培养好的一级种子液,10%接种量接入二级种子培养基中(lb培养基),培养温度37℃、摇床转速220r/min,培养时间20h。
1.4.将培养好的二级种子液按10%的接种量接入10l发酵罐中(装有6.5l发酵培养基),开始发酵。
1.510l发酵罐发酵过程中,发酵起始转速220r/min(发酵20h后上调转速250r/min)、风量10l/min、发酵过程中ph从初始ph7.4降低到6.0时,开始缓慢流加20%浓度氨水上调发酵液ph至7.5,一直维持到发酵结束(发酵培养基为现有技术)。
1.6发酵过程中每隔12h取样一次,镜检,使用茚三酮法测定发酵液ph及γ-聚谷氨酸含量。
测定结果为:发酵结束,γ-聚谷氨酸产量为22g/l。
实施例3:
1.1从四川菌种保藏中心购买的一株产γ-聚谷氨酸的地衣芽孢杆菌,其菌种编号为sicc1.1009,以该菌株为发酵菌株,挑取一环接种在lb斜面培养基上,恒温37℃,培养24h,进行活化和复壮。
1.2从培养好的新鲜斜面挑取一环接入一级种子液培养基(lb培养基),培养温度37℃、摇床转速220r/min,培养时间20h。
1.3培养好的一级种子液,10%接种量接入二级种子培养基中(lb培养基),培养温度37℃、摇床转速220r/min,培养时间20h。
1.4.将培养好的二级种子液按10%的接种量接入10l发酵罐中(装有6.5l发酵培养基),开始发酵。
1.510l发酵罐发酵过程中,发酵起始转速220r/min(发酵20h后上调转速250r/min)、风量10l/min、发酵过程中ph从初始ph7.4降低到6.0时,开始缓慢流加20%浓度氨水上调发酵液ph至7.5,一直维持到发酵结束(发酵培养基为现有技术)。
1.6发酵过程中每隔12h取样一次,镜检,使用茚三酮法测定发酵液ph及γ-聚谷氨酸含量。
测定结果为:发酵结束,γ-聚谷氨酸产量为22g/l。
对比例1:
1.1以产γ-聚谷氨酸的地衣芽孢杆菌为发酵菌株,挑取一环接种在lb斜面培养基上,恒温37℃,培养24h,进行活化和复壮。
1.2从培养好的新鲜斜面挑取一环接入一级种子液培养基(lb培养基),培养温度37℃、摇床转速220r/min,培养时间24h。
1.3培养好的一级种子液,5%接种量接入二级种子培养基中(lb培养基),培养温度37℃、摇床转速220r/min,培养时间24h。
1.4.将培养好的二级种子液按5%的接种量接入10l发酵罐中(装有7l发酵培养基、转速220r/min、初始ph7.4),开始发酵。
1.510l发酵罐发酵过程中,不调整发酵液转速、ph,直至发酵结束。
1.6发酵过程中每隔12h取样一次,镜检,使用茚三酮法测定发酵液γ-聚谷氨酸含量。
结果表明,10l发酵罐发酵产γ-聚谷氨酸,未优化发酵控制条件,发酵72小时结束后,γ-聚谷氨酸产量8.4-9.0g/l左右。
对比例2:
采用与实施例1相同的方法步骤进行发酵产γ-聚谷氨酸,但是在步骤1.5,对转速控制进行调整,初始转速220r/min,发酵培养20h后,上调转速至250r/min,发酵结束后,γ-聚谷氨酸产量在11-12.5g/l左右。
对比例3:
采用与实施例1相同的方法步骤进行发酵产γ-聚谷氨酸,但是在步骤1.5,对发酵液ph值进行调整,发酵过程中ph从初始ph7.4降低到6.0时,开始缓慢流加20%浓度氨水上调发酵液ph至7.5,一直维持到发酵结束,γ-聚谷氨酸产量在15.6-17.2g/l。
试验1.以实施例1为基础,测定菌种种龄对菌体浓度的影响:
lb为种子液培养基,培养温度37℃、摇床转速(旋转式摇床)220r/min、装液量80ml/500ml,种子液培养时间24h,每隔两小时取样,测定od600。
具体结果如图1:当种子液培养时间在20h时,od600值最大,达到1.2,镜检菌体情况良好,故确定种龄为20h。
试验2.以实施例1为基础,测定装液量对γ-聚谷氨酸产量的影响
培养好的种子液按5%接种量,分别接到装液量60ml、80ml、100ml的发酵培养基中,220r/min、37℃、发酵72h,检测γ-pga含量。
具体结果如图2所示,装液量在80ml/500ml,发酵液中γ-pga的含量最高达到12.3g/l。
试验3.以实施例1为基础,测定接种量对γ-聚谷氨酸产量的影响
装液量80ml、37℃、220r/min,接种量5%、7.5%、10%接入发酵培养基中,发酵72h,测定γ-pga含量。
具体结果如图3所示,当接种量在10%,发酵液中γ-pga含量较高达到13g/l。
综上所述,确定了摇瓶发酵条件:装液量80ml/ml、往复式摇床转速118r/min、接种量10%,发酵液中γ-pga的含量达到13g/l。
试验4.以实施例1为基础,测定ph对γ-聚谷氨酸产量的影响,详细情况见表一和表二:
表一发酵液ph值与γ-聚谷氨酸产量
通过摇瓶实验数据可以看出,发酵液的ph值在接近中性的条件下(ph值6.9-7.6),发酵液中γ-pga的产量最高,接近9g/l左右,随着ph的上升,γ-聚谷氨酸产量下降。针对⑨、⑩、
表二发酵液ph值与γ-聚谷氨酸产量
经过重复性实验验证,发酵液ph值在7.5左右,摇瓶发酵液中γ-pga的含量最高。
试验5:10l发酵罐控制条件优化:
1.以摇瓶实验为基础依据,在10l发酵罐上进行进一步实验,种龄20h,接种量10%,初始转速220r/min(20h后上调转速到250r/min)、温度37℃,以发酵控制过程中的不调控ph的发酵罐为对照,发酵培养基初始ph7.4,其余发酵罐发酵20h后,ph下降到6.0时,开始流加20%氨水调控ph至发酵结束,分别控制四个不同的ph值:6.5、7.0、7.5、8.0。发酵结束后,测定发酵液中的γ-pga含量。实验结果如下:
表三10l发酵罐调控ph值与γ-聚谷氨酸产量
表四10l发酵罐调控ph值与γ-聚谷氨酸产量
表五10l发酵罐调控ph值与γ-聚谷氨酸产量
表六10l发酵罐调控ph值与γ-聚谷氨酸产量
通过以上实验数据表明,10l发酵罐发酵产γ-聚谷氨酸,发酵过程中不调控发酵ph,发酵72小时结束后,发酵液ph在6.0-6.3范围内,γ-聚谷氨酸产量8.4-9.0g/l左右。发酵过程中对ph进行调控,发酵液ph降低到6.0时,分别调控ph值为6.5、7.0、7.5、8.0,维持直至发酵结束,ph控制在7.5时,γ-聚谷氨酸的含量最高。
最终,经过10l发酵罐多批次的实验,确定了最佳发酵控制条件:种龄20h、接种量10%、装液量6.5l(10l发酵罐)、发酵起始转速220r/min(发酵20h后上调转速250r/min)、风量10l/min、发酵过程中ph从初始ph7.4降低到6.0时,开始缓慢流加20%浓度氨水上调发酵液ph至7.5,一直维持到发酵结束,γ-聚谷氨酸产量由未优化发酵控制条件前的9g/l左右提高到22g/l,产量提升了150%。该发酵控制方法,大大提高了γ-聚谷氨酸的产量。
- 还没有人留言评论。精彩留言会获得点赞!