一种提高卵母细胞体外成熟质量和效率的方法与流程
本发明涉及生物工程技术领域,具体涉及哺乳动物卵母细胞体外成熟效率的方法
背景技术:
卵母细胞体外成熟(ivm),是家畜胚胎生物技术的关键环节,也是体外受精技术(ivf)的重要组成部分。然而与体内环境相比,已有的卵母细胞ivm体系仍不完善,进而导致ivm卵母细胞的质量较低。大量研究表明,现有技术的方法中ivm卵母细胞的质量,例如受精能力、发育能力、胚胎移植后的产子能力,都显著低于体内成熟的卵母细胞(shijm等,jpinealres,2009;47(4):318-323;lonerganp等,annurevanimbiosci,2016;4:255-268)。ivm卵母细胞较低的质量和发育潜力,已经成为限制胚胎生物技术效率的瓶颈,亟待解决。
在体内环境下,家畜卵母细胞的生长和成熟都是在下丘脑-垂体-性腺轴分泌激素的精确调控进行的,这些激素包括垂体促卵泡素(fsh)、促黄体素(lh)、雌激素(e2)等。在牛发情周期中,fsh的浓度于发情前12天左右开始上升、在发情前1~2天出现峰值,而lh的浓度则在发情后12h急剧上升并达到峰值、之后处于较低水平。而e2的浓度则在发情前两天开始升高,发情开始12h后达到峰值,随后开始下降,且在发情后第5~9天出现第二个峰值。由此可见,在卵母细胞体内成熟过程中,上述调控卵母细胞成熟进程的激素水平是动态变化的。
目前,卵母细胞ivm体系是通过模仿家畜体内环境来配制的,一般都由基础液(m199)、血清(fbs)、以及生殖激素等构成,生殖激素包括fsh、lh、e2,其中fsh的作用可促卵丘细胞扩展、胞质成熟等,而lh可提高卵母细胞核成熟率、受精率和发育率。牛卵母细胞ivm程序通常为:将从卵巢表面获取的卵丘卵母细胞复合体(cocs)放入ivm液中,在38.5℃、5%co2培养箱中成熟24h,在该期间ivm体系无任何变化。
由于目前采用的牛卵母细胞体外成熟的方法,并不能为卵母细胞体外成熟提供最佳的激素环境,因此势必会对卵母细胞成熟质量和效率产生影响。
技术实现要素:
本发明的目的在于针对现有技术中体外成熟方法导致的卵母细胞成熟质量和效率较低的问题,提供一种可以有效提高卵母细胞体外成熟质量和效率的方法。
为解决上述技术问题,本发明采用如下技术方案:
第一方面,本发明提供了一种提高卵母细胞体外成熟质量和效率的方法,其特征在于,所述方法包括在体外成熟过程中至少更换一次体外成熟液的步骤。
本发明的方法中,所述卵母细胞优选为牛卵母细胞。
本发明的方法中,优选每4-20小时更换一次体外成熟液,更优选地,每8-16小时更换一次体外成熟液,最优选地,每8-12小时更换一次体外成熟液。
以体外成熟培养24小时计,每8小时更换一次体外成熟液表示在培养开始后第8小时、第16小时更换体外成熟液;每12小时更换一次体外成熟液表示在培养开始后第12小时更换一次体外成熟液。
本发明的方法中,更换体外成熟液时可更换全部成熟液;在一些实施方式中,可更换至少50%、60%、70%、80%或90%的成熟液。
本发明的方法中,体外成熟液的组分包括:tcm199基础培养液,0.01iu/mlfsh,10μg/ml肝素,40ng/mligf,50ng/mlegf,0.01iu/mllh,1μg/mle2和10%fbs。
本发明的方法中,体外成熟液并不局限于上述组分及含量,现有技术中其他的包含基础培养液和生殖激素的体外成熟液,也均适用于本发明。
进一步的,本发明的方法中,体外成熟液中还包含了fgf(成纤维细胞生长因子),所述fgf的浓度为10-30ng/ml;优选的,所述fgf的浓度为20ng/ml。
第二方面,本发明提供了通过上述方法所制备的体外成熟的卵母细胞。
进一步的,所述体外成熟的卵母细胞为牛卵母细胞。
采用本发明的方法所制备的卵母细胞,相对于未更换体外成熟液的方法,mii期卵母细胞的比率显著提高,皮质颗粒和线粒体正常分布的比例、谷胱甘肽和atp的水平均显著提高,表示本发明的方法制备的卵母细胞具有更高的成熟质量和效率。
第三方面,本发明提供了所制备的体外成熟的卵母细胞在体外受精中的应用。采用本发明的方法制备的卵母细胞在体外受精(ivf)之后,相对于未更换体外成熟液的方法,卵裂率、囊胚率和囊胚细胞数均显著提高,表示本发明的方法制备的卵母细胞及受精卵质量更高,实际应用价值更大。
本发明通过在卵母细胞成熟过程中更换体外成熟液,克服了现有技术的方法中因生殖激素存在半衰期而导致的卵母细胞体外成熟质量和效率低下的问题,从而提供了一种操作简便,重复性高,显著提高卵母细胞成熟质量和效率的方法。
采用本发明的方法制备的卵母细胞,具有显著提高的细胞核成熟效率和细胞胞质成熟效率,mii期卵母细胞高达95%,皮质颗粒和线粒体正常分布的卵母细胞比例、谷胱甘肽和atp水平均显著高于正常成熟组;在体外培养液中添加一定量的fgf,可进一步提高了卵母细胞的成熟质量和效率。
本发明的方法制备的卵母细胞经体外受精之后,体外受精效率显著高于正常成熟组,体现为更高的卵裂率、囊胚率和更多的囊胚细胞数;在体外培养液中添加一定量的fgf,可进一步提高了卵母细胞体外受精的效率,具有重大的实际应用价值。
附图说明
图1.卵母细胞中皮质颗粒分布情况。图中a、b、c、d分别为环形分布、不连续分布、胞质均匀分布和完全释放,其中a为正常分布。标尺=20μm。
图2.卵母细胞中线粒体分布情况。图中a、b、c分别为环形分布、均匀分布和异常分布,其中a、b为正常分布。标尺=20μm。
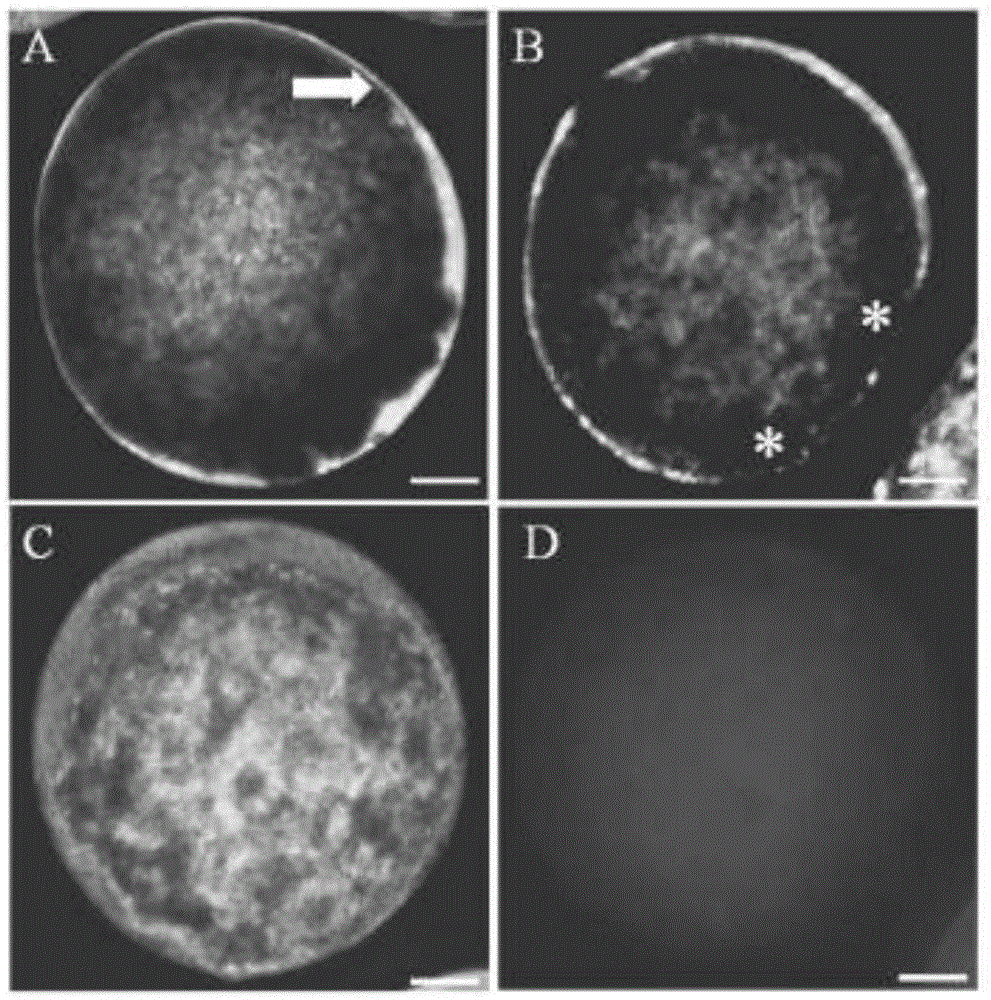
图3.cocs成熟照片。a:20ng/mlfgf+12h换液组,b:正常成熟组。放大倍数:200x。
具体实施方式
下面结合实施例详细介绍本发明,本发明的优点将会随着描述而更为清楚。应理解,本发明要求保护的范围不受所述具体实施方式的限制,本发明提供的具体实施例仅是范例性的,不对本发明的范围构成任何限制,本领域技术人员参照说明书的描述对本发明的具体实施方式进行修改或者对部分技术特征进行等同替换,这些无需创造性劳动的改进和替换也应落入本发明所附权利要求书的保护范围之内。
试剂和仪器:除特殊说明,本发明所有实验试剂均购于sigma公司(美国),奶牛冻精购自北京奶牛中心。
实施例1卵母细胞的获取和体外成熟方法
1.卵母细胞的获取与体外成熟
从屠宰场获取的卵巢,放入37℃生理盐水中2h内运到实验室。通过真空泵,抽出直径在2-8mm卵泡中的卵丘卵母细胞复合体(cocs),ivm液洗涤后在显微镜下检出,然后将cocs放入ivm液中在38.5℃、5%co2的培养箱中培养24h。其中,ivm液成分如下:tcm199基础培养液+0.01iu·ml-1fsh+10μg·ml-1肝素+40ng·ml-1igf+50ng·ml-1egf+0.01iu·ml-1lh+1μg·ml-1e2+10%fbs。
2.卵母细胞核成熟统计
各组卵母细胞ivm24h后,采用透明质酸酶脱除卵丘细胞,挑选mii期卵母细胞,进而统计mii期卵母细胞比例。
3.卵母细胞胞质成熟统计
选取各组mii期卵母细胞,进行皮质颗粒、线粒体分布和谷胱甘肽、atp水平分析。
皮质颗粒分析程序:用链霉蛋白酶(5mg/ml)消化卵母细胞,除去透明带后,在dbps溶液中清洗3次,然后室温固定在4%多聚甲醛中30min,用含3%bsa的dbps封闭液洗涤3次,再置于0.1%tritonx-100中室温通透处理5min,封闭液洗3次,每次5min,在20μg/mlfitc-lca染料中38.5℃避光孵育30min,dbps溶液洗涤3次。卵母细胞压片后,借助共聚焦显微镜照相,将皮质颗粒分布分为:环形分布、不连续分布、胞质均匀分布和完全释放,其中环状分布为正常分布(图1)。
线粒体分析程序:卵母细胞采用12.5μmmitotrackerredcmxros染色30min,而后采用dpbs洗涤两次、每次5min,进而进行压片,而后在激光共聚焦显微镜下观察(te2000-u,nikon,japan)。线粒体的分布分为:边缘分布,胞质分布,胞质分布部分缺失,其中边缘分布和胞质分布为正常分布(图2)。
谷胱甘肽水平分析:胞内gsh水平采用荧光强度分析,卵母细胞先采用10mmgsh染料(celltrackerbluecmf2hc;invitrogen,carlsbad,ca,usa)染色10min,而后采用dpbs洗涤2次、每次5min,压片后进行观察。采用imagej软件(nih,usa)对卵母细胞gsh荧光强度进行分析,gsh浓度采用荧光强度表示。
atp水平分析:用生物发光检测试剂盒(11699709001,atpbioluminescenceassaykithsii,roche)检测atp含量。用移液器吹打以使卵子破裂、释放atp。先往酶标板中加入100μlatp反应液,静置5min后加入20μl样品,混匀后于酶标仪中进行测定,记录各个样品酶标仪读数。在进行测定的同时,按说明书操作方法采用标准样品制备标准曲线。标准曲线梯度为0、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0pmol。每次测量重新测定标准曲线值,同时设空白对照。根据测定的数值,建立标准曲线。将各个样品酶标仪读数放入标准曲线中进行换算,除以样品中卵母细胞含量,即获得样品中atp含量。
4.ivf程序
ivf程序参照brackett和oliphant(1975)的方法进行,略作改动。具体操作为:将冻精从液氮中取出,迅速晃动以挥发冻精表面液氮,进而放入38℃水浴锅中解冻。解冻后的精液采用酒精消毒后,移入含有7ml洗精液的15ml离心管中,1500r/min洗涤2次、每次5min。离心结束后,弃上清后的精子沉淀加入受精液,调整调整精子密度至5×106个/ml。将20μl精液与80μl受精滴混合成100μl受精滴(精子最终密度为1×106个/ml),而后放入co2培养箱(5%co2、38.5℃、饱和湿度)平衡1.5h。最后,将卵母细胞移至受精滴(20~30枚/滴),放入co2培养箱中受精16~18h。受精结束后,将受精卵洗涤后放入mcr1aa中培养。48h后,记录卵裂率,并将卵裂的胚胎换到后期液中培养,以后隔48h换一次液(半量),统计第7天的囊胚率。
5.囊胚细胞计数
各组囊胚,先采用5mg/ml的链霉蛋白酶处理2-3min去除透明带(zp),而后采用10μg/ml的hoechst33342染色10min。染色囊胚压片后采用荧光显微镜观察,记录囊胚细胞数。
6.激素浓度检测
采用放射免疫分析法,结合fsh、lh、e2检测试剂盒(均购自北京北方生物技术研究所)测定待测样品中fsh、lh、e2的浓度。
7.统计分析
本发明所有生物生物学重组至少三次以上。数据以“平均值±标准差”表示,其中百分数数据经反正弦转换后用于分析。采用sas9.1对数据进行anova显著性分析,p<0.05被认为是差异显著。
实施例2空白组和cocs组ivm液中不同时间的激素水平
1.实验设计
空白组为不含cocs的ivm液在38.5℃、5%co2的培养箱中培养24h。
cocs组为含有cocs上的ivm液在38.5℃、5%co2的培养箱中培养24h。
上述ivm液组分如下:tcm199基础培养液+0.01iu·ml-1fsh+10μg·ml-1肝素+40ng·ml-1igf+50ng·ml-1egf+0.01iu·ml-1lh+1μg·ml-1e2+10%fbs。
分别于ivm开始后第0、4、8、12、16、20、24h,取空白组和cocs组ivm液,-80℃保存,用于激素检测。
2.空白组和cocs组不同时间的激素水平检测结果
空白组激素水平检测结果如表1所示,8h空白组fsh、lh、e2水平(5.75±0.52miu/ml,6.85±0.59miu/ml,703.74±63.45ng/ml)显著低于0h空白组(9.93±0.73miu/ml,9.72±0.86miu/ml,995.98±87.12ng/ml;p<0.05),16h空白组(3.38±0.31miu/ml,4.87±0.33miu/ml,655.12±51.79ng/ml)fsh、lh、e2水平显著低于8h空白组(p<0.05)。
表1空白组和cocs组ivm液中激素水平检测
a,b,c,d同列数据上标不同表示差异显著(p<0.05),下同。
cocs组激素水平检测结果如表2所示,8hcocs组fsh、lh、e2水平(7.98±0.73miu/ml,6.83±0.52miu/ml,823.12±80.98ng/ml)显著低于0hcocs(9.75±0.89miu/ml,9.56±0.84miu/ml,991.54±92.78ng/ml;p<0.05),16hcocs组fsh、lh、e2水平(5.42±0.41miu/ml,4.29±0.38miu/ml,781.32±75.09ng/ml)显著低于8hcocs组(p<0.05)。
表2空白组和cocs组ivm液中激素水平检测
实施例3更换体外成熟液对卵母细胞体外成熟和ivf效率的影响
1.实验设计
正常成熟组:将cocs放入ivm液中成熟24h,在成熟期间并无换液。
12h换液组:将cocs放入ivm液中成熟12h,而后移入新配制的ivm液中继续成熟12h。
8h换液组:将cocs放入ivm液中成熟,分别在ivm开始后第8h、16h移入新配制的ivm液中继续成熟。
上述ivm液组分如下:tcm199基础培养液+0.01iu·ml-1fsh+10μg·ml-1肝素+40ng·ml-1igf+50ng·ml-1egf+0.01iu·ml-1lh+1μg·ml-1e2+10%fbs。
成熟结束后,统计三组卵母细胞的mii期卵母细胞率,然后挑选各组mii期卵母细胞进行皮质颗粒分布、线粒体分布以及谷胱甘肽水平、atp含量检测。最后,各组mii期卵母细胞ivf后,统计卵裂率、囊胚率及囊胚细胞数。
2.ivm换液对卵母细胞核成熟效率的影响
ivm换液对核成熟效率的影响结果如表3所示,8h换液组(95.03±7.28%)和12h换液组(86.25±6.73%)卵母细胞核成熟率显著高于正常成熟组(77.66±6.82%;p<0.05);同时8h换液组卵母细胞核成熟率也显著高于12h换液组。
表3ivm换液对卵母细胞核成熟效率的影响
3.ivm换液对卵母细胞胞质成熟效率的影响
结果如表4和表5所示,根据表4结果显示,8h换液组的皮质颗粒正常分布率(93.02±8.39%)、线粒体正常分布率(91.30±8.12%)显著高于12h换液组(72.50±6.12%、80.95±7.81%)和正常成熟组(60.98±5.73%、66.67±5.03%;p<0.05);同时12h换液组也显著高于正常成熟组。
表4ivm换液对卵母细胞胞质成熟效率的影响
根据表5显示,8h换液组的谷胱甘肽水平、atp水平(93.39±8.21荧光强度,1.16±0.09pmol)显著高于12h换液组(67.74±6.37荧光强度,0.98±0.07pmol)和正常成熟组(44.12±3.98荧光强度,0.85±0.04pmol;p<0.05);同时12h换液组也显著高于正常成熟组。
表5ivm换液对卵母细胞胞质成熟效率的影响
4.ivm换液对卵母细胞ivf效率的影响
结果如表6所示,8h换液组的卵裂率、囊胚率和囊胚细胞数(95.65±8.53%,54.55±3.91%,118.82±10.71)均显著高于正常成熟组(75.59±5.38%,32.29±1.82%,100.32±5.62;p<0.05)和12h换液组(85.12±6.12%,42.72±2.17%,109.18±8.18;p<0.05);同时12h换液组也显著高于正常成熟组。
表6ivm换液对卵母细胞ivf效率的影响
实施例4添加fgf和更换体外成熟液对卵母细胞体外成熟的影响
1.添加fgf对卵母细胞核成熟的影响
1)实验设计
分别在ivm液中添加10ng/ml、20ng/ml、30ng/mlfgf,cocs按正常成熟程序成熟至24h,进而检测添加fgf对卵母细胞核成熟的影响。
2)结果分析
结果如表7所示,在卵母细胞ivm液中添加fgf后,10ng/mlfgf组、20ng/mlfgf组、30ng/mlfgf组核成熟率(77.27±7.38%,77.78±5.63%,78.57±7.38%)与正常成熟组无显著性差异(75.00±4.37%;p>0.05)。
表7fgf添加对卵母细胞核成熟的影响
2.添加fgf和换液对卵母细胞核成熟、胞质成熟和ivf效率的影响
1)实验设计
正常成熟组:将cocs放入ivm液中成熟至24h,在成熟期间并无换液。
8h换液组:将cocs放入ivm液中成熟,并在成熟开始后的第8、16h分别移入新配制的ivm液中继续成熟至24h。
fgf+12h换液组(添加fgf并换液组):将cocs放入添加了20ng/mlfgf的ivm液中成熟,并在ivm开始后第12h移入新配制的添加了20ng/mlfgf的ivm液中继续成熟至24h。
成熟结束后,统计三组卵母细胞的mii期卵母细胞率,然后挑选各组mii期卵母细胞进行皮质颗粒分布、atp含量检测。最后,各组mii期卵母细胞ivf后,统计卵裂率、囊胚率及囊胚细胞数。
2)添加fgf并换液对卵母细胞核成熟和胞质成熟的影响
如表8和图3所示,添加fgf并换液组的mii期卵母细胞率(95.16±7.43%)、卵母细胞皮质颗粒正常分布比率(93.02±8.28%)及atp含量(111.74±10.83pmol)均显著高于正常成熟组(74.81±6.34%,63.33±4.28%,0.81±0.04;p<0.05),且与8h换液组无显著区别(93.85±8.23%,92.11±7.35%,109.82±8.08;p>0.05)。
表8添加fgf并12h换液对卵母细胞核成熟和胞质成熟的影响
通过对比fgf并换液组(20ng/mlfgf+12h换液组)和12h换液组,我们发现在卵母细胞成熟过程中,换液的同时添加fgf,可进一步提高卵母细胞成熟的质量,mii期卵母细胞率、皮质颗粒正常分布百分比、atp含量均显著增加(p<0.05)。
3)添加fgf并换液对卵母细胞ivf效率的影响
如表9所示,添加fgf并换液组的卵裂率(93.94±9.24%)、囊胚率(53.23±4.92%)、囊胚细胞数(115.04±10.13)均显著高于正常成熟组(73.02±5.92%,32.61±3.02%,98.25±7.15;p<0.05),且与8h换液组无显著性差异(94.18±7.31%,53.13±4.24%,113.81±9.38;p>0.05)。
表9ivm换液对卵母细胞ivf效率的影响
- 还没有人留言评论。精彩留言会获得点赞!