一种高效利用葡萄糖的类球红细菌工程菌及其构建方法与流程
本发明涉及类球红细菌生产领域,尤其是一种高效利用葡萄糖的类球红细菌工程菌及其构建方法。
背景技术:
类球红细菌富含多种营养药用成分,具有抗脂质过氧化、抗辐射、抗肿瘤、调节机体免疫等功能,在食品、医药领域有了新应用。可从菌体中提取辅酶q10、番茄红素、维生素b12、超氧化物歧化酶等营养药用成分。目前利用类球红细菌发酵辅酶q10已实现产业化。随着研究的深入,该菌在食品、医药领域更多潜在的功用将被挖掘出来,获取大量的菌体细胞对生产上述营养药用成分具有重要意义。
葡萄糖是自然界分布最广且最为重要的一种单糖,它是一种多羟基醛。在生物学领域具有重要地位,是活细胞的能量来源和新陈代谢中间产物,即生物的主要供能物质,因此在微生物生长过程中,高效利用葡萄糖对其生长具有重要意义。
技术实现要素:
本发明所要解决的技术问题在于提供一种高效利用葡萄糖的类球红细菌工程菌。
本发明所要解决的另一技术问题在于提供上述高效利用葡萄糖的类球红细菌工程菌的构建方法。
为解决上述技术问题,本发明的技术方案是:
一种高效利用葡萄糖的类球红细菌工程菌,为敲除frua、gcd基因的类球红细菌(类球红细菌(rhodobactersphaeroides)2.4.1工程菌株。
优选的,上述高效利用葡萄糖的类球红细菌工程菌,是通过用连接有frua-lr、gcd-lr序列的载体pk18mobsacb::frua-lr、pk18mobsacb::gcd-lr敲除frua、gcd基因获得的。该方法实现了特异性无缝敲除,且效率高、稳定,可重复得到完全相同的类球红细菌工程菌。
上述高效利用葡萄糖的类球红细菌工程菌特异性无缝敲除frua、gcd基因的具体构建方法:所用宿主菌为类球红细菌(rhodobactersphaeroides)2.4.1,所述载体为pk18mobsacb::frua-lr、pk18mobsacb::gcd-lr;敲除载体pk18mobsacb::frua-lr、pk18mobsacb::gcd-lr化转至大肠s17-1感受态中,再通过接合转移的方法,将含有敲除载体的s17-1与类球红细菌(rhodobactersphaeroides)2.4.1共同培养,敲除载体pk18mobsacb::frua-lr、pk18mobsacb::gcd-lr将会被导入至类球红细菌(rhodobactersphaeroides)2.4.1,而后,发生左右臂同源交换获得敲除菌株,同源重组原理见图8,提取基因组进行验证,如果frua基因敲除,通过pcr验证,将会扩增出2015bp大小的片段,如果gcd基因敲除,通过pcr验证,将会扩增出1815bp大小的片段,即获得frua和gcd基因双敲除的类球红细菌菌株。
优选的,上述高效利用葡萄糖的类球红细菌工程菌,所述载体pk18mobsacb::frua-lr中包括frua左臂右臂1819bp重叠序列frua-lr,其中,类球红细菌中frua左臂979bp序列frua-l,其基因序列见序列表1、2;frua右臂834bp序列frua-r,其基因序列见序列表3、4。
优选的,上述高效利用葡萄糖的类球红细菌工程菌,所述frua左臂基因frua-l和frua右臂基因frua-r通过重叠pcr获得重叠基因frua-lr,将重叠基因frua-lr和出发载体pk18mobsacb分别用ecori和sali双酶切后进行连接,构建frua-lr基因的敲除载体,为pk18mobsacb::frua-lr,其质粒图谱见图2,pcr验证结果见图3,双酶切验证结果见图4。
优选的,上述高效利用葡萄糖的类球红细菌工程菌,所述载体pk18mobsacb::gcd-lr中包括gcd左臂右臂1709bp重叠序列gcd-lr,其中,类球红细菌中gcd左臂770bp基因gcd-l,其基因序列见序列表5、6;gcd右臂976bp基因gcd-r,其基因序列见序列表7、8。
优选的,上述高效利用葡萄糖的类球红细菌工程菌,所述gcd左臂基因gcd-l和gcd右臂基因gcd-r通过重叠pcr获得重叠基因gcd-lr,将重叠基因gcd-lr和出发载体pk18mobsacb分别用ecori和sali双酶切后进行连接,构建gcd-lr基因的敲除载体,为pk18mobsacb::gcd-lr,其质粒图谱见图5,pcr验证结果见图6,双酶切验证结果见图7。
上述获得frua和gcd基因双敲除的类球红细菌菌株,与野生型菌株差异性比较,测定其生长曲线、葡萄糖消耗速率等。
上述高效利用葡萄糖的类球红细菌工程菌所需培养基如下:
nh1液体培养基:8g/l酵母提取物,3g/l葡萄糖,2g/lnacl,1.3g/lkh2po4,0.125g/lmgso4,1mg/l盐酸硫胺,15μg/l生物素,1mg/l烟酸,用naoh调节ph至7.2,115℃灭菌20分钟。
固体培养基加入1.5%的琼脂。
nh1+kana液体培养基:nh1液体培养基基础上,加入卡那霉素,卡那霉素终浓度为25μg/ml。
smm培养基:葡萄糖8g/l,k2hpo43.5g/l,(nh4)2so40.5g/l,nacl0.5g/l,koh2g/l,cb母液20ml/l,生长因子母液1ml/l,调节ph至6.9。
cb母液:在500ml的去离子水中加入l0g氨三乙酸和8gkoh,待全部溶解后依次加入14.6g无水硫酸镁,1.7gcacl2·2h2o,50mlm44母液。
m44母液:2g/ledta,11g/lzns·7h2o,5g/lfeso4·7h2o,1.5g/lmnso4·h2o,0.4g/lcuso4·5h2o,0.12/lgh3bo3,0.37g/lcocl4·6h2o。
生长因子母液:在100ml去离子水中加入4mg生物素,200mg烟酸,100mg盐酸硫胺素,定容至200ml,过滤除菌。
smm+10%sucrose固体培养基:在smm培养基中加入l00g/l的蔗糖,15g/l的琼脂,115℃灭菌20min。
上述高效利用葡萄糖的类球红细菌工程菌所需发酵条件:100ml发酵液,接种量2%,30℃,ph6.9,转速200rpm。
上述培养基均可采用标准方法制备获得。
本发明的有益效果是:
本发明通过基因改造改变菌株葡萄糖代谢途径,获得一株能高效利用葡萄糖的类球红细菌菌株,相比野生型菌株,消耗单位质量的葡萄糖益于获得更多菌体细胞,降低生产成本,显现出良好的应用前景。具体来说,
本发明利用同源重组技术将类球红细菌中的葡萄糖pts转运蛋白iibc和周质葡萄糖脱氢酶编码基因进行无缝敲除,获得frua和gcd基因双敲除的高效利用葡萄糖类球红细菌工程菌重组菌。本发明将frua、gcd基因双敲除的重组菌以葡萄糖为唯一碳源化学合成培养基进行发酵分析,检测发酵液中的细胞浓度和葡萄糖浓度,发现最大生物量约是野生株的1.3倍,frua和gcd敲除后单位菌体干重对葡萄糖得率达到0.62g/g,比野生株提高31%。本发明显著提高类球红细菌菌体干重对葡萄糖得率,益于获得更多菌体细胞,降低生产成本。其中,
1、本发明利用同源重组技术获得frua、gcd的基因敲除菌株,不用插入筛选标记,无缝定点敲除frua、gcd基因,不影响其上游和下游基因的转录水平。
2、本发明将敲除frua、gcd基因的工程菌进行发酵分析,发现最大生物量约是野生株的1.3倍,单位菌体干重对葡萄糖得率达到0.62g/g,比野生株提高31%。
3、本发明将高效利用葡萄糖的类球红细菌工程菌株通过微生物发酵,分析发现,菌体干重对葡萄糖得率显著提高,益于获得更多菌体细胞,降低生产成本。
附图说明
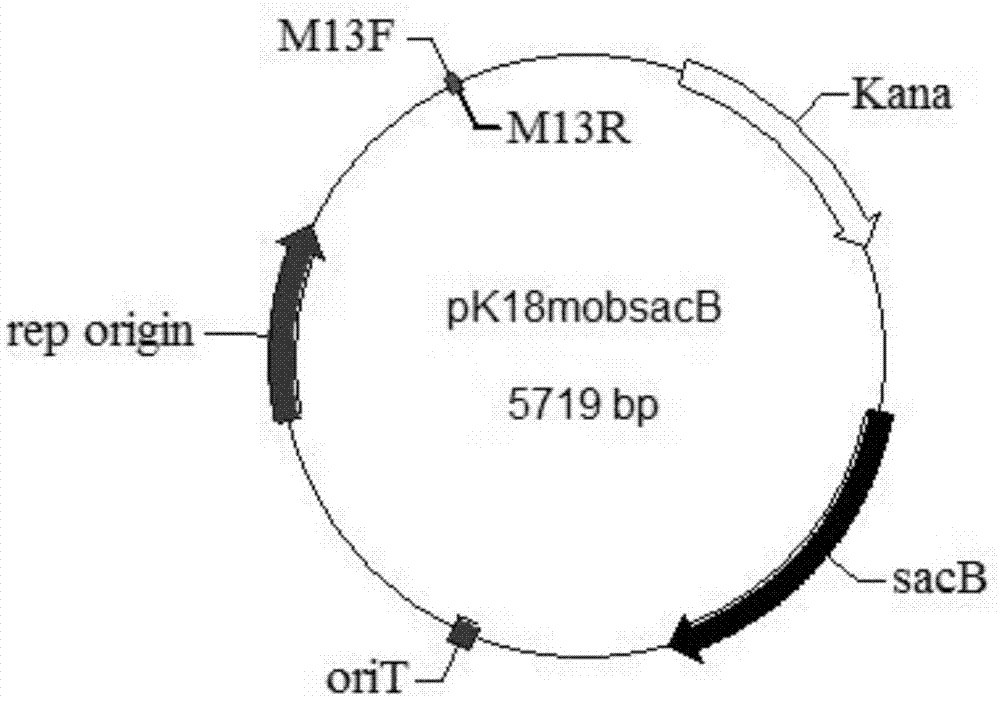
图1为本发明载体pk18mobsacb的构建图谱;
图2为本发明敲除载体pk18mobsacb::frua-lr的构建图谱;
图3为本发明构建敲除载体pk18mobsacb::frua-lr的pcr验证图,m:dnamarker;n:阴性对照;p:以frua-lr片段为模板的阳性对照,扩增获得frua-lr片段,大小为1819bp;片段成功连接到载体上,扩增获得frua-lr片段,大小为1819bp,与阳性对照相同;
图4为本发明将片段frua-lr用ecori和sali进行双酶切,与经同样内切酶处理过的质粒片段pk18mobsacb进行连接,菌落pcr验证和酶切验证,获得敲除载体pk18mobsacb::frua-lr。
图5为本发明敲除载体pk18mobsacb::gcd-lr的构建图谱;
图6为本发明构建敲除载体pk18mobsacb::gcd-lr的pcr验证图,m:dnamarker;n:阴性对照;p:以gcd-lr片段为模板的阳性对照,扩增获得gcd-lr片段,大小为1709bp;片段成功连接到载体上的菌株,扩增获得gcd-lr片段,大小为1709bp,与阳性对照相同;
图7为本发明将片段gcd-lr用ecori和sali进行双酶切,与经同样内切酶处理过的质粒片段pk18mobsacb进行连接,菌落pcr验证和酶切验证,获得敲除载体pk18mobsacb::gcd-lr。
图8为本发明frua、gcd敲除菌株筛选的同源重组原理图;
图9为本发明frua基因敲除菌株pcr验证图,m:dnamarker;n:阴性对照;p:野生型;1~2:敲除frua基因的菌株;
图10为本发明gcd基因敲除菌株pcr验证图,m:dnamarker;n:阴性对照;p:野生型;1~3:敲除gcd基因的菌株;
图11为本发明测定野生型和frua、gcd双敲菌株发酵处理后生长曲线图谱。
具体实施方式
为了使本领域的技术人员更好的理解本发明的技术方案,下面结合具体实施方式对本发明所述技术方案作进一步的详细说明。
本发明利用同源重组技术将类球红细菌中的葡萄糖pts转运蛋白iibc和周质葡萄糖脱氢酶编码基因frua和gcd进行无缝敲除,获得葡萄糖pts转运蛋白iibc和周质葡萄糖脱氢酶基因功能缺失的工程菌株,本发明的内容包括:构建所述frua和gcd敲除载体的方法,构建frua和gcd基因敲除菌株的方法。所述载体为pk18mobsacb,载体中包括sacb基因。
本发明所述的frua-l、frua-r来源于类球红细菌(rhodobactersphaeroides)2.4.1,frua-lr是frua-l、frua-r连接在一起的序列,是以frua-l、frua-r为模板通过重叠pcr技术扩增得到的;所述的gcd-l、gcd-r来源于类球红细菌(rhodobactersphaeroides)2.4.1,gcd-lr是gcd-l、gcd-r连接在一起的序列,是以gcd-l、gcd-r为模板通过重叠pcr技术扩增得到的。
所述敲除载体pk18mobsacb::frua-lr、pk18mobsacb::gcd-lr是分别将frua-lr、gcd-lr片段插入到初始载体pk18mobsacb,构建了敲除载体pk18mobsacb::frua-lr、pk18mobsacb::gcd-lr,接合转移至类球红细菌中,得到frua和gcd基因敲除菌株。上述菌株经发酵培养后,取不同培养时间的发酵液进行生长曲线的检测。
枯草芽孢杆菌sacb基因编码分泌型蔗糖果聚糖酶,该酶能催化蔗糖水解和合成高分子量的果聚糖。高分子量果聚糖积累对细胞存在潜在的毒性作用,可造成细胞死亡。也就是说,sacb基因使得细菌获得蔗糖敏感的特性。本研究已发现在5%或5%以上的蔗糖存在下,sacb基因的表达可以导致类球红细菌(rhodobactersphaeroides)2.4.1死亡。基于这种特性,sacb基因在遗传上被作为一种反向筛选标记应用于类球红细菌的基因功能研究上,10%蔗糖存在下的致死作用(10%蔗糖存在下,菌全部死亡)。本发明具体操作步骤如下:
一、敲除载体pk18mobsacb::frua-lr、pk18mobsacb::gcd-lr的构建
1、以类球红细菌(rhodobactersphaeroides)2.4.1(来自于浙江大学)的基因组为模板,利用表1中的引物frual-f、frual-r和fruar-f、fruar-r,通过pcr扩增得到frua-l和frua-r;利用表2中的引物gcdl-f、gcdl-r和gcdr-f、gcdr-r,通过pcr扩增得到gcd-l和gcd-r。
具体pcr反应体系为:
具体pcr反应条件为:
pcr结束后获得完整的目的片段frua-l、frua-r和gcd-l、gcd-r。
2、以frua-l、frua-r和gcd-l、gcd-r为模板,分别利用表1中的引物frual-f、fruar-r和表2中的引物gcdl-f、gcdr-r进行重叠pcr扩增获得frua-lr和gcd-lr。
具体pcr反应体系为:
具体pcr反应条件为:
pcr结束后获得完整的目的片段frua-lr和gcd-lr。
表1所用引物序列
表2所用引物序列
将已获得的dna片段frua-lr、gcd-lr用ecori(购自takara公司,货号d1040a)和sali(购自takara公司,货号d1080a)进行双酶切,回收后与经同样内切酶处理过的质粒片段pk18mobsacb进行连接,将连接产物转化至大肠杆菌jm109感受态细胞,并均匀涂布于带有卡那霉素(100μg/ml)的lb平板上,37℃培养过夜,挑取单克隆,进行菌落pcr验证和酶切验证,获得敲除载体pk18mobsacb::frua-lr、pk18mobsacb::gcd-lr,验证图如图4和图7。
二、frua、gcd基因敲除菌株的构建
将上述已获得的敲除载体接合转移至类球红细菌,具体方法为:
(1)从-80℃保藏的类球红细菌甘油管中三区划线于nh1固体平板上,并在30℃恒温培养箱中倒置培养至单菌落清晰;
(2)将构建好的载体化转入大肠杆菌s17-1的感受态细胞中,吸取100μl复苏后的菌液涂布于lb+kana的固体平板上,于37℃恒温培养箱中倒置培养24h左右;
(3)将类球红细菌和大肠杆菌s17-1分别挑取单克隆接种于nh1液体培养基和lb液体培养基(根据载体抗性添加相应浓度的抗生素)中,类球红细菌于30℃、200rpm摇床中培养24h左右,大肠杆菌s17-1于37℃、200rpm摇床中过夜培养;
(4)各取1ml菌液于1.5mlep管中,8000rpm离心3min后,弃去上清;
(5)用无菌水洗涤菌体沉淀一次;
(6)分别加入适量新鲜的液体培养基重悬菌体沉淀;
(7)按不同的比例将两种菌液混合,用枪头吸取混合菌液点于平板中无菌滤膜中央,于超净工作台中将菌液吹干;
(8)菌液吹干后将平板正置于30℃恒温培养箱中培养24h左右;
(9)用400μl无菌水将平板上的菌苔洗下,涂布于nh1+kana+k2teo3(kana浓度为25mg/l,k2teo3浓度为150mg/l)的固体平板上,于30℃恒温培养箱中静置培养;
(10)待平板上有黑色转化子长出,挑取单克隆接种于nh1+kana液体培养基并于32℃、200rpm控温摇床中培养24h左右
(11)最后在nh1+kana固体平板上划线进行分离纯化
三、frua、gcd敲除菌株的筛选,具体方法如下:
(1)挑取单克隆接种于nh1+kana液体培养基中,于30℃、200rpm控温摇床中培养24h左右;
(2)提取基因组dna进行pcr扩增,验证单交换菌株是否正确;
(3)挑取验证正确单交换菌株的单克隆接种于nh1液体培养基中(不添加任何抗生素),于30℃、200rpm控温摇床中培养24h左右;
(4)按1%的接种量进行转接,并将菌液稀释至合适的浓度,吸取100μl均匀的涂布于smm+10%sucrose的固体平板上,筛选双交换菌株;
(5)转接后的菌液于30℃、200rpm控温摇床中培养24h左右,并重复上步实验操作;
(6)待smm+10%sucrose固体平板上转化子长出,挑取单菌落接种于nh1液体培养基中于30℃、200rpm控温摇床中培养24h左右;
(7)提取基因组dna进行pcr扩增,验证双交换菌株是否正确。利用表3、表4中的引物p1、p4验证发生同源重组的菌株,同源重组原理图如图6,以待检测菌株的基因组为模板,如果没有发生同源重组,则用引物p1、p4扩增出来的片段大小分别为3736bp、3229bp;如果发生了同源重组,则片段大小分别为2015bp、1815bp,如图9、图10。
表3所用引物序列
表4所用引物序列
四、frua、gcd基因双敲除菌株生长检测
frua、gcd基因敲除菌株在如上所述的smm液态培养基中进行发酵。
发酵条件:100ml发酵液,接种量2%,30℃,ph6.9,转速200rpm,发酵120h以上,每12h取一次发酵液。检测结果如下表5及图11。
表5野生型菌株和frua、gcd双敲除菌株生长数据
上述参照具体实施方式对该一种高效利用葡萄糖的类球红细菌工程菌及其构建方法进行的详细描述,是说明性的而不是限定性的,可按照所限定范围列举出若干个实施例,因此在不脱离本发明总体构思下的变化和修改,应属本发明的保护范围之内。
序列表
<110>天津科技大学
<120>一种高效利用葡萄糖的类球红细菌工程菌及其构建方法
<150>2017110379573
<151>2017-10-31
<160>8
<170>siposequencelisting1.0
<210>1
<211>32
<212>dna
<213>frual-f(类球红细菌)
<220>
<221>primer_bind
<222>(1)..(32)
<400>1
acgcgtcgactccataccgtcacgctcaaccc32
<210>2
<211>40
<212>dna
<213>frual-r(类球红细菌)
<220>
<221>primer_bind
<222>(1)..(40)
<400>2
gtcagacggccgagggcacctgtcatgtcctctctccctg40
<210>5
<211>40
<212>dna
<213>fruar-f(类球红细菌)
<220>
<221>primer_bind
<222>(1)..(40)
<400>5
cagggagagaggacatgacaggtgccctcggccgtctgac40
<210>6
<211>28
<212>dna
<213>fruar-r(类球红细菌)
<220>
<221>primer_bind
<222>(1)..(28)
<400>6
ccggaattcaggtgccgacgatccgcta28
<210>3
<211>39
<212>dna
<213>gcdr-f(类球红细菌)
<220>
<221>primer_bind
<222>(1)..(39)
<400>3
ttccgccaagctccgggaagatggagcgtaccctcgtcg39
<210>4
<211>30
<212>dna
<213>gcdr-r(类球红细菌)
<220>
<221>primer_bind
<222>(1)..(30)
<400>4
acgcgtcgacagatgaggagcccaccttga30
<210>7
<211>39
<212>dna
<213>gcdr-f(类球红细菌)
<220>
<221>primer_bind
<222>(1)..(39)
<400>7
ttccgccaagctccgggaagatggagcgtaccctcgtcg39
<210>8
<211>30
<212>dna
<213>gcdr-r(类球红细菌)
<220>
<221>primer_bind
<222>(1)..(30)
<400>8
acgcgtcgacagatgaggagcccaccttga30
- 还没有人留言评论。精彩留言会获得点赞!