一种微量蛋白质样品浓缩的方法与流程
本发明涉及质谱样品制备领域,尤其针对微量蛋白质样品浓缩的方法。
背景技术:
样品制备仍是制约质谱分析的最大瓶颈问题之一,样品制备的一致性和可重现性是决定可重复和精确的质谱分析结果成败的关键所在。
当样品的蛋白质浓度非常低时(<10微克/毫升),例如,环境样品,用于研究蛋白质分泌物的培养基,珍贵的生物体液样本、大体积洗脱后的免疫共沉淀富集样本等,其中蛋白质的含量很低,这对质谱样品的前处理提出了很大的挑战。通常为了能得到足够量的蛋白,需要一种可以对样品进行浓缩、富集并与质谱鉴定兼容的方法策略。
蛋白质浓缩技术属于生物大分子的浓缩技术,目的是利用物理或化学的方法,除去蛋白质溶液中的水分、离子和其它小分子物质,使单位体积内的蛋白质浓度大幅度提高。蛋白质样品经过一系列的分离提取和层析会导致样品的稀释,而许多分析和研究都需要高浓度或高纯度的样品,所以蛋白质样品的浓缩至关重要。蛋白质浓缩技术主要有透析袋浓缩法、超滤膜浓缩法、冷冻干燥浓缩法、吹干浓缩法、化学沉淀法,凝胶浓缩法等。
当样品浓度足够大时,以上方法都可以取得满意效果。然而当样品浓度极低时,上述样品浓缩处理方法存在得率低、重复性差或蛋白质选择性损失的问题。超滤膜浓缩法、冷冻干燥浓缩法、吹干浓缩法等方法虽然理论上不存在样品丢失问题,但对样品中非蛋白成分要求严格,比如不能有不挥发盐类和去垢剂。化学沉淀法虽然对样品非蛋白成分没有要求,但因蛋白质浓度过低,造成回收率低,并且自身存在选择性回收问题。以上方法都会影响下游质谱鉴定过程。
近年来,fasp超滤辅助样品制备获得了普遍的认可。首先,样品通过加入(sds,十二烷基磺酸钠)缓冲器进行变性和二硫键打开,然后利用超滤管完成尿素等缓冲液的顺序交换,以完全去除sds。蛋白质样品经过烷基化,洗涤和消化成多肽,最终制备成无去垢剂,盐和烷基物的纯化肽。这种方法的优点在于对样品非蛋白成分要求不高,但在处理低蛋白浓度样品时同样有蛋白回收率低的问题。
技术实现要素:
有鉴于此,本发明的目的是提供一种微量蛋白质样品浓缩的方法,使得质谱样品损失少、蛋白产物得率高。
为了实现上述目的,本发明提供如下技术方案:
一种微量蛋白质样品浓缩的方法,包括以下步骤:
a)向生物微量蛋白样品中加入laemmli加样缓冲液和二硫苏糖醇,在90~100℃下反应5min;
b)将加入步骤a)得到的混合物冷却至室温后加入尿素粉末,溶解后离心浓缩;
c)将步骤b)得到的浓缩物装入超滤装置过滤,并用尿素进行冲洗,得到超滤物;
d)将步骤c)得到的超滤物进行sds-page电泳,得到蛋白质凝胶;
e)将步骤d)得到的蛋白质凝胶进行胶内酶解,得到质谱样品;
f)将步骤e)得到的质谱样品进行质谱分析,并通过数据库检索得到生物样品的多肽以及蛋白鉴定信息。
优选地,所述生物微量蛋白样品与所述2×laemmli加样缓冲液的体积比为1:1。而对样品本身无体积的限制。样品浓度应低于10微克/毫升.如样品蛋白浓度高于10微克/毫升,样品一般不需要浓缩,可用其他方法酶解样品。
优选地,所述二硫苏糖醇的终浓度为50mm/l。
优选地,离心浓缩前所述混合物中尿素的浓度为8mol/l。
优选地,超滤离心采用的是10kda的超滤离心管。
优选地,步骤c)中所述尿素的浓度为8mol/l。
优选地,步骤e)中胶内酶解具体步骤为将蛋白质凝胶的色部分切成小块依次进行胶块脱色、脱水、还原、二硫键封闭,再加入胰蛋白酶过夜,提取肽段,真空干燥,得到质谱样品。
本发明提供了一种微量蛋白质样品浓缩的方法,生物微量蛋白样品中加入laemmli加样缓冲液和二硫苏糖醇进行加热变性,能够使得生物微量蛋白样品中的二硫键还原,打开了蛋白结构。然后将尿素加入样品中,再将样品混合物加入超滤管中,超滤浓缩,并将浓缩处理的蛋白样品sds-page电泳、胶内酶解,即得质谱样品,再将质谱样品进行质谱鉴定分析。本发明能够对超低浓度蛋白样品进行检测,不受样品的体积或蛋白质浓度的限制,整个处理操作流程方便简洁,样品损失少、蛋白产物得率高。
附图说明
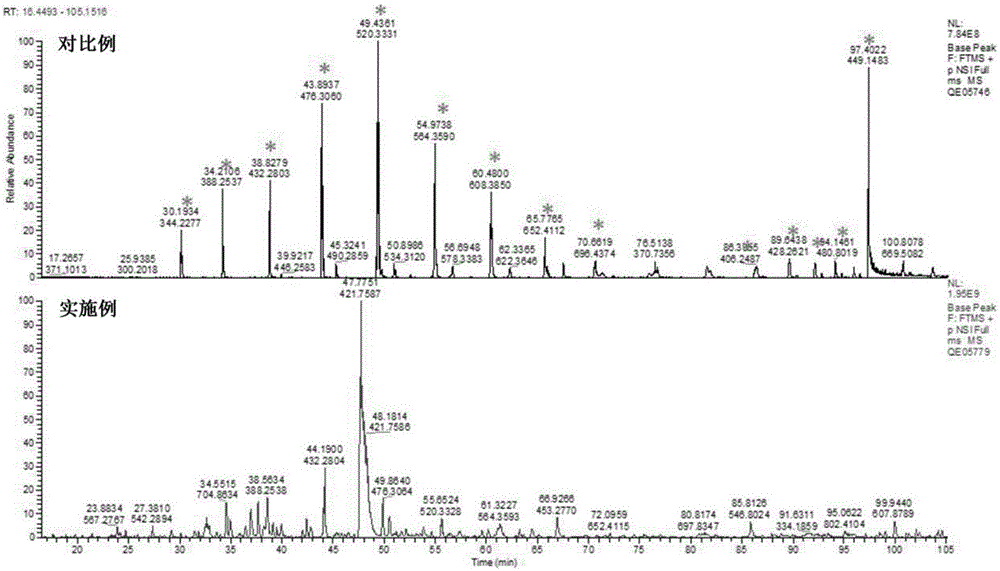
图1为实施例和对比例的质谱图;
图2为实施例和对比例鉴定的二级谱图数对比图;
图3为实施例和对比例鉴定的多肽数目对比图;
图4为实施例和对比例鉴定的蛋白数目对比图;
图5为实施例和对比例鉴定的多肽与蛋白种类韦恩图。
具体实施方式
本发明提供的一种微量蛋白质样品浓缩的方法,包括以下步骤:
a)向生物微量蛋白样品中加入laemmli加样缓冲液和二硫苏糖醇,在90~100℃下反应5min;
b)将加入步骤a)得到的混合物冷却至室温后加入尿素粉末,溶解后离心浓缩;
c)将步骤b)得到的浓缩物装入超滤装置过滤,并用尿素进行冲洗,得到超滤物;
d)将步骤c)得到的超滤物进行sds-page电泳,得到蛋白质凝胶;
e)将步骤d)得到的蛋白质凝胶进行胶内酶解,得到质谱样品;
f)将步骤e)得到的质谱样品进行质谱分析,并通过数据库检索得到生物样品的多肽以及蛋白鉴定信息。
上述技术方案中,生物微量蛋白样品中加入laemmli加样缓冲液和二硫苏糖醇进行加热变性,能够使得生物微量蛋白样品中的二硫键还原,打开了蛋白结构。然后将尿素加入样品中,再将样品混合物加入超滤管中,超滤浓缩,并将浓缩处理的蛋白样品sds-page电泳、胶内酶解,即得质谱样品,再将质谱样品进行质谱鉴定分析。本发明能够对超低浓度蛋白样品进行检测,不受样品的体积或蛋白质浓度的限制,整个处理操作流程方便简洁,样品损失少、蛋白产物得率高。
本发明中,向生物微量蛋白样品加入laemmli加样缓冲液和二硫苏糖醇,在90~100℃下反应5min。需要说明的是生物微量蛋白样品可以为1~n个生物微量蛋白样品,laemmli加样缓冲液为laemmli加样缓冲液(2×)。上述反应中样品蛋白在laemmli加样缓冲液和二硫苏糖醇的作用下使其二硫键还原,打开了蛋白结构。
需要说明的是,生物微量蛋白样品与2×laemmli加样缓冲液的体积比为1∶1,二硫苏糖醇的终浓度为50mm/l。
将加入步骤a)得到的混合物冷却至室温后加入尿素粉末,溶解;在本发明的实施例中,溶解物中尿素的浓度为8mol/l。
其中,需要说明的是,混合物反复通过10kda的超滤离心管离心浓缩,直至将步骤b)得到的溶解物离心浓缩,并用尿素进行冲洗,得到浓缩物;在本发明的实施例中,离心浓缩采用的是10kda的超滤离心管;并采用浓度为8mol/l的尿素进行冲洗。
需要说明的是,超滤管中浓缩物的体积为30~60ul,以便于sds-page电泳操作。如果超滤管中浓缩物的体积大于上述范围,可再次加入尿素进行冲洗,直至浓缩物的体积在上述范围内。
将步骤c)得到的浓缩物进行sds-page电泳,得到蛋白质凝胶。
需要说明的是,sds-page电泳为①取已浓缩蛋白质进行sds-page电泳,电泳条件:80v电泳10min后,120v电泳直到溴酚蓝距离上样孔大约1cm即可结束电泳;②用考马斯亮蓝染色方法对步骤①获得的凝胶进行染色:将凝胶置于质量分数为0.1%r-250染色液中,25-40℃摇床上振荡染色2h,脱色液脱色1h,超纯水水洗约4h,每30min换水一次,至凝胶背景脱净、条带清晰为止;染色液为体积比为25:10:65的乙醇、乙酸和水组成,含质量分数为0.1%的r-250,脱色液为体积比为45:10:45的乙醇、乙酸和水组成。
将步骤d)得到的蛋白质凝胶进行胶内酶解,得到质谱样品;在本发明的实施例中,胶内酶解具体步骤为将蛋白质凝胶的染色部分切成小块依次进行胶块脱色、脱水、还原、二硫键封闭,再加入胰蛋白酶过夜,提取肽段,真空干燥,得到质谱样品。具体为,①将蛋白质凝胶的染色部分切成约1mm3大小的胶块;②步骤①中的凝胶块用1000μl脱色液脱色两次,每次15min,可重复脱色,直到考马斯亮蓝颜色脱尽为止,弃上清,于labconco中真空干燥凝胶;脱色液为体积比为30:70的乙腈和50mmnh4hco3溶液组成;③加入1000μl10mmdtt溶液,55℃恒温箱中孵育45min,弃废液;④加入100μ200mm碘乙酰胺溶液,室温暗反应30min,弃废液;⑤加入1000μl脱色液清洗两次,每次10min,于labconco中真空干燥凝胶;⑥加入15μl胰酶溶液(20ng/μl,50mmnh4hco3),于4℃放置15min,待凝胶溶胀;⑦加入15μl50mmnh4hco3溶液浸没凝胶,37℃孵育过夜;⑧加入50μl提取液,所述提取液为5%甲酸溶液,37℃孵育1h,取上清转移至干净的离心管中;⑨胶块中再次加入50μl提取液,所述提取液为体积比为50:50的乙腈和5%甲酸溶液;⑩步骤⑧和⑨的两次提取液合并,于labconco中浓缩冻干,得到质谱样品——肽段。
将步骤e)得到的质谱样品进行质谱鉴定分析,并通过数据库检索得到生物样品的多肽以及蛋白鉴定信息。
为了进一步说明本发明,下面结合实施例对本发明提供的一种细菌分泌物测定量的方法进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
实施例和对比例采用6个不同的细菌培养基样品(蛋白浓度均低于1微克/毫升),分别标记为2223-1、2223-2、2223-3、4825-1、4825-2、4825-3进行试验,每次实施例和对比例采用的生物微量蛋白样品相同,分别采用如下方法进行质谱样品的制备,具体方法如下:
实施例
微量蛋白质样品浓缩的方法,包括以下步骤:
a)向500μl生物微量蛋白样品中加入500μllaemmli加样缓冲液(2x)和50μl1mol/l的二硫苏糖醇,在95℃下反应5min;
b)将加入步骤a)得到的混合物冷却至室温后加入尿素粉末,直至尿素的浓度达到8mol/l;
c)将步骤b)得到的溶解物加入到10kda的超滤离心管中,14000g离心25min离心浓缩,并用尿素进行冲洗,直至超滤管中浓缩物的体积为30~60μl,得到浓缩物;
d)将步骤c)得到的浓缩物进行sds-page电泳,得到蛋白质凝胶;
sds-page电泳为①取已浓缩蛋白质进行sds-page电泳,电泳条件:80v电泳10min后,120v电泳直到溴酚蓝距离上样孔大约1cm即可结束电泳;②用考马斯亮蓝染色方法对步骤①获得的凝胶进行染色:将凝胶置于质量分数为0.1%r-250染色液中,25-40℃摇床上振荡染色2h,脱色液脱色1h,超纯水水洗约4h,每30min换水一次,至凝胶背景脱净、条带清晰为止;染色液为体积比为25:10:65的乙醇、乙酸和水组成,含质量分数为0.1%的r-250,脱色液为体积比为45:10:45的乙醇、乙酸和水组成。
将步骤d)得到的蛋白质凝胶进行胶内酶解,得到质谱样品;在本发明的实施例中,胶内酶解具体步骤为将蛋白质凝胶的染色部分切成小块依次进行胶块脱色、脱水、还原、二硫键封闭,再加入胰蛋白酶过夜,提取肽段,真空干燥,得到质谱样品。
e)将步骤d)得到的蛋白质凝胶进行胶内酶解,得到质谱样品;
具体为,①将蛋白质凝胶的染色部分切成约1mm3大小的胶块;②步骤①中的凝胶块用1000μl脱色液脱色两次,每次15min,可重复脱色,直到考马斯亮蓝颜色脱尽为止,弃上清,于labconco中真空干燥凝胶;脱色液为体积比为30:70的乙腈和50mmnh4hco3溶液组成;③加入1000μl10mmdtt溶液,55℃恒温箱中孵育45min,弃废液;④加入1000μl20mm碘乙酰胺溶液,室温暗反应30min,弃废液;⑤加入1000μl脱色液清洗两次,每次10min,于labconco中真空干燥凝胶;⑥加入15μl胰酶溶液(20ng/μl50mmnh4hco3),于4℃放置15min,待凝胶溶胀;⑦加入15μl50mmnh4hco3溶液浸没凝胶,37℃孵育过夜;⑧加入50μl提取液,所述提取液为5%甲酸溶液,37℃孵育1h,取上清转移至干净的离心管中;⑨胶块中再次加入50μl提取液,所述提取液为体积比为50:50的乙腈和5%甲酸溶液;⑩步骤⑧和⑨的两次提取液合并,于labconco中浓缩冻干,得到质谱样品——肽段。
f)将步骤e)得到的质谱样品分别进行质谱分析,并通过数据库检索得到生物样品的多肽以及蛋白鉴定信息。
对比例
微量蛋白质样品浓缩的方法(fasp),包括以下步骤:
a)向500μl生物微量蛋白样品中加入500μllaemmli加样缓冲液和50μl1mol/l的二硫苏糖醇,在60℃下反应5min;
b)将加入步骤a)得到的混合物冷却至室温后加入600ug尿素粉末;
c)将步骤b)得到的溶解物加入到超滤装置,14000g离心5min,再加入400μl8mol/l尿素溶液,并在10000g离心15min,得到第一过滤物;向第一过滤物中再次加入400μl8mol/l尿素溶液,并在10000g离心15min,得到第二过滤物;
d)向尿素溶液中加入碘乙酰胺,得到尿素缓冲液,尿素缓冲液中尿素的浓度为8mol/l,碘乙酰胺的浓度为40mmol/l;向第二过滤物中加入尿素缓冲液,在暗处孵育40min后,10000g离心20min,得到第三过滤物;
e)将步骤d)得到的第三过滤物中加入400μl8mol/l尿素溶液,10000g离心15min,重复3次,得到第四过滤物;
f)将步骤e)得到的第四过滤物中加入400μl50mmol/l碳酸氢铵缓冲液,10000g离心15min,重复3次,得到第五过滤物;
g)将步骤f)得到的第五过滤物,加入15μl胰蛋白酶溶液(20ng/μl),37℃孵育过夜,10000g离心15min,重复3次,得到第六过滤物;再向第六过滤物中加入200μl50mmol/l碳酸氢铵缓冲液,收集流穿峰;
h)将步骤g)得到的流穿峰样品进行真空干燥、脱盐;
i)将步骤h)得到的样品进行质谱分析,并通过数据库检索得到生物样品的多肽以及蛋白鉴定信息。
对实施例和对比例制得的质谱样品进行试验,结果见图1~5。
实验结果表明,与对比例相比,本发明方法显著提高了对微量蛋白的回收率,从而增加了质谱对样品中多肽与蛋白的鉴定数目与种类。除去了fasp方法在制备样本过程中的多聚物污染干扰峰,得到样品中更多的蛋白肽段信息,且能够鉴定得到样品中更多的肽段图谱和蛋白信息。因此,本发明提供的方法使得生物微量蛋白样品的损失程度达到最小,鉴定多肽数目提高9倍以上,蛋白数目提高7倍以上。
上述说明,使本领域专业技术人员能够实现或使用本发明对所公开的实施例的上述说明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖性特点相一致的最宽的范围。
- 还没有人留言评论。精彩留言会获得点赞!