一种合成曲美替尼的方法与流程
本发明涉及药物合成领域,具体是一种曲美替尼的合成方法。
背景技术:
曲美替尼(trametinib)的中文化学名称:n-[3-[3-环丙基-5-[(2-氟-4-碘苯基)氨基]-3,4,6,7-四氢-6,8-二甲基-2,4,7-三氧代吡啶并[4,3-d]嘧啶-1(2h)-基]苯基]乙酰胺,由葛兰素史克公司开发,于2013年5月29日美国fda批准的曲美替尼(trametinib)在美国上市,商品名为mekinist。用于治疗伴有braf(鼠类肉瘤滤过性毒菌致癌同源体b1基因)v600e或v600k突变的不可切除或转移性黑色素瘤。
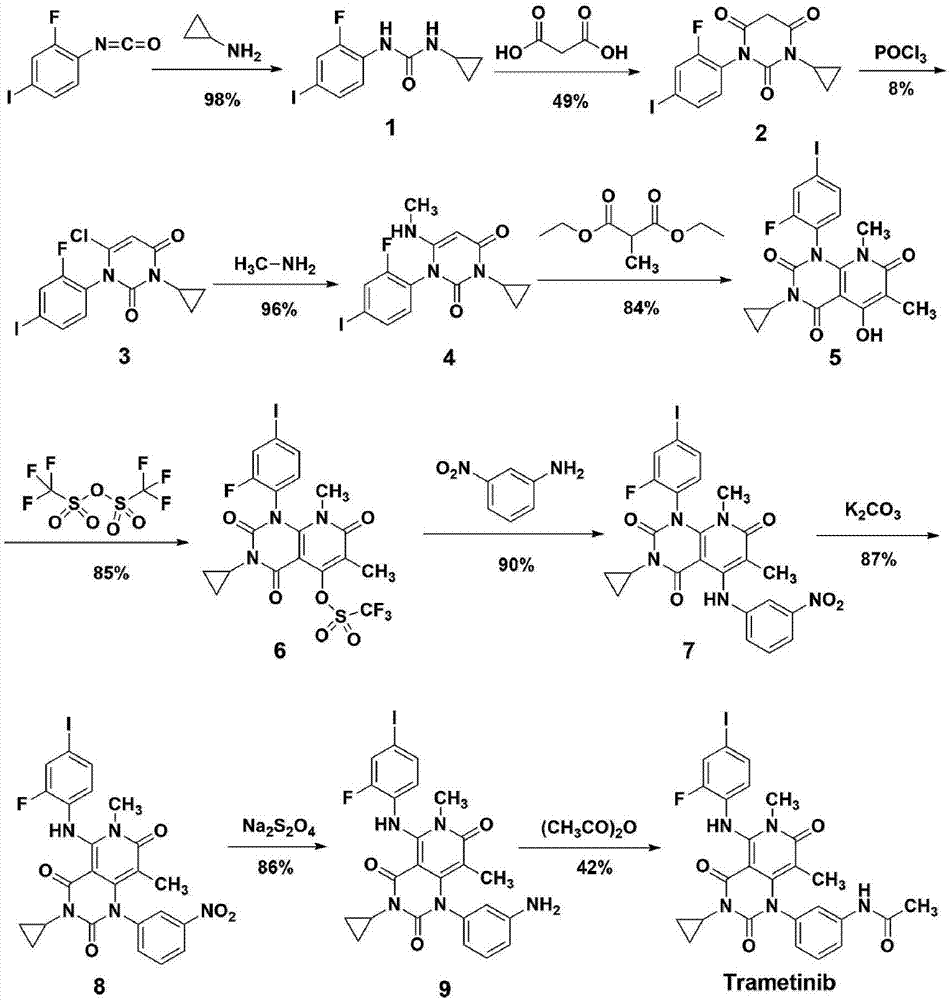
acsmedicinalchemistryletters,2011,2(4),320-324报道了其合成方法,如图1所示:采用2-氟-4-碘苯异氰酸酯和环丙基胺制备得到脲1,再与丙二酸进行环合得嘧啶三酮化合物2,嘧啶三酮化合物2与pocl3进行选择性氯代得到氯代物3,其后与甲胺反应得到化合物4,化合物4与2-甲基丙二酸二乙酯缩合得到吡啶并嘧啶化合物5,将吡啶并嘧啶化合物5中oh进行三氟甲磺酰化得化合物6后,与3-氨基硝基苯发生取代反应得化合物7,碱性条件下发生酰胺交换反应得化合物8,于na2s2o4下硝基还原得氨基化合物9,最后经过醋酐反应得到目标化合物曲美替尼。该方法步骤较多,且个别步骤产率较低,如选择性氯代产率仅8%,最后一步酰化产率也仅42%,导致总产率低,合成成本较高。
wo2005121142报道采用脲类化合物1与氰基乙酸进行反应得酰胺化合物10,碱性条件下进行环合得嘧啶二酮胺化合物11,缩合后得希夫氏碱12,希夫氏碱12经硼氢化钠还原得化合物4,化合物4再与甲基丙二酸在醋酐环境下缩合得到化合物5,采用上述类似的方法进行磺酸酯化,产物13直接与3-乙酰氨基苯胺进行缩合得到化合物14,最后在碱性条件下酰胺交换反应得目标物曲美替尼,见图2。然而,该方法仍然存在步骤较多,缩合得化合物5的一步产率较低。
即便将两种方法的优缺点进行互补,只能改变产率较低的缩合步骤及取代步骤的原料,对总产率可能具有一定的提高作用,但并没有改变反应路线设计的思路,操作依然比较繁琐,步骤较多的问题也难以解决。
当然也有如medchemlett,2011,2(6),320-324报道了与上述两方法不同的引入取代苯胺的顺序,即先将3-乙酰氨基苯胺结构,进行环的构建,最后再引入2-氟4-碘苯胺,该方法的优势在于避免了前两种方法进行碱性条件下酰胺交换过程,但整个路线比较繁冗,中间体控制较难,工艺稳定性将面临较大难度。
技术实现要素:
本发明所要解决的技术问题是针对现有技术的不足,通过逆合成分析,设计了一条曲美替尼的合成的新路线,以大大缩短曲美替尼合成工艺流程。
为了解决上述技术问题,本发明公开了一种曲美替尼的合成方法,包括如下步骤:
s1:采用n-(2-氟-4-碘苯基)-n’-甲基脲脱水成碳二亚胺后,与2-甲基-3-氧代-戊二酸二乙酯进行环合反应得2-(2-氟-4-碘苯基氨基)-4-羟基-1,5-二甲基-6-氧代-1,6-二氢吡啶-3-羧酸乙酯;
s2:将步骤s1制备的2-(2-氟-4-碘苯基氨基)-4-羟基-1,5-二甲基-6-氧代-1,6-二氢吡啶-3-羧酸乙酯与n-(3-硝基苯基)-n’-环丙基脲进行环合得3-环丙基-5-(2-氟-4-碘苯基氨基)-6,8-甲基-1-(3-硝基苯基)吡啶并[4,3-d]嘧啶-2,4,7(1h,3h,6h)-三酮;
s3:将步骤s2得到的3-环丙基-5-(2-氟-4-碘苯基氨基)-6,8-甲基-1-(3-硝基苯基)吡啶并[4,3-d]嘧啶-2,4,7(1h,3h,6h)-三酮先还原硝基,再进行乙酰化即得曲美替尼。
其中,步骤s1具体包括如下步骤:
s1.1:在n-(2-氟-4-碘苯基)-n’-甲基脲和三乙胺的二氯甲烷中,加入cbr4和三苯基膦,室温反应5~7h,浓缩,得n-(2-氟-4-碘苯基)-n’-甲基碳二亚胺粗品;
s1.2:在2-甲基-3-氧代-戊二酸二乙酯的干燥thf溶液中,0℃下加入乙醇钠,慢慢滴加步骤s1.1制得的n-(2-氟-4-碘苯基)-n’-甲基碳二亚胺粗品的thf溶液,于室温下反应2h,然后升温至40~60℃下反应10~14h,加入稀盐酸中和,乙酸乙酯提取水相,合并有机层,水洗,干燥,过滤,浓缩,硅胶柱分离,得到油状物2-(2-氟-4-碘苯基氨基)-4-羟基-1,5-二甲基-6-氧代-1,6-二氢吡啶-3-羧酸乙酯。
步骤s2具体包括如下步骤:
s2.1:在n-(3-硝基苯基)-n’-环丙基脲的thf溶液中,于0℃下分批加入乙醇钠,升至室温,加入步骤s1制备的2-(2-氟-4-碘苯基氨基)-4-羟基-1,5-二甲基-6-氧代-1,6-二氢吡啶-3-羧酸乙酯溶于thf的溶液,然后升温至50~70℃反应8~12h,冷至室温;
s2.2:将步骤s2.1得到的溶液采用浓盐酸调节ph至2-3,浓缩,得粘稠状固体,加入二氯甲烷溶解,水洗,干燥,浓缩,残留物用丙酮重结晶得3-环丙基-5-((2-氟-4-碘苯基氨基)-6,8-甲基-1-(3-硝基苯基)吡啶并[4,3-d]嘧啶-2,4,7(1h,3h,6h)-三酮。
步骤s3具体包括如下步骤:
s3.1:在步骤s2制备的3-环丙基-5-((2-氟-4-碘苯基氨基)-6,8-甲基-1-(3-硝基苯基)吡啶并[4,3-d]嘧啶-2,4,7(1h,3h,6h)-三酮溶于dmf的溶液中,一次性加入联二亚硫酸钠和水,混合液加热至80~100℃反应1~2h,冷却至室温,反应混合液用水稀释,得到沉淀,过滤,水洗,真空干燥得3-环丙基-5-((2-氟-4-碘苯基氨基)-6,8-甲基-1-(3-氨基苯基)吡啶并[4,3-d]嘧啶-2,4,7(1h,3h,6h)-三酮;
s3.2:于0℃下,在步骤s3.1制备的3-环丙基-5-((2-氟-4-碘苯基氨基)-6,8-甲基-1-(3-氨基苯基)吡啶并[4,3-d]嘧啶-2,4,7(1h,3h,6h)-三酮的吡啶和氯仿悬浮液中加入乙酸酐,室温下搅拌2~3h,混合液倒入稀盐酸中,分液,水层用氯仿提取,合并有机层,饱和食盐水洗涤,干燥,浓缩,乙酸乙酯重结晶两次,得白色粉末曲美替尼。
优选地,步骤s1.1中,n-(2-氟-4-碘苯基)-n’-甲基脲、cbr4、三苯基膦和三乙胺的摩尔比为1:1:1:4。
步骤s1.2中,2-甲基-3-氧代-戊二酸二乙酯、乙醇钠和步骤s1.1中n-(2-氟-4-碘苯基)-n’-甲基脲的摩尔比为0.85~1:0.9~1.1:1。
优选地,步骤s2.1中,n-(3-硝基苯基)-n’-环丙基脲、乙醇钠和2-(2-氟-4-碘苯基氨基)-4-羟基-1,5-二甲基-6-氧代-1,6-二氢吡啶-3-羧酸乙酯的反应摩尔比为1.1~1.3:2.5~3:1。
优选地,步骤s3.1中,联二亚硫酸钠和3-环丙基-5-((2-氟-4-碘苯基氨基)-6,8-甲基-1-(3-硝基苯基)吡啶并[4,3-d]嘧啶-2,4,7(1h,3h,6h)-三酮的反应摩尔比为:2.5~3:1。
步骤s3.2中,乙酸酐与3-环丙基-5-((2-氟-4-碘苯基氨基)-6,8-甲基-1-(3-氨基苯基)吡啶并[4,3-d]嘧啶-2,4,7(1h,3h,6h)-三酮的反应摩尔比为:1~1.3:1。
有益效果:
本发明通过逆合成分析,采用n-(2-氟-4-碘苯基)-n’-甲基脲脱水成碳二亚胺后,与2-甲基-3-氧代-戊二酸二乙酯进行环合反应得2-(2-氟-4-碘苯基氨基)-4-羟基-1,5-二甲基-6-氧代-1,6-二氢吡啶-3-羧酸乙酯,再与n-(3-硝基苯基)-n’-环丙基脲进行环合,最后原硝基,再进行乙酰化得曲美替尼,该新合成路线工艺流程大大缩短,未使用昂贵试剂,具有操作简便,成本较低的优势,为曲美替尼的制备提供了参考。
附图说明
下面结合附图和具体实施方式对本发明做更进一步的具体说明,本发明的上述和/或其他方面的优点将会变得更加清楚。
图1为acsmedicinalchemistryletters报道的合成曲美替尼的具体路线图;
图2为wo2005121142报道的合成曲美替尼的具体路线图;
图3为本发明合成曲美替尼工艺的具体路线图。
具体实施方式
根据下述实施例,可以更好地理解本发明。
实施例1
按照图3所示路线图制备合成曲美替尼:
s1:n-(2-氟-4-碘苯基)-n’-甲基脲(15g,51.0mmol)和三乙胺(28.3ml,204mmol)的二氯甲烷(250ml)中,加入cbr4(33.8g,102mmol)和三苯基膦(26.8g,102mmol),室温反应6h,浓缩,得n-(2-氟-4-碘苯基)-n’-甲基碳二亚胺粗品;2-甲基-3-氧代-戊二酸二乙酯(9.56g,44.2mmol)的干燥thf(100ml)溶液中,0℃下加入乙醇钠(50mmol),慢慢滴加上诉粗品的thf(150ml)溶液,于室温下反应2h,于50℃下反应12h,加入稀盐酸(1mol/l,80ml),乙酸乙酯(一次50ml,共三次)提取水相,合并有机层,水洗,干燥,过滤,浓缩,硅胶柱分离(200目,流动相环己烷/乙酸乙酯),得到油状物2-(2-氟-4-碘苯基氨基)-4-羟基-1,5-二甲基-6-氧代-1,6-二氢吡啶-3-羧酸乙酯(8.8g),两步产率44.7%(以2-甲基-3-氧代-戊二酸二乙酯计算)。hrms=447.0163[m+h]+,1hnmr(400hz,cdcl3)11.1(1h,brs),8.29(1h,brs),7.53(1h,dd,j1=10.4hz,j2=2.0hz),7.33(1h,d,j=8.4hz),6.39(1h,t,j=8.4hz),4.37(2h,q,j=7.2hz),3,41(3h,s),2.02(3h,s),1.33(3h,t,j=7.2hz);
s2:n-(3-硝基苯基)-n’-环丙基脲(22.1g,100mmol)的thf(500ml)溶液中,于0℃下,分批加入乙醇钠(15.6g,229mmol),升至室温,加入步骤s1制备的2-(2-氟-4-碘苯基氨基)-4-羟基-1,5-二甲基-6-氧代-1,6-二氢吡啶-3-羧酸乙酯(36.2g,81mmol)溶于thf(500ml)的溶液,于60℃反应10h,冷至室温,浓盐酸调节ph至2-3,浓缩,得粘稠状固体,加入二氯甲烷(600ml),水洗(一次150ml,共三次),干燥,浓缩,残留物用丙酮重结晶得3-环丙基-5-((2-氟-4-碘苯基氨基)-6,8-甲基-1-(3-硝基苯基)吡啶并[4,3-d]嘧啶-2,4,7(1h,3h,6h)-三酮(化合物8,24.5g),产率50.1%,hrms=604.0442[m+h]+;
s3:在步骤s2制备的化合物8(7.6g,12.6mmol)的dmf(100ml)溶液中,一次性加入联二亚硫酸钠(6.2g,35.4mmol)和水(5ml),混合液加热至90℃1h,冷却至室温,反应混合液用水(250ml)稀释,得到沉淀,过滤,水洗,真空干燥得化合物9(5.9g),产率81.7%,hrms=574.0665[m+h]+;于0℃下,化合物9(10g,17.4mmol)的吡啶(100ml)和氯仿(200ml)悬浮液中加入乙酸酐(2ml,20.9mmol)。室温搅拌2h,混合液倒入稀盐酸(1mol/l,500ml)中,分液,水层用氯仿(一次150ml,共两次)提取,合并有机层,饱和食盐水(200ml)洗涤,干燥,浓缩,乙酸乙酯重结晶两次,得白色粉末曲美替尼(4.8g),产率44.8%。hrms=616.0802[m+h]+;1hnmr(400mhz,dmso-d6)11.07(s,1h),10.06(1h,s),7.77(1h,dd,j1=10.4hz,j2=1.9hz),7.55-7.61(2h,m),7.56(1h,d,j=8.4hz),7.36(1h,dd,j1=8.2hz,j2=7.2hz),7.02(1h,m),6.92(1h,dd,j1=8.6hz,j2=8.2hz),3.06(3h,s),2.63(1h,tt,j1=7.2hz,j2=4.2hz),2.04(3h,s),1.25(3h,s),0.94-0.97(2h,m),0.66-0.69(2h,m)。
实施例2
s1:n-(2-氟-4-碘苯基)-n’-甲基脲(15g,51.0mmol)和三乙胺(28.3ml,204mmol)的二氯甲烷(250ml)中,加入cbr4(33.8g,102mmol)和三苯基膦(26.8g,102mmol),室温反应6h,浓缩,得n-(2-氟-4-碘苯基)-n’-甲基碳二亚胺粗品;2-甲基-3-氧代-戊二酸二乙酯(9.36g,43.4mmol)的干燥thf(100ml)溶液中,0℃下加入乙醇钠(45.9mmol),慢慢滴加上诉粗品的thf(150ml)溶液,于室温下反应2h,于40℃下反应14h,加入稀盐酸(1mol/l,80ml),乙酸乙酯(一次50ml,共三次)提取水相,合并有机层,水洗,干燥,过滤,浓缩,硅胶柱分离(200目,流动相环己烷/乙酸乙酯),得到油状物2-(2-氟-4-碘苯基氨基)-4-羟基-1,5-二甲基-6-氧代-1,6-二氢吡啶-3-羧酸乙酯(8.2g),两步产率41.7%(以2-甲基-3-氧代-戊二酸二乙酯计算);
s2:n-(3-硝基苯基)-n’-环丙基脲(19.7g,89.1mmol)的thf(500ml)溶液中,于0℃下,分批加入乙醇钠(13.8g,202.5mmol),升至室温,加入步骤s1制备的2-(2-氟-4-碘苯基氨基)-4-羟基-1,5-二甲基-6-氧代-1,6-二氢吡啶-3-羧酸乙酯(36.2g,81mmol)溶于thf(500ml)的溶液,于50℃反应12h,冷至室温,浓盐酸调节ph至2-3,浓缩,得粘稠状固体,加入二氯甲烷(600ml),水洗(一次150ml,共三次),干燥,浓缩,残留物用丙酮重结晶得3-环丙基-5-((2-氟-4-碘苯基氨基)-6,8-甲基-1-(3-硝基苯基)吡啶并[4,3-d]嘧啶-2,4,7(1h,3h,6h)-三酮(化合物8,23.1g),产率47.2%;
s3:在步骤s2制备的化合物8(7.6g,12.6mmol)的dmf(100ml)溶液中,一次性加入联二亚硫酸钠(5.5g,31.5mmol)和水(5ml),混合液加热至80℃反应2h,冷却至室温,反应混合液用水(250ml)稀释,得到沉淀,过滤,水洗,真空干燥得化合物9(5.9g),产率81.7%,hrms=574.0665[m+h]+;于0℃下,化合物9(10g,17.4mmol)的吡啶(100ml)和氯仿(200ml)悬浮液中加入乙酸酐(1.8ml,17.4mmol)。室温搅拌2h,混合液倒入稀盐酸(1mol/l,500ml)中,分液,水层用氯仿(一次150ml,共两次)提取,合并有机层,饱和食盐水(200ml)洗涤,干燥,浓缩,乙酸乙酯重结晶两次,得白色粉末曲美替尼(4.6g),产率42.9%。
实施例3
s1:n-(2-氟-4-碘苯基)-n’-甲基脲(15g,51.0mmol)和三乙胺(28.3ml,204mmol)的二氯甲烷(250ml)中,加入cbr4(33.8g,102mmol)和三苯基膦(26.8g,102mmol),室温反应6h,浓缩,得n-(2-氟-4-碘苯基)-n’-甲基碳二亚胺粗品;2-甲基-3-氧代-戊二酸二乙酯(11.03g,51mmol)的干燥thf(100ml)溶液中,0℃下加入乙醇钠(56.1mmol),慢慢滴加上诉粗品的thf(150ml)溶液,于室温下反应2h,于60℃下反应10h,加入稀盐酸(1mol/l,80ml),乙酸乙酯(一次50ml,共三次)提取水相,合并有机层,水洗,干燥,过滤,浓缩,硅胶柱分离(200目,流动相环己烷/乙酸乙酯),得到油状物2-(2-氟-4-碘苯基氨基)-4-羟基-1,5-二甲基-6-氧代-1,6-二氢吡啶-3-羧酸乙酯(8.4g),两步产率42.7%(以2-甲基-3-氧代-戊二酸二乙酯计算);
s2:n-(3-硝基苯基)-n’-环丙基脲(23.3g,105.3mmol)的thf(500ml)溶液中,于0℃下,分批加入乙醇钠(16.6g,243mmol),升至室温,加入步骤s1制备的2-(2-氟-4-碘苯基氨基)-4-羟基-1,5-二甲基-6-氧代-1,6-二氢吡啶-3-羧酸乙酯(36.2g,81mmol)溶于thf(500ml)的溶液,于70℃反应8h,冷至室温,浓盐酸调节ph至2-3,浓缩,得粘稠状固体,加入二氯甲烷(600ml),水洗(一次150ml,共三次),干燥,浓缩,残留物用丙酮重结晶得3-环丙基-5-((2-氟-4-碘苯基氨基)-6,8-甲基-1-(3-硝基苯基)吡啶并[4,3-d]嘧啶-2,4,7(1h,3h,6h)-三酮(化合物8,23.6g),产率48.3%;
s3:在步骤s2制备的化合物8(7.6g,12.6mmol)的dmf(100ml)溶液中,一次性加入联二亚硫酸钠(6.6g,37.8mmol)和水(6ml),混合液加热至100℃1h,冷却至室温,反应混合液用水(250ml)稀释,得到沉淀,过滤,水洗,真空干燥得化合物9(5.9g),产率81.7%,hrms=574.0665[m+h]+;于0℃下,化合物9(10g,17.4mmol)的吡啶(100ml)和氯仿(200ml)悬浮液中加入乙酸酐(2.2ml,22.6mmol)。室温搅拌3h,混合液倒入稀盐酸(1mol/l,500ml)中,分液,水层用氯仿(一次150ml,共两次)提取,合并有机层,饱和食盐水(200ml)洗涤,干燥,浓缩,乙酸乙酯重结晶两次,得白色粉末曲美替尼(4.5g),产率42.0%。
本发明提供了一种曲美替尼的合成方法的思路及方法,具体实现该技术方案的方法和途径很多,以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。本实施例中未明确的各组成部分均可用现有技术加以实现。
- 还没有人留言评论。精彩留言会获得点赞!