特异性识别Vimentin的核酸适配体及其应用的制作方法
本发明属于生物技术领域,具体涉及特异性识别vimentin的核酸适配体及其应用。
背景技术:
波形蛋白(vimentin,vim)是一种主要表达于间充质细胞中和中胚层来源的细胞中的中间丝蛋白。vimentin在进化上高度保守,参与多种生理学进程:维持细胞骨架形态,促进细胞黏附与迁移,调节细胞凋亡、信号转导、基因调节等。vimentin是肿瘤细胞发生上皮间质转化(emt)过程中的主要分泌蛋白,因此近年来成为了鉴定emt发生的重要标志物。而大量研究表明vimentin在多种上皮性恶性肿瘤中过度表达,通过参与emt与多种复杂的信用通路,加速肿瘤生长,促进癌细胞的浸润与转移,对癌症的发展与形成起重要作用。dna甲基化在基因水平下调肿瘤癌前病变相关vimentin蛋白的表达,因此vimentin甲基化程度也可作为胃癌、胰腺癌、结肠癌等多种癌症的诊断、分期与预后等指标。研究证实vimentin的过表达可引起癌细胞能动性与侵袭性的增强,敲除其表达后这些特性减弱,揭示其具有临床治疗价值。vimentin蛋白有望成为癌症临床预测的靶点,vimentin蛋白的研究同时也对癌症治疗具有重要价值(kosh,suhsh,kimbj,etal.expressionoftheintermediatefilamentvimentininproliferatingductcellsasamarkerofpancreaticprecursorcells[j].pancreas,2004,28(2):121-128;satellia,lis.vimentinincanceranditspotentialasamoleculartargetforcancertherapy[j].cellular&molecularlifesciences,2011,68(18):3033-3046;fuyuhiroy,yashirom,nodas,etal.clinicalsignificanceofvimentin-positivegastriccancercells[j].anticancerresearch,2010,30(12):5239-43;shirahataa,sakatam,sakurabak,etal.vimentinmethylationasamarkerforadvancedcolorectalcarcinoma.[j].anticancerresearch,2009,29(1):279-281)。
近年来发展的vimentin单克隆抗体虽然具有较高的亲和性和特异性,但抗体本身所具有的一些缺陷,如高免疫原性、不稳定、化学修饰困难、批次间的差异性、生产方法有限及生产成本昂贵等,使其在基础研究和临床应用上受到一定的局限性。
核酸适配体(aptamer)是利用体外筛选技术—基于指数富集的配体系统进化(systematicevolutionofligandsbyexponentialenrichment,selex)技术从大容量核酸分子文库中筛选得到的一段以较高特异性和亲和力结合靶物质的单链dna或rna寡核苷酸序列。核酸适配体在亲和力和特异性方面可媲美抗体,并具有一些抗体没有的优势:由于其小分子核酸的理化性质,核酸适配体免疫原性低,具有快速的组织穿透和细胞内化能力、较高的热/化学稳定性;并且核酸适配体的筛选周期短,易于化学修饰或偶联不同的功能基团,合成技术简单,批次间重复性强等。因此核酸适配体在基础研究与临床应用中具有优良的前景(sunh,zuy.ahighlightofrecentadvancesinaptamertechnologyanditsapplication.molecules2015,20(7):11959-80;
技术实现要素:
本发明的一个目的是提供一种用于特异性识别波形蛋白(vimentin)的核酸适配体及其核心序列。
本发明提供的核酸适配体的核心序列为如下a1)-a3)中任一种:
a1)seqidno.1第19-58位所示的单链dna分子;
a2)与seqidno.1第19-58位所示的单链dna分子具有60%或60%以上同源性,且具有相同功能的单链dna分子;
a3)将seqidno.1第19-58位所示的单链dna分子删除或增加一个或几个核苷酸,且具有相同功能的单链dna分子。
所述核酸适配体为如下b1)-b3)中任一种:
b1)seqidno.1所示的单链dna分子;
b2)与seqidno.1所示的单链dna分子具有60%或60%以上同源性,且具有相同功能的单链dna分子;
b3)将seqidno.1所示的单链dna分子删除或增加一个或几个核苷酸,且具有相同功能的单链dna分子。
所述“同源性”指与天然核酸序列的序列相似性。“同源性”包括与本发明的核酸适配体或其核心序列具有60%或更高,具有65%或更高,70%或更高,75%或更高,80%或更高,85%或更高,或90%或更高,或95%或更高同源性的核苷酸序列。同源性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同源性可以用百分比(%)表示,其可以用来评价相关序列之间的同源性。
上述核酸适配体及其核心序列均属于本发明的保护范围。
本发明的另一个目的是提供一种用于特异性识别波形蛋白的核酸适配体的衍生物。
本发明提供的用于识别和/或结合波形蛋白的核酸适配体的衍生物为如下(1)-(5)任意一种:
(1)将上述核酸适配体或其核心序列进行核苷酸取代或修饰,得到与所述核酸适配体具有相同功能的核酸适配体的衍生物;
(2)将上述核酸适配体或其核心序列的骨架改造为硫代磷酸脂骨架,得到与所述核酸适配体具有相同功能的核酸适配体的衍生物;
(3)将上述核酸适配体或其核心序列的一端或中间连接上信号分子和/或活性分子和/或功能基团,得到与所述核酸适配体具有相同功能的核酸适配体的衍生物;
(4)由上述核酸适配体或其核心序列编码的rna分子;
(5)由上述核酸适配体或其核心序列编码的肽核酸。
上述衍生物中,所述(3)中的衍生物可为标记荧光分子cy3或生物素分子biotin的核酸适配体,如在所述核酸适配体5’端标记荧光分子cy3或生物素分子biotin的核酸适配体。
本发明还有一个目的是提供上述核酸适配体或上述衍生物的新用途。
本发明提供了上述核酸适配体或上述衍生物在特异性识别和/或结合波形蛋白中的应用。
本发明还提供了上述核酸适配体或上述衍生物在制备特异性识别和/或结合波形蛋白的产品中的应用。
本发明还提供了上述核酸适配体或上述衍生物在检测或辅助检测波形蛋白中的应用。
本发明还提供了上述核酸适配体或上述衍生物在制备检测或辅助检测波形蛋白的产品中的应用。
本发明还提供了上述核酸适配体或上述衍生物在鉴定或辅助鉴定肿瘤细胞是否发生emt中的应用。
本发明还提供了上述核酸适配体或上述衍生物在制备鉴定或辅助鉴定肿瘤细胞是否发生emt的产品中的应用。
上述应用中,所述肿瘤细胞为vimentin阳性肿瘤细胞。
本发明还提供了上述核酸适配体或上述衍生物在作为emt诊断试剂中的应用。
本发明还提供了上述核酸适配体或上述衍生物在诱导肿瘤凋亡中的应用。
本发明还提供了上述核酸适配体或上述衍生物在制备诱导肿瘤细胞凋亡的产品中的应用。
本发明还提供了上述核酸适配体或上述衍生物在开发肿瘤治疗的药物中的应用。
上述应用中,所述肿瘤可为常见的肿瘤,如胃癌、胰腺癌、结肠癌等。
本发明还有一个目的是提供一种细胞或组织表达的波形蛋白的检测方法。
本发明提供的细胞或组织表达的波形蛋白的检测方法包括用上述核酸适配体或上述衍生物进行检测的步骤。
上述细胞或组织表达的波形蛋白的检测方法中,所述用上述核酸适配体或上述衍生物进行检测的方法可为现有技术中的常规方法,如免疫组化(ihc)、westernblot、流式实验和dotblot实验等。
上述细胞或组织表达的波形蛋白的检测方法中,所述核酸适配体末端连接生物素或荧光分子,如cy3或biotin。
本发明的最后一个目的是提供一种诱导肿瘤细胞凋亡的方法。
本发明提供的诱导肿瘤细胞凋亡的方法包括将上述核酸适配体或上述衍生物导入肿瘤细胞中的步骤。
上述诱导肿瘤细胞凋亡的方法中,所述核酸适配体经转染试剂包裹后导入肿瘤细胞中。
进一步的,所述核酸适配体在肿瘤细胞体系中的终浓度为1-2μm,如1μm、1.5μm或2μm。
更进一步的,所述转染试剂可为常见的转染试剂,如turbofect。
上述诱导肿瘤细胞凋亡的方法中,所述肿瘤细胞可为常见的肿瘤细胞,如结肠癌细胞、胰腺癌细胞、胃癌细胞等。所述胰腺癌细胞具体可为panc-1细胞或bxpc-3细胞。
本发明以vimentin为靶分子,利用selex技术筛选获得可特异性识别并结合vimentin的核酸适配体aptvim,其kd值可达到70.9±12.3nm。本发明的核酸适配体aptvim可用于emt特异靶点vimentin的鉴定,相较于传统vimentin抗体,核酸适配体aptvim不仅稳定性更高,成本更加低廉,并且其所需的反应条件更加简单,如孵育时间更短、反应温度更接近室温,在核酸适配体aptvim末端连接生物素或荧光分子后通常仅需一步便可完成细胞表达或组织表达vimentin蛋白的检测。另外,本发明的核酸适配体aptvim经合适的转染试剂(如turbofect)导入肿瘤细胞后,可诱导肿瘤细胞发生凋亡。因此本发明的核酸适配体aptvim不仅可作为基础实验与临床癌症的emt诊断试剂,也可诱导肿瘤细胞的凋亡用于肿瘤治疗。基于本发明的核酸适配体aptvim的进一步研究与改进有望产生新的靶向药物或治疗方法,为癌症治疗提供新工具。
附图说明
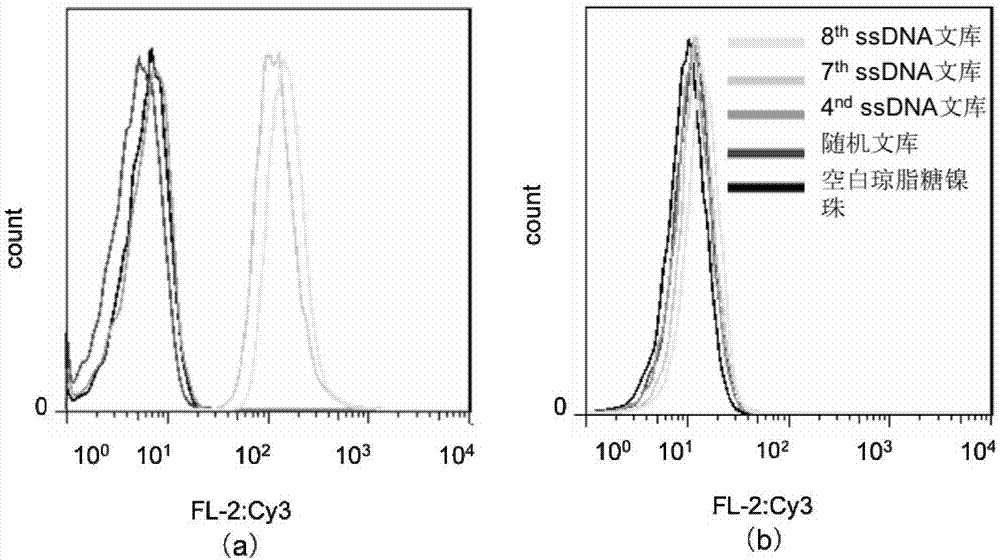
图1为selex筛选中核酸适配体富集情况的流式实验结果图。图a为第4、7、8轮筛选得到的ssdna产物、随机文库与vimentin蛋白偶联琼脂糖镍珠的结合情况;图b(阴性对照组)为第4、7、8轮筛选得到的ssdna产物、随机文库与无偶联琼脂糖镍珠的结合情况。
图2为selex筛选中核酸适配体富集情况的dotblot实验结果图。随机文库为阴性对照。
图3为核酸适配体aptvim的二级结构预测图。
图4为核酸适配体aptvim与vimentin蛋白偶联琼脂糖镍珠的结合情况的流式实验结果图。图a为核酸适配体aptvim、随机文库与vimentin蛋白偶联琼脂糖镍珠的结合情况;图b(阴性对照)为核酸适配体aptvim、随机文库与6x组氨酸多肽偶联琼脂糖镍珠的结合情况。
图5为核酸适配体aptvim与vimentin蛋白结合情况的dotblot实验结果图。随机文库为阴性对照。
图6为不同浓度下的核酸适配体aptvim与vimentin蛋白偶联的琼脂糖镍珠的结合情况。阴性对照为6x组氨酸多肽偶联的琼脂糖镍珠。
图7为核酸适配体aptvim、vimentin抗体分别对vimentin蛋白检测的westernblot结果。
图8为核酸适配体aptvim、vimentin抗体分别与肝癌组织vimentin蛋白结合的免疫组化结果。
图9为不同实验组诱导vimentin阳性细胞的凋亡率统计。vimentin阳性细胞株panc-1与bxpc-3分别进行不同实验处理,实验设置包括对照组(nc)、turbofect处理组、turbofect+随机文库处理组、aptvim处理组、turbofect+aptvim处理组。纵轴为细胞的早期凋亡率(annexinv+/pi-细胞比例)。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
下述实施例中所使用的实验材料来源如下:重组人vimentin蛋白(6x组氨酸标签)购自北京义翘神州公司;nc膜、ni-sepharosebeads、nap-5脱盐柱购自gelifesciences;6x组氨酸多肽(纯度>95%)购自中肽生化有限公司;dpbs(含有ca2+和mg2+)、streptavidinagarosebeads、trna、turbofect转染试剂、非酶消化液购自thermofisherscientific;bsa(无蛋白酶)购自sigma-aldrich;ripa裂解液、bca蛋白定量试剂盒、tween-20、depc水、ecl发光试剂盒、免疫组化相关试剂购自碧云天生物技术公司;氢氧化钠、琼脂糖购自上海生工生物工程有限公司;hstaqpcr试剂盒购自takara;humanvimentinbiotinylatedantibody、humanβ-actinantibody、hrp-conjugatedanti-mouseiggsecondaryantibody、tacsannexinv-fitc凋亡试剂盒、streptavidin-hrp购自r&dsystems;胰腺癌细胞株panc-1(vimentin+,编号为scsp-535)和bxpc-3(vimentin-,编号为tchu12)购自中科院细胞库,使用dmem/10%fbs培养基培养。
下述实施例中所涉及的selex初始文库序列:5’-atccagagtgacgcagca-n(40)-tggacacggtggcttagt-3’、上游引物序列:5’-atccagagtgacgcagca、下游引物序列:5’-actaagccaccgtgtcca、特异的核酸适配体序列、引物序列及其5’端cy3或biotin修饰均由上海生工生物合成并经hplc纯化。
实施例1、核酸适配体的筛选
一、随机文库的设计与合成
设计并合成两端包括18个固定核苷酸、中间包括40个核苷酸的随机文库:5’-atccagagtgacgcagca-n(40)-tggacacggtggcttagt-3’;n(40)代表40个a、t、c或g的随机核苷酸序列。
二、selex筛选
selex筛选流程分为正向筛选和负向筛选两部分。具体步骤如下:
1、正向筛选
将10μg重组人vimentin蛋白(6x组氨酸标签)与适量琼脂糖镍珠(ni-sepharosebeads)室温孵育30分钟,使其偶联至琼脂糖镍珠上,bindingbufferⅰ(1%bsa,0.1%tween-20,0.2mg/mltrna,dpbs,ph7.4)重悬备用、洗涤除去未结合物,以此为正向筛选的靶标。将10od(约14nmol)步骤一中的随机文库95℃变性,并缓慢冷却至室温后,加入上述制备好的vimentin蛋白偶联的琼脂糖镍珠中室温孵育1小时。将琼脂糖镍珠洗涤后用depc水重悬,95℃变性10分钟,离心后收集上清作为模板进行pcr扩增(95℃30s;56.3℃30s;72℃30s)。pcr扩增的引物序列如下:上游引物序列:5’-atccagagtgacgcagca;下游引物序列:5’-actaagccaccgtgtcca。pcr产物通过3%琼脂糖电泳鉴定,选择没有非特异条带的最高扩增循环数作为大量制备pcr产物的条件,以此对每轮筛选中的pcr循环数进行具体优化。
2、ssdna文库制备
5’端cy3修饰的ssdna文库的制备方法如下:用5’端cy3修饰的上游引物和5’端biotin修饰的下游引物进行pcr扩增,将biotin化的pcr产物偶联到链霉亲和素琼脂糖珠(streptavidinagarosebeads)上,200mmnaoh解离上游单链,经nap-5柱脱盐纯化,即为5’端cy3修饰的ssdna文库;5’端biotin修饰的ssdna文库的制备方法如下:用5’端biotin修饰的上游引物和无标签的下游引物扩增,将biotin化的pcr产物偶联至链霉亲和素琼脂糖珠,200mmnaoh解离后弃下游单链,加入50μl0.1%sds,100℃煮沸5min,取离心后上清过nap-5柱脱盐纯化,即为5’端biotin修饰的ssdna文库。以上述制备的ssdna文库为模板进行下一轮筛选,并逐渐降低vimentin蛋白、vimentin蛋白偶联的琼脂糖镍珠的用量以及ssdna文库浓度,逐次缩短筛选时间。正向筛选过程重复了8轮。
3、负向筛选过程
为减少筛选文库中非特异核酸序列的富集,在正向筛选的同时引入负向筛选。负向筛选和正向筛选过程基本相同,所不同的是,以偶联6x组氨酸多肽的琼脂糖镍珠作为筛选靶标,文库为上一轮正向筛选制备的ssdna文库,并在筛选过程中逐渐降低ssdna文库的浓度、增加偶联6x组氨酸多肽的琼脂糖镍珠的用量,并延长孵育时间。负向筛选在第4、7、8轮正向筛选后进行。
三、流式实验与dotblot实验检测各轮筛选文库富集程度
分别采用流式实验与dotblot实验检测各轮筛选文库富集程度。具体步骤如下:
1、流式实验
取1μl洗涤重悬后的琼脂糖镍珠与1μgvimentin蛋白室温孵育30分钟,洗涤除去未结合物。将cy3标记的ssdna文库(或核酸适配体)95℃变性冷却至室温后,加入上述制备好的vimentin蛋白偶联的琼脂糖镍珠中(终浓度200nm),室温孵育1小时。洗涤后使用流式细胞仪(bdbioscience,facscalibur)检测ssdna文库(或核酸适配体)的富集程度。
2、dotblot实验
将vimentin蛋白分次点样至nc膜上,室温干燥后用bindingbufferⅱ(3%bsa,0.1%tween-20,0.2mg/mltrna,dpbs,ph7.4)封闭。将ssdna文库95℃变性冷却后,用bindingbufferⅰ调整终浓度为200nm,与封闭好的nc膜室温孵育1小时。将streptavidin-hrp与nc膜室温反应45分钟,洗涤后ecl曝光。
selex筛选中核酸适配体富集的流式实验与dotblot实验结果图分别如图1和图2所示。流式实验与dotblot实验的结果均显示第7轮与第8轮正向筛选得到的ssdna文库已明显富集,且各文库均不与6x组氨酸多肽偶联的琼脂糖镍珠反应。
四、高通量测序获得核酸适配体aptvim
将第8轮正向筛选富集的ssdna文库用不带标签的上下游引物扩增(pcr条件同上),pcr产物送上海生工生物进行高通量测序(ngs),并分析文库中各核酸适配体序列的丰度,得到一条高丰度(丰度12.4%)的核酸适配体序列,其完整序列如下:5’-atccagagtgacgcagcacgggggtttaggcagacacctgacgcgttctggaaagtgctggacacggtggcttagt-3’(seqidno.1),将该核酸适配体序列命名为aptvim,其中seqidno.1第19~58位所示的序列(下划线部分的序列)为核酸适配体aptvim的核心区序列。
五、核酸适配体aptvim的二级结构分析
用mfold软件预测核酸适配体aptvim的二级结构,预测结构如图3所示。
实施例2、核酸适配体aptvim与vimentin蛋白的结合能力
一、流式实验与dotblot实验检测核酸适配体aptvim与vimentin蛋白的结合情况
按照实施例1中的方法分别合成5’端cy3修饰aptvim序列与5’端biotin修饰aptvim序列,分别采用流式实验与dotblot实验方法检测其与vimentin蛋白的结合情况。具体检测方法同实施例1步骤三中的方法。
流式检测结果与dotblot检测结果分别如图4和图5所示。结果显示,核酸适配体aptvim与vimentin蛋白明显结合,而不与6x组氨酸多肽结合。
二、核酸适配体aptvim的亲和力测定
为测定核酸适配体aptvim与vimentin蛋白的亲和力,将5’端cy3修饰aptvim的最终工作浓度调整为400nm、200nm、100nm、50nm、25nm、12.5nm、6.25nm、3.125nm,用流式细胞仪(方法同前)测定其在不同浓度下与vimentin蛋白结合的平均荧光密度(mfi),并用公式y=bmaxx/(kd+x)对亲和力(kds)进行计算。
不同浓度下aptvim与vimentin蛋白结合的流式结果如图6所示,经计算,核酸适配体aptvim与vimentin蛋白结合的亲和力为70.9±12.3nm。
三、westernblot检测aptvim与细胞vimentin蛋白的结合
胰腺癌细胞panc-1(vimentin+)和bxpc-3(vimentin-)经ripa裂解后,上清液通过bca法蛋白定量,取40μg细胞总蛋白经12%sds-page电泳分离后,转移至nc膜,bindingbufferⅱ封闭1小时,洗涤后备用。
aptvim检测组:用bindingbufferⅰ调整aptvim浓度至200nm与nc膜进行孵育。
vimentin抗体检测组(阳性对照):biotin化的vimentin抗体用不含trna的bindingbufferⅰ按1:2000稀释,与nc膜进行孵育。nc膜随后与streptavidin-hrp孵育45分钟,洗涤后ecl曝光。
核酸适配体aptvim、vimentin抗体分别对vimentin蛋白检测的westernblot结果如图7所示。结果显示,核酸适配体aptvim与vimentin抗体的检测效果相同,可特异地与panc-1细胞中的vimentin蛋白杂交,而在不表达vimentin的bxpc-3细胞中无条带显色。
四、免疫组化(ihc)检测aptvim与癌症组织vimentin蛋白的结合
病理诊断明确的肝细胞癌石蜡包埋组织切片经二甲苯脱蜡水化后备用。
aptvim染色组:组织切片经10mm枸橼酸纳(ph6.0)溶液在37℃条件下作用30分钟进行抗原修复,洗涤后经3%h2o2室温作用20分钟封闭内源性过氧化物酶,0.1%链霉亲和素(streptavidin)室温作用30分钟封闭内源性biotin。组织切片与aptvim(终浓度200nm)在室温下反应20分钟后,与streptavidin-hrp(1:800稀释)室温孵育20分钟,dab显色。
vimentin抗体染色组:其染色流程与aptvim染色组基本相同,所不同的是,抗原修复于95℃条件下进行,vimentin抗体(humanvimentinbiotinylatedantibody)与组织切片的孵育时间为90分钟。
核酸适配体aptvim和vimentin抗体分别与肝癌组织vimentin蛋白结合的免疫组化结果如图8所示。结果显示,尽管核酸适配体aptvim的染色条件更为简单,但其同样可以清晰地对肝癌组织中的vimentin蛋白进行特异性染色,达到与vimentin抗体染色同样的效果。
实施例3、核酸适配体aptvim诱导vimentin阳性细胞发生凋亡
将panc-1细胞与bxpc-3细胞分别接种于6孔板中过夜培养,根据处理试剂的不同分为如下各组:
aptvim+turbofect处理组:核酸适配体aptvim(以无血清dmem调整核酸适配体aptvim浓度至1μm)经turbofect包裹后,处理细胞24小时;
turbofect处理组:turbofect处理细胞24小时;
turbofect+随机文库处理组:随机文库(无血清dmem调整随机文库浓度至1μm)经turbofect包裹后,处理细胞24小时;
aptvim处理组:未经turbofect包裹,用核酸适配体aptvim直接处理细胞24小时,核酸适配体aptvim终浓度为1μm。
nc对照组:未用核酸适配体aptvim和turbofect处理。
各实验组经非酶消化液解离细胞,然后将各处理组的处理后细胞分别与fitc-annexinv抗体(1:100)和pi染料(1:10)室温孵育30分钟,再用dpbs洗涤后经流式细胞仪(facscalibur,bdbiosciences)检测annexinv+/pi-细胞比例,得到各实验组的annexinv+/pi-早期细胞凋亡率。
不同实验组诱导vimentin阳性细胞的早期凋亡率统计结果如图9所示。结果显示,核酸适配体aptvim经turbofect包裹后,可有效诱导vimentin阳性表达细胞panc-1发生明显凋亡(凋亡率为18.4%,**p<0.01),而其他处理组和vimentin阴性表达细胞bxpc-3均未发生明显凋亡。
序列表
<110>温州医科大学附属第一医院
<120>特异性识别vimentin的核酸适配体及其应用
<160>1
<170>patentinversion3.5
<210>1
<211>76
<212>dna
<213>人工序列(artificialsequence)
<400>1
atccagagtgacgcagcacgggggtttaggcagacacctgacgcgttctggaaagtgctg60
gacacggtggcttagt76
- 还没有人留言评论。精彩留言会获得点赞!