用于预测肾癌术后复发转移的分子诊断模型的制作方法
本发明涉及用于预测肾癌术后复发转移风险的单核苷酸多态性变异位点分子标记物及其应用,涉及用于预测肾癌术后高复发转移风险人群的界定。
背景技术:
在全球范围内,每年约有300000人被诊断为肾癌,每年约有129000人死于肾癌[1,2]。肾癌的主要组织学亚型为透明细胞癌(clearcellrenalcellcarcinoma,ccrcc),ccrcc约占所有肾癌病例的80%,为方便叙述,以下简称肾癌[2]。手术切除是目前局限性肾癌(i-ⅲ期)的主要治疗手段之一,约30%的局限性肾癌患者在外科手术切除后复发[3,4]。肾癌患者中存在肿瘤更具侵袭性的患者亚群,这些患者在手术后可以受益于辅助靶向治疗[5]。因此,局限性肾癌准确的复发转移风险评估是确定哪些患者需要辅助治疗的关键。目前,tnm分期和病理分级通常用于评估局限性肾癌患者术后的肿瘤复发转移风险。然而,相同tnm分期和病理分级的患者可能有不同的预后,因此,当前的分期系统的预测值亟待提高,这有望通过使用已验证的肿瘤相关分子标志物来实现。
目前已有报道几种多基因分类器来预测肾癌的复发转移风险[6-8],然而,迄今为止,在临床实践中仍然没有稳定可靠的分子标志物应用于预测肾癌术后复发转移风险评估。单核苷酸多态性(single-nucleotidepolymorphisms,snp)指在基因组水平上由单个核苷酸的变异所引起的dna序列多态性。它是人类可遗传的变异中最常见的一种,占所有已知多态性的80%以上。随着全基因组技术的不断发展,对包括癌症在内的与疾病结果相关的单核苷酸多态性的研究越来越深入[9-12]。
专利cn201680059656.8、cn201710872332.2和cn200680040739.9与肾癌预后相关的分子标志物(包括mirna、lncrna及蛋白等),但都是通过单个分子标记物进行检测。目前,还未见有基于利用单核苷酸多态性变异位点分类器对局限性肾癌患者进行术后复发转移风险预测的报道。
技术实现要素:
本发明所要解决的技术问题是克服单核苷酸多态性变异位点分子标记物在肾癌术后复发转移风险预测方面存在的缺陷和不足,提供一组用于预测肾癌术后复发转移风险的单核苷酸多态性变异位点的分子标记物rs4718593、rs7934644、rs17050001、rs9618567、rs7739947和rs4479520,通过综合分析上述六个单核苷酸多态性变异位点在局限性肾癌患者组织中基因型表达状态,通过建立预后模型,达到预测患者术后复发转移风险的目的。
本发明的目的是提供一种用于预测肾癌术后复发转移风险的单核苷酸多态性变异位点的分子标记物。
本发明的另一个目的是提供所述单核苷酸多态性变异位点的分子标记物的应用。
本发明的上述目的是通过以下技术方案给予实现的:一组用于预测肾癌术后复发转移风险的单核苷酸多态性变异位点的分子标记物,包括rs4718593、rs7934644、rs17050001、rs9618567、rs7739947和rs4479520。
本发明还请求保护上述单核苷酸多态性变异位点分子标记物在制备预测肾癌术后复发转移风险的试剂盒或构建预测肾癌术后复发转移风险的模型中的应用。
一种用于检测权利要求1所述单核苷酸多态性变异位点分子标记物的飞行时间质谱技术扩增及延伸引物组,其特征在于,包括分别检测rs4718593、rs7934644、rs17050001、rs9618567、rs7739947和rs4479520位点基因型状态的扩增引物及延伸引物,其序列依次如表1所示。
本发明还提供一种用于预测肾癌术后复发转移风险的模型,其特征在于,所述模型为通过检测rs4718593、rs7934644、rs17050001、rs9618567、rs7739947和rs4479520的基因型状态来计算局限性肾癌组织样本的预后评分指数,预后评分指数=(0.1186×rs4479520)–(0.0074×rs4718593)+(0.0072×rs9618567)+(0.0633×rs7934644)–(0.2123×rs7739947)–(0.1466×rs17050001)–0.1650。
本发明还提供一种用于预测肾癌术后复发转移风险的试剂盒,其特征在于,包含权利要求3所述的飞行时间质谱技术扩增及延伸引物组。
本发明还提供利用上述试剂盒进行局限性肾癌术后复发转移风险的方法为:
s1.提取局限性肾癌组织样品dna;
s2.利用上述引物组对s1的样本dna进行飞行时间质谱技术检测,确定单核苷酸多态性变异位点基因型状态。
s3.根据预后风险模型-预后评分指数预后评分指数=(0.1186×rs4479520)–(0.0074×rs4718593)+(0.0072×rs9618567)+(0.0633×rs7934644)–(0.2123×rs7739947)–(0.1466×rs17050001)–0.1650计算出局限性肾癌组织样本的预后评分指数,以预测肾癌术后复发转移风险。
与现有技术相比,本发明具有以下有益效果:
本发明公开了一组用于预测肾癌术后复发转移风险的单核苷酸多态性变异位点分子标记物,所述位点包括rs4718593、rs7934644、rs17050001、rs9618567、rs7739947和rs4479520。通过检测上述六个单核苷酸多态性变异位点在局限性肾癌患者组织中的基因型状态,并通过相应的预测模型,达到预测患者术后复发转移风险的目的,提高了通过肾癌患者组织标本预测术后复发转移风险的准确性,对患者的进一步诊治方案和延长患者生存期具有重大意义。
附图说明
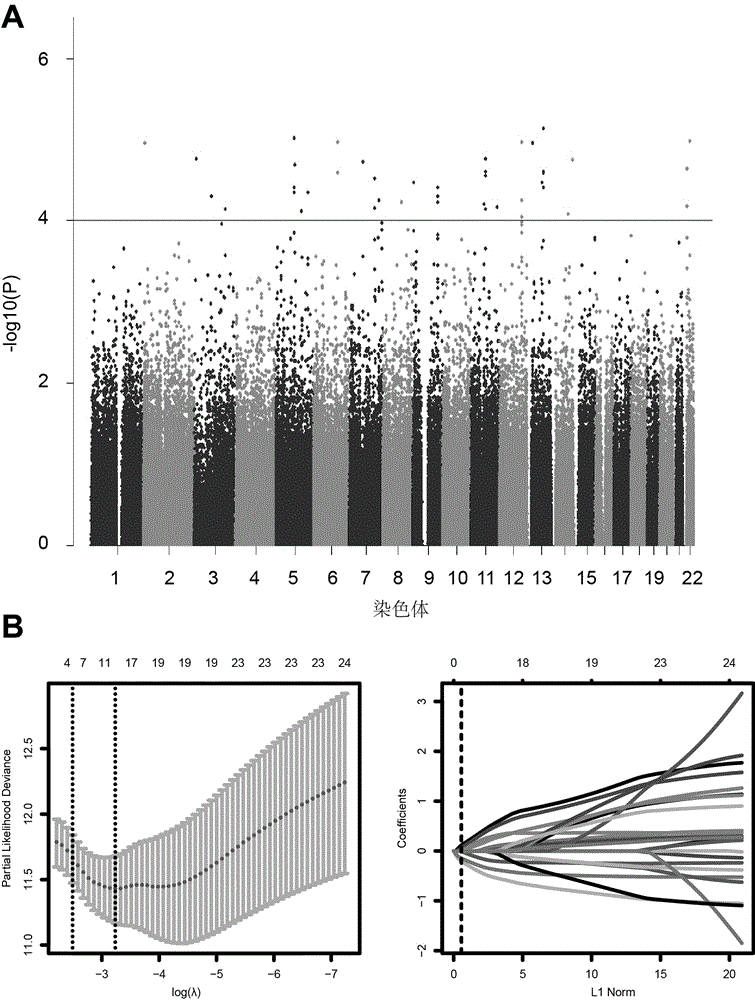
图1为本发现实施例1中单核苷酸多态性变异位点的筛选及预后风险模型的建立过程的曼哈顿图及lassocox图。图2为本发明实施例1中利用所述6个单核苷酸多态性位点对训练组评估六snp分类器预测准确度的风险评分图、基因型热图、roc曲线和km曲线图。图3为本发明实施例1中在内部测试组、独立验证组及tcga组验证预后风险模型的风险评分图、基因型热图、roc曲线和km曲线图。图4为本发明实施例1中分层分析的km曲线图。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
实施例1用于预测肾癌术后复发转移风险的单核苷酸多态性位点及预后风险模型建立
1、单核苷酸多态性变异位点的筛选及预后风险模型的建立
(1)tcga数据库中73例局限性肾癌术后复发转移定义为复发组,41例随访超过7年无复发的定义为无复发组。申请提取tcga数据库肾癌患者单核苷酸多态性芯片(affymetrixsnp6.0)数据。应用卡方检验方法统计复发组及无复发组之间单核苷酸多态性基因型状态差异。筛选出44个与肿瘤复发密切相关单核苷酸多态性位点(p<0.0001,图1a)
(2)设计步骤(1)所得44个单核苷酸多态性变异位点的飞行时间质谱技术扩增引物和延伸引物。
(3)提取训练组组织样本dna,采用步骤(2)的特异性引物,通过飞行时间质谱的方法,对步骤(1)中筛选出的单核苷酸多态性变异位点进行验证,排除检测成功率小于99%的44个snp中的19个snp,剩余25个snp位点。
(4)基于步骤(3)筛选到的25个单核苷酸多态性变异位点,在训练数据集中,采用lasso(leastabsoluteshrinkageandselectionoperator)回归模型方法[13-15],对步骤(3)的飞行时间质谱实验结果进行筛选,最终筛选出6个单核苷酸多态性位点用于局限性肾癌术后复发转移风险预测,分别为rs4718593、rs7934644、rs17050001、rs9618567、rs7739947和rs4479520(表1所示),其线性方程表示如下:预后评分指数=(0.1186×rs4479520)–(0.0074×rs4718593)+(0.0072×rs9618567)+(0.0633×rs7934644)–(0.2123×rs7739947)–(0.1466×rs17050001)–0.1650;
2、评估六snp分类器预测准确度
根据六个snp状态计算206例患者的评分指数,分数范围从-0.4914至0.2222。具有较低风险分数的患者一般比具有较高风险分数的患者的复发更少(图2a)。使用时间依赖的roc曲线来描述分类器和六个snp的预测值。5年auc为0.749,六个snp的5年auc在0.558-0.631。分类器的预测准确率显著高于单个snp(p<0.0001,图2b)。通过风险模型计算出每个样本的预后评分指数,选取0为cut-off值,将局限性肾癌患者分为低风险组和高风险组。在训练组中,低风险组患者的生存均明显优于高风险组(图2c)。
3、预后风险模型验证
对内部测试样本和独立验证样本进行飞行时间质谱检测,同时申请提取tcga单核苷酸多态性位点基因型数据,生成三个独立样本的数据集。使用该预后评分指数在上述三个样本集中进行验证。该分类器在内部测试、独立的验证和tcga组中显示出稳定预测准确度。5年auc分别为739、0.719和0.746。通过风险模型计算出每个样本的预后评分指数,选取0为cut-off值,将局限性肾癌患者分为低风险组和高风险组。无论在训练集还是验证集,低风险组患者的生存均明显优于高风险组(如图3所示)。多元变量分析及分层分析表明,评分指数与肾癌术后复发转移风险显著相关,并且是生存的独立危险因素(如表2、表3及图4所示)
基于上述技术方案,本发明所述的单核苷酸多态性变异位点及检测方法可有效的用于预测局限性肾癌术后复发转移风险。通过检测患者肿瘤组织中rs4718593、rs7934644、rs17050001、rs9618567、rs7739947和rs4479520共6个snp基因型状态的变化,用于预测局限性肾癌术后复发转移风险,从而提高了通过局限性肾癌患者组织标本预测预后的准确性,对患者的进一步诊治方案和延长患者生存期具有重大意义。
实施例2用于预测局限性肾癌预后及死亡风险的试剂盒
用于预测局限性肾癌术后复发转移风险的试剂盒,所述试剂盒包含下列所示检测6种snp飞行时间质谱扩增引物及延伸引物:
具体地,利用上述试剂盒进行局限性肾癌术后复发转移风险的方法为:
s1.提取局限性肾癌组织样品dna;
s2.利用上述引物组对s1的样本dna进行飞行时间质谱技术检测,确定单核苷酸多态性变异位点基因型状态。
s3.根据预后风险模型-预后评分指数预后评分指数=(0.1186×rs4479520)–(0.0074×rs4718593)+(0.0072×rs9618567)+(0.0633×rs7934644)–(0.2123×rs7739947)–(0.1466×rs17050001)–0.1650计算出局限性肾癌组织样本的预后评分指数,以预测肾癌术后复发转移风险。
以上对本发明公开的一种用于预测局限性肾癌术后复发转移风险的单核苷酸多态性位点以及检测方法进行了详细介绍,本文中应用了具体个例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的方法及其核心思想;同时,对于本领域的一般技术人员,依据本发明的思想,在具体实施方式及应用范围上均会有改变之处,综上所述,本说明书内容不应理解为对本发明的限制。
参考文献
1.ferlayj,soerjomatarami,dikshitr,etal.cancerincidenceandmortalityworldwide:sources,methodsandmajorpatternsinglobocan2012.intjcancer2015;136:e359-86.
2.nationalcomprehensivecancernetwork.kidneycancer:nccnclinicalpracticeguidelinesinoncology.version4.2018.2018(https://www.nccn.org/professionals/physician_gls/pdf/kidney.pdf).
3.rinibi,campbellsc,escudierb.renalcellcarcinoma.lancet2009;373:1119-32.
4.eggenerse,yossepowitcho,pettusja,snyderme,motzerrj,russop.renalcellcarcinomarecurrenceafternephrectomyforlocalizeddisease:predictingsurvivalfromtimeofrecurrence.jclinoncol2006;24:3101-6.
5.ravauda,motzerrj,pandhahs,etal.adjuvantsunitinibinhigh-riskrenal-cellcarcinomaafternephrectomy.nengljmed2016;375:2246-54.
6.rinib,goddarda,knezevicd,etal.a16-geneassaytopredictrecurrenceaftersurgeryinlocalisedrenalcellcarcinoma:developmentandvalidationstudies.lancetoncol2015;16:676-85.
7.morgantm,mehrar,tiemenyp,etal.amultigenesignaturebasedoncellcycleproliferationimprovespredictionofmortalitywithin5yrofradicalnephrectomyforrenalcellcarcinoma.eururol2018;73:763-9.
8.brookssa,brannonar,parkerjs,etal.clearcode34:aprognosticriskpredictorforlocalizedclearcellrenalcellcarcinoma.eururol2014;66:77-84.
9.abul-husnns,chengx,liah,etal.aprotein-truncatinghsd17b13variantandprotectionfromchronicliverdisease.nengljmed2018;378:1096-106.
10.nioip,sigurdssona,thorleifssong,etal.variantasgr1associatedwithareducedriskofcoronaryarterydisease.nengljmed2016;374:2131-41.
11.wallentinl,jamess,storeyrf,etal.effectofcyp2c19andabcb1singlenucleotidepolymorphismsonoutcomesoftreatmentwithticagrelorversusclopidogrelforacutecoronarysyndromes:ageneticsubstudyoftheplatotrial.lancet2010;376:1320-8.
12.garcia-donasj,estebane,leandro-garcialj,etal.singlenucleotidepolymorphismassociationswithresponseandtoxiceffectsinpatientswithadvancedrenal-cellcarcinomatreatedwithfirst-linesunitinib:amulticentre,observational,prospectivestudy.lancetoncol2011;12:1143-50.
13.tibshiranir.thelassomethodforvariableselectioninthecoxmodel.statmed1997;16:385-95.
14.zhangjx,songw,chenzh,etal.prognosticandpredictivevalueofamicrornasignatureinstageiicoloncancer:amicrornaexpressionanalysis.lancetoncol2013;14:1295-306.
15.qiuj,pengb,tangy,etal.cpgmethylationsignaturepredictsrecurrenceinearly-stagehepatocellularcarcinoma:resultsfromamulticenterstudy.jclinoncol2017;35:734-42.
- 还没有人留言评论。精彩留言会获得点赞!