一种子宫内膜干细胞分离方法与流程
本发明涉及干细胞的分离领域,具体而言,涉及一种子宫内膜干细胞分离方法。
背景技术:
子宫内膜从生理学上可分为基底层和功能层,基底层包含子宫内膜的下三分之一层,其作用是子宫内膜最初发育的地方,待功能层随着月经脱落后,基底层细胞按照特定的轨迹,快速地再生成功能层,来修复因功能层脱落受创的子宫内膜。子宫内膜功能层受体内激素变化的控制调节,具有一定规律的増殖、分化和脱落性变化,是胚胎置入的部位,包括子宫内膜的上三分之二层,包含包绕在腺体周围的疏松的血管化的基质和从表面延伸至基底层的假复层柱状上皮的腺体。
子宫内膜表面的腺体、血管、间质、上皮随着体内激素的变化而呈増殖性变化,内膜厚度由最初0.5mm増长至5-7mm。随着激素的变化,子宫内膜出现脱落,脱落的子宫内膜中有具有多分化潜能的多能干细胞,即子宫内膜干细胞。
经血的获取不会对人身体造成伤害,且取得途径简单方便,来源广泛,具有离度的自我更新能力,展现了干细胞的生物学特性。
目前经血源性子宫内膜干细胞分离培养较多,脱落内膜源性细胞分离较少。
有鉴于此,特提出本发明。
技术实现要素:
本发明的目的在于提供一种子宫内膜干细胞分离方法,同时分离提取两种源性干细胞,大大提高可使用细胞量。
为了实现本发明的上述目的,特采用以下技术方案:
一种子宫内膜干细胞分离方法,包括以下步骤:
样本去除血浆后,稀释后用不大于100μm的滤网过滤,得到的滤液加入抗生素后进行低温处理,然后经洗涤和分离,得到的细胞进行培养,得到第一子宫内膜干细胞;
所述滤网上的子宫内膜洗涤,然后加入红细胞裂解液,裂解的子宫内膜分离后进行剪切,经消化、分离,得到的细胞进行培养,得到第二子宫内膜干细胞;
所述第一子宫内膜干细胞和所述第二子宫内膜干细胞合并,得到所述子宫内膜干细胞。
本发明提供的子宫内膜干细胞分离方法,经血源性子宫内膜干细胞和脱落内膜源性细胞均进行分离,即分离两种来源的细胞,得到更多的子宫内膜干细胞,经流式检测,满足临床使用标准。
现有的子宫内膜干细胞分离方法中,一般只分离脱落内膜源性细胞,因为经血源性细胞易污染,本发明中通过样本滤网过滤后的滤液加入抗生素进行低温处理,能使污染概率大大降低,提高分离的成功率。
进一步地,所述样本去除血浆步骤为:样本于2000±200r/min离心8-15min,吸去血浆。另外,吸取的血浆还需要进行传染病检测,以得到健康的子宫内膜干细胞。
进一步地,所述样本去除血浆后,加入pbs缓冲液后进行过滤,得到的滤液中添加可溶两性霉素b与青霉素-链霉素双抗。
其中,添加的pbs缓冲液的体积为样品体积的2-5倍。
进一步地,所述滤液中,可溶两性霉素b的浓度为2.5-3.0μg/ml,所述青霉素-链霉素双抗以溶液的形式添加,添加的体积百分数为3%-5%,其中,青霉素-链霉素双抗溶液中,青霉素的含量为10000u/ml,链霉素的含量为10mg/ml。
进一步地,所述低温处理为:4±2℃放置24±4h。由于采集的经血会携带阴道内细菌和真菌,从而导致细胞死亡。而本发明添加双抗、两性霉素b等放置一段时间,可以有效杀死细菌和真菌。
进一步地,然后经洗涤和分离步骤为:2000±200r/min离心8-15min,弃上清;pbs重悬细胞,ficoll分离,1600±200r/min离心25-30min,4℃;吸白膜层,加入pbs缓冲液,1200±200r/min离心3-8min。
进一步地,所述滤网上的子宫内膜洗涤的步骤中,洗涤为:用pbs缓冲液将滤网上的子宫内膜冲洗至离心容器中,滤液2000±200r/min离心8-15min,去上清。
进一步地,裂解的子宫内膜分离的步骤中,分离为:2000±200r/min离心8-15min,去上清。
进一步地,添加消化酶于37±2℃摇床内进行消化。
进一步地,所述消化酶为胶原酶进行i型胶原酶。
进一步地,消化后的混合液过40μm筛网过滤,收集滤液,2000±200r/min离心8-15min,去上清。
进一步地,所述培养所用的培养基是以dmem培养基为基准,添加以下组分:fbs体积百分数为10%±2%,谷氨酰胺浓度为2±0.5mm,可溶两性霉素b浓度为2.5μg/ml,所述青霉素-链霉素双抗以溶液的形式添加,添加的体积百分数为0.5%-1%,其中,青霉素-链霉素双抗溶液中,青霉素的含量为10000u/ml,链霉素的含量为10mg/ml。
本发明中,所用的pbs缓冲液可以为单独的为pbs缓冲液,也可以使用添加抗生素的缓冲液。如添加两性霉素b、青霉素、链霉素等。
如添加抗生素的pbs缓冲液中,可溶两性霉素b的浓度为2.5±0.5μg/ml左右,以pbs缓冲液的体积计,青霉素-链霉素双抗以溶液的形式添加,添加的体积百分数为3%-5%,其中,所述,青霉素-链霉素双抗溶液中,青霉素的含量为10000u/ml,链霉素的含量为10mg/ml。
与现有技术相比,本发明的有益效果为:
(1)现有的子宫内膜干细胞多来自脱落的子宫内膜组织,直接分离培养,而经血源性的污染率高,一般都不被采用,本发明同时分离提取两种源性干细胞,大大提高可使用细胞量。
(2)本发明提供的一种子宫内膜干细胞分离方法,既可以满足临床使用细胞数量,并且得到的子宫内膜干细胞还可以满足临床使用标准。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,以下将对实施例或现有技术描述中所需要使用的附图作简单地介绍。
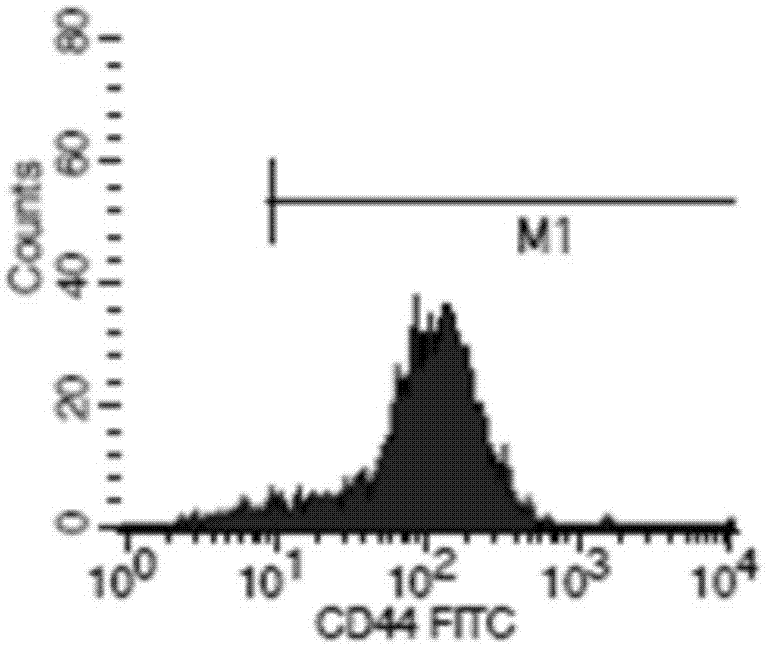
图1为本发明实施例1中对培养得到的子宫内膜干细胞标志物为cd44进行流式检测图;
图2为本发明实施例1中对培养得到的子宫内膜干细胞标志物为cd73进行流式检测图;
图3为本发明实施例1中对培养得到的子宫内膜干细胞标志物为cd29进行流式检测图;
图4为本发明实施例1中对培养得到的子宫内膜干细胞标志物为cd19进行流式检测图;
图5为本发明实施例1中对培养得到的子宫内膜干细胞标志物为cd34进行流式检测图;
图6为本发明实施例1中对培养得到的子宫内膜干细胞标志物为anti-hla-dr进行流式检测图;
图7为本发明实施例1中对培养得到的子宫内膜干细胞标志物为cd45进行流式检测图。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
实施例1
1、相关材料
1)可溶两性霉素b(有效浓度为2.5μg/ml)的配制:将25mg两性霉素b加入到5ml无菌水中,充分溶解,混匀,然后经0.22μm滤膜除菌,即制成可溶两性霉素b的储存液,于-20℃保存备用。
2)完全培养基:dmem+10%fbs+2mm谷氨酰胺+1%双抗+2.5μg/ml两性霉素b。
3)pbs缓冲液:将250μl可溶性两性霉素b储存液和15ml双抗加入到500mlpbs中,其中,双抗为青链霉素混合液,青霉素的含量为10000u/ml,链霉素的含量为10mg/ml。
2、子宫内膜干细胞分离方法,步骤如下:
将实验操作使用的镊子和剪刀准备好,准备三个培养皿,皿中加入10mlpbs。
1)将采集的样本转移到50ml离心管内,2000r/min离心,10min,轻轻吸取吸去血浆,取1ml血浆送检传染病。
2)样本经以下分离得到两部分:经血源性子宫内膜干细胞和脱落内膜源性细胞;
2.1将100μm细胞滤网置于50ml离心管上,样本加2倍体积未添加抗生素的pbs缓冲液后进行滤网过滤,以收集滤液加入体积3%双抗和两性霉素b(终浓度为2.5μg/ml),混匀后置于4℃冰箱处理24h。
2.2用pbs缓冲液将滤网上的子宫内膜冲洗至50ml离心管中,可用缓冲液浸泡滤网后再次冲洗,滤液2000r/min离心,10min,用移液管吸去上清。
对上述2.2步骤处理得到的物质进行以下处理:
2.2.1加入红细胞裂解液裂解红细胞,15分钟后,再次2000r/min离心,10min,用移液管吸去上清。
2.2.2无菌组织剪将子宫内膜剪成1mm3大小,0.1%i型胶原酶37℃摇床内消化30min-60min(30min时取出吹打观察消化程度,如果消化可以即可终止消化)。
2.2.3将消化后的混合液过40μm细胞筛网,收集滤液,2000r/min离心,10min,倒去上清。
2.2.4细胞计数,每个t75培养瓶接种1*106细胞,加入10ml完全培养基,吹打混匀,将培养瓶放置于co2培养箱培养。
对上述2.1步骤处理得到的物质进行以下处理:
2.1.124h后取出放在冰箱内的滤液,2000r/min离心,10min。
2.1.2弃上清,pbs缓冲液重悬细胞,ficoll分离,1600r/min离心,30min,4℃。
2.1.3吸白膜层,加入pbs缓冲液,1200r/min离心,5min。
2.1.4细胞计数,每个t75培养瓶接种1*106细胞,加入10ml完全培养基,吹打混匀,将培养瓶放置于co2培养箱培养。
2.1.5细胞密度到达80%以上时,可进行传代培养,将培养瓶中的培养基倒出,加入10mlpbs,轻轻摇晃,倒出,重复一次,尽量除去漂浮的死细胞。
2.1.6将t75培养瓶中加入1ml左右的胰酶,进行细胞消化,消化时间控制在1分钟左右。细胞全部消化起来后,利用终止液终止消化。
2.1.7将细胞收集到50ml离心管中,pbs洗瓶一次,收集到同一离心管中,1000r/min离心,5min,弃上清,完全培养基重悬,然后按照1*106每瓶,进行扩增,每个培养瓶中补满至10ml培养基,放入到37℃,co2培养箱中进行培养。
3)收集全部的p5代细胞,做流式检测。结果如图1-图7所示。
从图1-图7可以看出,本发明提供的子宫内膜干细胞符合其特性。
统计通过本方法分离培养的子宫内膜干细胞,共统计10份,每份采集的样本为50ml,平均每份收获细胞4*107,可以满足临床使用细胞数量。其中,经血源性子宫内膜干细胞占总数的40%左右。
实施例2
1、相关材料
1)可溶两性霉素b(有效浓度为2.5μg/ml)的配制:将25mg两性霉素b加入到5ml无菌水中,充分溶解,混匀,然后经0.22μm滤膜除菌,即制成可溶两性霉素b的储存液,于-20℃保存备用。
2)完全培养基:dmem+10%fbs+2mm谷氨酰胺+1%双抗+2.5μg/ml两性霉素b。
3)pbs缓冲液:将250μl可溶性两性霉素b储存液和15ml双抗加入到500mlpbs中,其中,双抗为青链霉素混合液,青霉素的含量为10000u/ml,链霉素的含量为10mg/ml。
2、子宫内膜干细胞分离方法,步骤如下:
将实验操作使用的镊子和剪刀准备好,准备三个培养皿,皿中加入10mlpbs。
1)将采集的样本转移到50ml离心管内,1800r/min离心,15min,轻轻吸取吸去血浆,取1ml血浆送检传染病。
2)样本经以下分离得到两部分:经血源性子宫内膜干细胞和脱落内膜源性细胞;
2.1将100μm细胞滤网置于50ml离心管上,样本加2倍体积未添加抗生素的pbs缓冲液后进行滤网过滤,以收集滤液加入体积3%双抗和两性霉素b(终浓度为3.0μg/ml),混匀后置于4±2℃冰箱处理20h。
2.2用pbs缓冲液将滤网上的子宫内膜冲洗至50ml离心管中,可用缓冲液浸泡滤网后再次冲洗,滤液2000r/min离心,10min,用移液管吸去上清。
对上述2.2步骤处理得到的物质进行以下处理:
2.2.1加入红细胞裂解液裂解红细胞,10分钟后,再次1800r/min离心,15min,用移液管吸去上清。
2.2.2无菌组织剪将子宫内膜剪成1mm3大小,0.1%i型胶原酶37℃摇床内消化30min-60min(30min时取出吹打观察消化程度,如果消化可以即可终止消化)。
2.2.3将消化后的混合液过40μm细胞筛网,收集滤液,1800r/min离心,15min,倒去上清。
2.2.4细胞计数,每个t75培养瓶接种1*106细胞,加入10ml完全培养基,吹打混匀,将培养瓶放置于co2培养箱培养。
对上述2.1步骤处理得到的物质进行以下处理:
2.1.124h后取出放在冰箱内的滤液,1800r/min离心,15min。
2.1.2弃上清,pbs缓冲液重悬细胞,ficoll分离,1800r/min离心,25min,4℃。
2.1.3吸白膜层,加入pbs缓冲液,1000r/min离心,8min。
2.1.4细胞计数,每个t75培养瓶接种1*106细胞,加入10ml完全培养基,吹打混匀,将培养瓶放置于co2培养箱培养。
2.1.5细胞密度到达80%以上时,可进行传代培养,将培养瓶中的培养基倒出,加入10mlpbs,轻轻摇晃,倒出,重复一次,尽量除去漂浮的死细胞。
2.1.6将t75培养瓶中加入1ml左右的胰酶,进行细胞消化,消化时间控制在1分钟左右。细胞全部消化起来后,利用终止液终止消化。
2.1.7将细胞收集到50ml离心管中,pbs洗瓶一次,收集到同一离心管中,1000r/min离心,5min,弃上清,完全培养基重悬,然后按照1*106每瓶,进行扩增,每个培养瓶中补满至10ml培养基,放入到37℃,co2培养箱中进行培养。
3)收集全部的p5代细胞,做流式检测。
本实施例提供的子宫内膜干细胞符合其特性。
统计通过本方法分离培养的子宫内膜干细胞,共统计10份,每份采集的样本为50ml,平均每份收获细胞3.8*107,可以满足临床使用细胞数量。其中,经血源性子宫内膜干细胞占总数的40%左右。
对比例1
一种子宫内膜干细胞的分离培养方法,该方法包括如下步骤:
1)采集经血样本,与实施例1体积相同。
2)子宫内膜干细胞的分离:取150重量份的步骤1)采集的经血样本,与30重量份的浓度为0.9%的氯化钠注射液混合均匀,放置于多功能振荡器上振摇25min,取出,放置于多功能振荡器上振摇25min,加入淋巴细胞分离液,离心,得到四层分离液,吸出底层分离液,即得a液,去除顶层透明液体,再加入1.5重量份的hes和2重量份的消化酶混合均匀,将混合液倒入离心管中,将离心管放置于离心机中离心7min,弃上清,取沉淀,即得b液,将a液和b液用同体积的pbs缓冲液洗涤,过200μm细胞筛网,收集子宫内膜干细胞,其中,多功能振荡器的震荡速度为40r/min,所述离心机的离心速度为1200r/min。
3)子宫内膜干细胞的原代培养:将步骤2)分离得到的子宫内膜干细胞进行采用实施例1的方法进行培养。
4)收集全部的p5代细胞,做流式检测。均符合相关指标。
统计通过本方法分离培养的子宫内膜干细胞,共统计10份,每份采集的样本为50ml,平均每份收获细胞2*107。其中,经血源性子宫内膜干细胞占总数的10%左右。
对比例2
1、采集经血样本,与实施例1体积相同。
样本加2倍体积未添加抗生素的pbs缓冲液混合均匀。
2、红细胞裂解液的配制:在纯化水中,分别加入终浓度为150mmol/l的nh4cl、终浓度为10mmol/l的khco3及终浓度为0.1mmol/l的edta-na2,充分混合均匀后,调节ph值至7.2。
经血样品保存液10ml,转移至15ml无菌离心管中,以1500rpm的转速离心5分钟,弃上清液,收集沉淀物。取15ml无菌离心管,加入10ml红细胞裂解液,将沉淀物加入红细胞裂解液中,充分吹打混匀后,在室温下静置裂解5分钟,然后以1200rpm的转速离心5分钟,弃上清液,收集有核细胞及子宫内膜沉淀物。
将有核细胞及子宫内膜沉淀物用pbs缓冲液洗涤2次后,加入5ml含有10%胎牛血清的dmem高糖培养基重悬,调整细胞密度,以5~10×104cells/cm2接种细胞培养瓶,在37℃、5%co2的细胞培养箱中培养2天,然后用pbs缓冲液洗掉未贴壁的细胞,再加入培养基继续培养,此后每隔3天更换一次培养基,直至细胞融合至80%左右,然后用0.25%的胰酶消化,传代。收集培养获得的细胞,即为所述的经血源性子宫内膜干细胞(menescs)。
得到的经血源性子宫内膜干细胞采用实施例1的方法进行培养以及传代培养。
收集全部的p5代细胞,做流式检测。均符合相关指标。
统计通过本方法分离培养的子宫内膜干细胞,共统计10份,每份采集的样本为50ml,平均每份收获细胞1*107。其中,经血源性子宫内膜干细胞占总数的50%左右。
尽管已用具体实施例来说明和描述了本发明,然而应意识到,在不背离本发明的精神和范围的情况下可以作出许多其它的更改和修改。因此,这意味着在所附权利要求中包括属于本发明范围内的所有这些变化和修改。
- 还没有人留言评论。精彩留言会获得点赞!