一种亮丙瑞林的液相合成方法与流程
本发明涉及一种医药化合物的制备方法,特别是一种亮丙瑞林的液相合成方法,在制备过程中采用了新型催化剂。
背景技术:
亮丙瑞林是一种促性腺素释放激素(gnrh)类似物,其结构序列为:pyr-his-trp-ser-tyr-d-leu-leu-arg-pro-nhet。其结构式如下所示:
目前合成亮丙瑞林的方法有固相法、液相法还有固液结合法。固相合成方法主要是国内的专利报道,涉及到不同的全保护肽的策略选择,然后通过不同的保护剂脱除法进行脱保护获得产品。中国公开专利文献cn102464702b采用酸稳定的树脂,和boc保护氨基酸策略进行全保护肽的合成,用胺解法将全保护肽从树枝上胺解成乙基胺,通过保护基脱除,获得亮丙瑞林。该方法采用大量的hcl的异丙醇溶液,采用大量的溶剂,对环境污染极大,成本相对较高,不适合产业化。中国公开专利文献cn101538315b采用高位阻的hmpb树脂,拟通过位阻效应避免二酮哌嗪的产生,达到大生产的目的,但是在碱性条件下,大规模生产的时候,二酮哌嗪随着抽滤的时间延长而大量产生,导致产率下降,杂质变多,不适合产业化生产。中国公开专利文献cn1865280b采用常规的wang树脂或者ctc树脂进行固相合成,用三氟醋酸脱保护基,在全裸的肽序下进行乙胺化,生产亮丙瑞林产品。该方法存在两个问题,一个在大生产过程中根本无法避免二酮哌嗪的产生,产率会大幅度下降;同时采用无保护的多肽进行乙胺化,会产生一些杂质,不易纯化。因此该方法不适合产业化生产。中国公开专利文献cn106146622采用了酸碱不同保护基策略,在同一树脂上同时采用酸稳定和碱稳定保护基进行全合成,有效避免了二酮哌嗪的生成,但是操作极其复杂,在前期的合成过程中,对环境极不友好,不适合产业化生产。《有机化学》杂志2010年第30卷第6期837-842页报道了片段法合成亮丙瑞林的方法,该方法采用2+7片段法,虽然成功的合成了亮丙瑞林,但是采用固相和液相相结合的方法,导致产品成本偏高,液相合成中用到了氯甲酸异丁酯等有毒物质,对环境不友好。的为了解决二酮哌嗪杂质导致产率降低的问题,为了获得环境友好且符合产业化生产需要,特开发本方法进行产业化生产。
技术实现要素:
本发明所要解决的技术问题是针现现有技术的上述缺陷,提供了一种适合放大生产、收率高、纯度好的亮丙瑞林的液相合成方法,采用了5+4的片段合成法。
本发明所要解决的技术问题是通过以下的技术方案来实现的。本发明是一种亮丙瑞林的液相合成方法,其特点是:所述的亮丙瑞林pyr-his-trp-ser-tyr-d-leu-leu-arg-pro-nhet是在液相条件下由五肽片段r1-pyr-his(r2)-trp(r3)-ser(r4)-tyr(r5)-or8在新型磁性催化剂fe3o4@silica-α-糜蛋白酶作用下脱除羧基保护基r8,磁性催化剂采用电磁铁吸引与产品进行分离,然后五肽与四肽片段r6-d-leu-leu-arg(r7)-pro-nhet在缩合剂作用下缩合、脱保护而成。
本发明所述亮丙瑞林的液相合成方法,其特征在于所述的羧基与氨基的缩合反应,通过催化剂完成反应,或者通过硫酯转移完成反应,或者通过酰氯反应完成,或者通过混合酸酐完成缩合反应,或者通过活化酯反应完成缩合反应。
本发明所述亮丙瑞林的液相合成方法,其进一步优选的技术方案是:所述的五肽片段r1-pyr-his(r2)-trp(r3)-ser(r4)-tyr(r5)-or8由以下步骤合成:首先合成tyr(r5)-or8,再与α氮端保护的r1-ser(r4)反应,生成r1-ser(r4)-tyr(r5)-or8,脱氨基保护后备用。羧基r8保护的nh2-trp(r3)-or8反应,与α氮端保护的r1-his(r2)反应,生成r1-his(r2)-trp(r3)-or8,脱保护,与α氮端保护的r1-pyr反应,生成r1-pyr-his(r2)-trp(r3)-or8,在新型磁性催化剂fe3o4@silica-α-糜蛋白酶作用下脱除羧基保护基r8,磁性催化剂采用电磁铁吸引方式与产品进行分离,得到r1-pyr-his(r2)-trp(r3)-oh,与nh2-ser(r4)-tyr(r5)-or8进行缩合反应后,得到r1-pyr-his(r2)-trp(r3)-ser(r4)-tyr(r5)-or8,在新型磁性催化剂fe3o4@silica-α-糜蛋白酶作用下脱除羧基保护基r8,磁性催化剂采用电磁铁吸引方式与产品进行分离,得到高纯五肽片段r1-pyr-his(r2)-trp(r3)-ser(r4)-tyr(r5)-oh。
本发明所述亮丙瑞林的液相合成方法,其进一步优选的技术方案是:所述的五肽片段r1-pyr-his(r2)-trp(r3)-ser(r4)-tyr(r5)-or8由以下步骤合成:首先合成tyr(r5)-or8,再与α氮端保护的r1-ser(r4)反应,生成r1-ser(r4)-tyr(r5)-or8,脱保护,与α氮端保护的r1-trp(r3)反应,生成r1-trp(r3)-ser(r4)-tyr(r5)-or8,脱保护,与α氮端保护的r1-his(r2)反应,生成r1-his(r2)-trp(r3)-ser(r4)-tyr(r5)-or8,脱保护,与α氮端保护的r1-pyr反应,生成r1-pyr-his(r2)-trp(r3)-ser(r4)-tyr(r5)-or8,在新型磁性催化剂fe3o4@silica-α-糜蛋白酶作用下脱除羧基保护基r8,磁性催化剂采用电磁铁吸引方式与产品进行分离,得到高纯五肽片段r1-pyr-his(r2)-trp(r3)-ser(r4)-tyr(r5)-oh。
本发明所述亮丙瑞林的液相合成方法,其进一步优选的技术方案是:所述的五肽片段r1-pyr-his(r2)-trp(r3)-ser(r4)-tyr(r5)-oh由以下步骤合成:首先合成r1-pyr的活化酯,再与羧基端保护his(r2)–r8反应,生成r1-pyr-his(r2);合成r1-pyr-his(r2)的活化酯,与羧基端保护trp(r3)-r8反应,生成r1-pyr-his(r2)-trp(r3);合成r1-pyr-his(r2)-trp(r3)的活化酯,与羧基端保护ser(r4)–r8反应,生成r1-pyr-his(r2)-trp(r3)-ser(r4);合成r1-pyr-his(r2)-trp(r3)-ser(r4)的活化酯,与nh2-tyr(r5)-r8反应,得到r1-pyr-his(r2)-trp(r3)-ser(r4)-tyr(r5)-or8,在新型磁性催化剂fe3o4@silica-α-糜蛋白酶作用下脱除羧基保护基r8,磁性催化剂采用电磁铁吸引方式与产品进行分离,得到高纯五肽片段r1-pyr-his(r2)-trp(r3)-ser(r4)-tyr(r5)-oh。
本发明所述的亮丙瑞林的液相合成方法中:
r1为boc、z、fmoc或h;
r2为boc、z、bzl、trt、tos、bom、dnp或h;
r3为boc、for、h或z;
r4为bzl、h、tbu、z、boc或tos;
r5为bzl、h、tbu、2,6-di-cl-bzl、me、z或2-cl-z;
r8为ome、oet、otbu、苄酯、硫酯或者有机盐、无机盐。
本发明所述亮丙瑞林的液相合成方法,其进一步优选的技术方案是:所述的四肽片段r6-d-leu-leu-arg(r7)-pro-nhet由以下步骤合成:首先合成r1-pro-nhet,脱保护,备用;取羧基r8保护、侧链r7保护的nh2-arg(r7)-or8反应,与α氮端保护的r1-leu-oh反应,生成α氮端保护的r1-leu-arg(r7)-or8;脱r1保护,与r6-d-leu-oh反应,生成r6-d-leu-leu-arg(r7)-or8,在新型磁性催化剂fe3o4@silica-α-糜蛋白酶作用下脱除羧基保护基r8,磁性催化剂采用电磁铁吸引方式与产品进行分离,得到r6-d-leu-leu-arg(r7)-oh,与pro-nhet进行缩合反应后,得到r6-d-leu-leu-arg(r7)-pro-nhet;最后脱去r6保护得到四肽片段d-leu-leu-arg(r7)-pro-nhet。
本发明所述亮丙瑞林的液相合成方法,其进一步优选的技术方案是:所述的四肽片段r6-d-leu-leu-arg(r7)-pro-nhet由以下步骤合成:首先合成r1-pro-nhet,脱保护,再与α氮端保护、侧链r7保护的r1-arg(r7)-oh反应,生成α氮端保护的r1-arg(r7)-pro-nhet;脱保护,与α氮端保护的r1-leu-oh反应,生成α氮端保护的r1-leu-arg(r7)-pro-nhet;脱保护,与r6-d-leu-oh反应,生成r6-d-leu-leu-arg(r7)-pro-nhet;最后脱去r6保护得到四肽片段d-leu-leu-arg(r7)-pro-nhet。
本发明所述亮丙瑞林的液相合成方法,其进一步优选的技术方案是:所述的四肽片段r6-d-leu-leu-arg(r7)-pro-nhet由以下步骤合成:首先合成r6-d-leu的活化酯,然后与羧基端保护leu-r8反应,生成r6-d-leu-leu-or8;合成r6-d-leu-leu的活化酯,与羧基端保护arg(r7)–r8反应,生成r6-d-leu-leu-arg(r7)-or8;合成r6-d-leu-leu-arg(r7)的活化酯,与pro-nhet反应,生成r6-d-leu-leu-arg(r7)-pro-nhet;最后脱去r6保护得到四肽片段d-leu-leu-arg(r7)-pro-nhet。
本发明所述亮丙瑞林的液相合成方法,其进一步优选的技术方案是:所述的四肽片段r6-d-leu-leu-arg(r7)-pro-nhet由以下步骤合成:首先合成r6-d-leu的活化酯,然后与羧基端保护leu-r8反应,生成r6-d-leu-leu-or8;合成r6-d-leu-leu的活化酯,与羧基端保护arg(r7)–r8反应,生成r6-d-leu-leu-arg(r7)-or8;合成r6-d-leu-leu-arg(r7)的活化酯,与pro-r8反应,生成r6-d-leu-leu-arg(r7)-pro-oh;生成r6-d-leu-leu-arg(r7)-pro-oh与nh2et,生成r6-d-leu-leu-arg(r7)-pro-nhet;最后脱去r6保护得到四肽片段d-leu-leu-arg(r7)-pro-nhet。
本发明所述亮丙瑞林的液相合成方法中:
r6为boc、z或fmoc;
r7为boc、(boc)2、pbf、tos、no2、h、pmc、hcl、adoc或mts;r8为ome、oet、otbu、苄酯、硫酯或者有机盐、无机盐。
本发明中的名词说明如下:
其中:r1-pyr为氨基r1保护的焦谷氨酸;
his(r2)为侧链r2保护的组氨酸;
trp(r3)为侧链r3保护的色氨酸;
ser(r4)为侧链r4保护的丝氨酸;
tyr(r5)为侧链r5保护的酪氨酸;
leu为亮氨酸;
arg(r7)为侧链r7保护的精氨酸;
pro为脯氨酸;
r1-his(r2)为α氮端r1保护、侧链r2保护的组氨酸;
r1-trp(r3)为α氮端r1保护、侧链r3保护的色氨酸;
r1-ser(r4)为α氮端r1保护、侧链r4保护的丝氨酸;
tyr(r5)-r8为侧链r8保护的酪氨酸;
nh2-his(r2)-r8为羧基端r8保护、侧链r2保护的组氨酸;
nh2-trp(r3)-r8为羧基端r8保护、侧链r3保护的色氨酸;
nh2-ser(r4)-r8为羧基端r8保护、侧链r4保护的丝氨酸;
tyr(r5)-r8为羧基端r8保护、侧链r5保护的酪氨酸;
nh2et为乙基氨;
r1-pro为α氮端r1保护的脯氨酸;
r1-arg(r7)为α氮端r1保护、侧链r7保护的精氨酸;
r1-leu为α氮端r1保护的亮氨酸;
r6-d-leu为α氮端r6保护、d型-亮氨酸。
与现有技术相比,本发明方法采用5+4的片段合成法,由于r8基团的脱除采用新型固定化的酶催化剂,使得常规的皂化反应再酸化得到羟基的方法显得累赘,收率低,操作复杂。本发明方法可以磁性载体固定化酶催化剂脱除羧基保护基,仅一步反应,简洁方便、污水少、收率高。避免了皂化合成周期长、避免了传统方法中苛刻的反应条件,而且收率高、产品纯度好、易于纯化、成本低、反应条件温和、适合于工业化生产。
附图说明
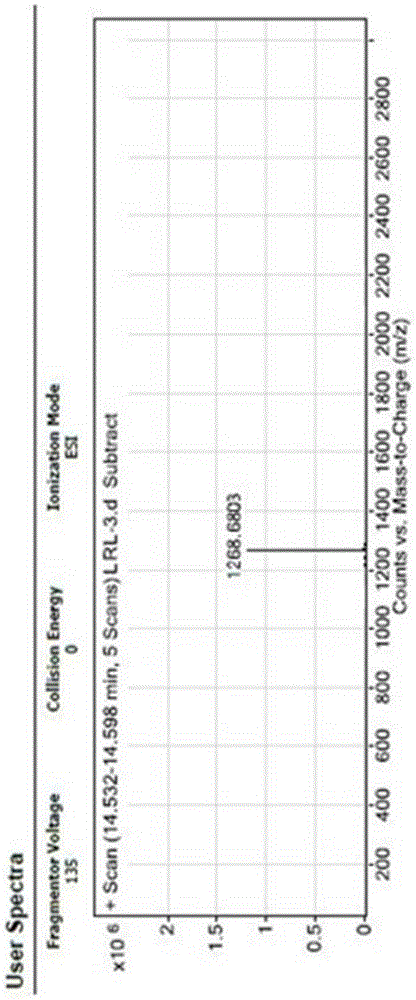
图1为本发明实施例制得的亮丙瑞林的质谱图。
具体实施方式
以下进一步描述本发明的具体技术方案,以便于本领域的技术人员进一步地理解本发明,而不构成对其权利的限制。
实施例1,一种亮丙瑞林的液相合成方法,所述的亮丙瑞林pyr-his-trp-ser-tyr-d-leu-leu-arg-pro-nhet是在液相条件下由五肽片段r1-pyr-his(r2)-trp(r3)-ser(r4)-tyr(r5)-or8在新型磁性催化剂fe3o4@silica-α-糜蛋白酶作用下脱除羧基保护基r8,新型磁性催化剂采用电磁铁吸引与产品进行分离,然后五肽与四肽片段r6-d-leu-leu-arg(r7)-pro-nhet在缩合剂作用下缩合反应、脱保护而成;
其中:r1为boc、z、fmoc或h;
r2为boc、z、bzl、trt、tos、bom、dnp或h;
r3为boc、for、h或z;
r4为bzl、h、tbu、z、boc或tos;
r5为bzl、h、tbu、2,6-di-cl-bzl、me、z或2-cl-z;
r8为ome、oet、otbu、苄酯、硫酯或者有机盐、无机盐。
所述的羧基与氨基的缩合反应,通过催化剂完成反应,或者通过硫酯转移完成反应,或者通过酰氯反应完成,或者通过混合酸酐完成缩合反应,或者通过活化酯反应完成缩合反应。
实施例2,实施例1所述亮丙瑞林的液相合成方法中:所述的五肽片段r1-pyr-his(r2)-trp(r3)-ser(r4)-tyr(r5)-or8由以下步骤合成:首先合成tyr(r5)-or8,再与α氮端保护的r1-ser(r4)反应,生成r1-ser(r4)-tyr(r5)-or8,脱氨基保护后备用;羧基r8保护的nh2-trp(r3)-or8反应,与α氮端保护的r1-his(r2)反应,生成r1-his(r2)-trp(r3)-or8,脱保护,与α氮端保护的r1-pyr反应,生成r1-pyr-his(r2)-trp(r3)-or8,在新型磁性催化剂fe3o4@silica-α-糜蛋白酶作用下脱除羧基保护基r8,磁性催化剂采用电磁铁吸引方式与产品进行分离,得到r1-pyr-his(r2)-trp(r3)-oh,与-ser(r4)-tyr(r5)-or8进行缩合反应后,得到r1-pyr-his(r2)-trp(r3)-ser(r4)-tyr(r5)-or8,在新型磁性催化剂fe3o4@silica-α-糜蛋白酶作用下脱除羧基保护基r8,磁性催化剂采用电磁铁吸引方式与产品进行分离,得到高纯五肽片段r1-pyr-his(r2)-trp(r3)-ser(r4)-tyr(r5)-oh。
实施例3,实施例1所述亮丙瑞林的液相合成方法中:所述的五肽片段r1-pyr-his(r2)-trp(r3)-ser(r4)-tyr(r5)-or8由以下步骤合成:首先合成tyr(r5)-or8,再与α氮端保护的r1-ser(r4)反应,生成r1-ser(r4)-tyr(r5)-or8,脱保护,与α氮端保护的r1-trp(r3)反应,生成r1-trp(r3)-ser(r4)-tyr(r5)-or8,脱保护,与α氮端保护的r1-his(r2)反应,生成r1-his(r2)-trp(r3)-ser(r4)-tyr(r5)-or8,脱保护,与α氮端保护的r1-pyr反应,生成r1-pyr-his(r2)-trp(r3)-ser(r4)-tyr(r5)-or8,在新型磁性催化剂fe3o4@silica-α-糜蛋白酶作用下脱除羧基保护基r8,磁性催化剂采用电磁铁吸引方式与产品进行分离,得到高纯五肽片段r1-pyr-his(r2)-trp(r3)-ser(r4)-tyr(r5)-oh。
实施例4,实施例1所述亮丙瑞林的液相合成方法中:所述的五肽片段r1-pyr-his(r2)-trp(r3)-ser(r4)-tyr(r5)-oh由以下步骤合成:首先合成r1-pyr的活化酯,再与羧基端保护his(r2)–r8反应,生成r1-pyr-his(r2);合成r1-pyr-his(r2)的活化酯,与羧基端保护trp(r3)-r8反应,生成r1-pyr-his(r2)-trp(r3);合成r1-pyr-his(r2)-trp(r3)的活化酯,与羧基端保护ser(r4)–r8反应,生成r1-pyr-his(r2)-trp(r3)-ser(r4);合成r1-pyr-his(r2)-trp(r3)-ser(r4)的活化酯,与nh2-tyr(r5)-r8反应,得到r1-pyr-his(r2)-trp(r3)-ser(r4)-tyr(r5)-or8,在新型磁性催化剂fe3o4@silica-α-糜蛋白酶作用下脱除羧基保护基r8,磁性催化剂采用电磁铁吸引方式与产品进行分离,得到高纯五肽片段r1-pyr-his(r2)-trp(r3)-ser(r4)-tyr(r5)-oh。
实施例5,实施例1-4中任意一项所述亮丙瑞林的液相合成方法中:所述的四肽片段r6-d-leu-leu-arg(r7)-pro-nhet由以下步骤合成:首先合成r1-pro-nhet,脱保护,备用;取羧基r8保护、侧链r7保护的nh2-arg(r7)-or8反应,与α氮端保护的r1-leu-oh反应,生成α氮端保护的r1-leu-arg(r7)-or8;脱r1保护,与r6-d-leu-oh反应,生成r6-d-leu-leu-arg(r7)-or8,在新型磁性催化剂fe3o4@silica-α-糜蛋白酶作用下脱除羧基保护基r8,磁性催化剂采用电磁铁吸引方式与产品进行分离,得到r6-d-leu-leu-arg(r7)-oh,与pro-nhet进行缩合反应后,得到r6-d-leu-leu-arg(r7)-pro-nhet;最后脱去r6保护得到四肽片段d-leu-leu-arg(r7)-pro-nhet;
其中:r6为boc、z或fmoc;
r7为boc、(boc)2、pbf、tos、no2、h、pmc、hcl、adoc或mts。
实施例6,实施例1-4中任意一项所述亮丙瑞林的液相合成方法中:所述的四肽片段r6-d-leu-leu-arg(r7)-pro-nhet由以下步骤合成:首先合成r1-pro-nhet,脱保护,再与α氮端保护、侧链r7保护的r1-arg(r7)-oh反应,生成α氮端保护的r1-arg(r7)-pro-nhet;脱保护,与α氮端保护的r1-leu-oh反应,生成α氮端保护的r1-leu-arg(r7)-pro-nhet;脱保护,与r6-d-leu-oh反应,生成r6-d-leu-leu-arg(r7)-pro-nhet;最后脱去r6保护得到四肽片段d-leu-leu-arg(r7)-pro-nhet;
其中:r6为boc、z或fmoc;
r7为boc、(boc)2、pbf、tos、no2、h、pmc、hcl、adoc或mts。
实施例7,实施例1-4中任意一项所述亮丙瑞林的液相合成方法中:所述的四肽片段r6-d-leu-leu-arg(r7)-pro-nhet由以下步骤合成:首先合成r6-d-leu的活化酯,然后与羧基端保护leu-r8反应,生成r6-d-leu-leu-or8;合成r6-d-leu-leu的活化酯,与羧基端保护arg(r7)–r8反应,生成r6-d-leu-leu-arg(r7)-or8;合成r6-d-leu-leu-arg(r7)的活化酯,与pro-nhet反应,生成r6-d-leu-leu-arg(r7)-pro-nhet;最后脱去r6保护得到四肽片段d-leu-leu-arg(r7)-pro-nhet;
其中:r6为boc、z或fmoc;
r7为boc、(boc)2、pbf、tos、no2、h、pmc、hcl、adoc或mts。
实施例8,实施例1-4中任意一项所述亮丙瑞林的液相合成方法中:所述的四肽片段r6-d-leu-leu-arg(r7)-pro-nhet由以下步骤合成:首先合成r6-d-leu的活化酯,然后与羧基端保护leu-r8反应,生成r6-d-leu-leu-or8;合成r6-d-leu-leu的活化酯,与羧基端保护arg(r7)–r8反应,生成r6-d-leu-leu-arg(r7)-or8;合成r6-d-leu-leu-arg(r7)的活化酯,与pro-r8反应,生成r6-d-leu-leu-arg(r7)-pro-oh;生成r6-d-leu-leu-arg(r7)-pro-oh与nh2et,生成r6-d-leu-leu-arg(r7)-pro-nhet;最后脱去r6保护得到四肽片段d-leu-leu-arg(r7)-pro-nhet;
其中:r6为boc、z或fmoc;
r7为boc、(boc)2、pbf、tos、no2、h、pmc、hcl、adoc或mts。
实施例9,亮丙瑞林的液相合成方法实验:
一、合成五肽片段r1-pyr-his(r2)-trp(r3)-ser(r4)-tyr(r5)-oh
1、fmoc-his(trt)-trp(boc)-ome的合成:
在100毫升的圆底烧瓶中加入fmoc-his(trt)-oh(20mmol),nh2-trp(boc)-ome(20mmol),hobt(22mmol),用无水dmf40毫升溶解,在冰水浴下加入dcc(22mmol)和磁子后,在室温下搅拌2小时,检测反应完全。抽滤除去反应产生的沉淀,减压浓缩除去dmf,之后用大量乙酸乙酯溶解,用饱和nahco3水溶液洗涤(100ml×3),用稀盐酸洗涤(100ml×3),饱和食盐水洗涤(100ml×3),用无水硫酸钠干燥,旋干乙酸乙酯,得到浅黄色固体(fmoc-his(trt)-trp(boc)-ome)。
hplc纯度:大于92.2%,收率为91.6%。
2、pyr-his(trt)-trp(boc)-ome的合成:
称取fmoc-his(trt)-trp(boc)-ome(20mmol)置于100毫升的圆底烧瓶中加入哌啶/dmf为25%的溶液50毫升,在室温下反应30分钟,检测反应完全,加入大量冰乙醚,析出大量沉淀,过滤,沉淀用乙醚洗涤数次,干燥,得到白色固体产品(nh2-his(trt)-trp(boc)-ome)。
在100毫升的圆底烧瓶中加入pyr-oh(20mmol),nh2-his(trt)-trp(boc)-ome(20mmol),hobt(22mmol),用无水dmf40毫升溶解,在冰水浴下加入dcc(22mmol)和磁子后,在室温下搅拌2小时,检测反应完全。抽滤除去反应产生的沉淀,减压浓缩除去dmf,之后用大量乙酸乙酯溶解,用饱和nahco3水溶液洗涤(100ml×3),用稀盐酸洗涤(100ml×3),饱和食盐水洗涤(100ml×3),用无水硫酸钠干燥,旋干乙酸乙酯,得到浅黄色固体(pyr-his(trt)-trp(boc)-ome)。
hplc纯度:大于93.2%,收率为89.5%。
3、fmoc-ser(tbu)-tyr(tbu)-ome的合成:
在100毫升的圆底烧瓶中加入fmoc-ser(tbu)-oh(20mmol),nh2-tyr(tbu)-ome(20mmol),hobt(22mmol),用无水dmf40毫升溶解,在冰水浴下加入dcc(22mmol)和磁子后,在室温下搅拌2小时,检测反应完全。抽滤除去反应产生的沉淀,减压浓缩除去dmf,之后用大量乙酸乙酯溶解,用饱和nahco3水溶液洗涤(100ml×3),用稀盐酸洗涤(100ml×3),饱和食盐水洗涤(100ml×3),用无水硫酸钠干燥,旋干乙酸乙酯,得到浅黄色固体(fmoc-ser(tbu)-tyr(tbu)-ome)。
hplc纯度:大于94.1%,收率为93.6%。
4、pyr-his(trt)-trp(boc)-ser(tbu)-tyr(tbu)-ome的合成:
称取fmoc-ser(tbu)-tyr(tbu)-ome(20mmol)置于100毫升的圆底烧瓶中加入哌啶/dmf为25%的溶液50毫升,在室温下反应30分钟,检测反应完全,加入大量冰乙醚,析出大量沉淀,过滤,沉淀用乙醚洗涤数次,干燥,得到白色固体产品(nh2-ser(tbu)-tyr(tbu)-ome)。
配制缓冲溶液:缓冲液位30%acn/nah2po4水溶液,ph调为8,备用。
称取pyr-his(trt)-trp(boc)-ome(20mmol)置于100毫升的圆底烧瓶中加入fe3o4@silica-α-糜蛋白酶的缓冲溶液50毫升,在室温下反应3h,检测反应完全,在搅拌下,用电磁铁吸引,将固体都集中于反应瓶底部。缓慢倾倒并过滤固体,用少量缓冲液淋洗,干燥后回收套用。滤液用稀盐酸调节ph值为3-4,减压蒸馏过滤液,除去乙腈及大部分水,加入大量冰乙醚,析出大量沉淀,过滤,沉淀用乙醚洗涤数次,干燥,得到白色固体产品(pyr-his(trt)-trp(boc)-oh)。
在100毫升的圆底烧瓶中加入pyr-his(trt)-trp(boc)-oh(20mmol),nh2-ser(tbu)-tyr(tbu)-ome(20mmol),hobt(22mmol),用无水dmf40毫升溶解,在冰水浴下加入dcc(22mmol)和磁子后,在室温下搅拌2小时,检测反应完全。抽滤除去反应产生的沉淀,减压浓缩除去dmf,之后用大量乙酸乙酯溶解,用饱和nahco3水溶液洗涤(100ml×3),用稀盐酸洗涤(100ml×3),饱和食盐水洗涤(100ml×3),用无水硫酸钠干燥,旋干乙酸乙酯,得到浅黄色固体(pyr-his(trt)-trp(boc)-ser(tbu)-tyr(tbu)-ome)。
hplc纯度:大于97.2%,收率为96.8%。
二、合成四肽片段d-leu-leu-arg(pbf)-pro-nhet
1、fmoc-pro-nhet的合成
称取fmoc-pro-oh(20mmol)置于100毫升的圆底烧瓶中,用55毫升dmf溶解,之后加入hosu(22mmol),冰水浴下加入dcc(22mmol)的dmf溶液20毫升,室温下反应4小时,滤除沉淀,将溶液浓缩至40毫升,加入浓乙胺水溶液20毫升,室温下反应过夜,点板反应完成,滤除沉淀,将溶液除去,用大量乙酸乙酯溶解,用饱和nahco3洗涤(100ml×3),食盐水洗涤(100ml×3),无水硫酸钠干燥,旋干溶剂,得到浅黄色固体(fmoc-pro-nhet)。
hplc纯度:大于92.5%,收率为94.3%。
2、fmoc-arg(pbf)-pro-nhet的合成
称取fmoc-pro-nhet(20mmol)置于100毫升的圆底烧瓶中加入哌啶/dmf为25%的溶液50毫升,在室温下反应30分钟,检测反应完全,加入大量乙醚,析出大量沉淀,过滤,沉淀用乙醚洗涤数次,干燥,得到白色固体产品(nh2-pro-nhet)。
在50毫升的圆底烧瓶中加入fmoc-arg(pbf)-oh(20mmol),nh2-pro-nhet(20mmol),hosu(22mmol),用无水dmf40毫升溶解,在冰水浴下加入dcc(22mmol)后,在室温下搅拌2小时,检测反应完全。抽滤除去反应产生的沉淀,减压浓缩除去dmf,之后用大量乙酸乙酯溶解,用饱和nahco3洗涤(100ml×3),用稀盐酸洗涤(100ml×3),饱和食盐水洗涤(100ml×3),用无水硫酸钠干燥,旋干乙酸乙酯,得到浅黄色固体(fmoc-arg(pbf)-pro-nhet)。
hplc纯度:大于94.2%,收率为93.8%。
3、fmoc-leu-arg(pbf)-pro-nhet的合成
称取fmoc-arg(pbf)-pro-nhet(20mmol)置于100毫升的圆底烧瓶中加入哌啶/dmf为25%的溶液50毫升,在室温下反应30分钟,检测反应完全,加入大量乙醚,析出大量沉淀,过滤,沉淀用乙醚洗涤数次,干燥,得到白色固体产品(nh2-arg(pbf)-pro-nhet)。
在50毫升的圆底烧瓶中加入fmoc-leu-oh(20mmol),nh2-arg(pbf)-pro-nhet(20mmol),hosu(22mmol),用无水dmf40毫升溶解,在冰水浴下加入dcc(22mmol)后,在室温下搅拌2小时,检测反应完全。抽滤除去反应产生的沉淀,减压浓缩除去dmf,之后用大量乙酸乙酯溶解,用饱和nahco3洗涤(100ml×3),用稀盐酸洗涤(100ml×3),饱和食盐水洗涤(100ml×3),用无水硫酸钠干燥,旋干乙酸乙酯,得到固体(fmoc-leu-arg(pbf)-pro-nhet)。
hplc纯度:大于95.1%,收率为90.4%
4、fmoc-d-leu-leu-arg(pbf)-pro-nhet的合成
称取fmoc-leu-arg(pbf)-pro-nhet(20mmol)置于100毫升的圆底烧瓶中加入哌啶/dmf为25%的溶液30毫升,在室温下反应30分钟,检测反应完全,加入大量乙醚,析出大量沉淀,过滤,沉淀用乙醚洗涤数次,干燥,得到白色固体产品(nh2-leu-arg(pbf)-pro-nhet)。
在50毫升的圆底烧瓶中加入fmoc-d-leu-oh(20mmol),nh2-leu-arg(pbf)-pro-nhet(20mmol),hosu(22mmol),用无水dmf40毫升溶解,在冰水浴下加入dcc(22mmol)后,在室温下搅拌2小时,检测反应完全。抽滤除去反应产生的沉淀,减压浓缩除去dmf,之后用大量乙酸乙酯溶解,用饱和nahco3洗涤(100ml×3),用稀盐酸洗涤(100ml×3),饱和食盐水洗涤(100ml×3),用无水硫酸钠干燥,旋干乙酸乙酯,得到固体(fmoc-d-leu-leu-arg(pbf)-pro-nhet)。
hplc纯度:大于93.5%,收率为89.3%
5、d-leu-leu-arg(pbf)-pro-nhet的合成
称取fmoc-d-leu-leu-arg(pbf)-pro-nhet(20mmol)置于100毫升的圆底烧瓶中加入哌啶/dmf为25%的溶液30毫升,在室温下反应30分钟,检测反应完全,加入大量乙醚,析出大量沉淀,过滤,沉淀用乙醚洗涤数次,干燥,得到白色固体产品(nh2-d-leu-leu-arg(pbf)-pro-nhet)。
hplc纯度:大于95.5%,收率为97.1%。
三、pyr-his-trp-ser-tyr-d-leu-leu-arg(pbf)-pro-nhet的合成
配制缓冲溶液:缓冲液位30%acn/nah2po4水溶液,ph调为8,备用。
称取pyr-his(trt)-trp(boc)-ser(tbu)-tyr(tbu)-ome(20mmol)置于100毫升的圆底烧瓶中加入fe3o4@silica-α-糜蛋白酶的缓冲溶液50毫升,在室温下反应3h,检测反应完全,在搅拌下,用电磁铁吸引,将固体都集中于反应瓶底部。缓慢倾倒并过滤固体,用少量缓冲液淋洗,干燥后回收套用。滤液用稀盐酸调节ph值为3-4,减压蒸馏过滤液,除去乙腈及大部分水,加入大量冰乙醚,析出大量沉淀,过滤,沉淀用乙醚洗涤数次,干燥,得到白色固体产品(pyr-his(trt)-trp(boc)-ser(tbu)-tyr(tbu)-oh)。
hplc纯度:大于99.1%,收率为97.9%。
在100毫升的圆底烧瓶中加入pyr-his(trt)-trp(boc)-ser(tbu)-tyr(tbu)-oh(20mmol),nh2-d-leu-leu-arg(pbf)-pro-nhet(20mmol),hobt(22mmol),用无水dmf50毫升溶解,在冰水浴下加入dcc(22mmol)和磁子后,在室温下搅拌3小时,检测反应完全。抽滤除去反应产生的沉淀,减压浓缩除去dmf,之后用大量乙酸乙酯溶解,用饱和nahco3水溶液洗涤(100ml×3),用稀盐酸洗涤(100ml×3),饱和食盐水洗涤(100ml×3),用无水硫酸钠干燥,旋干乙酸乙酯,得到浅黄色固体(pyr-his(trt)-trp(boc)-ser(tbu)-tyr(tbu)-d-leu-leu-arg(pbf)-pro-nhet)。
在500毫升的圆底烧瓶中加入pyr-his(trt)-trp(boc)-ser(tbu)-tyr(tbu)-d-leu-leu-arg(pbf)-pro-nhet(20mmol),在室温下加入脱保护试剂(tfa:苯甲硫醚:水:edt=92:4:2:2)200ml,室温下裂解1.5小时,将裂解液倒入预先冷却好的(0℃)无水乙醚中,搅拌沉降3小时,离心,用无水乙醚洗涤5次,真空干燥,得到白色固体。白色产品为pyr-his-trp-ser-tyr-d-leu-leu-arg-pro-nhet。采用制备柱对产品进行纯化制备。hplc纯度:大于99.5%,收率为75.8%;ms=1268.6703;其质谱图参照图1。
- 还没有人留言评论。精彩留言会获得点赞!