一种鉴别猪链球菌和猪多杀性巴氏杆菌的多重实时荧光PCR检测引物组合物及检测方法与流程
本发明涉及分子生物学菌株检测技术领域,特别涉及一种鉴别猪链球菌和猪多杀性巴氏杆菌的多重实时荧光pcr检测引物组合物,还涉及使用此检测引物组合物的检测方法。
背景技术:
猪链球菌病(swinestreptococcussuis,suis-gdh)是由多个血清群链球菌引起的一种急性人畜共患传染病,暴发时疫情猛烈,传播迅速,病猪体温骤然升高到41℃以上,几乎看不到典型症状,几小时内死亡。猪链球菌病是我国规定的二类动物疫病,不仅给世界养猪业造成很大的威胁,而且也会危害公共卫生的安全。由于该病症状病变较为复杂,一般根据病理变化结合临床资料只可作为初步诊断,确诊还需实验室诊断。临床诊断易与猪瘟、猪丹毒、副伤寒混淆。病猪的鼻液、唾液、血液、肌肉、内脏、肿胀的关节内均可检出病原体。
猪多杀性巴氏杆菌(pasteurellamultocida,pm)是一种可引起多种动物及人类感染发病的重要人畜共患性病原菌。可引发高死亡率疾病猪肺疫,在世界各国广泛流行,在我国规模化猪场常有发生。多杀性巴氏杆菌的流行严重危害着人类和动物的健康,对世界养猪业造成重大经济损失。目前国内兽医临床对该病的诊断仍普遍采用传统的病原分离方法,不但复杂、费时,而且敏感性低。
建立针对猪链球菌和猪多杀性巴氏杆菌研究快速检测的方法是成功防治的关键。鉴于猪链球菌和猪多杀性巴氏杆菌均是猪呼吸道疾病综合征的常见重要病原体,且往往是混合感染,而传统的诊断技术如细菌分离、免疫学试验等费时费力,不适于临床快速诊断,也不适于大规模的流行病学调查。随着分子生物技术的快速发展,针对病原微生物的核酸建立很多检测方法,这包括pcr检测技术、核酸探针杂交技术、环介导等温扩增技术(lamp)等。其中pcr技术是分子生物学重要研究手段之一,该方法省时,简便,经济实用,大大提高了临床样品的检测效率。在单重pcr的基础上,建立了多种新型的pcr技术,如多重pcr技术、实时荧光定量pcr技术、多重荧光定量pcr技术、反转录pcr技术等。
如cn108315401a公开了一种检测猪链球菌2型、猪多杀性巴氏杆菌和副猪嗜血杆菌的三重pcr引物、方法及试剂盒。而实时荧光定量pcr被公认为pcr诊断技术的一次质的飞跃。现有技术中还未有以猪链球菌和猪多杀性巴氏杆菌为研究对象建立的双重荧光pcr检测方法。由于普通pcr扩增片段大小一般在150-1000bp,荧光pcr既要求引物g+c含量在40%-60%,又要求扩增片段大小最好为100-300bp,这就对荧光pcr有了更高的要求,所以并不是所有的普通多重pcr的基因都可以使用多重荧光pcr来进行检测,这也为多重荧光pcr检测技术的发展带来了新的问题。
技术实现要素:
为了解决以上现有技术中无以猪链球菌和猪多杀性巴氏杆菌为研究对象建立的双重荧光pcr检测方法,本发明提供一种用于鉴定猪链球菌和猪多杀性巴氏杆菌的荧光pcr检测引物组合物。
本发明还提供了一种鉴定猪链球菌和猪多杀性巴氏杆菌的荧光pcr检测方法。该方法具有高度的特异性与专一性,并且扩增效率高,灵敏度高,准确率高,重现性好,检测周期短,且能实时检测dna扩增反应,具有很高的可行性与应用前景。
gdh基因是新近发现的一个与猪链球菌毒力相关的因子,属于谷氨酸脱氢酶蛋白家族,暴露于菌体的细胞壁上,对细菌致病性有重要意义。猪链球菌不同血清型之间gdh基因的核苷酸序列高度保守,同源性约为96%-100%,该蛋白抗原可作为检测猪链球菌的重要标志性抗原,可准确地检测猪链球菌的感染,对于该病的流行病学研究具有重要意义。
plpe基因存在于所有血清型的pm,且是该菌的特异保守基因,不同血清型pm的plpe基因序列相似性在92%以上,适合于pm病原的检测。
为实现上述目的,本发明采用下述技术方案:
一种鉴别猪链球菌和猪多杀性巴氏杆菌的多重荧光pcr检测引物组合物,包括猪链球菌特异上下游引物与特异探针、猪多杀性巴氏杆菌特异上下游引物与特异探针和细菌通用上下游引物与探针,核苷酸序列分别如下:
猪链球菌特异上游引物suis-gdhqf:5’-cctccgccagtttgatgc-3’;
猪链球菌特异下游引物suis-gdhqr:5’-gaaggatttaccgtttgctgc-3’;
猪链球菌特异探针suis-gdhqp:5’-x1-tcattgatccgcccagaagca-y1-3’;
猪多杀性巴氏杆菌特异上游引物pmqf:5’-tagttgcatgtagcggtggt-3’;
猪多杀性巴氏杆菌特异下游引物pmqr:5’-aggggcttgaaaggagga-3’;
猪多杀性巴氏杆菌的特异探针pmqp:5’-x2-cgctggaaatcgtgctgacc–y2-3’;
细菌通用上游引物16sf:5’-cgtattaccgcggctgctgg3’;
细菌通用下游引物16sr:5’-gattagataccctggtagtcc-3’;
细菌通用探针16sp:5’-x3-ccgccttcgccaccggtgttctt–y3-3’。
所述的多重荧光pcr检测引物组合物,猪链球菌特异探针、猪多杀性巴氏杆菌及细菌通用探针5’端优选x1、x2、x3分别为fam、joe、cy5、rox、cy3中与其他两者不同的荧光修饰,所述3’端y1、y2、y3分别为dabcyl、bhq1、bhq2、tamra中与其他两者不同的淬灭基团。
所述的多重荧光pcr检测引物组合物,优选
猪链球菌的特异探针suis-gdhqp:5’-tamra-tcattgatccgcccagaagca-bhq2-3’;
猪多杀性巴氏杆菌的特异探针pmqp:5’-joe-cgctggaaatcgtgctgacc-bhq2-3’;
细菌通用探针16sp:5’-cy5-aagtacgctccattggtgacctca-bhq2-3’。
一种鉴别猪链球菌和猪多杀性巴氏杆菌的多重荧光pcr检测试剂盒,优选含有上述权利要求1-3中任一项所述的多重荧光pcr检测引物组合物。
所述的多重荧光pcr检测试剂盒,含有20μlpcr扩增体系:2×taqmanmastermix10μl,suis-gdhqf、suis-gdhqr、pmqf、pmqr、16sf和16sr终浓度分别为0.25μm,suis-gdhqp、pmqp和16sp终浓度分别为0.125μm,20ng/μl的dna模板2μl,双蒸水补足20μl。
一种鉴别猪链球菌和猪多杀性巴氏杆菌的多重荧光pcr检测方法,包括以下步骤:
1)提取待测样本的模板dna,使用含有权利要求1中所述的多重荧光pcr检测引物组合物的试剂或权利要求2中的多重荧光pcr检测试剂盒进行pcr扩增;
2)如果suis-gdhqp和16sp荧光修饰探针有扩增曲线时,且满足ct≤35说明待检样本为猪链球菌;如果pmqp和16sp荧光修饰探针有扩增曲线时,且满足ct≤35说明待检样本为猪多杀性巴氏杆菌;如果suis-gdhqp和pmqp荧光修饰探针都没有扩增曲线,但16sp有扩增曲线时,且满足ct≤35说明待检样本不是两种细菌中的任何一种。
所述的多重荧光pcr检测方法,优选扩增程序:95℃,2min;95℃,10s;58℃,35s,40个循环。
所述的多重荧光pcr检测方法,优选在5通道或5通道以上荧光定量pcr仪上进行检测。
进一步的,本发明还提供了一种用于猪链球菌和猪多杀性巴氏杆菌的基于基因组精确定量检测方法,具体方法:
猪链球菌基因组-标准品制备:初始浓度为30ng/μl,猪链球菌基因组大小为2.007mb,copy数=(6.02×1023)×(30ng/ul×10-9)/(2.007×106×660)=1.36×107copies/μl;
猪多杀性巴氏杆菌-标准品制备:初始浓度为30ng/μl,副猪嗜血杆菌基因组大小2.3mb,copy数=(6.02×1023)×(30ng/ul×10-9)/(2.3×106×660)=1.19×107copies/μl;
将猪链球菌、猪多杀性巴氏杆菌基因组dna分别从1.36×107copies/μl和1.19×107copies/μl按10×逐级稀释5个梯度,即106、105、104、103、102数量级拷贝数。以5个梯度标准品为模板,进行实时荧光定量pcr检测,生成标准曲线,同时对待检样本进行精确定量。
本发明的有益效果:
本发明猪链球菌和猪多杀性巴氏杆菌分别以gdh、plpe为专属靶基因,具有高度的特异性与专一性;本发明设计细菌通用引物及通用探针,可以有效避免因pcr抑制因素而造成假阴性,3色多重实时荧光pcr同时对两种细菌加以鉴别。本发明在提供猪链球菌和猪多杀性巴氏杆菌定性检测的同时可以精确定量,并且扩增效率高,灵敏度高,准确率高,重现性好,检测周期短,能在1.5小时内完成检测,且能实时监测,具有很高的可行性与应用前景,为病原微生物鉴定和降低养殖经济损失提供科学可靠的方法。
附图说明
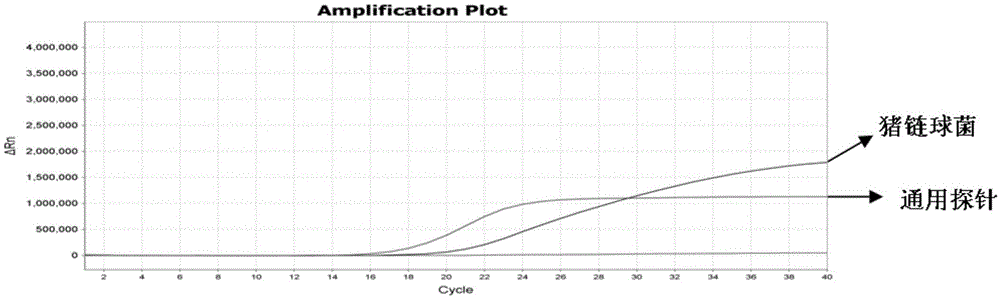
图1为猪链球菌在不同荧光修饰探针下的扩增曲线图;从图中可以看出:当suis-gdhqp和16sp探针有扩增曲线时,且满足ct≤35说明待检样本为猪链球菌;
图2为猪多杀性巴氏杆菌在不同荧光修饰探针下的扩增曲线图;从图中可以看出:当pmqp和16sp探针有扩增曲线时,且满足ct≤35说明待检样本为猪多杀性巴氏杆菌;
图3为两种细菌之外的细菌在不同荧光修饰探针下的扩增曲线图;从图中可以看出:当只有16sp探针有扩增曲线时,且满足ct≤35说明待检样本不是两种细菌中的某一种;
图4为猪链球菌板分别为10ng、1ng、0.1ng、0.01ng、0.001ng、0.0001ng时的灵敏度扩增曲线图;从图中可以看出:其最低检出限为0.01ng;
图5为猪多杀性巴氏杆菌模板分别为10ng、1ng、0.1ng、0.01ng、0.001ng、0.0001ng时的灵敏度扩增曲线图;从图中可以看出:其最低检出限为0.01ng;
图6猪多杀性巴氏杆菌准曲线图。
图7猪链球菌标准曲线图。
具体实施方式
下面结合附图和实施例对本发明进行进一步的阐述,应该说明的是,下述说明仅是为了解释本发明,并不对其内容进行限定。
本发明中所用实验材料、试剂与仪器如下:
实验材料:猪链球菌、猪多杀性巴氏杆菌、副猪嗜血杆菌、猪胸膜肺炎放线杆菌、大肠杆菌、化脓杆菌、金黄色葡萄球菌、枯草芽孢杆菌、副鸡禽杆菌、凝结芽孢杆菌、罗伊氏乳杆菌、植物乳杆菌、卡氏杆菌和屎肠球菌。
所用试剂:细菌dna提取试剂盒购自宝生物工程(大连)有限公司。引物与探针由生工生物工程(上海)有限公司负责合成。2×taqmanmastermix为dbibioscience品牌。dna测序由山东省农业科学院生物技术中心测序中心完成。
所用仪器:abi7500荧光定量pcr仪为abi公司产品,takarapcr仪为宝生物工程(大连)有限公司产品。5424d型高速离心机为eppendorf公司产品。
实施例1
1、猪链球菌样品、猪多杀性巴氏杆菌样品、及其他细菌样本dna提取:
采用细菌dna提取试剂盒提取,具体操作步骤见试剂盒说明书。提取的基因组dna经紫外分光光度计测定其纯度和浓度。测定od260/od280值均为1.8~1.9左右,浓度在10ng/μl以上,说明dna纯度较高,浓度适中,符合pcr扩增要求。
2、靶基因的选择和引物的设计:猪链球菌(suis)、猪多杀性巴氏杆菌(pm)分别以gdhgene、plpegene及omlagene为特异性靶基因引物的核苷酸序列,设计的引物及探针的核苷酸序列见表1。
表1引物及探针的核苷酸序列
3.标准品制作:
猪链球菌基因组-标准品制备:初始浓度为30ng/μl,猪链球菌基因组大小为2.007mb,copy数=(6.02×1023)×(30ng/ul×10-9)/(2.007×106×660)=1.36×107copies/μl;
猪多杀性巴氏杆菌-标准品制备:初始浓度为30ng/μl,副猪嗜血杆菌基因组大小2.3mb,copy数=(6.02×1023)×(30ng/ul×10-9)/(2.3×106×660)=1.19×107copies/μl;
将猪链球菌、猪多杀性巴氏杆菌基因组dna分别从1.36×107copies/μl和1.19×107copies/μl按10×逐级稀释5个梯度,即106、105、104、103、102数量级拷贝数。以5个梯度标准品为模板,进行实时荧光定量pcr检测,生成标准曲线,同时对待检样本进行精确定量。
4.荧光检测:
优先选用20μl的实时荧光pcr扩增体系,反应体系见表2。
表2pcr反应扩增体系
5、pcr扩增条件为:95℃2min;95℃10s,58℃,35s,在此收集荧光信号,40个循环。
6、结果分析:每次试验设立猪链球菌阳性对照、猪多杀性巴氏杆菌阳性对照、阴性对照及空白对照,试验结束后打开分析软件,分析实验结果,给出δrn(第n个循环时的荧光增加值)与扩增曲线ct值,根据探针荧光信号及扩增曲线ct值来判定待测样品是否为猪多杀性巴氏杆菌或猪链球菌。结果见图1,suis-gdhqp和16sp探针有扩增曲线时,且满足ct≤35说明待检样本为猪链球菌;图2,pmqp和16sp探针有扩增曲线时,且满足ct≤35说明待检样本为猪多杀性巴氏杆菌;图3,显示当只有16sp探针有扩增曲线时,且满足ct≤35说明待检样本中不是这两种细菌中的任何一种。
图6,猪多杀性巴氏杆菌标准曲线图,通过方程y=-3.547x+21.167(r2:0.997,eff%:91.38),来计算待检样本副猪嗜血杆菌的拷贝数;
图7,猪链球菌标准曲线图,通过方程y=-3.971x+25.296(r2:0.990,eff%:90.30),来计算待检样本猪链球菌的拷贝数。
实施例2特异性验证
利用本发明设计的引物和探针,分别以猪链球菌、猪多杀性巴氏杆菌、副猪嗜血杆菌、猪胸膜肺炎放线杆菌、大肠杆菌、化脓杆菌、金黄色葡萄球菌、枯草芽孢杆菌、副鸡禽杆菌、凝结芽孢杆菌、罗伊氏乳杆菌、植物乳杆菌、卡氏杆菌和屎肠球菌细菌总基因组dna为模板,进行实时荧光pcr检测,验证其引物和探针的特异性。其结果见表3及图3,结果表明本研究所设计的探针及引物具有很强的特异性。
表3特异性验证试验
实施例3灵敏度实验
将猪链球菌、猪多杀性巴氏杆菌的基因组dna定量分别到5ng/μl,按10×梯度稀释,每个梯度均取2.0μl为模板量,(即:10ng、1ng、0.1ng、0.01ng、0.001ng、0.0001ng、0.00001ng)进行实时荧光定量pcr检测,评估本发明的检测限。见图4-图5,猪链球菌和猪多杀性巴氏杆菌灵敏度均为0.01ng,结果表明本方法定量检测限为0.01ng,说明本发明所提供的方法具有很高的灵敏度,相对于普通pcr灵敏度更高。
实施例4临床可疑样本检测
本发明所建立的同时针对猪链球菌和猪多杀性巴氏杆菌的多重实时荧光pcr检测方法对22份临床可疑样本进行检测,样本类型包括寿光烟台等不同地区的病料和血清。22份临床可疑样本的来源及编号,同时使用病毒分离方法和测序进行检测。其荧光定量检测结果见表4,结果显示本发明所建立的方法与病毒分离后测序结果验证完全一致,本方法准确、可靠。
表4
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受实施例的限制,其它任何未背离本发明的精神实质与原理下所做的改变、修饰、组合、替代、简化均应为等效替换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!