一种验证miRNA对于大鼠腺垂体GH分泌调控作用的方法与流程
本发明涉及一种验证mirna对gh分泌调控作用的方法,尤其是一种验证mirna对于大鼠腺垂体gh分泌调控作用的方法,属于生物科技应用领域。
背景技术:
垂体是动物体内最重要的内分泌器官,通过对下游内分泌腺的控制,在众多生理过程中起重要的调节作用。其分泌的多种激素在调节生物活动中其重要作用。gh就是其中一种激素,它能促进全身的生长发育。这是由于它一方面促进骨骼的生长,使身材高大,另一方面促进蛋白质合成使肌肉发达。
mirna是一个非编码的短链rna,长度在18-23个碱基长度,不论动物还是植物中都扮演着十分重要的角色。其可以通过与mrna的3’utr结合,降低mrna的翻译效率。自lin-4和let-7被发现以来,几乎在所有的动物的基因组中都发现了许多mirna。在以前许多的研究报告中说,mirna可以影响激素的调节,例如,mir--325-3p可以降低lh的分泌。再比如,mir-26b参与gh的调节。
所以为了探究某一mirna是否能影响gh的分泌调控我们发明了这种方法来准确判断它们的关系。
技术实现要素:
本发明目的在于探究某一mirna能否影响gh的分泌调控作用,因此研究出这种方法。
一种验证mirna对于大鼠腺垂体gh分泌调控作用的方法,包括预测、筛选、转染、提取和酶联免疫吸附实验五个试验过程,所述五个试验过程的目的基因为大鼠gh1基因,具体步骤如下:
(1)预测可调控gh分泌的mirna
利用targetscan程序预测出可能与大鼠gh1基因有靶向作用的mir-192-3p;
(2)筛选可调控gh分泌的mirna
对步骤1中的mirna进行双荧光素酶实验,确定可以靶向抑制gh1基因的mir-192-3p;
(3)gh3细胞系和大鼠腺垂体原代细胞转染实验
通过mir-192-3pmimics、mimicsnc、inhibitors、inhibitorsnc分别对gh3细胞系和大鼠腺垂体原代细胞进行转染,整个实验重复三次;
(4)rna的提取和qrt-pcr
对步骤(3)中gh3细胞系和大鼠腺垂体原代细胞转染结束后的细胞进行rna的提取和qrt-pcr操作,利用qrt-pcr来检测gh3细胞系和大鼠腺垂体原代细胞中gh1基因mrna表达水平和mirna表达水平,发现不论在gh3细胞系还是大鼠腺垂体原代细胞中转染mimics后,gh1基因mrna表达量均下调,转染inhibitors后,gh1基因mrna表达量均上调,差异显著,证明mir-192-3p对gh1基因mrna表达有抑制作用;
(5)酶联免疫吸附实验,即elisa
收集步骤(3)中原代细胞和gh3细胞系转染结束后的细胞上清液,用大鼠ghelisa试剂盒测定培养液中gh的分泌水平,elisa实验显示gh激素分泌量不论在gh3细胞系还是大鼠腺垂体原代细胞中转染mimics后,gh激素分泌量均减少,转染inhibitors后,gh激素分泌量均增加,证明mir-192-3p能够抑制gh激素的分泌。
优选地,所述双荧光素酶实验由广州市锐博生物科技有限公司进行操作。
优选地,所述gh3细胞系来自于国家实验细胞资源共享平台。
优选地,所述mir-192-3pmimics、mimicsnc、inhibitors、inhibitorsnc均采购自广州市锐博生物科技有限公司。
优选地,所述步骤(3)中gh3细胞系转染实验采用的培养基为完全培养基,配方为800μl基础培养基d-mem/f-12+200μl血清;所述步骤(3)中原代细胞转染实验采用的培养基分别为一号完全培养基和二号完全培养基,其中一号完全培养基配方为1700μl基础培养基d-mem/f-12+300μl血清,二号完全培养基配方为425μl基础培养基d-mem/f-12+75μl血清。
优选地,所述基础培养基d-mem/f-12型号为hyclone,sh30023.01b,所述血清型号为bi,04-001-1a。
优选地,所述步骤(3)转染实验中使用的转染试剂型号为锐博,c10511-05。
优选地,所述大鼠腺垂体原代细胞转染实验中,一只大鼠的腺垂体细胞可铺六孔板一个孔,原代细胞转染实验培养4天后,六孔板中一孔细胞可铺二十四孔板4孔。
优选地,所述步骤(4)中qrt-pcr使用的反转录试剂盒fastkingcdna型号为withgdnase,qrt-pcr使用的pcr仪型号为2720thermalcycler。
优选地,所述步骤(5)酶联免疫吸附实验中使用的大鼠ghelisa试剂盒型号为mlbio,ml002921。
本发明的有益效果是:
第一、通过检测gh3细胞系和大鼠腺垂体原代细胞中gh1基因mrna表达水平和mirna表达水平,发现不论在gh3细胞系还是大鼠腺垂体原代细胞中转染mimics后,gh1基因mrna表达量均下调,转染inhibitors后,gh1基因mrna表达量均上调,差异显著,证明mir-192-3p对gh1基因mrna的表达有抑制作用;
第二、采用elisa实验检测大鼠gh的分泌水平,结果显示不论在gh3细胞系还是大鼠腺垂体原代细胞中转染mimics后,gh激素分泌量均减少,转染inhibitors后,gh激素分泌量均增加,证明mir-192-3p能够抑制大鼠gh激素的分泌。
附图说明
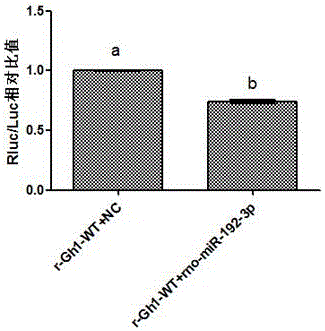
图1为双荧光素酶报告系统结果。
图2为gh3细胞系中转染mir-192-3pmimics、mimicsnc、inhibitors、inhibitorsnc后gh1基因mrna表达量。
图3为gh3细胞系中转染mir-192-3pmimics、mimicsnc、inhibitors、inhibitorsnc后mir-192-3p的表达量。
图4为大鼠腺垂体原代细胞中转染mir-192-3pmimics、mimicsnc、inhibitors、inhibitorsnc后gh1基因mrna表达量。
图5为大鼠腺垂体原代细胞中转染mir-192-3pmimics、mimicsnc、inhibitors、inhibitorsnc后mir-192-3p的表达量。
图6为gh3细胞系中转染后上清中gh分泌量。
图7为大鼠腺垂体原代细胞中转染后上清中gh分泌量。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例
一种验证mirna对于大鼠腺垂体gh分泌调控作用的方法,包括预测、筛选、转染、提取和酶联免疫吸附实验五个试验过程,所述五个试验过程的目的基因为大鼠gh1基因,具体步骤如下:
(1)预测可调控gh分泌的mirna
利用targetscan程序http://www.targetscan.org/预测出可能与大鼠gh1基因有靶向作用的mirna;
(2)筛选可调控gh分泌的mirna
为了进一步确定可调控gh1基因的mirna,需经双荧光素酶实验以确定可靶向gh1基因的mirna,所以将之前预测的mirna交由广州市锐博生物科技有限公司进行双荧光素酶实验,从而筛选出mir-192-3p可以靶向抑制gh1基因,需继续加以验证;
即对步骤1中的mirna进行双荧光素酶实验,确定可以靶向抑制gh1基因的mir-192-3p,如图1所示;
(3)gh3细胞系和大鼠腺垂体原代细胞转染实验
a、gh3细胞系转染实验
a、接种gh3细胞于12孔板中,每孔加入1ml完全培养基,37℃的co2培养箱中培养至每孔5×105个细胞,进行转染实验;
b、取1.5ml离心管,用216μlpbs稀释24μl10xribofecttmcpbuffer溶液至240μl1xribofecttmcpbuffer溶液;
c、取4个新1.5ml离心管,每个离心管管中加入60μl1xribofecttmcpbuffer,再在上述4个管中分别加入50nm的mir-192-3pmimics、mimicsnc、inhibitors、inhibitorsnc各5μl,轻轻吹打混匀,室温孵育5min;
d、向各离心管中加入6μlribofecttmcpreagent,轻轻吹打混匀,室温孵育3min,配置成ribofecttmcpreagent混合液;
e、12孔板中4孔培养gh3细胞,吸出该4孔各孔培养液并丢弃,再向各孔中分别加入929μl基础培养基d-mem/f-12,将步骤d中配好的四管ribofecttmcpreagent混合液加入上述4个孔中,轻轻混匀,将12孔板置于37℃的co2培养箱中培养24小时。
其中,gh3细胞系从国家实验细胞资源共享平台中获取。
用于gh3细胞系转染实验的完全培养基配方为800μl基础培养基d-mem/f-12+200μl血清,基础培养基d-mem/f-12型号为hyclone,sh30023.01b,血清型号为bi,04-001-1a。
b、大鼠腺垂体原代细胞转染实验
a、杀一只大鼠,取大鼠腺垂体原代细胞,将大鼠腺垂体原代细胞铺设在六孔板中的一个孔内,向该孔中加入2ml一号完全培养基,37℃的co2培养箱中培养4天,第4天时均匀转入二十四孔板上的4个孔内,每孔加入500μl二号完全培养基,37℃的co2培养箱中培养24小时,每孔细胞浓度为1×105,进行转染实验;
b、取1.5ml离心管,用108μlpbs稀释12μl10xribofecttmcpbuffer溶液至120μl1xribofecttmcpbuffer溶液;
c、取4个新1.5ml离心管,每个离心管管中加入30μl1xribofecttmcpbuffer,再向上述4个管中分别加入50nm的mir-192-3pmimics、mimicsnc、inhibitors、inhibitorsnc各2.5μl,轻轻吹打混匀,室温孵育5min;
d、向各离心管中加入3μlribofecttmcpreagent,轻轻吹打混匀,室温孵育5min,配置成ribofecttmcpreagent混合液;
e、吸出24孔板上4孔内培养液并丢弃,再向上述4孔中分别加入464.5μl基础培养基d-mem/f-12,再将步骤d中配好的四管ribofecttmcpreagent混合液分别加入四个孔中,轻轻吹打混匀,将24孔板置于37℃的co2培养箱中培养24小时。
上述实验重复三次。
其中,用于大鼠腺垂体原代细胞转染实验的一号完全培养基配方为1700μl基础培养基d-mem/f-12+300μl血清,二号完全培养基配方为425μl基础培养基d-mem/f-12+75μl血清,基础培养基d-mem/f-12型号为hyclone,sh30023.01b,血清型号为bi,04-001-1a。
在大鼠腺垂体原代细胞转染实验中,一只大鼠的腺垂体细胞可铺六孔板一个孔,原代细胞转染实验培养4天后,六孔板中一孔细胞可铺二十四孔板4孔。
步骤(3)转染实验中使用的转染试剂型号为锐博,c10511-05。
步骤(3)转染实验中采用的mir-192-3pmimics、mimicsnc、inhibitors、inhibitorsnc均购自广州市锐博生物科技有限公司。
(4)rna的提取和qrt-pcr
a、rna的提取
a、分别向步骤(3)中gh3细胞系转染实验孵育24小时的4孔细胞以及大鼠腺垂体原代细胞转染实验中孵育24小时的4孔细胞内每孔加入1mltrlzol,室温静置两分钟后分别转移至1.5ml离心管中,每管中加入200ul氯仿,双手上下用力振荡15s,室温静置2~3min,12000g离心15min;
b、步骤a离心后管内液体自动分为三层,上层为无色水相,中层为薄薄的白色蛋白层,下层为有颜色的有机相,分别吸取两个离心管中的上层透明液体400μl~500μl于两个新的1.5ml离心管;
c、分别向两个装有上清液的离心管中加入等体积的异丙醇,吹打混合均匀,置于4℃冰箱中沉淀10~30min,12000g离心10min;
d、去上清,沉淀用1ml75%冰乙醇清洗,旋涡振荡30s后,7500g离心5min;
e、小心去上清,在超净台中打开管盖,沉淀静置干燥3~5min,用枪头吸取上清液;
f、各管中加入20μl的0.1%depc水溶解rna沉淀,分装,-80℃保存;
b、qrt-pcr
a、使用fastkingcdna试剂盒进行反转录,每个pcr管中先加入5×gdnabuffer2μl,上述步骤中提取的totalrna8μl,吹打均匀后,42℃孵育3min;
b、在各pcr管中加入10×kingrtbuffer2μl,fastkingrtenzymemix1μl,fq-rtprimermix2μl,rnase-freeddh2o5μl,按照该体系配制混合液;
c、将a和b两混合液充分混匀,42℃孵育15min,95℃孵育3min,得到cdna;
d、2×superrealpremixplus10μl,forwardprimer0.5μl,reverseprimer0.5μl,cdna1μl,ddh2o8μl,按照该体系进行qrt-pcr来检测gh3细胞系和大鼠腺垂体原代细胞中gh1基因mrna表达水平和mirna表达水平,如图2~5所示。
图3为gh3细胞系中转染mir-192-3pmimics、mimicsnc、inhibitors、inhibitorsnc后mir-192-3p的表达量,以此检测转染效率。
图5为大鼠腺垂体原代细胞中转染mir-192-3pmimics、mimicsnc、inhibitors、inhibitorsnc后mir-192-3p的表达量,以此检测转染效率。
步骤(4)中qrt-pcr使用的反转录试剂盒fastkingcdna型号为withgdnase,qrt-pcr使用的pcr仪型号为2720thermalcycler。
通过采用qrt-pcr检测gh3细胞系和大鼠腺垂体原代细胞中gh1基因mrna表达水平和mirna表达水平后发现,不论在gh3细胞系还是大鼠腺垂体原代细胞中转染mimics后,gh1基因mrna表达量均下调,转染inhibitors后,gh1基因mrna表达量均上调,差异显著,证明mir-192-3p对gh1基因mrna的表达有抑制作用。
(5)酶联免疫吸附实验,即elisa
收集步骤(3)中gh3细胞系转染实验孵育24小时的12孔细胞板以及大鼠腺垂体原代细胞转染实验中孵育24孔细胞板的两板细胞各孔上清液,用大鼠ghelisa试剂盒测定培养液中gh的分泌水平。
其中,步骤(5)酶联免疫吸附实验中使用的大鼠ghelisa试剂盒型号为mlbio,ml002921。
elisa实验显示gh激素分泌量不论在gh3细胞系还是大鼠腺垂体原代细胞中转染mimics后,gh激素分泌量均减少,转染inhibitors后,gh激素分泌量均增加,证明mir-192-3p能够抑制gh激素的分泌,如图6~7所示。
综上所示,首先经双荧光素酶报告,初步确定mir-192-3p对gh1基因mrna的表达有抑制作用,之后在gh3细胞系和大鼠腺垂体原代细胞中进行验证,细胞转染后经totalrna提取和qrt-pcr分析,发现转染mimics后,gh1基因mrna表达量均下调,转染inhibitors后,gh1基因mrna表达量均上调,差异显著,elisa实验显示gh激素分泌量也显示相同趋势,因此证明mir-192-3p对于gh基因的表达有抑制作用。
对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。不应将权利要求中的任何附图标记视为限制所涉及的权利要求。
此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
- 还没有人留言评论。精彩留言会获得点赞!