三维聚球培养板的制作方法
本实用新型主要涉及生物领域,特别是涉及一种主要用于细胞培养的三维聚球培养板。
背景技术:
我国目前是肝癌高发的国家之一,肝癌的治疗有着十分重要的地位以及影响。在研制化疗药物时往往需要培养癌细胞,培养肝癌细胞的培养量较大。目前采用的培养器具主要能实现肝癌细胞的平面化培养,难以模拟体内真实的情况。同时由于培养器皿的结构,在吸取液体、添加液体如更换培养基、添加药物时,由于流体扰动,所培养的细胞经常被吹出指定的培养区域,或者由于流体剪切力,所培养的细胞受到不同程度的损伤甚至死亡。现有技术中肝癌细胞在这种平面化的培养下,细胞活率不高、细胞密度较小,并由于频繁的换液、添加药物等操作导致细胞死亡或受到伤害,进而影响体外实验的模拟效果,进一步影响实验结论。同时由于体外实验的平面化、粗放式培养,培养的细胞与体内状态存在一定区别,使所培养的肝癌细胞不能较好地模拟体内状态,造成实验结果偏差。以上众多技术问题,导致应用普通培养器皿以及细胞培养方法的药物筛选方法所得结果偏离实际情况或者受到较严重的影响。
基于现有技术的缺陷以及遇到的问题,本实用新型旨在提供一种能够实现三维聚球培养的三维聚球培养板。
技术实现要素:
本实用新型提供了一种三维聚球培养板,其包括孔板以及与所述孔板配套的板盖,所述三维聚球培养板上排列有若干培养孔,所述培养孔由上至下至少包括通过第一导流孔相连接的第一腔体以及第二腔体,还包括设置在所述第二腔体的腔底的至少一个半球形的第三腔体,所述第一导流孔与第一腔体接壤处为第一定位环。
优选地,所述第一导流孔由第一环形侧壁所限定,所述第一环形侧壁的导流上沿直径大于其导流下沿直径。
更优选地,所述第一环形侧壁的母线的第一延长线与所述第二腔体的侧壁相交。
更优选地,所述第一腔体自所述导流上沿向上扩展而形成,所述第一腔体包括作为培养孔边缘的第一上沿和与所述导流上沿重合的第一下沿;所述第二腔体自所述导流下沿向下扩展而成,所述第二腔体包括与所述导流下沿重合的第二上沿和腔底接壤的第二下沿。
进一步优选地,所述第二上沿和第二下沿同时与第二延长线垂直相交。
更进一步优选地,所述第一上沿的直径大于或等于所述第一下沿的直径。
进一步优选地,所述第二腔体包括接壤所述第一导流孔的第一过渡孔,以及连接所述第一过渡孔和腔底的第二导流孔。
更进一步优选地,所述第一过渡孔的为圆柱形孔或倒台锥形孔;所述第二导流孔为倒台锥形孔;所述第一过渡孔和第二导流孔的接壤处定义为第二定位环。
优选地,所述培养孔的总容积大于或等于50μL;所述第二腔体和第一导流孔的容积总和等于所述第一腔体的容积。
优选地,若干所述第三腔体在第二腔体的腔底周向排列和/或等距排列。
优选地,所述第三腔体的直径为400μm;所述第三腔体的深度为400μm;同一所述培养孔内相邻的第三腔体中心间距为300μm。
优选地,所述培养孔在所述孔板上以矩阵形式排列。
本实用新型提供了一种三维聚球培养板,能够较好解决部分技术问题,并具有下述优点:
(1)本实用新型所涉及的三维聚球培养板,通过第三腔体的特殊结构,使细胞进入三维聚球培养状态,使细胞、细胞团能够处于近似于体内状态,更好地模拟体内状况,为所述筛选方法提供一定基础;
(2)本实用新型所涉及的三维聚球培养板,通过三维聚球培养板中的培养孔,还设有若干导流结构、缓冲结构,包括但不限于第一导流孔、第二导流孔等,用于缓冲吸取液体、添加液体操作时所产生的液体流动,避免影响细胞的位置以及生长状态;
(3)本实用新型所涉及的三维聚球培养板,设置包括但不限于第一定位环以及第二定位环的位置,控制每次吸取的液体数量,进而实现预定更换液体的比例,便于使用者操作;
(4)本实用新型所涉及的三维聚球培养板,通过设置数量较多的培养孔,能够满足设置对照组、空白组、重复实验复孔的要求,使药物筛选实验能在同一培养板上实现,避免产生混淆。
附图说明
本实用新型上述的和/或附加的方面和优点从下面结合附图对实施例的描述中将变得明显和容易理解,其中:
图1为本实用新型所述三维聚球培养板的俯视图;
图2为本实用新型所述三维聚球培养板的单个培养孔剖视图;
图3为本实用新型所述三维聚球培养板的单个培养孔俯视图;
图4为本实用新型所述癌细胞化疗药物与浓度的筛选方法的步骤图;
图5为本实用新型所述癌细胞化疗药物与浓度的筛选方法的分离原代肝癌细胞的显微放大图;
图6为本实用新型所述癌细胞化疗药物与浓度的筛选方法的分离原代肝癌细胞的甲胎蛋白(AFP)免疫荧光染色图;
图7为本实用新型所述癌细胞化疗药物与浓度的筛选方法的分离原代肝癌细胞的DAPI免疫荧光染色图;
图8为本实用新型所述癌细胞化疗药物与浓度的筛选方法应用的三维聚球培养板中单个培养孔的显微放大图;
图9为图8的单个培养孔的第三腔体显微放大图;
图10为本实用新型所述癌细胞化疗药物与浓度的筛选方法中顺铂药物浓度与肝癌细胞抑制率的拟合曲线图;
图11为本实用新型所述癌细胞化疗药物与浓度的筛选方法中奥沙利铂药物浓度与肝癌细胞抑制率的拟合曲线图;
图12为本实用新型所述癌细胞化疗药物与浓度的筛选方法中吉西他滨药物浓度与肝癌细胞抑制率的拟合曲线图;
图13为本实用新型所述癌细胞化疗药物与浓度的筛选方法中阿霉素药物浓度与肝癌细胞抑制率的拟合曲线图;
图14为本实用新型所述癌细胞化疗药物与浓度的筛选方法中药敏图谱。
具体实施方式
下面详细描述本实用新型的实施例,所述实施例的示例在附图中示出。下面通过参考附图描述的实施例是示例性的,仅用于解释本实用新型,而不能解释为对本实用新型的限制。
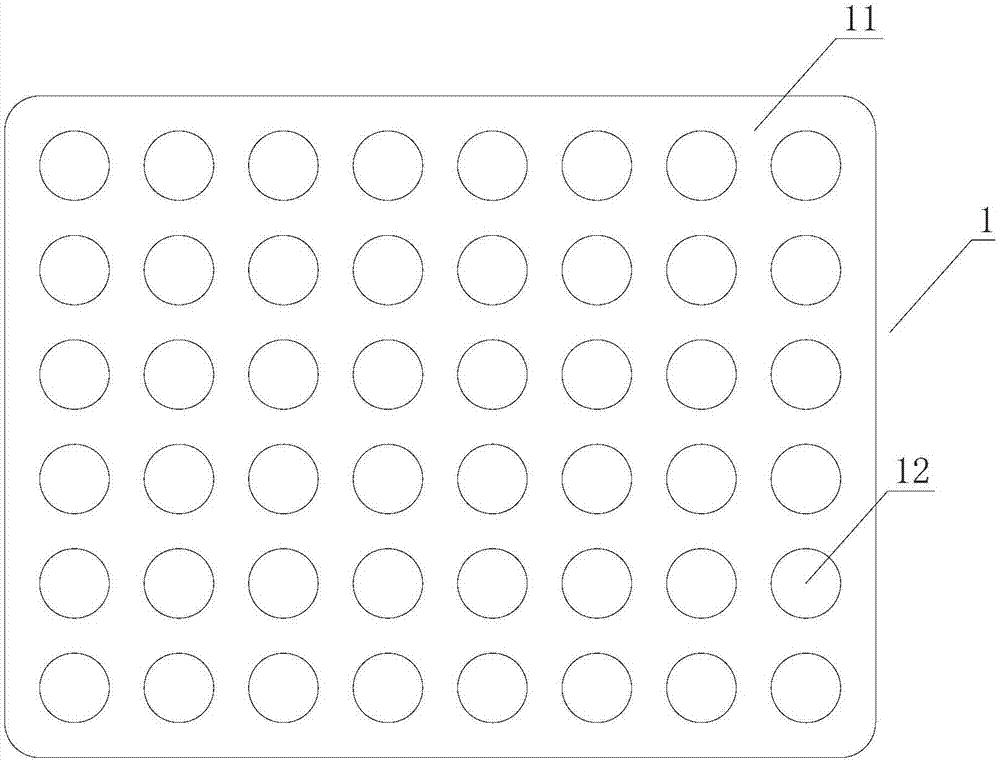
请参考图1,本实施例提供一种三维聚球培养板1,所述三维聚球培养板1包括有孔板11以及与孔板相配套用以盖合的板盖(图中未出示)。更具体地,所述三维聚球培养板1上以矩阵形式排列有若干培养孔12。仅在本实施例中,所述培养孔以每行8个、共6行,共计设有48孔的矩阵形式排列。在其它可能的实施方式中,所述三维聚球培养板1上培养孔12的数量和排列方式可以根据培养的需要进行调整。
所述培养孔12的详细结构,请具体参照图2以及图3。图2为所述培养孔12沿培养孔12的轴心纵向剖切的剖面图,图3为单个培养孔12的俯视图。
现请参照图2,所述培养孔12由上至下包括第一腔体121以及第二腔体122,所述第一腔体121以及第二腔体122通过第一导流孔124连接,所述培养孔12还包括设置于第二腔体122的腔底122-4的第三腔体123,所述第三腔体123为半球形设计,所述第三腔体123的形状设计便于所培养的细胞在增殖、生长的过程中团聚,进一步形成具有或类似体内功能的细胞团。所述第一导流孔124与第一腔体121相接壤处为第一定位环125,所述第一定位环125可供如移液枪头抵靠,即提供定位的作用。同时,第一定位环125的设置位置确定一次吸取的液体量。
具体地,请参考图2以及图3,所述第一导流孔124由第一环形侧壁124-1所构成,所述第一环形侧壁124-1具有导流上沿124-1A以及导流下沿124-1B,所述导流上沿124-1A为第一环形侧壁124-1的上界限,导流下沿124-1B为第一环形侧壁124-1的下界限。所述导流上沿124-1A的周长大于导流下沿124-1B的周长。在导流上沿124-1A与导流下沿124-1B为圆形的情况下,导流上沿124-1A的直径大于导流下沿124-1B的直径。
更具体地,请继续参考图2,第一环形侧壁124-1在空间上可视为是一倒圆台的侧面,第一延长线124-1C实质是所述第一环形侧壁124-1的母线的延长线。所述第一延长线124-1C与第二腔体122的第二导流孔122-5相交,以限制第一延长线124-1C穿过第二腔体122腔底122-4以外的区域。这一设计目的在于,使流经第一环形侧壁124-1的流体在惯性以及自然重力作用下,受到引导以避开腔底122-4所在区域。值得注意的是,所述第一延长线124-1C是所述第一环形侧壁124-1母线的延长线,在空间上,多条第一延长线124-1C扫射的区域也应该处于所述第二腔体122的腔底122-4的区域之外。
更具体地,请参考图2,所述第一腔体121是导流上沿124-1A向上扩展而成,所述第一腔体121包括了用作培养孔12边缘的第一上沿121-1以及与导流上沿124-1A重合的第一下沿121-2。所述第一腔体121所在区域即由第一上沿121-1以及第一下沿121-2所限定。
请继续参考图2,所述第二腔体122由导流下沿124-1B向下扩展形成,所述第二腔体122包括与导流下沿124-1B重合的第二上沿122-1以及与第二腔体122的腔底122-4接壤的第二下沿122-2。
更具体地,所述第二上沿122-1与第二下沿122-2同时与第二延长线126垂直相交。所述第二上沿122-1与第二下沿122-2的周长或直径相等。
进一步具体地,第一上沿121-1的周长等于或大于所述的第一下沿121-2周长,当第一上沿121-1与第一下沿121-2为圆形时,第一上沿121-1的直径等于或大于所述的第一下沿121-2的直径。在本实施例中,第一上沿121-1的直径大于所述的第一下沿121-2的直径。结合图2以及图3可以观察到,在本实施例中,所述第一上沿121-1与第一下沿121-2共同限定的第一腔体121呈现无底无盖的倒梯台轮廓。
更进一步具体地,所述第二腔体122包括与第一导流孔124接壤的第一过渡孔122-3以及连接第一过渡孔122-3和腔底122-4的第二导流孔122-5。所述第一过渡孔122-3的上边缘由与所述导流下沿124-1B所限定。
再进一步具体地,请参考图1,仅在本实施例中,所述第一过渡孔122-3为圆柱形孔。在其他可能的实施方式中,第一过渡孔122-3可以采用倒台锥形孔(或称倒圆台)。所述第二导流孔122-5为便于液体流动并集中于腔底122-4处,设置为倒台锥形孔。所述第一过渡孔122-3以及第二导流孔122-5的接壤处为第二定位环122-6。所述第二定位环122-6可供如移液枪头等器具提供定位点,第二定位环122-6的设置位置同样确定吸取的液体量。
具体地,仅在本实施例中所述培养孔12的总体积等于50μL,在其它可能的实现方式中,所述培养孔12的总体积可以设置大于50μL。所述第一腔体121的容积等于第二腔体122和第一导流孔124的容积总和。以移液枪吸取液体为例,在本实施例中,移液枪头尖端抵靠第一定位环125将吸取第一腔体121内全部液体,第一定位环125以下的液体得到保留。在第一腔体121的容积等于第二腔体122和第一导流孔124的容积总和的设计下,可以每次吸取培养孔12内液体的50%左右(浮动范围在40%~60%),达到半量换液的目的。本实施例仅对此给出参考,本实用新型允许对第一定位环125的位置调整,即调整第一腔体121的容积与第二腔体122和第一导流孔124的容积总和之间比例,可以适应不同换液量的需要。
具体地,请参考图3,第三腔体123在第二腔体122的腔底122-4周向排列。在本实施例中,共有6个所述第三腔体123在腔底周向排列以及等距排列。在其它可能的实施方式中,所述第三腔体123在第二腔体122的腔底122-4等距排列或周向排列。
更具体地,所述第三腔体123的直径为400μm,所述第三腔体123的深度为400μm。所述第三腔体123的近半球腔可分解为圆柱形孔以及与圆柱形孔相连的半球形腔,所述圆柱形孔的直径等于半球形腔的直径。
请参考图3,在同一培养孔12内,相邻的第三腔体123的中心间距为300μm。
在其它可能的实施方式中,所述三维聚球培养板1的任意一侧设有用做标记的倒角或者可用笔标记的磨砂区域。所述三维聚球培养板1采用无毒无害的有机高分子聚合物材料、玻璃等制成。具体到本实施例中,所述三维聚球培养板1采用聚二甲基硅氧烷(PDMS)材料制得。在其它可能的实施方式中,所述三维聚球培养板1采用3D打印模具并利用打印的模具进行浇铸制得。更具体地,所述打印的模具采用光敏树脂制成。操作者根据设计图纸等,采用光敏树脂通过3D打印技术打印模具,等待模具成型后,向模具中灌入聚二甲基硅氧烷,待成形后,剥离模具。利用3D打印法以及模具浇铸法,可以批量地、高精度地制作所述三维聚球培养板1.
请参考图4,本实施例还提供一种癌细胞化疗药物浓度的筛选方法(以下简称“筛选方法”),所述筛选方法采用所述三维聚球培养板1。下文通过更具体的癌细胞化疗药物以及浓度筛选应用实例,解释所述三维聚球培养板1以及所述筛选方法的操作和实际效果。
所述筛选方法包括以下步骤:
S1:对所述三维聚球培养板1消毒,并用表面改性剂包被处理。具体地,在本实施例的S1中,所述表面改性剂采用3%牛血清白蛋白对所述三维聚球培养板1进行包被处理。在其它可能的实施方式中,所述表面改性剂采用0.01%~5%的牛血清白蛋白、巯基聚乙二醇、2-甲基丙烯酰氧乙基磷酸胆碱等的至少一种表面改性剂。所述表面改性剂的作用是对所述三维聚球培养板1内部的表面改性,防止细胞在培养的过程中贴壁。在其他可能的实施方式中,综合或单独对三维聚球培养板1内部,通过基于等离子体表面处理、静电自组装法、紫外光辐照接枝聚合及表面活性剂动态改性等表面改性方法进行表面改性,可以进一步防止细胞贴壁。
具体地,表面改性剂包被所述三维聚球培养板1的处理事件为24h。在其它可能的实施方式中,可以根据三维聚球培养板1的材质、表面改性剂浓度适当调整,包被处理时间在24h至48h之间。
在其它可能的实施方式中,对三维聚球培养板1的消毒采用75%酒精,必要时可以采用重铬酸钾酸洗彻底清洁三维聚球培养板1。
S2:取用达到细胞活率以及细胞密度要求的原代分离细胞悬液接种于所述三维聚球培养板1中进行三维聚球培养,以形成细胞三维聚球。具体地,本实施例S2中,接种细胞的密度为每培养孔1000个。在其它可能的实施方式中,细胞密度可以为每培养孔500个至2000个。在本实施例中,具体到操作,操作人员可批量地将经过计数的细胞注入培养孔12中,再通过摇床或平板离心机将细胞沉降并除去气泡,使细胞在所述第三腔体123中生长、增殖最后实现细胞团聚。
更具体地,在本实施例的S2中,每24h更新一次所述培养孔12中的培养基。进一步具体地,每次更新培养孔12中培养基的比例为50%。在其它可能的实施方式中,根据培养需要而使第一定位环125的位置设置不同,也即第一腔体121容积以及第二腔体122和第一导流孔124容积之和的比例可以根据培养需要调整,每次更新培养孔12中培养基的比例可以在40%~60%之间浮动变化。由于第三腔体123的容积占整个培养孔12的比例较小,在粗略计算时可以忽略。当需要严格计算更新比例时,第三腔体123的容积可以被计算入内。换而言之,考虑由于第一定位环125设置位置而精确控制吸取、添加液体量时,可以在所述培养孔12或三维聚球培养板1整体设计、制造时将第三腔体123的容积考虑入内。
在本实施例中,示例性地给出原代细胞分离的步骤以及方法。供体术前未经任何抗肿瘤治疗,所述原代细胞分离的步骤具体包括:
(1)在无菌条件下取1.0cm3大小新鲜肝癌组织,剔除血污及坏死组织;
(2)操作者用含双抗(100U/mL青霉素混合100μg/mL链霉素)的Williams'E培养基漂洗处理后的肝癌组织两次;
(3)操作者用眼科剪等刀具将漂洗后的肝癌组织剪成约1mm3大小的组织块;
(4)向剪碎后的组织块中加入0.1%的Ⅱ型胶原酶,置于摇床内37℃消化1h,制成细胞悬液;
(5)用100目筛网过滤消化后的细胞悬液;
(6)用Williams'E培养基稀释过滤后的细胞悬液,并在4℃下以50xg离心力离心5min;
(7)弃去离心后的部分上层清液,取下层细胞5mL,并加Williams'E培养基重悬,并在4℃下以50xg离心力离心5min;
(8)弃去离心后的全部上清,加入5mL红细胞裂解液,并作用5min;
(9)用Williams'E培养基稀释作用后的红细胞裂解液,并在4℃下以50xg离心力离心5min;
(10)弃去离心后的全部上层清液,用含10%胎牛血清、20μg/L肝细胞生长因子、20μg/L表皮生长因子、100nmol/L地塞米松、0.2U/mL胰岛素、2mmol/L谷氨酰胺及所述含双抗的Williams'E培养基重悬细胞,制得细胞悬液;
(11)用台盼蓝拒染法计数上述所得肝癌细胞悬液的细胞活率和细胞密度,若细胞活率低于90%,则进行以下步骤;
(12)将所得的细胞悬液沿管壁缓慢加入40%的Percoll密度梯度分离液,在4℃下以500xg离心力离心5min;
(13)弃去离心后上层含大量死细胞、细胞碎片及非实质细胞的上层清液,加Williams'E培养基稀释,在4℃下以50xg离心力离心5min;
(14)弃去步骤离心后的全部上层清液,重复步骤(10)以及(11)用完全培养基重悬细胞并计数细胞活率和细胞密度,直至细胞活率以及细胞密度达到培养要求。
在培养过程中,还需要对三维聚球培养板1(特别是培养孔12)更换培养基。更换培养基时,采用微量移液枪。操作者将微量移液枪的枪头抵靠第一定位环125实现半量换液,即一次更换50%培养孔12中的原有培养基。在其他可能的实施方式中,根据培养需要,第一定位环125可能实现其他比例的换液需求。
S3:所述细胞三维聚球达到试验要求之后,向培养孔12中加入预设浓度梯度的待测药物。更进一步具体地,在步骤S3中更新培养基或加入待测药物时,微量移液枪抵靠在所述第一定位环125位置进行操作。在本实施例中,操作者控制微量移液枪从所述培养孔12的第一上沿121-1出发抵靠第一腔体121的侧壁滑动直至第一定位环125(即第一下沿121-2与第一导流孔12-1A的接壤处),在第一定位环125所在位置会有明显的角度变化,以帮助操作者辨识第一定位环125的位置。
在此处添加液体(包括添加待测药物以及更新培养基等操作)时,液体在第一导流孔124的第一环形侧壁124-1的引导下,液体的流动影响的区域将会避开位于腔底122-4的第三腔体123,进一步保护第三腔体123中的细胞免受流体剪切力的影响,或者由于液体流动将培养于第三腔体123的细胞或细胞团吹出第三腔体123。更具体地,本实施例限制所述第一延长线124-1C,即为所述第一环形侧壁124-1的母线的对应延长线,流体由于从微量移液枪喷出而具有的初速度以及固有惯性,在重力场的影响下,流体流至第二腔体122的第二导流孔122-5,并在第二导流孔122-5的引导下缓慢流向第二腔体122的腔底122-4。
在此处吸取液体时,由于微量移液枪头抵靠第一定位环125,微量移液枪只能吸取位于第一定位环125以上的液体,位于第一定位环125以下的液体得到保留,因此可以通过第一定位环125的设置位置控制吸取的液体量。同时由于培养孔125中的结构,特别是第一导流孔124中第一环型侧壁124-1的阻隔以及第一过渡孔122-3的缓冲下,可以屏蔽液体扰动对第三腔体123中所培养细胞的影响。
更换进一步地,本实施例还设有第二定位环122-6,第二定位环122-6的位置可以控制吸取与第一定位环125处的液体量不同的液体,即在培养孔中实现不同的定量控制。同时,清洗培养孔12时,如果细胞团聚使细胞与第三腔体123结合比较紧密,还可以令微量移液枪头抵靠第二定位环122-6,流体在第二导流孔122-5侧壁的引导下,可以直达第三腔体123,可使第三腔体123中的细胞团冲洗而出,减少细胞残留,使培养孔12的清洗更彻底。
在本实施例中,细胞三维聚球的试验要求是观察到团聚成球的细胞球直径增大至相对恒定的状态。其后即可加入待测药物,同时设置对照组以及空白组,每组设置若干重复的培养孔12,以控制误差。
本实施例中加入待测药物以及不同浓度梯度:向所述培养孔12中分别加入的顺铂(浓度梯度为30μg/mL、15μg/mL、7.5μg/mL、3.75μg/mL、1.875μg/mL、0.9375μg/mL)、奥沙利铂(浓度梯度为50μg/mL、25μg/mL、12.5μg/mL、6.25μg/mL、3.125μg/mL、1.5625μg/mL)、吉西他滨(浓度梯度为25μg/mL、12.5μg/mL、6.25μg/mL、3.125μg/mL、1.5625μg/mL、0.78125μg/mL)、阿霉素(浓度梯度为10μg/mL、5μg/mL、2.5μg/mL、1.25μg/mL、0.625μg/mL、0.3125μg/mL),同时设置对照组和空白组,每个浓度梯度以及对照组和空白组对应设置3个复孔。
S4:与所述待测药物共同培养预定时间后,测定细胞活性指标,以确定针对所述细胞化疗药物及该化疗药物的敏感浓度。
具体地,本实施例中测定的细胞活性指标采用的是CCK-8间接测定活细胞数量的方法。在电子耦合试剂作用下,2-(2-甲氧基-4-硝苯基)-3-(4-硝苯基)-5-(2,4-二磺基苯)-2H-四唑单钠盐可以被线粒体内的脱氢酶还原生成高度水溶性的橙黄色的甲臜产物(formazan)。颜色的深浅(吸光值)与细胞的活性成正比,与细胞毒性成反比。使用酶标仪在450nm波长处测定吸光值,间接反映活细胞数量。
在本实施例中,与所述待测药物共同培养的时间为48h,弃去各个培养孔12内的溶液,加入等量的CCK-8溶液使培养孔12中CCK-8的浓度为10%,并继续孵育细胞4h。孵育时间过后,对培养孔12中的液体采用酶标仪测定在450nm处的吸光度。根据各组吸光值数据,计算对应化疗药物的半数抑制浓度(IC50)并绘制三维药敏图谱。
在其他可能的实施方式中,还可以通过测定细胞代谢物浓度指标、细胞凋亡标记物指标、细胞内酶活性指标、细胞染色等方式直接或间接测定细胞活性。
值得注意的是,微量移液枪以及微量移液枪头在本实施例中仅为示例,其他能够达到同样或类似效果的器具,也同样适用本实施例以及本实用新型。同时,为适应所述三维聚球培养板1上排列的若干培养孔12,还可以使用多道移液枪。
在本实施例中,刚分离的原代肝癌细胞的显微镜图如图5,原代肝癌细胞呈现分散状态,大部分呈多边形,轮廓清晰。图6为人原代肝癌细胞培养1天后甲胎蛋白(AFP)的免疫荧光染色图,免疫荧光染色显示甲胎蛋白(AFP)在原代肝癌细胞中呈阳性表达,图6中分离的原代肝癌细胞呈现绿色荧光比例较高,说明原代分离肝癌细胞的细胞密度较高。图7展示的是DAPI或称4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole)的免疫荧光染色图,细胞核被DAPI染成蓝色荧光。图8为培养一定时间后,培养孔12的显微镜放大图,图9为对应图8的单个第三腔体123的细节展示图。图8中可以看到肝癌细胞基本在第三腔体123中生长,大部分第三腔体123中所培养的细胞大小相近,状态相似。更清晰地,请参考图9,图9中可以看到肝癌细胞生长为团聚细胞团,进入三维聚球培养状态,肝癌细胞状态良好,说明本实施例中的三维聚球培养板1能够有效使细胞进入三维聚球培养状态并且生长良好。
本实施例的药物筛选实验结果如下:
图10为药物顺铂在不同药物浓度下的肝癌细胞抑制率。从图10中可以看出,随着顺铂浓度的升高对肝癌细胞的肝癌细胞抑制率也随之升高,顺铂浓度与肝癌细胞抑制率呈现正相关的趋势,图10中的曲线为拟合曲线。从拟合曲线中可以看出顺铂浓度高于5μg/mL时,肝癌细胞抑制率升高的趋势放缓。采用药物顺铂,针对该供体的肝癌细胞抑制率最高可达69.88%。
图11为药物奥沙利铂在不同药物浓度下的肝癌细胞抑制率。从图11中可以看出,随着奥沙利铂浓度的升高对肝癌细胞抑制率也随之升高,奥沙利铂浓度与肝癌细胞抑制率呈现正相关的趋势,图11中的曲线为拟合曲线。从拟合曲线中可以看出奥沙利铂浓度高于10μg/mL时,肝癌细胞抑制率升高的趋势放缓。采用药物奥沙利铂,针对该供体的肝癌细胞抑制率最高可达81.95%。
图12为药物吉西他滨在不同药物浓度下的肝癌细胞抑制率。从图12中可以看出,随着吉西他滨浓度的升高对肝癌细胞抑制率也随之升高,吉西他滨浓度与肝癌细胞抑制率呈现正相关的趋势,图12中的曲线为拟合曲线。从拟合曲线中可以看出吉西他滨浓度高于5μg/mL时,肝癌细胞抑制率升高的趋势放缓。采用药物吉西他滨,针对该供体的肝癌细胞抑制率最高可达87.24%。
图13为药物阿霉素在不同药物浓度下的肝癌细胞抑制率。从图13中可以看出,随着阿霉素浓度的升高对肝癌细胞抑制率也随之升高,阿霉素浓度与肝癌细胞抑制率呈现正相关的趋势,图13中的曲线为拟合曲线。从拟合曲线中可以看出阿霉素浓度高于2μg/mL时,肝癌细胞抑制率升高的趋势放缓。采用药物阿霉素,针对该供体的肝癌细胞抑制率最高可达71.29%。
根据以上实验结果,采用一定的算法,绘制药敏图谱如图14,在本实施例中示例性地采用SPSS(Statistical Product and Service Solutions,统计产品与服务解决方案)软件进行计算。图14中,纵坐标为肝癌细胞半数抑制时(IC50)药物浓度(单位为mg/mL),横坐标为药物名称。从图14中可以看出,在肝癌细胞半数抑制的条件下,顺铂的肝癌细胞半数抑制浓度最高,达到2.48mg/mL;吉西他滨的肝癌细胞半数抑制浓度最低,低至0.21mg/mL;奥沙利铂半数抑制浓度为0.96mg/mL;阿霉素肝癌细胞半数抑制浓度为0.42mg/mL。相较而言,本实施例中可以得出以下结论,供体的肝癌细胞对吉西他滨最为敏感,阿霉素以及奥沙利铂次之,对顺铂最不敏感。该药物敏感性结果可以指导性并有针对性地指引药物适用以及对药物进行配伍适用,敏感性的结果基于本筛选方法而具有针对供体的特殊性,更有针对性。
值得注意的是,本实施例中仅示例性地采用以上药物作为示范,在不脱离本实用新型的指导思想以及技术方案的范围内,操作者可以选用其他药物并应用所述筛选方法。本实用新型同时可以应用于除肝癌细胞之外的其他癌细胞或其他恶性增殖细胞的药物筛选实验。
本实用新型的三维聚球培养板1由于第三腔体123的特殊结构,能够使细胞进入三维聚球培养状态,使细胞、细胞团能够处于近似于体内状态,更好地模拟体内状况,为所述筛选方法提供一定基础。本实用新型所提供三维聚球培养板1中的培养孔12,还具有若干导流结构、缓冲结构,包括但不限于第一导流孔124、第二导流孔122-5等,用于缓冲吸取液体、添加液体时所产生的液体流动,避免影响细胞的位置以及生长状态。本实用新型所述三维聚球培养板1中的培养孔12还通过设置包括但不限于第一定位环125以及第二定位环122-6的位置,控制每次吸取的液体数量,进而实现预定更换液体的比例,便于操作。本实用新型的三维聚球培养板1采用3D打印结合模具浇铸的制造方法,能快速、批量地生产所述三维聚球培养板1,以适应培养的需要。本实用新型的三维聚球培养板1设置的培养孔数量较多,能够满足设置对照组、空白组、重复实验复孔的要求,使药物筛选实验能在同一三维聚球培养板1上实现,避免混淆。本实用新型所提供的一种筛选方法,所述筛选方法应用所述三维聚球培养板1,能针对不同的供体筛选药物并提供药敏图谱。所述筛选方法利用三维聚球培养板1的三维聚球培养,能较高程度地模拟供体体内状态,结果可靠,筛选周期短,能够满足现需求。
以上所述仅是本实用新型的部分实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本实用新型原理的前提下,还可以作出若干改进和润饰,这些改进和润饰也应视为本实用新型的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!